纳米制剂在透皮药物递送系统中的应用研究进展
2023-08-22李铉焕吕慧侠诸吕锋
李铉焕 ,吕慧侠,诸吕锋
(1. 中国药科大学药学院,江苏 南京 211198;2. 上海合全药物研发有限公司药物固态研发部药物表征中心,上海 200131)
透皮药物递送系统(transdermal drug delivery system,TDDS)作为一种极具前景的全身给药方式,与传统的口服、静脉注射与皮下注射等方式相比操作更容易、便捷,在提高患者顺应性的同时也能够避免首过效应与药物副作用。皮肤作为人体的最大器官,同时也是人体抵御外来微生物和化学物质的第一道防线,其药物通透性较低,与胃肠道及肺部上皮细胞相比存在数量级差异[1]。因此,如何通过人体皮肤的诸多屏障便是药物透皮递送时面临的第一个问题。近20年来,随着纳米技术的不断发展,各类纳米制剂越来越广泛地被应用于透皮给药[2]。这些纳米制剂透皮递送系统因其纳米级的尺寸和独特的理化性质,可大幅增强药物对皮肤的渗透,提高药物的透皮效率。本文将结合近5年来的文献报道,对各类纳米制剂透皮递送系统的概况、制备方法、优势以及研究进展进行综述。
1 皮肤屏障
1.1 皮肤生理结构
人体皮肤由组成与结构各不相同的三层构成,由外至内分别为表皮、真皮及皮下组织,此外还有毛囊、汗腺、皮脂腺等附属器。表皮由外向内又可分为角质层(stratum corneum,SC)、透明层、颗粒层、棘状层和基底层。其中除角质层外的四层由活细胞构成,统称为活性表皮;而角质层主要由死亡脱水的无核角质细胞以及角质细胞间的脂质基质构成。角质层内部结构排列紧密且高度疏水,这使其在皮肤渗透屏障中起到了主要作用。角质层结构一般被简单表示为“砖与砂浆”模型,即角质细胞类似于砖块层叠交错排布,脂质基质则填充于角质细胞间隙,但这一模型并不完全准确。脂质基质的新模型包括不对称(双分子层展开)模型、域镶嵌模型、三明治模型、单凝胶相模型等[3],更好地描述了脂质基质的体系结构。表皮之下的真皮由纤维网络、基质和细胞构成,纤维网络是由胶原蛋白、弹性蛋白等形成的密集网络结构,可为皮肤提供机械强度;基质主要由多种亲水的蛋白多糖组成,填充于纤维网络间;真皮内的细胞主要为成纤维细胞,其次则是巨噬细胞、肥大细胞、树突状细胞等免疫细胞,负责皮肤的免疫反应。此外,毛细血管、淋巴管、神经末梢以及各种附属器的根部也处于真皮层。皮肤最深层的皮下组织主要由疏松结缔组织和脂肪组成,起到缓冲、储能等作用。
1.2 皮肤吸收途径
药物透过皮肤进入体循环的途径包括表皮途径和附属器途径(见图1)[4]。表皮途径是药物透过表皮进入真皮,后扩散进入毛细血管,进而转移至体循环的过程。表皮途径包括跨细胞途径以及细胞间隙途径,其中药物分别穿过角质细胞扩散和经角质细胞间的脂质基质扩散。表皮途径中药物主要通过皮肤表面与皮肤深层间的浓度差进行被动扩散转运,而角质层特殊的组成与结构使其成为了药物转运时的主要屏障[5]。在附属器途径中,药物则是通过皮肤附属器的开口直接进入真皮并到达体循环。
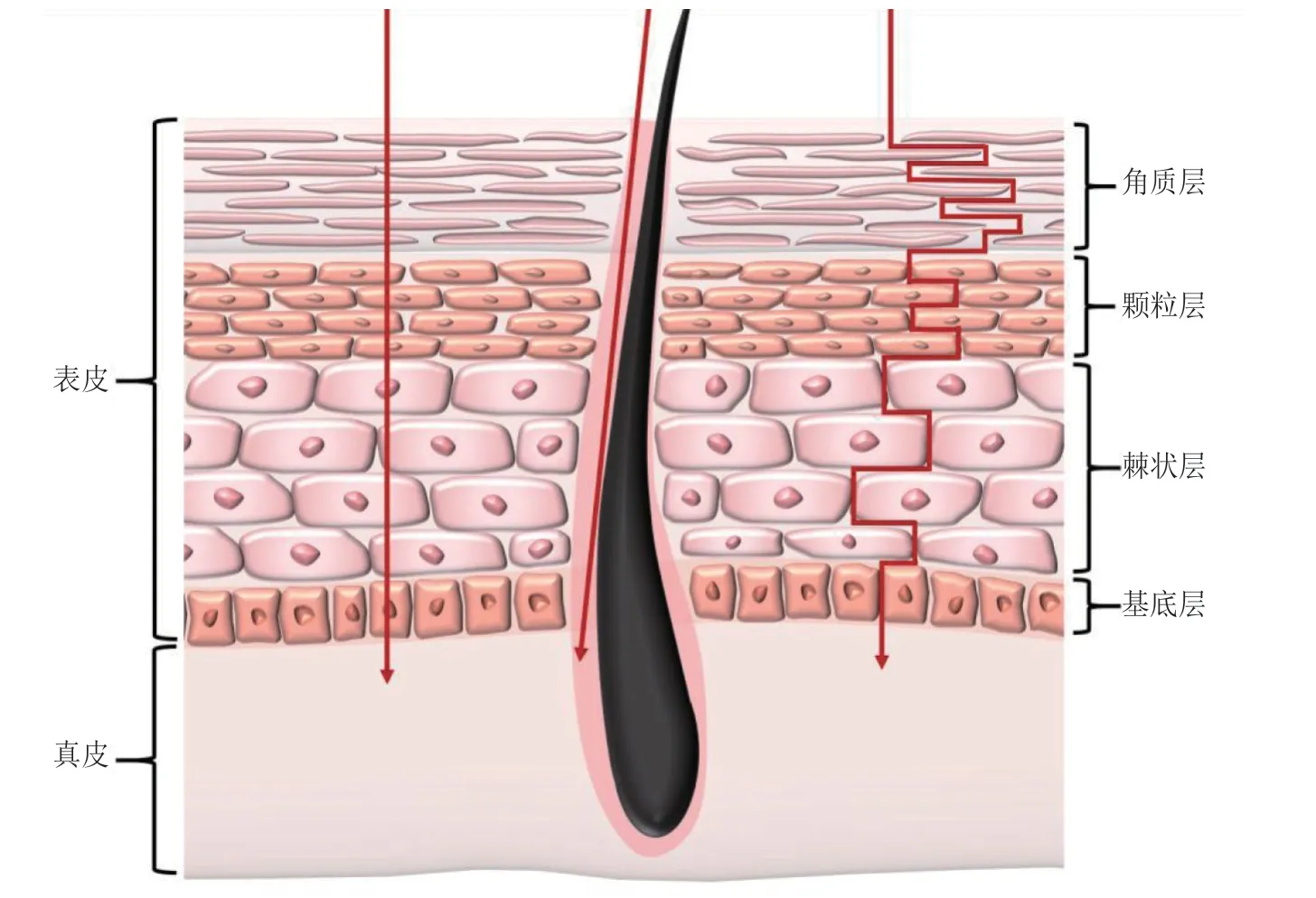
图1 药物透皮吸收途径Figure 1 The transdermal absorption pathway of drugs
一般而言,表皮途径是药物透皮吸收的主要途径,而附属器途径的药物吸收虽然穿透速率更快,但附属器只占皮肤表面积的0.1%[6],因此当表皮途径的药物吸收达到稳态后,附属器途径的吸收可以被忽略。不过对于离子型药物和亲水大分子药物而言,其在角质层中极难渗透,因此该类药物以附属器途径吸收为主[7]。此外,脂质纳米粒(lipid nanoparticle,LN)、聚合物纳米粒(polymer nanoparticle,PNP)、纳米晶体(nanocrystal,NC)等纳米制剂能够在毛囊内聚集形成药物储库,通过附属器途径加快药物透皮吸收。
2 药物透皮吸收促进方法
2.1 化学促渗剂
化学促渗剂指能够与角质层(主要与其中的脂质基质)产生相互作用,降低角质层的渗透屏障,从而提高药物的渗透效率的物质[8]。理想的化学促渗剂应当是无毒、无刺激性、无过敏性、迅速起效、不具备药理活性且不与药物或辅料发生反应的;此外,化学促渗剂对皮肤的作用应是可逆的,即去除促渗剂后皮肤可以快速且完全地恢复,同时不损失内源性物质。然而,目前用作促渗剂的化合物尚未能满足以上所有要求,大部分促渗剂在提高皮肤通透性的同时也会带来相应的刺激性[9]。
目前常见的促渗剂包括:1)脂肪酸及其衍生物,如油酸、月桂酸、单油酸甘油酯等;2)萜类化合物,如薄荷醇、柠檬烯、法尼醇等;3)醇类化合物,如乙醇、异丙醇、月桂醇、肉豆蔻醇等;4)表面活性剂,如十二烷基磺酸钠、吐温80、卵磷脂等;5)亚砜类化合物,如二甲基亚砜、癸基甲基亚砜等。
2.2 物理促渗技术
物理促渗根据基本原理分为两类:一是直接促渗,即使用机械方法或外部能量暂时、局部地破坏角质层屏障;二是间接促渗,即通过外加能量场对药物分子的作用力促进药物渗透。常用的物理促渗方法总结于表1。
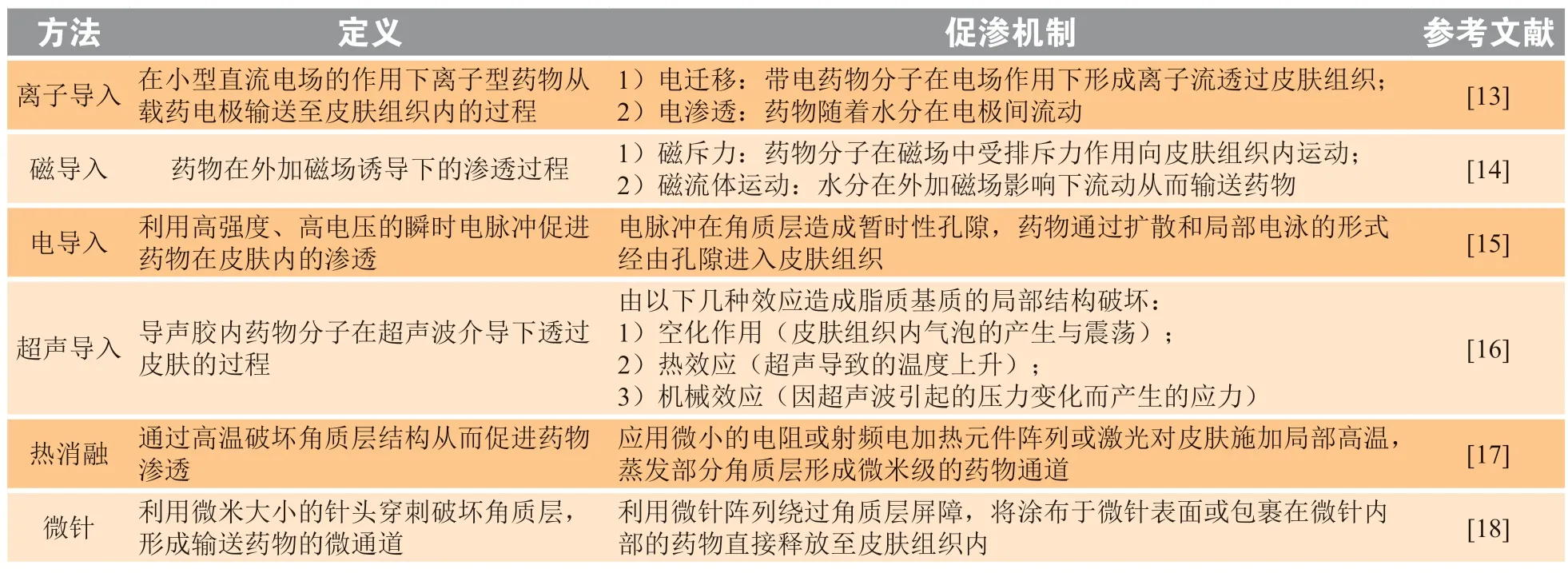
表1 常用物理促渗方法Table 1 Commonly used physical methods for penetration enhancement
各种物理促渗技术也可联合应用,常见方法是将直接促渗与间接促渗相结合。Noh等[10]联合使用微针和离子导入技术,将其作为重组人生长激素的促渗手段,结果表明高电流密度的阳极离子导入增强了药物在微针产生的微通道内的渗透,很好地克服了大分子生物药物透皮给药困难的障碍。
除此之外,近年来一些新的物理促渗手段也在不断出现。Xie等[11]与Miao等[12]将中医的傅氏拔罐疗法应用于透皮促渗,通过罐内负压以及“摇罐”、“走罐”等刺激方式提高角质层通透性、增加皮肤血流量。实验结果表明傅氏拔罐疗法可以显著提高数种药物的渗透效率,具备较高的临床应用价值,为药物透皮促渗提供了新的思路。
3 纳米制剂透皮递送系统
纳米制剂指尺寸在1000 nm以下的药物载体或药物颗粒,其纳米尺寸能够带来独特的物理与化学性质。目前研究中常用于透皮递送系统的纳米制剂包括纳米乳(nanoemulsion)、脂质纳米囊泡(lipid-based nano-vesicle)、LN、PNP、NC、溶致液晶(lyotropic liquid crystal,LLC)等。这些纳米制剂通过独特的渗透促进机制和药物释放机制为透皮递送提供了新的平台,其在药物透皮递送和制剂制备等方面的优缺点总结于表2。
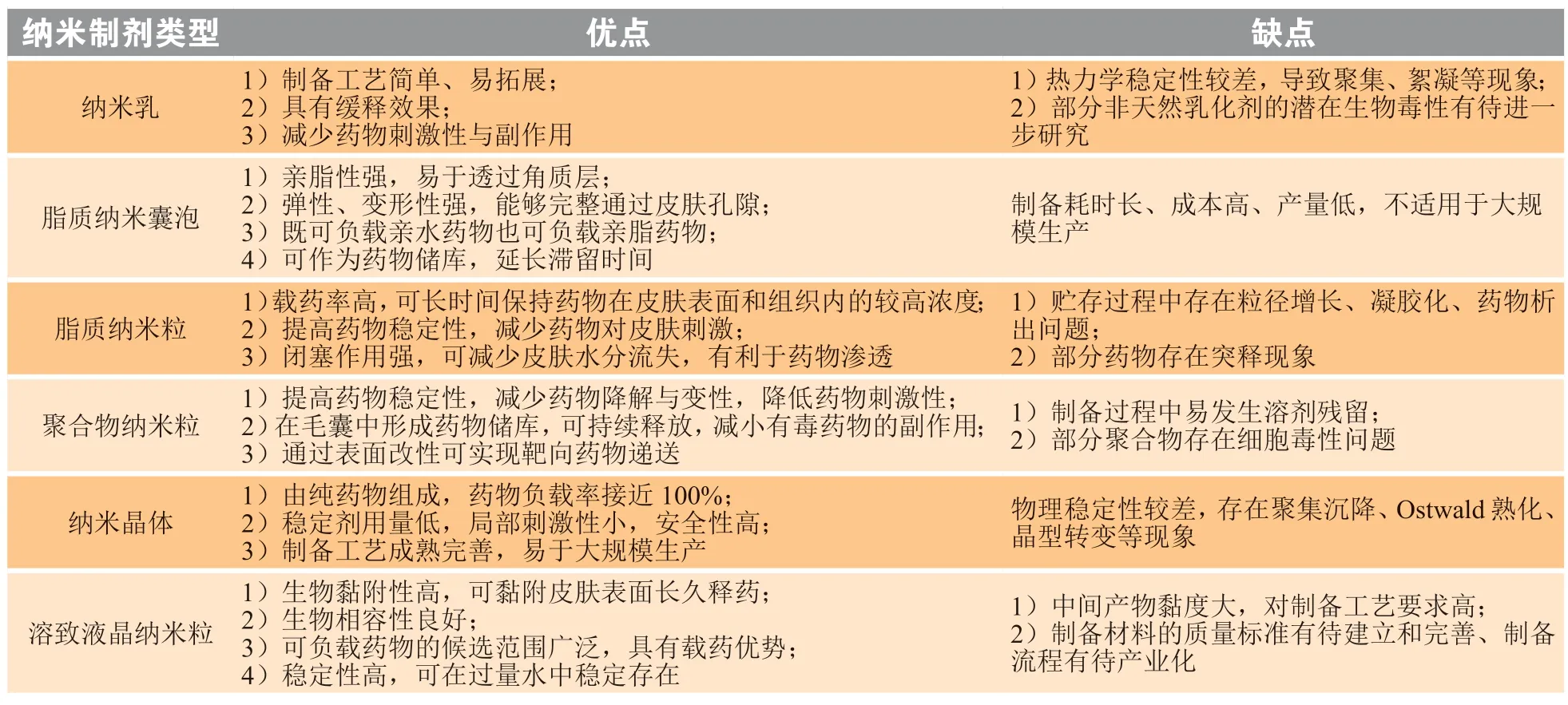
表2 各类纳米制剂优缺点比较Table 2 Comparison of advantages and disadvantages of different nanopreparations
3.1 纳米乳
纳米乳是由2种不相溶液体组成的胶体体系,分散相平均粒径一般在10 ~ 100 nm,其外观呈透明或半透明状,光学上表现为各相同性。纳米乳的制备方法分为低能与高能这2种。低能方法包括相转化技术与自乳化技术[19]。其中,相转化技术系通过改变温度或混合体系中的油-水比例进而改变表面活性剂的油-水分配系数,实现乳化;自乳化技术系在温和的搅拌条件下,向油/表面活性剂混合体系中加入水相(或向水/表面活性剂混合体系中加入油相),形成纳米乳滴。高能方法是通过高压均质、微流化、超声破碎等机械方法,在外部能量的作用下将乳滴破碎至纳米级别[20]。
与微乳相比,纳米乳是一种动力学稳定而热力学较不稳定的体系,纳米乳相比于形成前的相分离状态具有更高的自由能(微乳则相反)[21],这导致纳米乳在制备时需要更高的外部能量输入。此外,微乳体系对于表面活性剂的要求较高,需要其具备很强的降低表面张力的能力,相比之下纳米乳的表面活性剂不仅选择范围更广,所需用量也更低[21-22],因此纳米乳在毒理学方面具有更好的安全保证。
Hussain等[23]使用自乳化法制备并优化了抗生素利福平的阳离子纳米乳凝胶剂,该制剂在离体皮肤渗透实验中药物渗透通量为药物混悬凝胶的7.43倍,且24 h后的皮肤滞留量达到994.40 µg · cm-2;药代动力学实验结果显示,该制剂涂布于皮肤后的药峰浓度(Cmax)与AUC0-∞分别为口服药物混悬液的4.34倍和4.74倍,表明该制剂在治疗全身和皮肤结核方面具有良好前景。Razzaq等[24]创新性地以丁香油为油相基质,开发了格列美脲亲水复合物的纳米乳凝胶剂,显著提高了格列美脲的体外释放与皮肤渗透;同时,动物实验表明,该制剂相比于市售的口服格列美脲具有更长的降糖维持时间,提高了总体治疗效果。这一制剂使丁香油与格列美脲达到协同降糖目标,且有希望规避口服格列美脲带来的副作用和低依从性,为糖尿病治疗提供了有价值的新型给药策略。
3.2 脂质纳米囊泡系统
脂质纳米囊泡是一类由脂质双分子层构成的载药微粒,包括传统脂质体(liposome)以及在其基础上发明的传递体(transfersome)、醇质体(ethosome)、醇传递体(transethosome)、萜质体(invasome)等,常见脂质纳米囊泡的结构如图2所示。脂质囊泡的亲脂性使其能够与角质层内的脂质相溶并穿过角质层,从而表现出优异的促渗性能;同时它们还可以作为药物的局部储库,延长药物滞留时间[25]。脂质囊泡的纳米级尺寸也可以进一步增强药物渗透:一般来说,600 nm以下的囊泡可以进入角质层,300 nm以下的囊泡可以穿透至表皮深层,而70 nm以下的囊泡可以同时传递到活表皮和真皮层[26]。此外,脂质囊泡系统的特殊结构使其对于药物的亲水/亲脂性并无特殊要求——亲水性药物可被负载于脂质双分子层内部的水性介质中,亲脂性药物则被负载于脂质双分子层的夹层内。
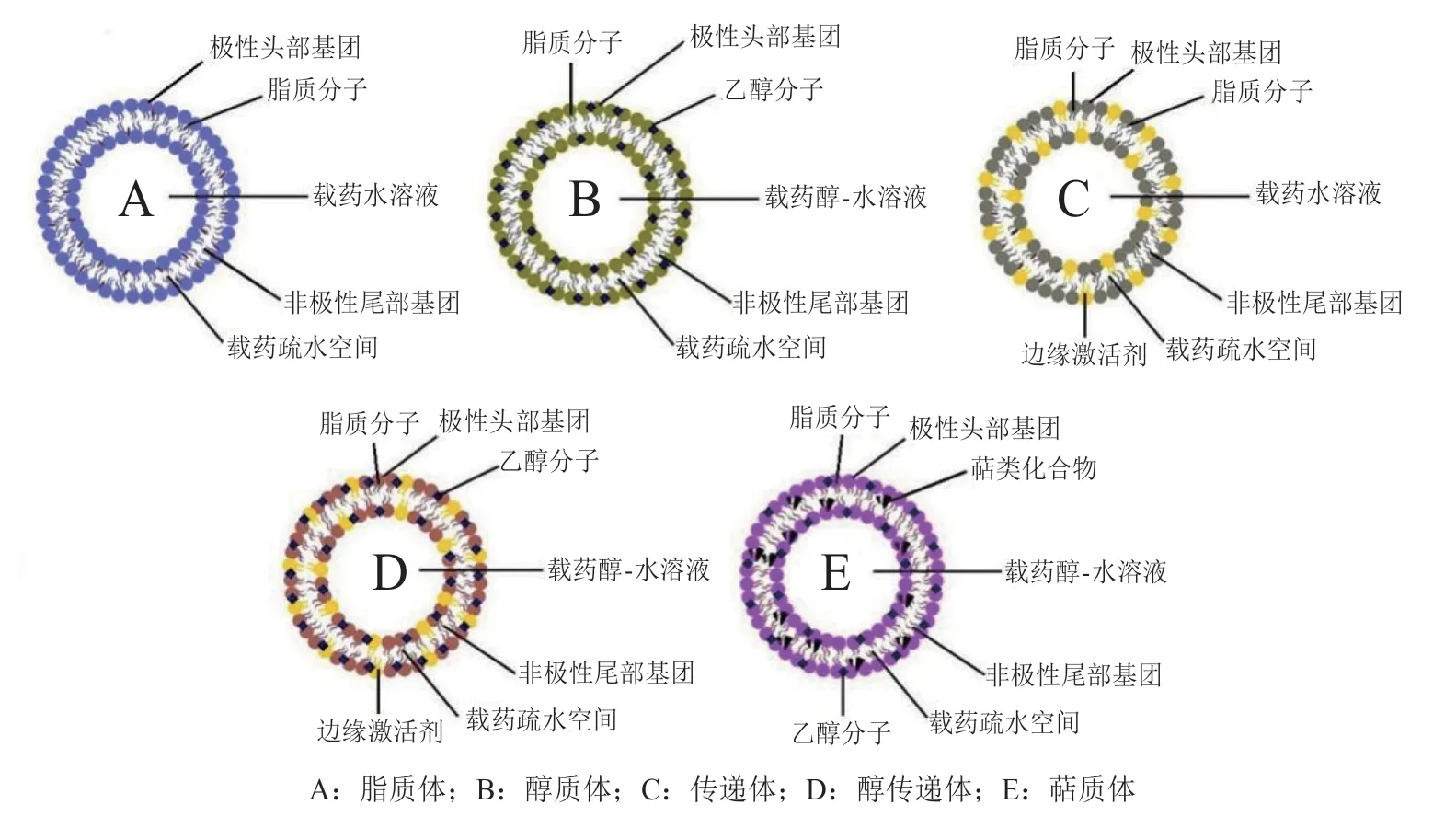
图2 脂质纳米囊泡结构示意图Figure 2 Schematic diagram of lipid-based nano-vesicles
目前脂质囊泡最常用的制备方法是薄膜水合法,大致制备流程为:首先将脂质溶解于有机溶剂,随后在真空环境下挥发溶剂,使脂质沉积为薄膜,最后用含水缓冲液使脂质自发溶胀,发生水合形成脂质囊泡[27]。此外,通过高压均质、挤出或超声等方法可以进一步降低脂质囊泡的粒径[28]。
3.2.1 脂质体 脂质体最早由Bangham等[29]于20世纪60年代提出,由磷脂(通常为天然磷脂酰胆碱,如大豆或鸡蛋提取的卵磷脂)组成并以胆固醇作为稳定剂。然而,由于传统脂质体作为经皮给药载体时渗透效率不高,难以将药物输送至体循环[30],因此目前基于传统脂质体的皮肤给药基本为局部给药而非透皮全身给药[31-33]。
3.2.2 醇质体 Touitou等[34]于2000年提出了醇质体,这是一类由磷脂和高含量乙醇(20% ~ 50%)构成的囊泡系统。在醇质体中,乙醇与磷脂分子的极性头部相互作用,提高磷脂的流动性,使囊泡具有更高的弹性与变形性,更易通过皮肤孔隙;同时,乙醇也会与角质层内的脂质作用并增加其流动性,从而提高角质层通透性[35]。此外,醇质体在进入角质层后会与角质层脂质融合,进而渗透至更深层并释药[36]。乙醇的加入还能够使囊泡带负电荷,通过静电斥力防止囊泡聚集且有利于小粒径囊泡的形成,并提供一定的空间稳定性[37-38]。
Dave等[39]研制并优化了载有氯沙坦钾醇质体的贴剂,将其用于高血压治疗,最终制备的醇质体包封率高达89.21%±2.82%,体外药物释放率在72 h达到86.45%±0.02%。在体内实验中,高血压模型大鼠在施用氯沙坦钾醇质体贴剂后降压效果可持续至48 h,相比于普通给药对照组(降压效果持续时间为4 h)显著延长,有助于高血压患者的长效降压治疗。El-Shenawy等[40]制备并优化了非布索坦(FXT)醇质体,随后开发了负载FXT醇质体的凝胶剂。体外渗透实验显示,FXT醇质体凝胶的渗透通量(14.22±2.33 μg · cm-2· h-1)显著高于纯药物凝胶(9.44±1.16 μg · cm-2· h-1)。体内药代动力学研究显示,相比于口服市售片剂,FXT醇质体凝胶给药后的Cmax、血药浓度达峰时间(Tmax)及AUC0-t均显著提高,表明该制剂在提高生物利用度的同时可以延长药效持续时间。考虑到FXT醇质体凝胶可以避免口服片剂的高给药频率和副作用,这无疑为痛风治疗提供了一种应用前景良好的给药途径。
3.2.3 传递体 传递体又被称为超柔性脂质体,是由脂质双分子层骨架、边缘激活剂以及低含量乙醇组成的囊泡体系。传递体中的边缘激活剂通常是大曲率半径的单链表面活性剂(如吐温、司盘、胆酸钠、甘草酸二钾等)[41],它们能低程度地破坏脂质双分子层结构,赋予传递体比传统脂质体更高的弹性与变形性,使传递体完整通过远小于自身尺寸的皮肤孔隙[42]。边缘激活剂浓度是影响传递体性质的关键因素,适当的边缘激活剂/磷脂比例可以提高传递体弹性,减小传递体在透过皮肤时破裂的概率[43];但过高的边缘激活剂浓度会导致磷脂/边缘激活剂聚集体的形成(如混合胶束等),使药物包封率下降[44]。
Balata等[45]制备了携带盐酸伊伐布雷定(IVB)传递体的透皮膜制剂,相比于负载纯IVB的透皮膜,该制剂在离体皮肤渗透实验中的渗透通量、渗透系数和滞后时间均显著提高。在药代动力学实验中,与口服给药相比,IVB传递体透皮膜给药后的Cmax有所下降而Tmax则延长至3倍,呈现出更良好的药物释放曲线;同时AUC0-∞显著提高(为口服给药的2.4倍),表现出更好的生物利用度。Mahmood等[46]以司盘80和司盘85作为复合边缘激活剂制备了盐酸雷洛昔芬传递体的凝胶剂,与载药传统脂质体的凝胶剂、载药乙醇-水凝胶以及市售口服药物相比,该制剂在药代动力学实验中的Cmax、Tmax、AUC0-∞及消除半衰期均显著更高,表现出更优秀的生物利用度。
3.2.4 醇传递体 醇传递体结合了醇质体和传递体的特征,同时含有边缘激活剂和高含量乙醇。与醇质体和传递体相比,醇传递体综合了二者的优势,在包封率、稳定性、渗透性等方面通常优于前两者[47-49]。
Albash等[50]将奥美沙坦美多索米(OLM)负载于醇传递体并进行了优化,在体外皮肤渗透实验和表征中证实,该制剂具有比OLM传递体更高的弹性和更强的皮肤渗透能力。在药效研究中,相比于市售的口服OLM片剂,OLM醇传递体将有效降压时长由6 h延长至24 h,且24 h后的血压数据与阴性对照组间无显著差异。Kumar等[51]制备了盐酸普萘洛尔醇传递体凝胶剂,药动学实验结果显示,该制剂可使有效血药浓度维持24 h,其Cmax和AUC0-t相较于市售片剂分别提高了2.06倍和3.24倍,很好地规避了普萘洛尔口服给药时频率高、首过效应强等缺点。
3.2.5 萜质体 与传统脂质体不同,萜质体的脂质双分子层骨架中除了少量乙醇还含有单种或多种萜类化合物。萜类物质不仅可以干扰脂质骨架结构,提高囊泡的弹性和变形性,还可以作为促渗剂破坏角质层结构,进而提高渗透效率[52-53]。
Ammar等[54]制备了盐酸伐地那非(VRD)萜质体,该萜质体在体外透皮实验中0.5与12 h的累积药物渗透百分率与稳态通量均显著高于药物混悬液。该课题组还基于已有的临床药代动力学数据验证并建立了生理药代动力学(PBPK)模型,并利用该模型模拟了成年人和老年人分别接受VRD萜质体透皮给药和口服VRD混悬液后的血药浓度曲线。根据模拟结果,两类人群在萜质体透皮给药后均表现出更低的Cmax和更高的Tmax,同时AUC0-t值提高了1倍,表现出更长效、更稳定的释药特点。El-Tokhy等[55]制备了马来酸阿森纳平(ASPM)的萜质体,该萜质体透皮给药后相比于静脉注射和口服给药表现出更高的Cmax和Tmax,生物利用度达到口服给药的15倍;同时,ASPM经静脉注射和口服给药24 h后便几乎完全消除,而萜质体给药后的释药可达72 h以上,非常适合ASPM治疗精神疾病的给药需求。
3.3 脂质纳米粒
LN是一类由乳化剂稳定脂质分散相从而形成的胶体体系,根据其中脂质分散相的不同又可分为固体脂质纳米粒(solid lipid nanoparticle,SLN)和纳米结构脂质载体(nanostructured lipid carrier,NLC)。与纳米乳剂和脂质囊泡系统相比,LN在维持和控制药物释放方面更具优势[56]。同时,LN的制备工艺较简单且可拓展,包括高压均质、乳化法、超声法等[57-58]。不过通过查阅文献发现,LN的经皮应用多集中于局部给药,而在透皮给药方面应用较少,且常常局限于体外评价。在此值得强调的是,透皮给药系统的有效性须通过体内药代动力学研究才能被证明。
3.3.1 固体脂质纳米粒 SLN是由固体脂质作为分散相,并在脂质颗粒外覆盖单层表面活性剂分子,使其稳定而形成的纳米分散体系。SLN体系的脂质内核对脂溶性化合物的负载量较大,且能提高其稳定性,使药物免受氧化、光降解和水分等因素影响[59-60]。SLN在被应用于皮肤后能够黏附于皮肤表面并通过配方脂质与角质层脂质间的相互作用穿透角质层,从而达到促渗效果。此外,SLN的促渗功能还来源于其强闭塞性——即涂布于皮肤后能够减少皮肤水分流失,提高角质层含水量,使角质层结构松散,进而提高药物透过角质层的效率[61]。
Dudhipala等[62]开发并优化了罗匹尼罗SLN(RP-SLN)的凝胶剂,将其用于帕金森病治疗。体外渗透实验表明,RP-SLN凝胶相比于纯药物凝胶具有促渗和缓释特性。在药代动力学研究中,RP-SLN凝胶经皮给药的生物利用度是纯药物混悬凝胶的2.0倍,是RP-SLN口服给药的1.8倍。在药效学实验中,相比于使用药物混悬凝胶经皮给药组和药物混悬液口服给药组,RP-SLN凝胶组的帕金森病模型大鼠在给药后其谷胱甘肽含量、多巴胺含量等指标的显著改善,证实RP-SLN凝胶有助于帕金森病模型大鼠的恢复。Gaur等[63]制备了姜黄素SLN(Cur-SLN)凝胶,并对其脂质组成进行优化,结果表明以神经酰胺/棕榈酸作为脂质内核的Cur-SLN具备最佳的渗透性质。优化后的Cur-SLN凝胶的绝对生物利用度相比于市售凝胶剂由小于1%提升至68.12%;此外,优化后的Cur-SLN凝胶在大鼠足肿胀模型中用药后6 h的水肿抑制率达到90.75%,而市售凝胶剂仅有50.54%。
3.3.2 纳米结构脂质载体 NLC与SLN结构类似,不同之处在于NLC的脂质内核由固体脂质与液体脂质混合形成。液体脂质的存在能够降低固体脂质重结晶的概率,提高NLC的载药能力,同时防止药物在储存过程中泄露[61,64]。
Kapoor等[65]制备并优化了氨氯地平NLC(AM-NLC),优化后的AM-NLC具备较高透皮通量(58.33 μg · cm-2· h-1)和包封率(88.11%),且具有较长释放时间。基于AM-NLC开发的凝胶剂在体内药代动力学实验中相比于口服市售片剂具有更低的Cmax和更高的Tmax;同时,AM-NLC凝胶剂的AUC0-t亦有所提高,其生物利用度为市售片剂的1.23倍。Pandey等[66]研制并优化了载有瑞格列奈NLC(RG-NLC)的凝胶剂,该制剂在大鼠模型中的生物利用度为口服片剂的2.0倍,缓释时间也达到24 h,表现出经皮给药治疗糖尿病的潜力。
3.4 聚合物纳米粒
PNP是由无毒、具有生物黏附性且能生物降解的聚合物组成的纳米颗粒,这些聚合物可以是合成的[如聚乳酸(PLA)、聚乳酸-羟基乙酸共聚物(PLGA)等],也可以是天然的(如壳聚糖、明胶等)[67]。根据结构不同,PNP又可分为纳米囊(nanocapsule)和纳米球(nanosphere):纳米囊由聚合物壳以及内部包裹着的液体或半固体载药基质构成,而纳米球则是全部由聚合物构成的固体颗粒。由于自身的刚性结构,PNP无法完整穿过角质层,但其在皮肤上的长滞留时间有助于药物累积并借助更强的浓度梯度渗透皮肤[68]。此外,PNP也可积累在毛囊中,经由附属器途径进入皮肤深层[69]。
目前通常以纳米乳模板法制备PNP,该方法又可分为乳液-扩散/蒸发法与乳液-凝聚法。乳液-扩散/蒸发法即是将纳米乳中的有机相通过扩散或蒸发除去,使得溶解在有机相中的聚合物在相界面上沉淀形成聚合物外壳[70-71]。乳液-凝聚法类似于扩散/蒸发法,不同之处在于聚合物外壳通过物理凝聚或化学交联的方式形成并稳定[72]。此外,复乳也可作为生成PNP的模板,以此形成的PNP可以同时作为亲水和疏水药物的载药平台,在药物选择上更具灵活性[73]。
PNP在经皮给药方面基本均应用于局部给药而非透皮给药,但有一些文献报道了将PNP透皮制剂作为脑靶向给药方式的新观点。Bali等[74]开发了负载司来吉兰PNP(SGN-PNP)的透皮膜制剂,将其用于治疗帕金森病。该制剂相比于负载纯药物的透皮膜制剂具有缓释效果,持续释药时间可达72 h,同时生物利用度明显提高。在生物分布实验中,SGN-PNP静注给药后的脑内药物浓度AUC0-t达到SGN静注的7.7倍,证实了SGN-PNP的脑靶向能力;同时,SGN-PNP透皮膜相比于SGN-PNP静注,使脑内药物Tmax由0.5 h延长至36 h,AUC0-t由1401.28 ng · h · mL-1提高至25451.58 ng · h · mL-1,表现出优秀的缓释给药能力。在药效学实验中,使用SGN-PNP透皮膜后可减少帕金森病模型大鼠的惊厥等运动体征,且给药后脑内多巴胺与B型单胺氧化酶(MAO-B)水平明显下降。SGN-PNP透皮膜制剂不但对脑组织具有有效的靶向作用,其无创、自主给药、长效释药的特点亦有助于提高老年患者的顺应性,是一种很有潜力的帕金森病治疗新途径。
3.5 纳米晶体
NC是药物在高分子聚合物或表面活性剂的稳定作用下加工形成的纳米级分散体系。当NC应用于皮肤时,其纳米级尺寸带来的高比表面积可以大幅度提高药物的饱和溶解度,增强制剂与皮肤间的浓度梯度,从而起到促渗效果[75]。同时,NC的高比表面积也可以增加药物颗粒铺展面积、增强生物黏附性[76]。此外,还有一些研究表明特定大小的NC可以通过附属器途径提高药物渗透[77-78]。
与其他纳米体系相比,NC的物理稳定性较差,易发生粒子聚集沉降、Ostwald熟化、晶型转变等影响其性质的现象[79]。为提高NC体系的稳定性,稳定剂是NC开发过程中的关键因素。稳定剂通常是表面活性剂或高分子聚合物,可以通过降低分散体系表面自由能、静电屏障、空间位阻等机制提高NC体系稳定性[7]。
NC的制备方法可分为自上而下(Top-down)、自下而上(Bottom-up)以及联用技术3种[80-81]。其中自上而下技术是通过对较大粒径的药物颗粒进行研磨与粉碎制得纳米级颗粒,包括介质研磨、高压均质等制备工艺。自下而上技术是通过对药物分子结晶过程的调控直接得到药物NC,如微量沉淀法、超临界流体法、喷雾干燥等。在联用制备技术中,通常先使用自下而上技术进行预处理,得到尺寸合适的药物晶体粗颗粒,再使用自上而下技术进一步降低粒径,制备药物NC。
Yoshioka等[82]制备了2种不同尺寸的西洛他唑(CLZ)纳米晶体:CLZ-Nano(74.5 nm)与CLZMicro(236.6 nm),并基于NC开发了凝胶贴片、卡波姆凝胶剂与软膏剂。在凝胶贴片中,CLZ-Nano体外皮肤渗透率达到CLZ-Micro的1.4倍;同时,CLZ-Nano凝胶贴片的体外皮肤渗透明显优于CLZ凝胶剂与CLZ软膏剂。此外,体外渗透实验中还观察到施用CLZ-Nano凝胶贴片后药物NC可直接穿透皮肤并仍然保持纳米粒径(216 nm),穿透量与CLZ-Nano凝胶贴片中药物含量呈正相关,这表明CLZ的NC可通过皮肤间隙并进入血管。在体内研究中,CLZ-Nano凝胶贴片的表观吸收速率常数与AUC0-t显著高于CLZ凝胶剂与CLZ软膏剂,皮肤渗透效果更显优势。Im等[83]制备了不稳定药物孟鲁司特(MTK)的NC凝胶剂,相比于药物的溶液、常规凝胶剂与纳米混悬液,该制剂中的药物稳定性得到明显提高,光照下降解产物的生成显著低于另外3种制剂。在体内研究中,MTK-NC凝胶的药代动力学性质与常规水凝胶间无明显差异,具有等效的AUC0-t与Cmax,表明该制剂适用于MTK透皮给药,可改善患者顺应性。
3.6 溶致液晶脂质纳米粒
LLC是一定比例的两亲性分子在溶剂中自组装形成的有序液晶结构,由脂质分子形成的热力学稳定的LLC结构包括层状相、立方相、六角相等中间相,均具有足够的平均分子取向和结构对称性[84]。当溶剂为水时,构成中间相的脂质分子亲水头部向外,疏水尾部向内;而当溶剂为有机相时,脂质分子的头尾方向发生反转,此时中间相则是反向的[85]。
层状相结构可形成前文所述的脂质囊泡系统,而LLC脂质纳米粒(lyotropic liquid crystalline lipid nanoparticle,LCNP)可表示为以中间相作为晶胞构成的晶体结构在稳定剂作用下形成的分散体系。目前在药物透皮递送中常用的LCNP包括由双连续立方相构成的立方液晶纳米粒(cubosome)与由反向六角相构成的六角液晶纳米粒(hexosome)[86-87]。与囊泡系统相比,LCNP具备坚固的二维或三维纳米结构、更大的脂质-水界面积和内部疏水性空间,这使其在药物负载与释放方面具有更好的稳定性、灵活性和选择范围[88]。此外,这类液晶纳米结构亦广泛存在于自然界,在细胞中也有类似结构[89],因此当LCNP被应用于皮肤后会与皮肤组织内的中间相或纳米级结构相互作用从而提高渗透性[90]。
在中间体的形成过程中,利用临界堆积参数(P)可以很好地预测优先形成的中间体构型。临界堆积参数计算公式为:
其中V和l分别表示脂质分子疏水尾部的体积和长度,a为脂质分子亲水头部的横截面积。当P=1时,脂质分子形成曲率为零的平面界面;当P<1时,脂质分子优先形成头部向外的正向聚集体;相反,P>1时,脂质分子则形成反向聚集体[91]。此外,离子强度、温度、表面活性剂等因素的变化也会引发P值的改变,进而形成不同的中间相结构[92]。目前常用于制备LCNP的脂质有单油酸甘油酯、植三醇、二油酰基卵磷脂等,常用稳定剂则有泊洛沙姆407、吐温80等。
LCNP的制备方法可分为自上而下和自下而上2种途径。自上而下途径的制备分两步进行:第一步,将脂质与稳定剂混合形成高黏度的预产物;第二步,将预产物通过高压均质或超声等高能方式破碎并分散在水介质中,得到终产物[93]。在自下而上途径中,脂质、稳定剂与有机溶剂的混合物被加入水介质中,并通过搅拌等低能方式形成LCNP,其中有机溶剂的主要作用是溶解脂质并防止脂质在加入水介质前产生黏性液晶[94]。
3.6.1 脂质立方液晶纳米粒 LLC的立方相可分为胶束(不连续)立方相与双连续立方相,其中胶束立方相又可根据脂质胶束堆积方式的不同分为体心立方晶格(bcc)与面心立方晶格(fcc)。立方液晶纳米粒中的立方相为双连续立方相,是由高度弯曲的双连续脂质双层形成的三维蜂窝结构,其中包含被脂质双层分隔开的两个连续而互不相通的内部亲水区域[95]。双连续立方相根据晶格排布不同分为初始晶格(Im3m)、双菱形晶格(Pn3m)以及螺旋二十四面体晶格(Ia3d),这3种不同结构可通过小角度X射线衍射(SAXS)表征结果中不同散射峰强度加以区分[96]。在负载药物时,亲水性药物分子位于脂质头部附近或亲水区域内部,亲脂分子插入脂质的疏水尾部区域,两亲性分子则位于脂质层界面[97]。
在透皮给药应用方面,Salah等[98]开发了依托度酸透皮立方液晶,其在体外释药研究中表现出良好的控释特性,释药速率达到每小时15.08%。在人体药代动力学研究中,依托度酸透皮立方液晶相比于口服胶囊显示出更低的Cmax和更长的药物释放时间,同时生物利用度显著提高至口服胶囊的2.66倍,Salah等推测药物立方液晶可与皮肤脂质相互作用形成药物储库从而提高控释性能。总的来说,依托度酸透皮立方液晶可以避免口服时的胃肠道副作用,同时其控释特性亦能降低给药频次。Nasr等[99]制备并优化了秋水仙碱(COL)立方液晶凝胶,相比于口服溶液,COL立方液晶凝胶剂在大鼠体内的Cmax和Tmax显著提高,表明药物从立方液晶中缓慢释放;同时COL立方液晶的AUC0-t显著增加,生物利用度提高至口服溶液的4.6倍。
3.6.2 脂质六角液晶纳米粒 形成脂质六角液晶的中间相——反向六角相在纳米结构上为平行排列的反向圆柱形胶束,胶束由头部向内的脂质分子组成,而平行的圆柱胶束在横截面上呈二维六角密堆积[90]。在药物负载方面,六角液晶中的药物分布规则与立方液晶相同。
Wan等[100]分别制备了含有反式肉桂醛(TCA)的六角液晶与立方液晶,在体外透皮实验中,两种液晶纳米粒均具有比TCA凝胶更高的累积渗透量和渗透速率。体内药代动力学研究中,TCA六角液晶与立方液晶的生物利用度分别达到TCA凝胶的1.62倍和1.53倍,而更长的平均驻留时间表明两种液晶纳米粒均具备缓释效果,但实际操作中TCA立方液晶过于黏稠,不利于给药。进一步的药效学研究表明,高剂量TCA六角液晶可显著抑制全身炎症模型大鼠的足肿胀,改善滑膜增生和炎性细胞浸润并下调炎症细胞因子水平,其抗炎效果与市售的TCA乳胶剂相似。
4 纳米制剂透皮系统与物理促渗方法的联合应用
尽管上述各类纳米制剂可以通过不同的方式增强药物皮肤渗透,达到药物的透皮递送,但纳米制剂在皮肤给药方面仍主要局限于局部药物递送。近年来,许多研究将物理促渗手段与纳米透皮制剂共同应用,通过物理方法进一步加强纳米制剂的渗透性,实现透皮给药目的。
Teaima等[101]制备了替米沙坦(TEL)醇传递体透皮凝胶,并通过离子导入技术提高其透皮吸收。体内药代动力学研究表明离子导入透皮凝胶的Cmax是单独使用透皮凝胶的1.5倍,是口服市售片剂的1.85倍,同时其Tmax比另2种给药方式降低一半,且表现出更高的生物利用度,综合表明离子导入法提高了TEL醇传递体的皮肤渗透并起到快速吸收作用。Takeuchi等[102]开发了聚乙烯醇包被的17β-雌二醇的PNP(E2-PVAcoated-PNP)并通过离子导入增强其透皮效果,以实现对老年妇女绝经后骨质疏松症(PMO)的治疗。E2-PVAcoated-PNP的表面电荷密度达到无聚乙烯醇包被的常规E2-PNP的82倍,适用于离子导入技术,在体外和体内实验中均表现出比常规NP更高的皮肤渗透性。在药效学实验中,将E2-PVAcoated-PNP通过离子导入施用于PMO大鼠,可观察到大鼠骨密度明显提高,提示该方法是一种很有潜力的PMO治疗手段。
Vora等[103]将亲脂性药物胆钙化醇(CL)的纳米晶体(CL-NC)包埋在可溶性微针(DMN)内,以促进其透皮吸收。CL-NC-DMN表现出足够的机械强度和皮肤插入能力,同时其体外皮肤渗透量(498.2 μg±89.3 μg)显著高于CL-NC贴片(73.2 μg±26.5 μg)。该文献首次报道将疏水药物NC整合至微针阵列中,为疏水药物透皮给药提供了新的思路。Huang等[104]研究了微针对芍药苷醇质体的透皮辅助效果,使用微透析技术进行了体内药代动力学研究。结果表明,微针与醇质体的联合应用对于芍药苷的皮肤渗透起到了协同作用,同时药物醇质体凝胶具有比普通药物凝胶更良好的透皮吸收。
5 结语与展望
综上研究表明,纳米乳、LN等纳米制剂具有提高药物稳定性、缓控释性能好、促进药物经皮吸收等优势,在药物透皮递送方面具有优异应用前景。但纳米透皮制剂的相关研究总体上仍处于基础阶段,在走向临床应用的过程中仍存在以下几方面的难点。
首先,纳米制剂的皮肤给药研究总体上倾向于局部药物递送,而在透皮全身给药所需的更深的组织渗透、更稳定的药物释放与更强的经血管转运等能力上仍有局限。近年来纳米制剂与物理促渗方法的结合一定程度上提高了纳米制剂透皮给药的能力,特别是与微针体系的联合应用,在便于使用的同时可以通过穿刺致孔直接将药物释放至真皮层,是非常具有潜力的纳米制剂透皮给药策略。
其次,在制药方面,如何将制备工艺从实验室规模拓展至工业生产水平也是纳米制剂透皮递送系统未来发展的一大挑战,在这一过程中应当关注纳米制剂相关的基础研究,包括生产设备研发、处方开发、产品表征与稳定性研究等方面,以提高扩大生产过程中的重现性。
另外,虽然FDA已经发布一系列相关指导原则,但是仍没有针对纳米制剂的法规来规范药物研发行业的具体工作,现有的药物审评体系并不完全适用于纳米透皮制剂。同时,对于纳米制剂透皮给药的临床有效性和安全性研究以及非临床药理学和毒理学研究的监管体系尚不完善,关于纳米制剂透皮给药的具体机制和长期给药安全性的研究也尚不充分。因此,监管机构应当加强对纳米透皮制剂的质量控制、深入研究体内外相关性和安全性、汇总统计临床研究与市场数据,推动纳米透皮制剂实现商业化并为其提供指南。
上述问题在纳米透皮制剂研究中亟待解决,相关研究也将在今后成为重点。随着相应技术的开发与完善,相信纳米透皮制剂会逐渐应用于临床治疗并造福于人类。
