免疫细胞在动脉粥样硬化进程中作用的研究进展
2023-08-22李婧玉李琦陈畅
李婧玉,李琦,陈畅**
(1. 哈尔滨医科大学药学院药理学教研室,黑龙江 哈尔滨 150086;2. 哈尔滨医科大学附属肿瘤医院生物治疗中心,黑龙江 哈尔滨150086)
动脉粥样硬化(atherosclerosis,AS)以局部病变血管脂质累积为主要特征,而由斑块破裂所导致的局部血栓形成更是引起急性心肌梗死的主要原因[1]。研究证实,多种因素参与AS的发生发展,主要包括血管平滑肌细胞(vascular smooth muscle cell,VSMC)、血管内皮细胞(endothelial cell,EC)、血小板活化、氧化应激和血管炎症反应等[2]。尽管目前对于AS的发病机制存在着多种假说,但是任何一种假说都不能独立且全面地阐述AS的发生和发展。最新研究表明,机体固有免疫和适应性免疫在AS的发生和发展过程中扮演着重要的角色[3],提示机体免疫系统的异常改变很可能是促进AS形成的关键,同时也是导致斑块不稳定的重要诱发原因之一[4]。本文就各类免疫细胞在AS发生发展过程中所起到的作用,以及近年来针对AS的抗炎免疫治疗研究进展进行综述,以期进一步解释免疫活化在AS中的作用机制,并为以免疫细胞为治疗靶点的临床药物的研发提供思路。
1 动脉粥样硬化病理概述
AS病变早期,EC在高胆固醇、吸烟、高血压及炎症等因素的刺激下发生损伤,同时分泌黏附分子和趋化因子,进而招募单核细胞进入血管内膜下,促进单核细胞转化为巨噬细胞(macrophage,Mø)。活化后的巨噬细胞通过其表面清道夫受体(scavenger receptor,SR)识别氧化型低密度脂蛋白(oxidized low density lipoprotein,ox-LDL),并吞噬脂蛋白及胆固醇结晶,将胆固醇重新酯化从而形成泡沫细胞。泡沫细胞在病变血管内膜下大量堆积形成脂纹,随着胞内脂质的不断累积以及死亡细胞的大量堆积,最终形成AS斑块[5]。
2 动脉粥样硬化过程中免疫细胞的作用
大量基础与临床研究发现,在AS斑块内存在多种免疫细胞的浸润,且局部微环境会发生一系列复杂的变化,提示AS与机体固有免疫和适应性免疫的异常改变密切相关。研究人员通过免疫学技术发现,免疫细胞约占 AS斑块组织的 1/5,而常驻的基质细胞,包括血管平滑肌细胞、内皮细胞和成纤维细胞,通过分泌趋化因子影响局部斑块免疫细胞的异位浸润。在斑块内适应性免疫细胞和固有免疫细胞参与AS进展的过程中,T细胞浸润病变血管,通过释放细胞因子促使单核/巨噬细胞活化并吞噬脂质,从而形成单核细胞/巨噬细胞源性的泡沫细胞[6];此外,ox-LDL发生沉积,促进单核细胞源性树突状细胞(dendritic cell,DC)分化成熟,并激活T细胞,进而使上述细胞参与AS斑块处的免疫性炎症病变[7]。这些对免疫系统异常改变的研究有助于揭示AS的发病机制,并为开发新的预防和治疗策略提供理论依据。
2.1 T细胞在动脉粥样硬化中的作用
T细胞来源于骨髓中的淋巴样祖细胞,在胸腺中发育成熟,主要介导适应性免疫应答,在机体清除病原体以及对肿瘤的免疫反应中起着关键作用[8]。根据分化阶段的不同,T细胞可分为初始T细胞(native T cell)、效应T细胞(effector T cell)和记忆性T细胞(memory T cell)[9]。根据是否表达CD4或CD8分子,T细胞可分为CD4+T细胞[又称为辅助性T细胞(helper T lymphocyte,Th)]和CD8+T细胞[又称为细胞毒性T细胞(cytotoxic T lymphocyte,CTL)][10]。
研究发现,AS斑块中存在大量CD4+T细胞,通过分泌炎症因子,在炎症因子的作用下诱发血管内皮细胞损伤及促进巨噬细胞活化并吞噬脂质,形成泡沫细胞。且存在于斑块内的CD4+T细胞在局部微环境的不断刺激下,还能定向分化为Th1、Th2或Th17细胞亚群[11]并最终放大炎症反应。
研究证实,Th1通过释放干扰素(IFN)-γ、白细胞介素(interleukin,IL)-2和IL-12进而发挥促AS的作用。此外,活化的巨噬细胞所分泌的IL-12和IL-18同样还具有诱导CD4+T细胞向Th1分化并分泌IFN-γ的作用[12]。而Th2在AS中同样具有重要作用。Th2所分泌的IL-4作为经典的促炎因子具有诱导巨噬细胞膜表面CD36、SR-A、血管细胞黏附因子(vascular cell adhesion molecule,VCAM)-1、基质金属酶(matrix metalloproteinases,MMP)-1及单核细胞趋化蛋白(monocyte chemotactic protein,MCP)-1表达的作用。而IL-13则具有促胶原蛋白沉积及诱导巨噬细胞极化为M2型巨噬细胞的作用。
Th17属于CD4+T细胞,可以分泌多种细胞因子,主要有IL-17A、IL-17F和IL-22等[13]。Th17具有促进中性粒细胞活化,进而调控机体免疫反应的作用[14]。研究发现,Th17及其所分泌的细胞因子IL-17与AS的病理进程呈正相关[15]。尽管研究证实IL-17具有促AS的作用[16],但也有部分学者认为IL-17同样还具有抗AS的作用[17]。有文献报道,敲除IL-17明显减轻血管炎症反应及淋巴细胞浸润[18]。且IL-17的稳定存在还有利于斑块的稳定性[19]。
调节性T细胞(regulatory T cell,Treg)是一种控制体内自身免疫反应性的T细胞亚群,可分为天然产生的Treg和诱导产生的Treg。体内Treg可抑制多种免疫细胞包括CD4+T细胞、CD8+T细胞、B细胞和自然杀伤T细胞(natural killer T cell,NKT)细胞的活化。研究证实,动物体内Treg的募集和功能抑制,可明显促进AS的进程[20-21],提示Treg在AS的发生发展中具有重要作用。
研究人员在AS斑块的肩部区和纤维帽周围发现大量CD8+T细胞。清除体内CD8+T细胞可导致斑块稳定性降低、胶原蛋白含量明显减少,以及巨噬细胞含量和坏死核心面积增加[22]。
2.2 巨噬细胞在动脉粥样硬化中的作用
巨噬细胞由单核细胞进入组织器官和表皮层分化而来[23]。单核细胞进入组织器官后,体积增大,细胞内溶酶体增多并伴有吞噬能力增强。巨噬细胞在全身广泛分布,主要分为组织内固有型巨噬细胞和游走型巨噬细胞。体内巨噬细胞主要作用是清除衰老损伤或凋亡的细胞、免疫复合物和病原体等抗原性异物[24]。机体内巨噬细胞在刺激因素作用下具有明显的极化现象,即形成M1型(促炎性)和M2型(抗炎型)巨噬细胞。研究表明,巨噬细胞在机体免疫应答中起到重要作用,尤其在机体固有免疫应答、炎症反应和血管类疾病中均扮演着重要角色[25]。
在AS形成早期,单核细胞由管腔迁移至血管中层并分化形成巨噬细胞,通过吞噬局部累积的脂质,进而形成泡沫细胞,大量泡沫细胞的堆积加速了AS斑块的损伤,最终导致斑块破裂和血栓形成。这一病理进程是构成AS脂纹的重要病理基础[26]。同时,巨噬细胞还具有分泌基质金属蛋白酶(matrix metalloproteinase,MMP)的功能,从而降解斑块内的胶原纤维,从而导致纤维帽结构的不稳定并诱发斑块破裂,最终导致病变血管内血栓形成[27]。
迁移至血管中层的巨噬细胞可极化为M1和M2表型[28]。M1型巨噬细胞通过巨噬细胞源性炎症因子或诱导性一氧化氮合酶(inducible nitric oxide synthase,iNOS)源性一氧化氮(nitric oxide,NO)促进斑块内炎症反应。而M2型巨噬细胞则具有抗炎作用,通过清除局部凋亡细胞,进而抑制免疫细胞的持续性招募[29]。研究发现,机体内M2型巨噬细胞存在不同亚型,即M2a、M2b、M2c和M2d[30]。机体内的多种细胞因子或炎症因子可通过细胞信号转导途径促使M2型巨噬细胞向不同亚型分化。例如,Th2分泌的IL-13促使M2型巨噬细胞向M2a分化[31],IL-10具有诱导M2型巨噬细胞向M2c巨噬细胞分化的作用[32]。上述结果提示机体内多种免疫细胞间存在明显相互作用,进而在AS的发生发展过程中扮演重要的角色。
巨噬细胞迁移抑制因子(macrophage migration inhibitory factor,MIF)在AS的发展进程中同样具有重要的作用。MIF通过趋化因子受体-4(CXCR4)促进免疫细胞在局部病灶聚集并加重AS斑块形成[33]。此外,巨噬细胞还具有促胆固醇逆向转运进而抑制斑块形成的作用[34]。
2.3 B细胞在动脉粥样硬化中的作用
B细胞是机体内抗体产生细胞,其在免疫器官中聚集并形成淋巴细胞冠状带(mantle zone)。在抗原刺激和Th作用下,B细胞活化增殖并形成生发中心(germinal center)暗区,进而分化形成浆细胞和记忆性B细胞[35]。B细胞膜表面表达多种膜分子,在B细胞识别抗原、加工提呈及产生抗体中具有重要的意义[36]。B细胞根据细胞膜表面标记物的不同,可以分为B1细胞、B2细胞和边缘区B细胞3个亚群。
动物实验显示,在刺激因素存在条件下,B1细胞可分化为B1a和B1b细胞,而B1a细胞可合成并释放天然的抗氧化低密度脂蛋白的IgM,从而抑制巨噬细胞对ox-LDL的摄取,并最终抑制泡沫细胞的产生。除此之外由B1a产生的IgM还具有抑制AS斑块内坏死核心形成的作用[37]。
研究发现,B2细胞可以通过至少2种机制促进AS:B2细胞合成分泌的肿瘤坏死因子(TNF)-α可扩大坏死核心和增加凋亡细胞,使巨噬细胞的募集和炎症细胞因子的表达增加,从而促进AS的发展[38];B2细胞将抗原递呈给可导致AS的CD4+T细胞,并激活这些T细胞,进一步加重AS。此外,B2细胞致AS的作用也可能与其合成分泌的IgG有关[39]。尽管研究证实B2细胞具有促进AS作用,但关于IgG在AS中的作用目前还存在着争议[40]。
此外,调节性B细胞(regulatory B cell,Breg)合成并分泌的IL-10同样具有抗AS作用[7]。临床前研究揭示,机体B细胞消耗与AS斑块形成间存在负相关,提示B细胞数量在AS的发生发展过程中具有重要作用[41]。
2.4 树突状细胞在动脉粥样硬化中的作用
DC起源于CD34+前体细胞,广泛分布于除脑以外的全身各组织脏器。机体内DC根据其来源不同可分为髓样DC(myeloid DC)和淋巴样DC(lymphoid DC)[42]。DC是机体内专职的抗原递呈细胞(antigen-presenting cell,APC),其主要功能是摄取、加工处理和提呈抗原,进而启动特异性免疫应答[43]。研究证实,由DC分泌生成的IL-12与T细胞分化密切相关[44]。
正常血管壁中存在有少量驻留DC。研究人员在AS病变血管中检测发现CD11c+阳性细胞显著增加,同时伴随斑块稳定程度下降。这一观察结果提示DC与AS间存在明显正相关。而这种DC与AS间的正相关很可能是DC通过活化巨噬细胞或促Th1型免疫应答而实现的[45]。
临床研究发现,AS患者斑块内可检测到大量成熟型DC,提示DC在斑块形成的过程中很可能具有重要作用[46]。除此之外,大量的临床数据表明经典他汀类药物抑制AS形成的作用很可能与调控DC的专职抗原递呈功能有关[47]。DC除行使抗原递呈功能外,还具有促炎性介质及趋化因子分泌的功能。研究发现,成熟的DC表达趋化因子受体CCR-7,通过CCR-7介导的信号途径进而启动CD4+和CD8+T细胞反应,同时分泌IL-15、IL-12和IFN等细胞因子[48]。斑块内DC还可以通过分泌CCL2和CCL14吸引未成熟的DC,从而促使未成熟DC在局部炎症微环境下分化为成熟的抗原呈递DC[49]。
研究显示,浆细胞样DC(plasmacytoid DC,pDC)在共刺激分子(如CD40和CD80等)作用下通过向T细胞递呈抗原、进而诱导T细胞增殖分化参与AS[50]。但也有研究认为,pDC通过抑制外周T细胞的增殖活化来拮抗AS的发生发展[51]。
2.5 免疫细胞协同调控动脉粥样硬化
在AS病变早期,LDL在血管中膜大量累积,经氧化修饰后形成ox-LDL。ox-LDL除具有诱导EC的VCAM-1表达的作用外,还能促进单核细胞和T细胞向血管壁迁移黏附[52]。与此同时,在巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)和粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)的共同作用下,浸润的单核细胞转化为巨噬细胞[53],随后巨噬细胞通过吞噬ox-LDL而转化为泡沫细胞,进而加重AS的病理进程[54]。病变血管局部泡沫细胞在不断累积的同时还可以通过APC促进T细胞活化[55],从而进一步加剧AS。在AS晚期,活化的T细胞通过IL-12和IL-18等细胞因子进一步诱发Th1释放IFN-γ和TNF-α,促使VSMC增殖并向管腔迁移,参与血管重构及胶原蛋白生成[56](见图1)。
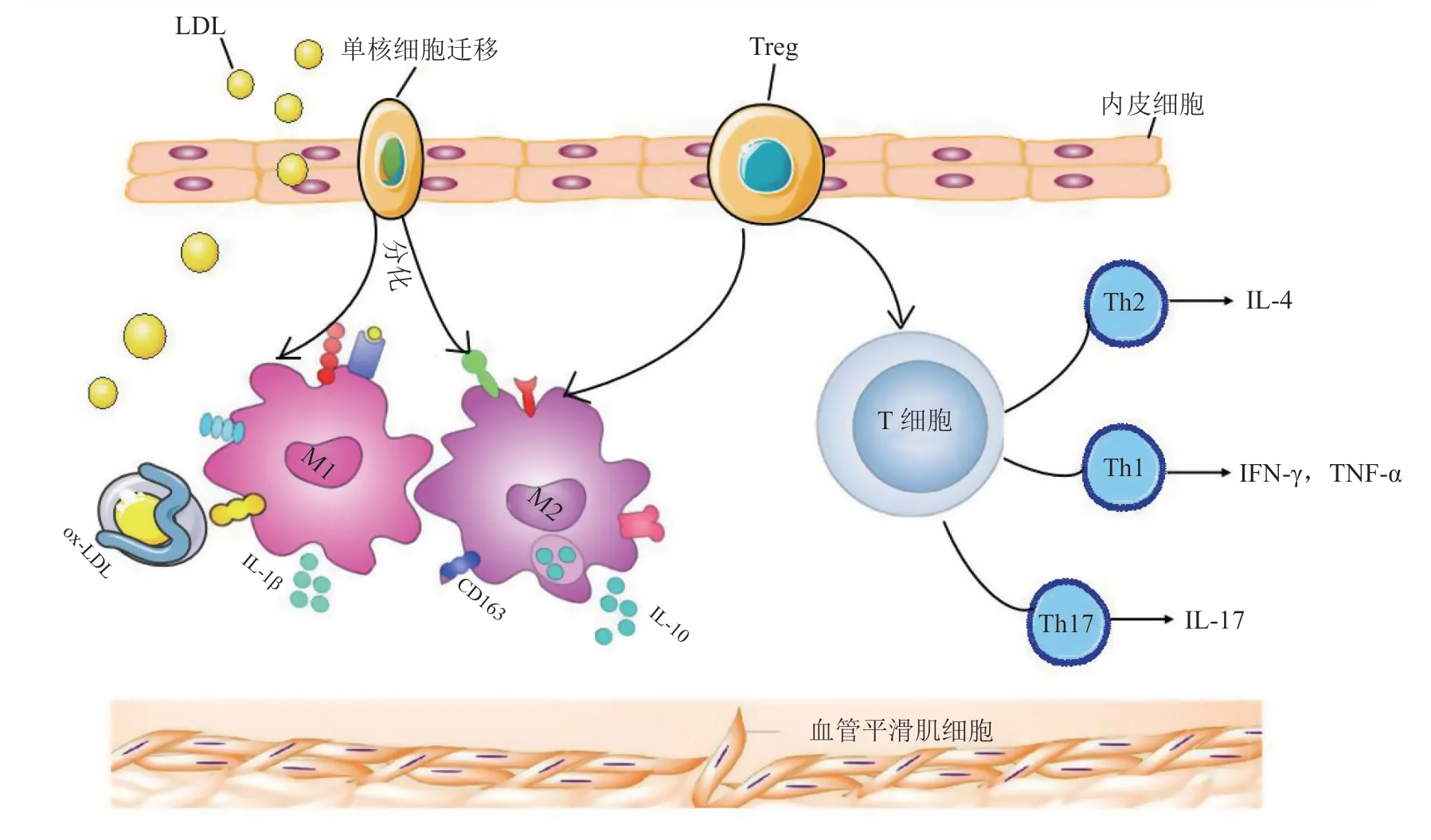
图1 免疫细胞在动脉粥样硬化中的作用Figure 1 The role of immune cells in atherosclerosis
3 动脉粥样硬化的免疫治疗策略
随着对AS发生发展过程中免疫系统活化研究的不断深入,人们发现免疫系统在AS全过程中均具有重要意义。因此,研发相应的免疫活化抑制策略便成为了AS免疫治疗领域的重要目标。
3.1 抗动脉粥样硬化疫苗
AS疫苗一直是AS治疗研究领域的热点之一。现有研究方向主要包括:1)以抑制Treg或免疫因子释放为作用机制,如由载脂蛋白B(ApoB)来源的多肽片段研制的疫苗;2)通过直接或间接的方式调控机体胆固醇水平,如胆固醇酯转运蛋白(cholesteryl ester transfer protein,CETP)疫苗。
ApoB-100作为人体中ApoB的主要亚型之一,具有良好的免疫原性、安全性和稳定性,在AS预防中具有良好的应用价值。早期研究着眼于ApoB-100肽疫苗的体液免疫作用[57]。目前更多的研究却倾向于ApoB-100肽疫苗通过细胞免疫发挥抗AS作用[58]。有研究表明,应用ApoB-100肽疫苗后可明显促Treg活化增殖并诱发由Th2介导的免疫反应[59]。虽然动物实验证实ApoB-100肽疫苗具有明显的抗AS疗效,但ApoB-100肽疫苗活化Treg的安全性和有效性仍需进一步研究[60]。
3.2 B细胞活化抑制药物
B细胞抗原受体(B cell receptor,BCR)复合物由识别和结合抗原的胞膜免疫球蛋白(mIg)和传递抗原刺激信号的Igα(CD79a)/Igβ(CD79b)异源二聚体组成,具有调控B细胞活化及增殖的作用。研究发现由BCR复合物所诱发的B1a细胞活化及IgM的生成与B细胞膜表面抗原CD20间存在密切关联。CD20表达于除浆细胞外的各发育阶段的B细胞,通过调节钙离子跨膜来调控B细胞的增殖分化。研究表明,应用CD20单克隆抗体利妥昔单抗(rituximab,商品名:Rituxan)治疗类风湿性关节炎时,患者血浆脂蛋白及动脉粥样硬化指数均存在明显下降,提示抑制B细胞活化在AS治疗中具有重要意义[61-62]。然而也有研究显示利妥昔单抗会明显增加心脏移植患者AS斑块体积百分比(percent atheroma volume,PAV)[63]。虽然以CD20为靶点来消耗B细胞在AS治疗中具有一定效果,但是长期B细胞消耗可能会导致机体面临感染风险的增加。因此,若要将抑制B细胞活化的策略广泛应用于AS治疗,还需要深入研究B细胞在AS中的作用机制,为临床治疗提供充分的理论依据。
3.3 具有抗炎活性的药物
越来越多的临床前及临床研究表明,炎症反应在AS 中起到至关重要的作用。他汀类药物不仅具有调脂作用,还具有抑制单核/巨噬细胞黏附及抑制斑块内T细胞活性的作用[64]。氯吡格雷属于第2代血小板二磷酸腺苷受体亚基12(platelet adenosine diphosphate receptor subunit 12,P2Y12)受体拮抗药,具有显著的抗血小板聚集作用。最新临床研究表明,氯吡格雷除抑制血小板活化外,还可抑制炎症因子释放[65]。研究发现环氧合酶-2(cyclooxygenase,COX)-2介导的前列腺素(prostaglandin,PG)生成,在趋化因子及炎性细胞活化中具有重要作用,提示以COX-2为靶点的药物或可用于抗AS治疗[66]。
3.4 免疫抑制药物
许多免疫抑制药物常被应用于药物洗脱支架(drug-eluting stent,DES)。通过向血管壁缓慢释放药物,抑制局部炎症反应,从而达到抑制VSMC增殖迁移的作用[67]。除应用于药物洗脱支架外,口服免疫抑制药物同样具有良好的治疗效果。研究表明,与金属裸支架(bare metal stent,BMS)相比,口服免疫抑制药物可明显降低血管再狭窄的风险[68]。有研究报道,硫唑嘌呤(细胞周期特异性抑制剂)、他克莫司和环孢素A(CsA)可调控细胞周期,从而影响T细胞和B细胞的生长[69]。然而,CsA对代谢的调控作用复杂,且极易影响机体正常组织的生理功能,因此对于CsA在AS治疗中究竟扮演什么样的角色,业界观点尚不统一[70]。需强调的是,长期服用免疫抑制剂极易导致机体免疫功能下降,从而造成极高的感染[71]。因此,对于免疫抑制剂的应用还需要更多的临床前及临床数据支持。
4 结语与展望
AS是心血管系统疾病中的常见病,发病机制复杂,而机体免疫系统活化则贯穿AS全过程。近年来,随着对免疫功能研究的不断深入,免疫细胞在AS中的重要作用也逐步被证实,为免疫活化在AS发生发展中作用机制的阐明以及临床治疗新策略的发现奠定了理论基础。以免疫活化抑制为切入点,研发可靶向抑制免疫细胞从而延缓和减少AS斑块形成的治疗药物,成为目前AS治疗领域的重要方向之一。值得注意的是,尽管各类免疫细胞在AS发生发展过程中的作用已被广泛研究,但鉴于机体免疫细胞种类的多样性,以及各类免疫细胞间的相互作用与免疫细胞活化调控通路的复杂性,继续开展对AS过程中免疫细胞间相互作用及其调控机制的深入探索仍是现阶段的重要任务,也是解决从基础研究走向临床转化的瓶颈问题的关键。
