外周血淋巴细胞/单核细胞比值在预测多发性骨髓瘤患者预后中的应用价值研究
2023-08-19赵海军张丽翠
赵海军,张丽翠,张 玉,魏 瑜
(石河子大学第一附属医院检验科,新疆 石河子 832000)
多发性骨髓瘤(multipe myeloma,MM)是临床上常见的恶性肿瘤之一,其主要临床特点是分泌单克隆免疫球蛋白的浆细胞异常增殖。MM 占血液系统恶性肿瘤的10%,本病患者占全部癌症患者的0.9%[1]。临床上针对MM 患者主要以药物治疗为主,常用的药物有蛋白酶抑制剂、免疫调节剂等[2]。近年来随着医疗技术的不断发展,MM 的治疗方案也更加多样化,然而本病仍无法治愈,临床只能通过治疗延长患者的生存期,提高其生存质量。MM 患者的治疗受到全球医学界的关注,在新修订的国际分期系统(revised international staging system,R-ISS)中[3],将一些实验室指标作为MM 患者治疗效果和预后的预测指标,其中就包括外周血淋巴细胞计数(bsolute lymphocyte count,ALC)与 单 核 细 胞 计 数(absolute monocyte count,AMC)比 值(ALC/AMC ratio,LMR)[4]。国外的临床研究显示,LMR 是影响MM 患者预后的独立因素[5]。本文就LMR 在预测MM 患者预后中的应用价值进行探讨分析,现报道如下。
1 资料与方法
1.1 临床资料
回顾性分析2020 年1 月至2022 年12 月石河子大学第一附属医院收治的62 例MM 患者的临床资料。纳入标准:(1)病情符合《中国多发性骨髓瘤诊治指南(2015 年)》[6]中关于MM 的诊断标准,且患者分为有症状和无症状两类;(2)临床资料完整,并能够积极配合研究;(3)患者及其家属对本研究知情,并自愿参与。排除标准:(1)合并其他恶性肿瘤;(2)既往治疗中接受过化疗;(3)既往有其他免疫药物治疗史;(4)中途因不可抗力因素退出研究。62 例MM 患者中,有男性患者33 例(53.23%),女性患者29 例(46.77%);中位年龄为64 岁(年龄范围:54 ~74 岁),其中年龄≥65 岁者有17 例(27.42%);MM 分型:免疫球蛋白G(IgG)型41 例(66.13%)、免疫球蛋白A(IgA)型14 例(22.58%)、轻链型7例(11.29%);Durie-Salmon(DS)分 期:Ⅰ期11例(17.74%)、Ⅱ期10 例(16.13%)、Ⅲ期41 例(66.13%);R-ISS 分期:Ⅰ期13 例(20.97%)、Ⅱ期21 例(33.87%)、Ⅲ期28 例(45.16%)。
1.2 方法
收集患者的资料,并查阅相关病历,对患者的性别、年龄、DS 分期、R-ISS 分期、血红蛋白(Hb)、β2-微球蛋白(β2-MG)、血肌酐、乳酸脱氢酶(LDH)、骨髓浆细胞比例、LMR 等临床资料进行收集、整理。随访及预后评估:对患者进行随访,随访方式主要为门诊及电话随访,统计患者的5 年总生存(OS)率及无进展生存(PFS)率。OS 时间指从患者发病起至其死亡时间或末次随访时间;PFS 时间指从患者发病起至疾病进展或死亡的时间。观察MM 患者LMR 阈值的分布情况,根据患者的LMR 将其分为高LMR 组与低LMR 组,比较两组的5 年OS 率与PFS 率。对影响MM 患者预后的因素进行单因素及多因素分析。
1.3 统计学方法
2 结果
2.1 MM 患者LMR 阈值的分布情况
根据ROC 曲线,将ALC 1.24×109/L 作为其最佳界值(AUC 为0.549、敏感度为70.38%、特异度为44.52%),据此将患者分为高ALC 组(≥1.24×109/L)和 低ALC 组(<1.24×109/L),例 数 分 别 为40 例(64.52%)、22 例(35.48%);外周血AMC 的最佳界值为0.60×109/L(AUC 为0.641、敏感度为33.78%、特异度为83.29%),据此将患者分为高AMC 组(≥0.60×109/L)和 低AMC 组(<0.60×109/L),例数分别为44 例(70.97%)、18 例(29.03%);外周血LMR 的最佳界值为3.60(AUC 为0.599、敏感度为41.00%、特异度为41.00%),据此将患者分为高LMR 组(>3.60)和低LMR 组(≤3.60),例数分别为39 例(62.90%)、23 例(37.10%)。
2.2 LMR 与患者预后之间的关系
按照国际骨髓瘤工作组制定的疗效判定标准展开判断,疗效分为完全缓解、部分缓解、稳定、进展。对患者化疗4 周后的疗效展开评估,本研究的62 例MM 患者中,44 例患者治疗有效,有效率为70.97%。所有患者均能接受随访,将其纳入生存分析中,结果显示高LMR 组的5 年OS 率为84.62%(33/39),低LMR组 的5 年OS 率 为56.52%(13/23),组 间 差 异 明显(P<0.05)。高LMR 组的5 年PFS 率为76.92%(30/39),低LMR 组的5 年PFS 率为30.43%(7/23),组间差异明显(P<0.05)。
2.3 影响MM 患者预后的单因素分析
以5 年OS 为预后良好,展开单因素分析,结果发现,不同性别、年龄患者的5 年OS 率差异不显著(P>0.05);不同DS 分期、Hb、β2-MG、血肌酐、LDH、骨髓浆细胞比例、LMR 患者的5 年OS 率差异显著(P<0.05)。详见表1。
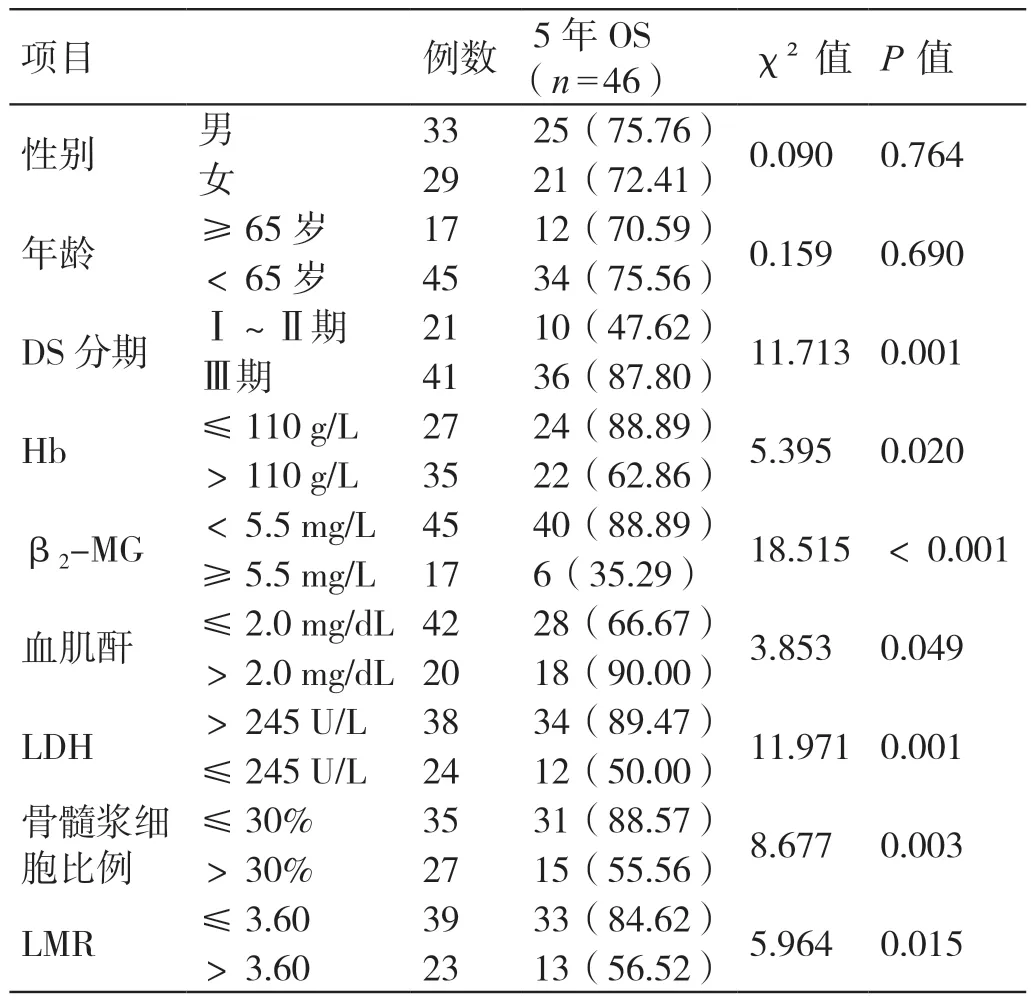
表1 影响MM 患者预后的单因素分析[例(%)]
2.4 影响MM 患者预后的多因素分析
将经单因素分析后有显著差异的因素纳入到多因素分析中,再将性别和年龄这两个常见影响因素同时纳入多因素分析中,结果得出,DS 分期 Ⅲ 期、LDH >245 U/L、β2-MG ≥5.5 mg/L、Hb ≤110 g/L、LMR ≤3.60 是导致MM 患者预后不良的独立危险因素(P<0.05)。详见表2。
3 讨论
恶性肿瘤在发生、发展的过程中,会伴有免疫系统的改变,炎性反应使大量白细胞聚集并凋亡,这对患者机体的抗肿瘤免疫应答反应有严重的影响,进而使肿瘤细胞数量大幅度增加。淋巴细胞、单核细胞是人体内重要的免疫细胞,在肿瘤的发生、发展中起到重要作用[7]。外周血ALC、AMC 及LMR 是一类相对容易获得的免疫检测指标[8],且检测费用较为廉价,对患者造成的经济压力较小,患者更容易接受。现阶段,临床上关于LMR 与肿瘤相关的机制并不十分明确,这与患者治疗前的免疫抑制、免疫缺陷、机体对淋巴细胞的依赖性等均有很大关系[9]。而MM 的发生与机体免疫功能缺陷密切相关,虽然其具体机制尚不明确。MM 患者在病情进展的过程中,会出现局部或全身免疫微环境的改变[10],其中淋巴细胞和单核细胞均参与了肿瘤的发生、发展,对二者及其比值进行测定有助于评估患者的预后,包括5 年OS 率与PFS率[11-12]。本次研究选取的指标均与临床密切相关,可以很好地评估MM 患者的治疗效果及预后。本研究中,高LMR 组的5 年OS 率为84.62%(33/39),低LMR组 的5 年OS 率 为56.52%(13/23),组 间 差 异 明显(P<0.05);高LMR 组的5 年PFS 率为76.92%(30/39),低LMR 组的5 年PFS 率为30.43%(7/23),组间差异明显(P<0.05)。此外,本研究还发现,DS 分期Ⅲ期、LDH >245 U/L、β2-MG ≥5.5 mg/L、Hb ≤110 g/L、LMR ≤3.60 是导致MM 患者预后不良的独立危险因素。可见,LMR 是MM 患者预后的独立影响因素(P<0.05)。这是因为,LMR 可以有效反映MM 患者体内抗肿瘤细胞的增殖、扩散能力[13],LMR 较低者体内抗肿瘤免疫应答被抑制,肿瘤细胞恶性增殖活动加快,故其预后较差。同时,ALC作为适用性免疫效应细胞,其功能被抑制可导致机体对肿瘤细胞等有害因子的抵抗力减弱,这类患者更容易出现感染等情况,导致其预后不良[14-15]。
综上所述,LMR 在MM 患者的预后预测中具有较高的应用价值,可为临床治疗方案的制定提供重要依据。
