碳离子辐射诱导的远隔效应*
2023-08-14高玉婷金晓东
高玉婷 李 媛 金晓东
(1)西北师范大学生命科学学院,兰州 730070;2)中国科学院近代物理研究所,兰州 730000)
放射治疗(radiotherapy,RT)可以诱导肿瘤细胞DNA 损伤和增殖性死亡,引发肿瘤微环境(tumor microenvironment,TME) 的变化,超过50%的肿瘤患者采用RT 或RT 联合其他治疗手段(手术、化疗等)进行肿瘤治疗[1]。RT 对TME 有免疫促进和免疫抑制作用,RT 通过诱导肿瘤细胞主要组织相容性复合体I类分子的表达[2]、促进免疫相关细胞因子和趋化因子的分泌以及促进免疫细胞向TME的迁移等,增强TME中的免疫原性[3-4],但RT 也能增强肿瘤细胞辐射抗性和肿瘤复发、转移的风险[5]。RT对TME的不同作用主要由辐射性质决定,包括辐射类型、辐射剂量及剂量分割方式等[6]。其中有一类RT 引发的特殊免疫刺激效应——远隔效应(abscopal effect,AE,也称远端效应、远位效应),引起了研究者的关注。AE在临床上非常罕见且不可预测,研究者对其发生机制也知之甚少。本文探讨了AE发生的免疫学机制以及碳离子诱导的AE,为寻找新的肿瘤RT方法提供理论基础。
1 远隔效应(AE)
1.1 AE的临床研究
AE 是指局部RT 引起的、在未接受RT 部位产生的抗肿瘤反应现象,由Mole[7]在1953年首次提出,当时Mole 对大鼠的腹部进行照射后,观察到大鼠甲状腺合成能力的下降,进而提出了辐射诱发AE 的概念。缺乏对肿瘤转移病灶的有效控制是晚期癌症患者死亡的主要原因,因此,发现AE具有重大的临床意义[8-9]。回顾1969~2019年间AE的病例报告,发现临床至少报告了55 例RT 诱导的AE病例,病种包括非小细胞肺癌、肾癌、黑色素瘤、淋巴癌以及肝癌等,发生AE 的患者5 年总存活率为63%,无进展生存率为45%,报告的病例除了接受RT 外,还接受了手术、化疗和免疫治疗(immunotherapy,IO)等辅助治疗手段[10]。
相关研究表明,转移性肿瘤患者在接受IO(尤其是免疫检查点抑制剂)的基础上加以RT,更易诱发 AE。 Theelen 等[11]对比分析了Pembrolizumab (PD-1 抑 制 剂 ) 以 及Pembrolizumab联合RT对非小细胞肺癌患者的治疗效果,发现接受Pembrolizumab 治疗的患者AE 发生率为19.7%,接受Pembrolizumab联合RT治疗的患者AE发生率为41.7%。Postow等[12]对一例接受过ipilimumab(CTLA-4 抑制剂)单抗治疗的黑色素瘤患者进行RT,发现患者非辐照部位(右肺门淋巴结、脾脏)的转移病灶开始缩小,单核细胞和CD4+T 细胞数量增加。此外,鉴于RT 联合IO 在AE 研究中的进展,研究者提出了RT 与IO 联合治疗其他转移癌的策略,包括卵巢癌[13]、头颈癌[14]及乳腺癌[15]等,并且可能取得良好的治疗效果。
因此,目前的临床研究充分证明,RT 能够引起肿瘤AE 的发生,当与IO 联合治疗时AE 效果更加明显,但由于病例的稀有性,AE 发生的具体机制以及AE 在恶性肿瘤患者治疗中的作用还有待研究。
1.2 AE的发生机制
科学家们不断研究RT 引发AE 的生物学机制。2004 年,Demaria 等[16]首次发现免疫缺陷的小鼠不会发生AE,这是最早将AE 与免疫相联系的研究。目前,一般认为功能性的T 细胞对引发AE 起关键作用。RT可诱导肿瘤细胞释放肿瘤相关抗原,这些抗原被抗原呈递细胞(antigen-presenting cells,APCs) 识别并呈递到肿瘤引流淋巴结,激活CD8+T 细胞成为细胞毒性T 淋巴细胞(cytotoxic T lymphocytes,CTLs),CTLs 通过血液运输到未辐照的转移灶,引发AE[17-18]。此外,Kroemer 等[19]提出了免疫原性细胞死亡(immunogenic cell death,ICD)诱发的AE,这与凋亡细胞表面呈递或释放出的损伤相关分子模式(damage associated molecular patterns,DAMPs)有关。DAMPs 包括I型干扰素(type I interferon,IFN-I)、钙网蛋白(calreticulin,CRT)、高迁移率族蛋白B1(high mobility group protein 1,HMGB1)、ATP 和热休克蛋白 (heat shock proteins, HSPs) 等[20-21]。DAMPs通过与TME中的免疫因子及细胞等相互作用,诱导肿瘤免疫的发生。
1.2.1DAMPs诱导的AE
a. IFN-I
辐射通过直接和间接方式诱导肿瘤细胞DNA损伤,包括DNA双链断裂、DNA单链断裂等,其中DNA 双链断裂是引起细胞死亡的主要损伤类型[22-23]。当辐射诱导DNA 双链断裂在核内修复失败后,游离的双链DNA(double-stranded DNA,dsDNA)进入细胞质,结合并激活胞质内的环化GMP-AMP 合成酶(cyclic GMP-AMP synthase,cGAS)传感器,催化ATP 和GTP 生成环鸟苷单磷酸腺苷单磷酸合酶,该酶作为胞内第二信使激活干扰素基因刺激因子(stimulator of interferon genes,STING),最终促进IFN-I 产生,IFN-I 还可由受辐照肿瘤细胞产生的肿瘤相关抗原激活树突状细胞(dendritic cells,DCs)中的cGAS-STING 通路产生,最终调节下游免疫刺激基因的活性,促进DCs的募集和活化[24-26]。活化的DCs 迁移到肿瘤引流淋巴结,激活CD8+T细胞转变为CTLs,CTLs离开肿瘤引流淋巴结并迁移到远处的转移肿瘤部位,引发AE[27-29](图1)。
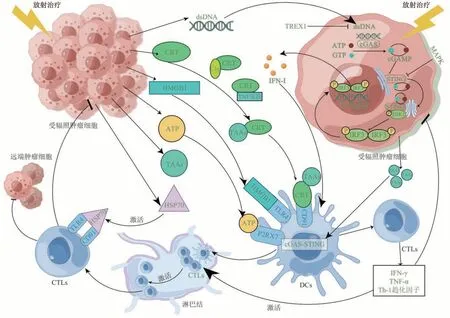
Fig. 1 Mechanism of the abscopal effect induced by radiation图1 辐射诱导远隔效应发生的机制
然而,cGAS-STING 通路会受到p38 丝裂原活化蛋白激酶和DNA 外切酶的负调控。研究表明,在衰老细胞中,激活p38丝裂原活化蛋白激酶会抑制STING,抑制IFN-I 产生[30]。此外,胞质dsDNA 的积累与辐射剂量相关,更高辐射剂量会导致更多的DNA 损伤,产生更多的胞质dsDNA,但同时也会激活胞质DNA 外切酶来降解胞质dsDNA[31]。因此,寻找既能维持cGAS-STING 通路的激活,又能最小化DNA外切酶降解效应的RT方案(辐射剂量与分次)至关重要,这是将AE应用于临床中首要考虑的因素。另外,dsDNA 的来源并不限于细胞核,最近的一项研究发现,线粒体释放的dsDNA 也能够诱导AE 的发生[32]。总之,IFN-I是肿瘤TME产生免疫促进作用的重要细胞因子,对AE的发生也至关重要。
b. 其他DAMPs
如上所述,dsDNA 诱导的IFN-I 对产生AE 至关重要。除此之外,CRT、HMGB1、ATP 和HSPs也能被免疫系统识别,并在AE 中发挥相应作用。在辐射诱导的ICD期间,CRT会快速富集在细胞表面,并与不同受体相互作用,产生生物效应。例如,CRT与补体因子C1q作用,促进凋亡细胞的清除,CRT 与肿瘤坏死因子(tumor necrosis factor,TNF)家族的多个成员作用,特别是TNF相关的凋亡诱导配体,促进吞噬细胞的有效摄取。此外,CRT 还能解除CD47-SIRPα 信号通路对吞噬细胞吞噬功能的抑制[20]。HMGB1 通过结合APCs 上表达的受体(如DCs 上的Toll 样受体2/4)形成晚期糖基化终末产物,促进细胞因子的产生和抗原呈递,激活DCs[33]。ATP可结合APCs上的嘌呤受体(如巨噬细胞上的P2Y2 和DCs 上的P2X7),激活炎性体(一种多蛋白质复合物)组装,刺激炎性细胞因子的产生,从而促进免疫细胞募集,增强抗肿瘤作用[34]。HSP70 可与Toll 样受体4 和CD91 结合,激活CTLs 和自然杀伤细胞[35]。活化的CTLs 能释放炎性细胞因子TNF-α 和IFN-γ,这些细胞因子通过激活淋巴结中的CD8+T细胞、触发CD4+T细胞增殖并转化为CTLs 后,杀伤原位及远端肿瘤[36-37]。此外,这些细胞因子还能抑制调节性T细胞和髓源性抑制细胞的活性,增强抗肿瘤作用[38]。值得注意的是,目前研究所揭示的AE产生分子机制与RT通过免疫效应杀伤肿瘤的机制基本相同,即通过cGASSTING通路、相关的免疫细胞及细胞因子等发挥抗肿瘤作用[39-40]。
1.2.2辐射剂量和分割对AE的影响
辐射剂量和分割可以改变RT引起的免疫原性,抑制或促进AE的发生。研究表明,较低辐射剂量(1.8~2 Gy)不足以引发TME内的强免疫反应,中等辐射剂量(8~12 Gy)能增强CTLs、DCs和自然杀伤细胞的免疫反应,诱导强抗肿瘤作用,但更高辐射剂量(15 Gy/20 Gy) 可能会降低AE 的发生[41]。例如,中等辐射剂量比低辐射剂量更能诱导肿瘤细胞DNA损伤,增加微核的数量和dsDNA向胞质的释放,诱导更多IFN-I产生,但高辐射剂量(12~18 Gy)会强烈激活胞质DNA 外切酶来降解dsDNA,抑制IFN-I产生[42]。
此外,较多的临床前研究表明,大分割辐射能诱发强的免疫原性,似乎是联合IO引发AE的良好选择。在口腔癌小鼠模型中,与低剂量辐射分割(10 次×2 Gy)相比,大分割方案(2 次×8 Gy)更能增加CD8+T 细胞的浸润,减少髓源性抑制细胞的积累[43]。在小鼠乳腺癌和结肠癌模型中,大分割(3 次×8 Gy)RT 联合抗细胞毒性T 淋巴细胞相关抗原 4 (cytotoxic T lymphocyte-associated antigen-4,CTLA-4)抗体能抑制局部和远处肿瘤的生长,促进AE 的发生,但单次20 Gy 辐照联合抗CTLA-4抗体治疗不能诱发AE[44]。然而,AE的发生受多种因素的影响,包括肿瘤类型、患者自身免疫能力和免疫药物等,单一的分割方案不能在所有情况下提供最佳的免疫调节,需要制定不同治疗目标的最佳RT 剂量和分割方案,以有效地诱发AE[45]。
1.2.3外泌体调控的AE
最近的研究表明,辐射诱发AE的机制还与外泌体有关。肿瘤衍生外泌体(tumor-derived exosomes,TEXs)可携带和传递多种免疫刺激分子,充当辐照和未辐照细胞之间通讯的介质,增强辐射诱发AE 的机率[46]。研究表明,TEXs 能够将携带的肿瘤相关抗原和DAMPs(HSP70和HSP90)呈递给DCs,进而激活并促进CD4+T 和CD8+T 细胞的肿瘤浸润[47]。此外,TEXs 还能向DCs 传递dsDNA,激活DCs 中的cGAS-STING 通路,诱导IFN-I产生[48]。然而,TEXs的释放受到辐射类型、时间、剂量和肿瘤类型等因素影响。Li 等[49]用10 Gy 的γ 射线和1 Gy的重离子束分别辐照人的支气管上皮细胞,发现重离子照射细胞释放的外泌体数量是γ 射线辐照的4 倍。Kabakov 等[50]用2、4、6和8 Gy的X射线辐射胶质母细胞瘤细胞,导致外泌体随时间和剂量的依赖性释放。但外泌体在辐射诱导AE中的具体作用还有待研究,尤其是高传能线密度(linear energy transfer,LET)辐射诱导的AE[51]。然而,TEXs 中也会携带免疫抑制分子,如细胞程序性死亡配体1(programmed cell death 1 ligand 1,PD-L1)、白介素-10、转化生长因子-β等,需要进一步的研究来评估外泌体中不同成分对AE的影响[52]。
此外,目前的研究还阐述了其他因素对AE的作用。研究表明,辐射能够促进远端TME 中的巨噬细胞向M1 型极化并释放TNF-α,抑制远端肿瘤细胞的增殖和迁移[53]。辐照具有功能性p53 的非小细胞肺癌细胞,能够诱导细胞衰老并分泌携带衰老信息的囊泡,该囊泡迁移到辐射场外的p53野生型肿瘤细胞中,能诱导细胞衰老,引发AE,但AE的出现需在单次高辐射剂量(至少20 Gy)下诱导,并且依赖于功能性的p53基因[54]。
2 碳离子诱导的免疫反应和AE
2.1 碳离子放射治疗的优势
碳离子放射治疗(carbon ions radiotherapy,CIRT)是临床粒子放射治疗中的优选方法,具有多方面优势,被认为具有更大的免疫原性潜力[55]。首先,从物理学角度来看,碳离子在入射通道上的能量损失较小,而在射程末端的能量损失却急剧增加,进而在末端形成一个大的释放能量密度峰,即Bragg 峰。Bragg 峰使得碳离子束在肿瘤部位有更高的能量沉积和陡峭的剂量梯度[56-57],进而能够在保护正常组织的情况下,最大程度地杀伤肿瘤,降低继发性肿瘤发生的风险[58]。Dong 等[59]建立了巨噬细胞、肺癌细胞及上皮细胞的共培养体系,发现碳离子辐照组的上皮细胞二次损伤弱于γ 射线。其次,从生物学角度来看,碳离子束在射程末端具有高的LET,可导致辐照肿瘤和非辐照肿瘤DNA 发生难以修复的团簇损伤,增加肿瘤细胞内基因组的不稳定性,具有比光子RT 更高的相对生物学效应(relative biological effectiveness,RBE)(碳离子的RBE=2~4)[57,60-61]。在体内研究中,Wang等[62]用4.5 Gy的碳离子局部辐照小鼠的乳腺组织,发现非辐照乳腺组织中的DNA 损伤标志蛋白质表达增加,表明碳离子束能诱导远端乳腺组织的DNA 损伤。此外,碳离子束多以直接作用的方式损伤DNA,较少依赖于氧,具有较低的氧增强比(oxygen enhancement ratio,OER)[63]。鉴于碳离子束在物理学和生物学方面的优势,CIRT 可能比常规放疗更能诱导强免疫反应。
2.2 碳离子诱导的AE
对于CIRT 引发的AE 已有临床报告。日本国立放射线医学综合研究所报告了两例复发的结直肠癌患者,在接受CIRT 后,未照射肿瘤有明显的缩小[64]。武威肿瘤医院张雁山等[65]报告复发的胸腺癌患者接受CIRT后发生了AE。
目前已经开展了CIRT 诱导AE 的临床前研究,主要是探索碳离子与免疫细胞或免疫抑制剂联合,对肿瘤肺转移的抑制作用以及对未照射肿瘤的影响(表1)。在抑制肿瘤肺转移的研究中,日本国立放射线医学综合研究所团队进行了大量的CIRT+DCs实验。他们首先发现,半乳糖苷基神经酰胺(α-GalCer)+DCs结合碳离子并不能增强原位肿瘤的抑制,而是通过激活自然杀伤T细胞,抑制了肺转移肿瘤的生成[66]。进一步的研究发现,碳离子结合活化的DCs 能明显抑制肿瘤肺转移,这与CD8+T 细胞的浸润有关[67]。此外,研究表明,在生物等效剂量下,碳离子+DCs 对原位肿瘤的抑制与光子+DCs 类似,但对于肿瘤肺转移的抑制,碳离子+DCs的抑制作用强于光子+DCs,光子辐射想要达到相同的抑制效果需要将剂量提高3.75 倍(4~15 Gy),并且将与碳离子辐照肿瘤细胞共培养的DCs 细胞注入荷瘤鼠体内,也明显抑制了肺转移的发生[68]。值得注意的是,仅当来源于辅助性T细胞1型小鼠的DCs激活后,才能抑制肺转移发生,如果DCs来源于辅助性T细胞2型小鼠,则没有抑制效果[69]。这些研究表明,CIRT联合DCs的治疗方式能够抑制肿瘤肺转移的发生,并且在生物等效剂量下,碳离子+DCs比光子+DCs对肿瘤肺转移的抑制效果更明显,但是对于原位肿瘤的抑制,碳离子联合DCs治疗并未表现出更强的抑制作用。
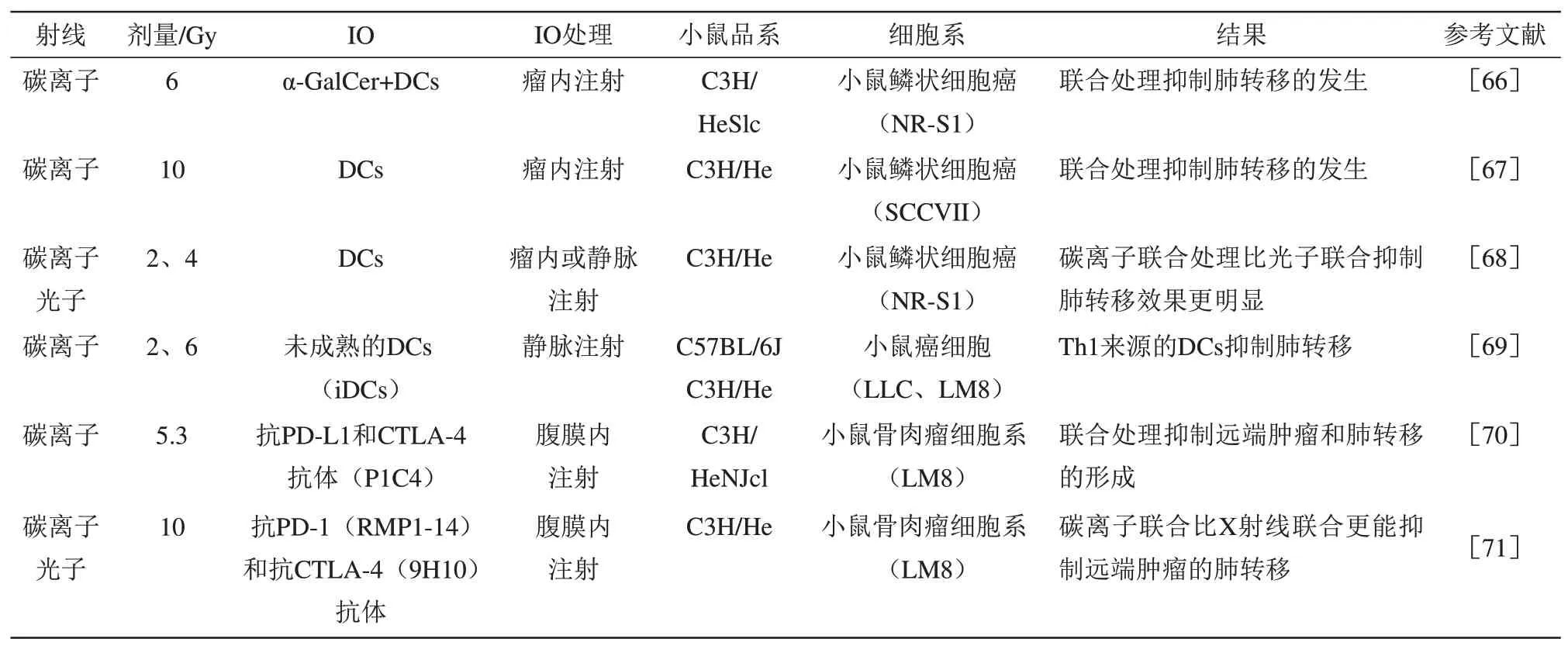
Table 1 Pre-clinical studies on CIRT combined with immunotherapy (IO) to induce AE表1 碳离子放射治疗(CIRT)与免疫疗法(IO)联合引发AE的临床前研究
关于CIRT 对远端已形成肿瘤影响的研究,通常采用碳离子与程序性死亡受体1(programmed cell death protein 1,PD-1)和CTLA-4 抑制剂结合的方式进行。Takahashi等[70]发现,碳离子能够抑制远端肿瘤的生长,碳离子联合免疫抑制剂的抑制效果更明显,同时还能抑制肿瘤向肝、肺的转移,但CD8α蛋白的加入逆转了AE的发生。Helm等[71]的研究表明,相同剂量(10 Gy)照射时,碳离子和X射线分别联合免疫抑制剂均能抑制远端肿瘤的生长,但两种处理的抑制效果没有明显区别,而在抑制肿瘤的肺转移过程中,碳离子联合的效应大于X射线联合,同时,在联合处理中还观察到CD8+T细胞和CD11b+的细胞在远端肿瘤的浸润。以上的研究表明,与单独的CIRT 相比,CIRT 联合PD-1和CTLA-4 更能抑制远端肿瘤的生长和肿瘤肺转移,与X 射线联合PD-1 和CTLA-4 的治疗方式相比,CIRT 联合PD-1 和CTLA-4 对肿瘤肺转移的抑制效果更明显,但是对于远端肿瘤生长的抑制,两者无明显区别。
由于条件的限制,目前对于CIRT诱导肿瘤AE的临床和机理研究较少,但已有的大部分实验结果表明,与X 射线相比,碳离子能诱导更多DAMPs的释放,从而引发更强烈的促免疫反应以及AE。AE 的机理可能与X 射线类似,都是促进未照射肿瘤TME 中CTLs 的浸润,但更深入的机理仍有待研究。
2.3 碳离子诱导AE的机制
目前,有研究表明CIRT 能够诱导肿瘤细胞DAMPs的释放(表2)。在细胞水平,Onishi等[72]用生物等效剂量相同,LET 不同(LET 为13 和70 keV/μm) 的碳离子束照射HeLa、SiHa 和KYSE70 细胞,照射后72 h,发现培养基中HMGB1 的水平随射线LET 的升高而升高。Ran等[73]用4 Gy 的X 射线和碳离子分别照射3 株肺癌细胞(A549、H520和LLC),均能引起HMGB1的释放,但碳离子辐射诱导的释放明显高于X 射线,通过检测肿瘤中免疫抑制因子(转化生长因子-β和白介素-10)的释放情况,发现X 射线诱导的释放明显高于碳离子。Huang 等[74]对比了光子、质子和碳离子照射人类肿瘤细胞后的CRT 外翻情况,结果显示,3种类型的辐射都增加了CRT在细胞膜上的定位,但碳离子照射后的CRT 外翻更明显。此外,体内研究表明,碳离子辐照能够提高小鼠血清中HMGB1 的含量[70]。然而,Ando 等[68]对NR-S1细胞进行生物等效剂量的X射线和碳离子辐照后发现,两种射线引起的HMGB1 释放没有区别,但对于CRT的外翻情况,则与辐照剂量有关,在10 Gy之内,碳离子明显高于X射线,但剂量大于10 Gy时,两者没有区别。
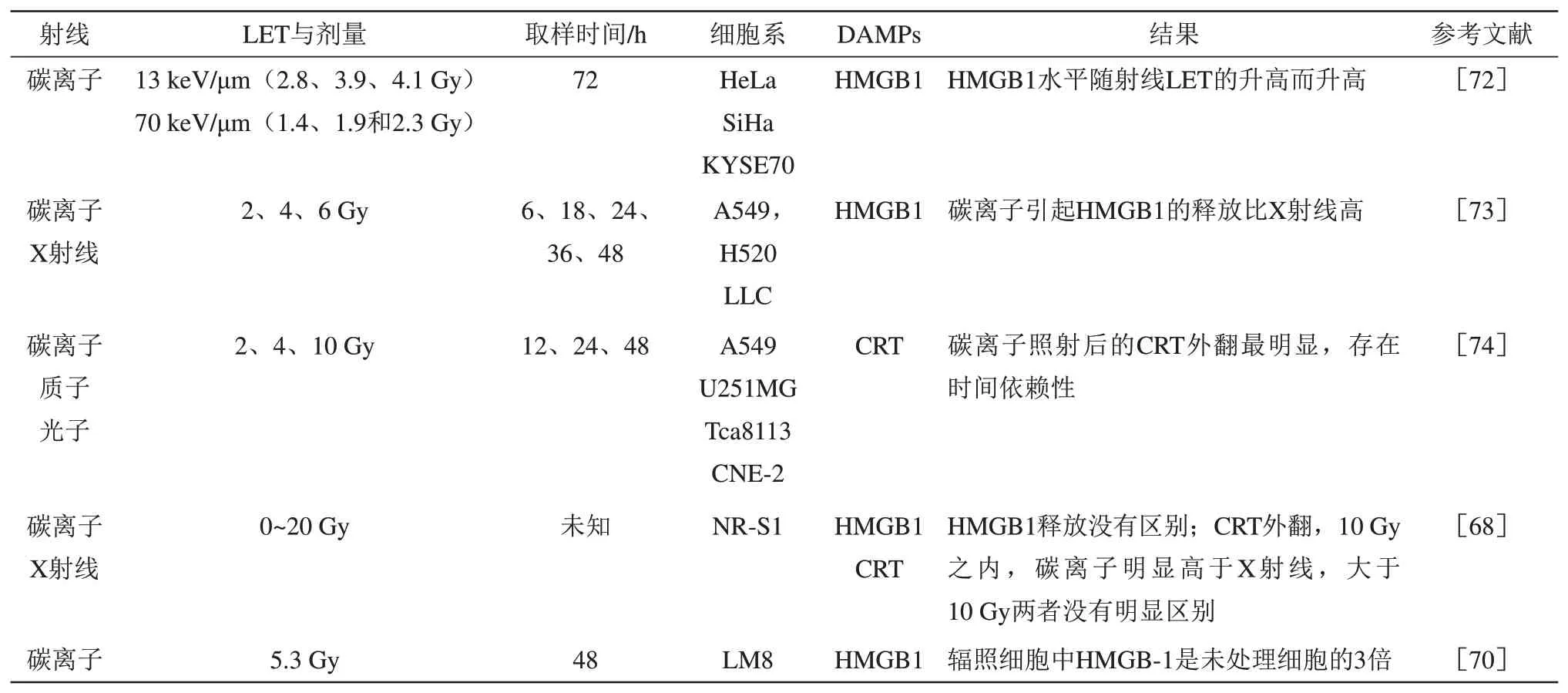
Table 2 DAMPs release from tumor cells was induced by carbon ions radiotherapy (CIRT)表2 碳离子放射治疗(CIRT)诱导肿瘤细胞释放DAMPs
以上研究表明,碳离子辐照具有与光子辐照相似的功能,能够诱发肿瘤细胞释放HMGB1 和CRT。大部分的研究表明,碳离子束诱发HMGB1释放的能力强于常规射线,并且还能减少免疫抑制因子的表达,适当提高碳离子辐照的LET 有助于增加HMGB1 的释放。但也存在两种辐照引起的HMGB1 释放没有区别的结果,这可能与细胞类型、辐照剂量等因素有关,而对于碳离子辐照诱发肿瘤细胞内的CRT 向细胞膜外翻的情况,则与辐射剂量有关。
关于CIRT更高效诱导肿瘤细胞DAMPs释放的原因,也有研究者进行了探索。Bao 等[75]研究表明,生物等效剂量的碳离子能诱导更高水平的磷酸化混合系激酶区域样蛋白表达,该蛋白质是提供DAMPs 和ICD 分子的重要来源。另外,由于碳离子诱导更为复杂的DNA团簇损伤,使得DNA修复更加困难,形成更多的dsDNA 片段并释放到细胞质,激活cGAS-STING 通路,引起肿瘤中更多的IFN-I向TME释放。因此,对于相同肿瘤细胞的杀伤效果,碳离子诱导的免疫效应可能强于光子,同时也预示碳离子辐照可能引起更强的AE。此外,碳离子不仅能引起肿瘤细胞DAMPs 的释放,还能重塑TME。Spina 等[76]发现,在生物等效剂量辐照下,碳离子辐照增加了TME中IFN-γ、白介素-2和白介素-1b 等免疫因子的分泌,而光子辐照增加了调节性T细胞的数量、促进了免疫抑制因子白介素-6 的分泌。另外,CIRT 还能抑制髓源性抑制细胞的活化、增强巨噬细胞的吞噬活性和影响炎性细胞因子表达谱,促进抗肿瘤免疫作用[61]。
3 结语与展望
AE是RT期间激活免疫系统对抗原发性肿瘤和远端转移肿瘤的刺激剂,AE的发现有可能使RT由一种局部的肿瘤治疗方法,转变为一种全身性的治疗手段。通过基础研究的深入,RT 可使肿瘤细胞释放一系列的免疫刺激因子,形成原位“疫苗”,在消减原位肿瘤的同时,抑制肿瘤的转移,并消灭已形成的转移,从而诱发AE,达到全身治疗的目的。RT与已获批的PD-1、PD-L1、CTLA-4抑制剂结合,诱发AE 效果更加明显,但目前AE 在临床上仍然非常少见且不可预测[36]。为了让更多转移癌患者受益于RT诱发的AE,基础研究应从两方面着手。一是从机理出发,深入探究RT 诱发AE 的机理,包括外泌体、巨噬细胞和p53 诱发的AE,探究不同IO 药物在RT 诱发AE 中的作用机制,精准选择符合治疗目标的治疗方法。二是设计能联合IO 引发强烈AE 的RT 方案,包括辐射类型、剂量及分次等,不同RT 方案对原位肿瘤和远端肿瘤的抑制效果不同。临床前研究表明,3 次×8 Gy 的大分割RT是调节IO诱发强肿瘤免疫的优选方案[44]。但这些研究仅涉及有限的肿瘤类型、RT 分割方式和免疫方案,不能广泛适用。目前,对于激活强大以及多样化的抗肿瘤免疫反应,没有最佳或标准的单一方案,需要设计临床试验,验证不同组合方案对不同治疗目标的治疗效果[45]。
对于不同辐照类型对AE的影响,目前的基础研究表明,CIRT 是粒子放射治疗中的优选方法,与光子RT 相比,CIRT 能诱导更强的肿瘤免疫反应,与光子RT 联合IO 相比,CIRT 联合IO 能更有效地抑制肿瘤转移,改善转移灶的TME(由免疫抑制性转化为免疫促进),诱发更明显的AE。但目前研究涉及CIRT 的转移肿瘤类型较少,需要进一步探索CIRT 在不同转移肿瘤中的应用,并对比光子RT 的治疗效果。研究表明,碳离子束能在胚胎青鳉鱼脑中诱导非辐照部位小胶质细胞的活化,该研究的发现为颅内肿瘤的RT 提供了适合的脊椎动物模型,并表明脑部肿瘤的CIRT可能诱发AE[77]。此外,Tubin 等[78]用CIRT 治疗复发性不可切除的大块肿瘤,发现治疗后的平均肿瘤大小比之前缩小了61%,并在60%的患者中观察到了AE,局部CIRT 或许是治疗无法切除的复发性大块肿瘤的有效方法。
综上所述,RT 通过激活肿瘤免疫系统诱发AE,RT联合IO治疗增加了AE的发生率,但还不足以让更多的转移肿瘤患者受益。CIRT 具有高LET、高RBE、低OER 以及复杂DNA 损伤等优势,比常规RT 更能诱导肿瘤细胞释放多的DAMPs,更能抑制肿瘤的肺转移和远端转移灶的形成,具有激活肿瘤细胞更强免疫原性的潜力,深入探索CIRT 诱发AE 的机理,能为寻找更有效的肿瘤RT方法提供理论基础。
