光调控在阿尔茨海默病治疗中的潜在应用*
2023-08-14周非凡
李 茜 王 淼 周非凡
(海南大学生物医学工程学院,海南省生物医学工程重点实验室,海口 570228)
阿尔茨海默病(Alzheimer’s disease,AD)是老年痴呆症最常见的类型,占所有痴呆病例的60%~80%[1]。AD是发生在老年和老年前期的中枢神经系统退行性病变,主要表现为进行性认知功能障碍和行为损害。临床表现包括记忆衰退、失语、视空间能力减退、抽象思维和计算力减退、人格和行为改变等。2020 年《The Lancet Public Health》发表的统计数据显示,中国60 岁以上老年人痴呆症发病率约为6.00%,其中90岁以上的老年人发病率高达31.90%。据此推算中国痴呆症患者超过1 500万人,其中AD患者已经接近1 000万[2],占世界AD患者总人数的1/4。中国目前用于AD患者治疗的社会经济负担占国内生产总值的1.47%,高于全球平均水平(1.09%),且这一数值随着老龄化的加剧不断增加[3-4]。AD 不仅仅是复杂的健康问题,更是棘手的家庭问题和社会问题。对AD患者家庭来说,他们承受的不仅仅是精神上的打击,还要面临更现实的照护重担。而随着AD患者数量的增加,社会也将面临着更加沉重的经济负担。
AD 以老年斑和神经元纤维缠结(neurofibrillary tangles,NFTs)为主要病理特征。老年斑由β 淀粉样蛋白(amyloid β-protein,Aβ)聚集形成,NFTs 则是过度磷酸化的Tau 蛋白配对螺旋化形成。AD的病程根据认知能力和身体机能的恶化程度被分为7个阶段[5]。a. 无认知功能衰退阶段,无外显症状,认知功能正常,临床检查无记忆缺陷,但大脑中存在淀粉样蛋白沉积。b. 轻微认知功能衰退阶段,伴有主观记忆担忧,但临床检查无客观证据证明记忆缺陷。c. 轻度认知功能衰退阶段(mild cognitive impairment,MCI),记忆力和其他认知功能进行性衰退,可在临床检查中获得客观证据。MCI是AD患者出现客观认知障碍的最早阶段,虽然患者注意力处理和工作记忆的能力下降[6],但仍可独立生活。d. 中度认知功能衰退阶段,患者学习和记忆能力受损,出现明显的认知缺陷,不再能够有效地执行复杂的任务[7-8],生活质量降低。e. 重度认知功能衰退阶段,患者开始在日常生活活动中需要帮助。f. 严重认知功能衰退阶段,患者认知性意志急剧减退,完全依赖照顾者生存。g. 极严重认知功能衰退阶段,患者失去语言功能和精神性运动技能,并表现出广泛皮层性神经系统症状和体征。
AD 治疗的主流方法仍然是药物治疗,通过美国食品药品监督管理局(FDA)认证的AD治疗药物一共有6 种,其中加兰他敏(Galantamine)、利斯的明(Rivastigmine)、多奈哌齐(Donepezil)和他克林(Tacrine)为胆碱酯酶抑制剂,美金刚(Memantine)为N-甲基-D-天冬氨酸(NMDA)受体拮抗剂,阿杜那单抗(Aducanumab)为2021 年上市的Aβ 抗体,然而由于其III 期临床试验失败,存在较大争议[9-13]。此外,GV-971 是国内研发上市的靶向AD患者肠道菌群的治疗药物,但其未通过FDA 认证[14-15]。药物治疗可以在一定程度缓解AD 导致的认知与记忆障碍,但不能阻止病程进展,更加无法治愈AD,长期服用后有效时间缩短,并且部分患者用药后会产生呕吐、头痛、幻觉等副作用[16-19]。因此无副作用、疗效显著的治疗手段是当前研究的热点与难点。
光生物调节(photobiomodulation,PBM)指的是从激光器或发光二极管(LED)发出的可见光到近红外(NIR)光(波长为400~1 100 nm)在生物组织引起的非热效应,以刺激或调控各种生物过程[20],减轻疼痛和炎症,修复机体损伤。研究表明,PBM 可以促进微循环、细胞增殖和再生,还可以缓解创伤性或急慢性疾病的疼痛、氧化应激和炎症,增强机体免疫机能[21-26]。越来越多研究证实了PBM的安全性和有效性,从而促进了PBM应用领域的拓展。近年来,PBM 在神经病学领域的作用备受关注,特别是在神经退行性疾病的调控、治疗方面,均开展了广泛且深入的研究。
本文总结了PBM 在AD 调控中的应用研究,对PBM 的治疗机制、量效关系、治疗效果进行了系统梳理,为PBM 在AD 治疗中的深入研究和潜在应用提供参考。
1 PBM在AD细胞模型中的应用研究
1.1 PBM对Aβ引起的神经毒性具有保护作用
Aβ 是由β 和γ 分泌酶水解淀粉样前体蛋白(amyloid precursor protein,APP)生成的含有39~43 个氨基酸的多肽。它可由多种细胞产生,并在血液、脑脊液和脑间质液内循环流动,大部分与伴侣分子结合,少数以游离状态存在,但其在细胞基质沉淀聚积后则具有强烈的神经毒性作用[27-32]。研究人员进行的体外实验表明PBM对Aβ引起的神经毒性具有保护作用。Duan 等[27]报道640 nm LED PBM能够抵抗Aβ25-35诱导的大鼠肾上腺嗜铬细胞瘤细胞(PC12)凋亡。邢达课题组发现,632.8 nm低能量激光PBM 通过激活PKC 信号通路使Bax/Bcl-xl mRNA 比值降低或激活Akt/YAP/p73 信号通路,均能抑制Aβ25-35引起的PC12 细胞凋亡[28-29],使用632.8 nm激光照射Aβ25-35孵育的PC12、人神经元样神经母细胞瘤细胞(SH-SY5Y)和人胚肾细胞(HEK 293T),发现PBM 能够通过Akt/GSK3β/βcatenin途径减弱Aβ25-35诱导的细胞凋亡[30]。其进一步研究发现,632.8 nm激光(2 J/cm2)可以通过增加线粒体细胞色素c 氧化酶(cytochrome oxidase,CCO)活性,从而增加cAMP和ATP的水平,激活SH-SY5Y-APPswe细胞的PKA/SIRT1信号通路,导致Aβ水平下降[31]。此外,人神经元样神经母细胞瘤细胞(SH-EP)内化Aβ42后,用670 nm激光照射可显著降低细胞内Aβ42聚集量[32]。Duggett 等[33]利用人工合成的人Aβ1-42多肽在试管中聚集,形成大小不等的纤维(单个约为10 μm),这些纤维与神经母细胞瘤细胞(CAD)共培养引起了高达73%的剂量依赖性神经毒性,而用1 068 nm LED预处理细胞可以显著抑制Aβ42引起的神经毒性。
突触是神经元之间信息交换的重要元素,神经元之间突触连接的破坏是已知的AD 病理性特征。因此,恢复这些连接对于AD的治疗至关重要。脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是一种中枢神经系统蛋白质,在维持现有神经元的活动方面发挥关键作用,突触和神经元的再生受到BDNF 的刺激[34]。Nagahara 等[35]研究发现,给予AD 转基因小鼠BDNF 基因治疗,可以逆转Aβ 斑块介导的神经毒性所引起的树突萎缩和突触丢失,部分恢复异常基因表达,改善细胞信号转导,恢复学习和记忆功能。而这些结果的发生与淀粉样斑块负荷的影响无关,表明BDNF通过非淀粉样蛋白依赖的机制,对AD中涉及的关键神经回路起到实质性的保护作用。邢达教授团队发现,在Aβ 孵育的小鼠海马神经元中,632.8 nm PBM 可以通过激活ERK/CREB 途径,上调BDNF来避免Aβ诱导的神经元丢失和树突萎缩[36]。
此外,Hamblin 教授团队[37-38]用810 nm 激光直接照射小鼠皮层原代神经元,发现PBM 在增加ATP、提高线粒体膜电位、降低细胞内钙离子浓度、减少氧化应激和减少一氧化氮(nitric oxide,NO) 方面有非常显著的益处。Zupin 等[39]用970 nm和445 nm波长的光照射SH-SY5Y细胞,发现970 nm PBM 处理组细胞活性氧(reactive oxygen species,ROS) 和ATP 增加,而445 nm PBM 处理组细胞ROS 减少,ATP 增加,表明不同波长PBM 通过对线粒体功能的选择性作用促进SH-SY5Y 的分化。Topaloglu 和Bakay[40]分别采用低剂量光动力疗法(photodynamic therapy,PDT)和PBM两种不同的方法诱导PC12细胞分化,经形态学检查、机械学方法和qRT-PCR 分析发现,低剂量PDT 和PBM 通过刺激细胞内ROS 生成和NO释放实现组织反应,促进轴突延长和细胞分化。
1.2 PBM对胶质细胞介导的神经炎症具有调节作用
神经胶质细胞,简称胶质细胞,是神经组织中除神经元以外的另一大类细胞,广泛分布于中枢和周围神经系统,主要包括星形胶质细胞、少突胶质细胞(与前者合称为大胶质细胞)和小胶质细胞等。小胶质细胞炎症反应有两种不同的表型[41]。在没有病原体的情况下,小胶质细胞处于静息状态。当检测到AD的病理标志物时,小胶质细胞被激活,释放炎症因子,并通过吞噬作用清除Aβ 斑块。激活的小胶质细胞表现为促炎(M1)或抑炎(M2)两种状态[42]。M1 小胶质细胞处于促炎状态,可不断释放ROS和NO等炎症因子,通过过度修剪神经元突触并脱落髓鞘,最终导致信息传递受阻,甚至细胞死亡[43]。M2 小胶质细胞呈抑炎状态,能够吞噬Aβ斑块[44],提供营养因子,促进神经元网络重建,并修复脑损伤[45]。
在包括AD 在内的多种神经退行性疾病中,PBM 通过调节小胶质细胞介导的中枢神经系统损伤发挥重要作用。Von Leden 等[42]使用808 nm LED 对原代小胶质细胞和小胶质细胞样BV-2 细胞进行不同剂量的照射,发现在较高剂量(4~30 J/cm2)时小胶质细胞主要转化为M1表型,而在较低剂量(0.2~10 J/cm2)时,主要向M2 表型转变。Song等[46]用BV-2 细胞和SH-SY5Y 细胞,研究了PBM(633 nm 激光) 对脂多糖(lipopolysaccharide,LPS)活化小胶质细胞所致神经毒性的影响,结果显示PBM 可通过活化非受体酪氨酸激酶Src 抑制LPS活化小胶质细胞,减轻小胶质细胞引起的神经毒性,提高其吞噬能力,继而清除Aβ 聚集体。屈军乐教授课题组[47]使用808 nm激光照射被寡聚体Aβ1-42激活的小鼠海马体原代小胶质细胞,结果发现,在受寡聚体Aβ 激活的M1 型小胶质细胞中,PBM 能有效诱导从糖酵解到线粒体活动的代谢转变,即小胶质细胞促炎因子分泌减少和吞噬功能激活,向M2型转变。同时在神经元与小胶质细胞共孵育模型中发现,PBM也可以通过调节被Aβ激活的小胶质细胞产生的ROS 水平来有效减少神经元的凋亡。大量研究表明,Aβ 处理的小胶质细胞会表现出代谢变化和炎症表型的转变,它通过激活氮氧化物(nitrogen oxide,NOX)来刺激小胶质细胞生成高水平的ROS,但是PBM可以逆转这种Aβ诱导的变化,保护神经元免受损伤。因此,利用近红外光调控被Aβ 激活的小胶质细胞可能成为控制AD炎症发展的一种治疗策略。
此外,与小胶质细胞相似,在中枢神经系统炎症中,星形胶质细胞也表现为促炎(A1)和抑炎(A2)两种状态。A1 星形胶质细胞释放NO、ROS等促炎因子,对胶质细胞产生毒性,使其失去吞噬功能,难以消除Aβ 斑块[48]。A2 星形胶质细胞释放 ATP、 γ 氨基丁酸 (γ-aminobutyric acid,GABA)、神经营养因子和细胞因子,促进神经元的增殖和分化以及突触的修复[49]。早期研究发现,632.8 nm 激光预处理能够抑制Aβ1-42诱导的星形胶质细胞超氧化物歧化,减少白介素-1β(IL-1β)和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的表达,从而发挥抗神经炎症作用[50]。Silveira 等[51]研究发现,使用660 nm 激光照射C6星形胶质瘤细胞,其呼吸链复合体I活性和己糖激酶活性增加,导致细胞质和线粒体氧化还原状态的变化,增加ATP 的产生,显著增强C6 星形胶质瘤细胞线粒体活性。Yoon 等[52]发现660 nm LED 处理SD 大鼠原代星形胶质细胞,增加GFAP 和溴脱氧尿苷(BrdU)/Ki67 共表达量,促进特异性增殖。此外,Oct4和GFAP共表达减少,神经上皮干细胞蛋白(Nestin)和ALDH1L1 表达增加,表明660 nm LED 能够促进星形胶质细胞分化。这些结果表明,PBM 可以改变星形胶质细胞的活性,促进其增殖或分化,从而改善中枢神经系统病理状态。
在细胞层面的研究表明,PBM 治疗能够抑制Aβ 斑块引起的神经毒性,同时诱导小胶质细胞和星形胶质细胞表型的改变,降低细胞内的炎症因子水平,进而调控中枢神经系统免疫微环境,以修复大脑损伤,治疗AD。尽管PBM在细胞层面显示出了良好的治疗效果,但目前其作用机制仍不清楚。
基于目前的研究,PBM 被认为至少在两种不同的生物水平上起作用。首先,PBM 作用于细胞水平,激活细胞内级联反应,最终有助于靶标以及邻近细胞的存活或神经刺激作用。其次,PBM 似乎能够触发全身保护机制。这涉及尚未识别的循环细胞或体液因子,其可以转导PBM 对大脑的保护作用。已有大量研究表明PBM 能够影响诸多分子和细胞系统[53]。Karu[54]和Hamblin 教授等[24]学者认为,介导PBM 效应的部位主要位于线粒体,存在于细胞线粒体内膜的CCO 作为光受体,吸收光后发生分子构象改变,酶活性增强,进而促进电子传递,增加ATP的产生,从而增强细胞活性。而邢达教授团队研究则认为介导PBM 效应的部位主要位于细胞膜,细胞膜表面非受体酪氨酸激酶吸收光发生分子构象变化,激活下游信号分子,从而启动信号转导途径,调控促增殖或抗凋亡通路。然而,目前的两种细胞机制假说均未得到公认,PBM 在神经元、胶质细胞不同类型细胞中的调控机理并未清晰。PBM在AD细胞模型中的研究参数见表1。
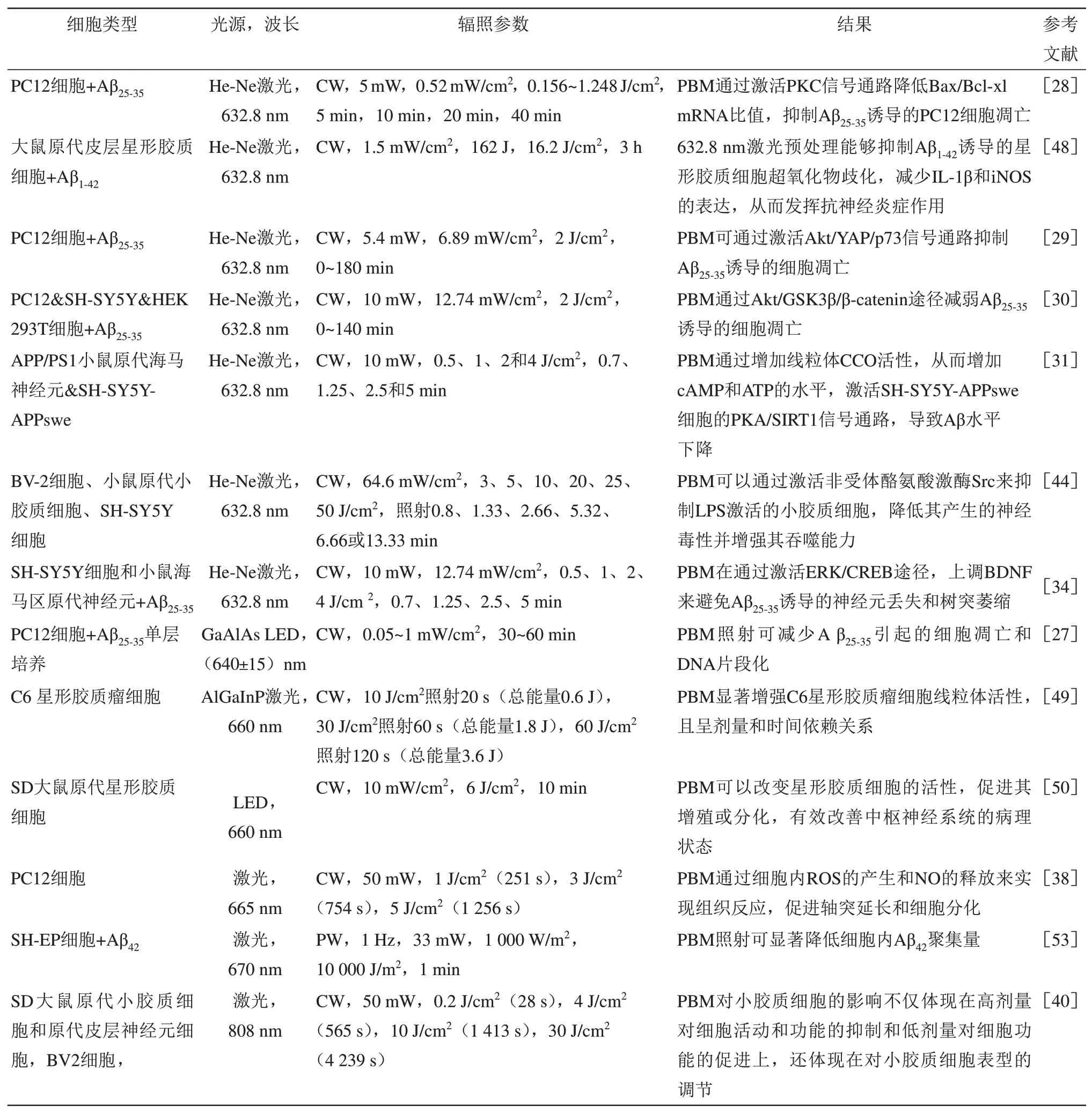
Table 1 Applied research of PBM in AD cell model表1 PBM在AD细胞模型中的应用研究
2 PBM在AD动物模型中的应用研究
目前,应用于AD有关研究的动物模型大致有两种类型:一是直接向啮齿类动物脑内注射毒性Aβ 多肽或腹腔注射东莨菪碱等化合物损伤胆碱能神经元模拟AD 病症,虽然该处理方式操作简便,造模耗时短,但个体差异较大;二是转基因成功培育的表达人类APP 突变体(K670N/M671L、V717I、V717F 和D23N 系)、PSEN1(PS1 系)和PSEN2(PS2系)突变体的小鼠,均能表现出渐进的、早发型的痴呆症状。APP/PS1双转基因小鼠由Mo/HuAPP695swe 和PS1-dE9 基因共同构建,可表达突变的人类早老素(PS1-dE9)和嵌合的人鼠淀粉样前蛋白(APPswe)融合体。3×Tg小鼠系模型由APP Swedish、MAPT P301L和PSEN1 M146V基因突变构建,可同时表现突触功能障碍和AD相关的斑块和NFTs 病理。成熟的APP/PS 小鼠和3×Tg小鼠系(包含人类APP、PS1 突变和Tau 突变)模型,在AD研究中被广泛使用。而5×FAD小鼠系则是结合3 个人类APP 突变体和两个PS1 突变创建的,该小鼠模型更早地出现淀粉样病变、认知障碍及神经元丢失。相较于单转基因小鼠,多转基因小鼠的病理表现与AD更为相似,具有更高的应用前景,但其难以评估一些新的基因突变是否对AD的发生发展产生影响。
2.1 PBM在药物处理构建的AD小鼠模型中的研究
为了建立啮齿类动物AD模型,研究人员通常直接向海马体注射不同Aβ多肽以模拟Aβ沉积的病理特征。陆玉娇等[55]利用808 nm连续激光经颅治疗Aβ1-42注射的大鼠,发现PBM 连续治疗5 d 可以改善海马的神经退行性病变,巴恩斯迷宫(Barnes Maze) 和新物体识别(novel object recognition,NOR)测试结果表明PBM 治疗改善了AD 大鼠的空间和物体识别记忆。对海马CA1 区细胞组织进行深入分析,发现PBM治疗可改善线粒体动力学,升高线粒体膜电位,降低线粒体DNA 氧化损伤及线粒体自噬,抑制细胞凋亡,提高线粒体抗氧化水平、CCO活性和ATP含量,抑制Aβ引起的反应胶质化,缓解炎症反应和Tau 蛋白过度磷酸化。Da Luz Eltchechem等[56]给大鼠海马区注射Aβ25-35肽构建AD 模型,用627 nm 连续LED 经颅治疗大鼠3周,通过旷场和Morris 水迷宫行为学测试发现PBM 治疗有效增强大鼠的运动技能和空间记忆,组化分析发现海马区Aβ斑块水平显著降低。Blivet等[57]针对海马CA1 区注射Aβ25-35构建的AD 小鼠模型,使用红光和NIR 光结合的脉冲PBM 经颅治疗,降低了海马炎症标志物TNF-α、IL-6 和IL-1β的水平,同时降低星形胶质细胞和小胶质细胞的活化,恢复小鼠在Y 迷宫测试中的空间工作记忆。Zinchenko 等[58]使用1 267 nm 连续激光经颅治疗Aβ1-42注射的小鼠,发现PBM 治疗显著减少了Aβ在脑组织中的沉积,同时在小鼠不同脑区注射金纳米棒颗粒,通过光学相干断层扫描(optical coherence tomography,OCT)活体监测右侧颈深淋巴结的金纳米棒蓄积率发现PBM 治疗显著增加了大脑深层(海马、脑室)和浅层(枕大池、皮质)金纳米棒的清除,表明PBM 促进淋巴引流可能是其减少脑内Aβ 斑块和改善AD 小鼠神经系统功能、认知和记忆状态的可能机制之一。2021年,该团队深入研究PBM(1 267 nm 连续激光)在夜间和白天对AD 小鼠脑内淋巴Aβ 清除的影响,发现夜间PBM 比白天PBM 更能有效地刺激Aβ 从大脑中清除,减少其在AD小鼠脑内的蓄积,改善识别记忆[59]。Zinchenko 团队的研究为PBM 治疗AD提供了新的靶点,为PBM 的治疗机制提供了新的研究思路。
2.2 PBM在转基因AD小鼠模型中的研究
在转基因小鼠模型中,Taboada 等[60]利用810 nm连续激光经颅治疗AβPP转基因小鼠,明显增强了AβPP 小鼠在Morris 水迷宫测试中的空间学习和记忆功能。同时组化分析显示PBM 治疗显著降低AβPP 小鼠脑内Aβ 斑块和炎症标志物(如TNF-α、IL-1β、TGF-β),增强脑组织的线粒体功能和c-fos 表达,且呈剂量依赖性。Purushothuman等[61]使用670 nm连续LED治疗 APP/PS1和K369I Tau模型小鼠,发现PBM治疗可以降低海马、皮层和脑干的Aβ斑块水平和NFTs水平,降低过度磷酸化的Tau、NFTs 以及新皮质和海马的氧化应激指标,恢复存活神经元中线粒体CCO的表达。近来,另一个研究组使用670 nm 连续LED 经颅治疗Tg2576[62]和人Tau 蛋白病(3×TgAD 和hTau)[63]转基因小鼠,增强了AD 小鼠在NOR 测试中的记忆功能,显著降低AD小鼠海马区和大脑皮层突触体的Tau和Aβ水平,阻止Aβ寡聚体对长时程增强作用的抑制[63]。
在PBM 调控转基因AD 小鼠的研究中,除普通红光及近红外波段的连续光处理方式外,其他波段及照射方式均有所报导。2013 年,Grillo 等[64]对TASTPM 转基因痴呆模型小鼠进行1 072 nm 脉冲 LED 经颅治疗,降低齿状回 Aβ 斑块水平,增加脑组织热休克蛋白(heat shock proteins,HSPs)HSP60、HSP70、HSP105、HSP27 等的表达,同时下调热休克蛋白αB-晶体蛋白(HSP αB-crystallin)水平,减少Aβ毒性,推测其可能促进热弛豫过程,局部放能,从而改变细胞内信号转导机制。魏勋斌教授团队[65]使用1 040~1 090 nm 连续LED 设备经颅治疗APP/PS1 小鼠,明显改善AD 小鼠在Morris水迷宫测试中的空间学习和记忆,减少海马区Aβ斑块面积。2021 年,该团队分别使用10 Hz 和40 Hz 1 070 nm 近红外光对AD 模型小鼠进行经颅治疗,其结果表明10 Hz 和40 Hz 1 070 nm 近红外光均能够减少M1 样小胶质细胞的产生,减轻AD模型小鼠的炎症反应,从而减轻Aβ 负荷缓解认知功能障碍,为PBM 治疗AD 的机制提供了清晰的线索[66]。Zhang 等[67]利用可见光(2 Hz)刺激3×Tg AD模型小鼠,改善小鼠的空间学习能力和条件恐惧记忆,但并未改变小鼠扣带回皮层的Aβ42水平,而是通过上调扣带回和外侧杏仁核的同源蛋白1a 水平来改善Aβ 对锥体细胞BK 通道抑制作用。2016 年,Tsai Li-Huei 教授课题组[68]在《自然》(Nature)杂志上发表了一篇研究性论文,研究发现,40 Hz LED白光会在脑部视觉皮层区域引起无创伽马震荡,促使AD小鼠脑内小胶质细胞发生形态变化,继而提高淀粉样蛋白吞噬能力,以减轻AD 的发生。2019 年,该团队探究40 Hz 视觉和听觉刺激联合治疗的疗效,发现联合刺激可促进小胶质细胞在Aβ 斑块周围聚集,继而广泛引起大脑多个区域淀粉样蛋白和磷酸化Tau 蛋白减少,AD 小鼠空间记忆和认知能力改善[69]。同年,该研究小组探讨40 Hz 长期光照治疗机理,结果发现40 Hz长期光照可在视觉皮层、海马体和前额叶皮层等多个脑区引起伽马振荡,改变与神经元、突触损伤及小胶质形态相关的部分基因表达,减轻神经元损伤和小胶质细胞炎症反应,改善突触功能,增强神经保护,进而改善AD小鼠认知功能[70]。最近,一项在AD 大鼠上进行的PBM 实验也表明PBM 治疗能显著改善AD的典型病理症状,包括记忆丧失、淀粉样斑块沉积、Tau 蛋白过度磷酸化、神经元变性、脊髓损伤和突触丢失。此外,PBM 通过促进小胶质细胞IL-3Rα 和星形胶质细胞IL-3 的表达,促进淀粉样斑块周围小胶质细胞的募集[71]。
此外,研究发现PBM还可增强老年鼠的认知,降低其大脑炎症水平。Cardoso 等[72]使用810 nm连续激光对青年(4月龄)和老年(20月龄)大鼠经颅治疗,结果表明接受PBM 治疗的青年和老年大鼠在Barnes Maze 中表现出比对照组更好的认知表现。同时PBM 治疗降低了青年和老年大鼠大脑皮质GM-CSF、IL-10、MCP-1、LIX、TNF-α 和IL-5 的水平,起到抑炎作用。在海马区,PBM 组老年大鼠与对照组老年大鼠相比,IP-10 和Fractalkine水平降低,阻止了老年大鼠神经性营养不良和Tau 蛋白磷酸化的进程。事实上,PBM 似乎有能力从几个不同的角度瞄准AD,使其成为一种可行的潜在治疗方法。
无论是药物处理构建的AD小鼠模型,还是转基因AD小鼠模型,PBM治疗均能改善其在行为学测试中的空间学习和记忆能力,降低脑内的Aβ 斑块沉积和炎症水平,显示出良好的治疗效果,这为PBM的临床研究奠定了基础。但目前PBM作用于AD小鼠的治疗机制、量效关系仍不清楚。未来的研究需要聚焦于动物实验和临床研究的结合,在确定PBM 作用机制、量效关系的基础上,确保其在临床应用中的安全有效性。PBM在AD动物模型方面的应用研究参数见表2。
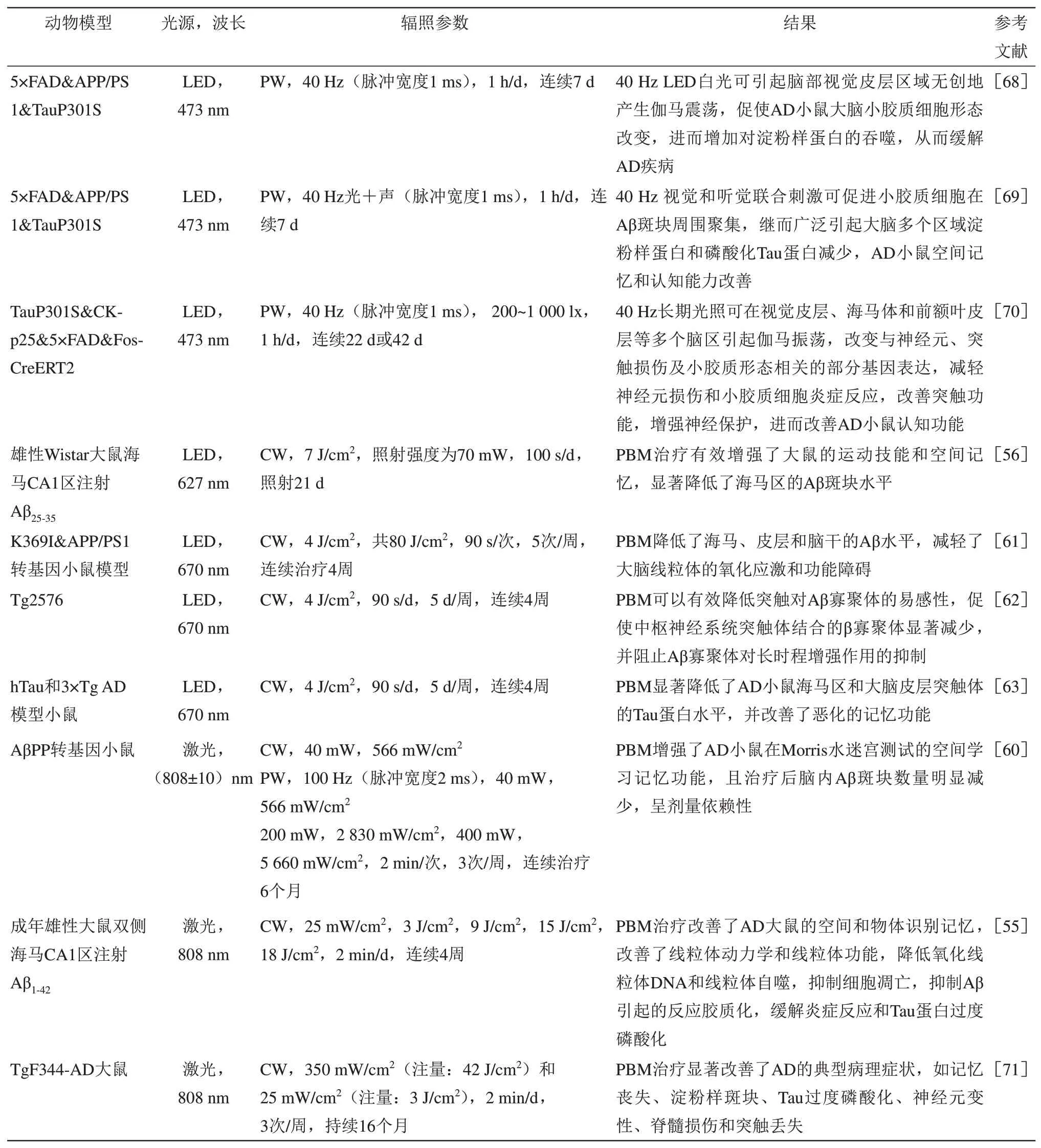
Table 2 Applied research of PBM in AD animal model表2 PBM在AD动物模型方面的应用研究
3 PBM在AD患者临床治疗中的应用研究
3.1 单一无创PBM疗法
在早期治疗中,Maksimovich[73-74]对比了在股总动脉进行穿刺和插管安装柔性光纤激光器对大脑前动脉和大脑中动脉近端进行激光治疗的患者同药物 Memantin、Rivastigmine 治疗患者的疗效差异,发现 PBM 介入治疗组患者的脑微循环和代谢得到改善,使得患者认知恢复,痴呆症永久性减轻。PBM 介入治疗虽然展示出了良好疗效,但其操作繁琐、技术要求高,创伤较大,易引发炎症。为规避介入治疗的缺点,经颅无创治疗被提出并得到快速发展。Berman 等[75]对11 位轻度认知障碍患者进行小型双盲实验,8 位患者接受了1 070 nm脉冲LED经颅无创治疗,其余3位为安慰剂组,经过28 d连续治疗,治疗组病人在时钟绘制、即时回忆、练习记忆、视觉注意力和任务切换方面的能力显著提高。脑电图(electroencephalogram,EEG)结果显示,PBM 治疗提高了患者的警觉性及注意力并减轻焦虑情绪。Chan 等[76]对30 位没有神经病史的老年人(≥60岁)进行了小型双盲实验,治疗组和对照组各15人,使用633 nm和870 nm连续LED 同时经颅治疗。与对照组相比,PBM 治疗组在侧翼测试的一致和不一致条件下都表现出更快的反应,在类别流利性测试中产生的独特单词总数增加,表明PBM 改善了老年人的行动选择、控制能力和思维灵活性,促进了额叶功能。其在另一项研究中使用810 nm连续LED分别对18名轻度认知障碍老年人进行单次经颅PBM 治疗,显著改善了患者的视觉记忆能力和血流动力学反应[77]。在Nizamutdinov等[78]的研究中,分别对60 名轻、中度痴呆患者(2∶1)进行为期8周的1 060~1 080 nm LED 经颅PBM 治疗,阿尔茨海默病神经成像计划(Alzheimer’s disease neuroimaging initiative,ADNI)神经心理成套测验评估结果表明,与对照组相比,PBM 治疗组患者焦虑减轻,情绪、精力和认知能力改善。在另一项相同的研究中,PBM治疗组患者的认知能力显著改善,且痴呆症患者对PBM 刺激的反应没有表现出基于性别的差异[79]。在经颅无创PBM 治疗出现的同时,一些研究人员也开始探索利用鼻腔无创PBM治疗AD。周畅课题组[80]的一项研究表明,经670 nm连续激光鼻腔内照射治疗后,轻度认知障碍患者血清内Aβ 含量降低,推测PBM能够影响Aβ代谢过程,延缓疾病进程。Lim[81]使用Vielight公司生产的鼻腔光治疗仪(810 nm脉冲LED)对2名AD患者进行为期1年的持续治疗后,患者不再有严重的认知障碍,且根据基础简易精神状态检查(mini mental state examination,MMSE)的测量,其认知功能改善到“正常水平”,且治疗期间未观察到不良反应。最新的研究使用1 064 nm 连续激光对健康老年人左侧背外侧前额叶进行单次和一周重复刺激,发现10 min 左右的单次PBM 刺激可以明显改善健康成年人的记忆、注意力以及执行功能等高级认知能力,一周重复经颅PBM 干预能够有效改善健康老年人工作记忆,并且这种改善效果能够维持至少3周[82]。
3.2 联合无创PBM治疗
基于经颅治疗和鼻腔治疗已经取得的良好疗效,研究人员开始探索联合PBM 疗法对AD 患者的治疗效果。Arakelyan 等[83]使用PBM、磁场疗法(magnetic field therapy,MFT)、光色疗法(light chromotherapy,LCT)、AD 药物疗法和PBM+MFT+LCT联合疗法等5种方法分别治疗145位AD患者,并比较其疗效。阿尔茨海默病评估量表(Alzheimer’s disease assessment scale-cognitive subscale,ADAS-cog)结果显示,接受组合疗法、PBM、MFT 或药物疗法的患者相较于安慰剂组,认知功能得到改善,其中组合疗法疗效最显著,PBM疗法次之,随后是药物疗法,MFT疗效最低。这些结果提示,不同类型的综合疗法对于改善AD患者的认知障碍有很好的作用,而在临床上应用这几种方法时需要考虑到各种治疗方案的优势与劣势。此研究显示,组合疗法不失为一种很有发展前途的治疗方式。Zomorrodi 等[84]使用40 Hz 810 nm LED装置结合经颅加鼻内PBM治疗一位MMSE评分为21 分的轻度AD 患者,两周治疗后患者的MMSE评分和阿尔茨海默病合作研究(Alzheimer’s Disease Cooperative Study,ADCS-ADL)分数显著提高,ADAS-cog 分数明显降低。Saltmarche 等[85]通过10 Hz 810 nm LED 经颅加鼻内PBM 治疗5 位AD患者,12周后患者症状明显改善(MMSE评分平均提高5 分,ADAS-cog 分数也明显降低),同时,患者焦虑和愤怒情绪减少,睡眠质量提高,且未观察到不良反应。Salehpour 等[86]使用3 种不同的可穿戴LED设备对一名患有AD病史的白人患者进行治疗,患者在第一周使用包含连续红色(635 nm)和近红外(810 nm)LED 的经颅头盔和身体垫进行治疗,从第2周开始增加经左侧鼻孔的10 Hz脉冲模式近红外(810 nm)LED治疗,经过4周PBM治疗后患者的认知功能增强(蒙特利尔认知评估评分从18 分提高至24 分,工作记忆问卷评分从53分降低至10分),艾伯塔省嗅觉测试和花生酱气味检测测试显示嗅觉功能障碍出现逆转,生活质量指标得到改善,且无不良反应。Chao[87]报道了8 名痴呆症受试者分别接受12 周的常规护理(UC,n=4)和家庭PBM 治疗(n=4)的效果。常规护理组从事12 周的日常活动,PBM 组在家中使用Vielight Neuro Gamma 设备(810 nm,40 Hz)进行为期12 周的近红外经颅和鼻腔照射治疗。12周后,PBM组的ADAS-cog分数和神经精神病学调查(Neuropsychiatric Inventory,NPI)分数有所改善,脑血流灌注量增加,并增加了后扣带回皮质与默认模式网络内的外侧顶节点之间的连接。此外,Tsai Li-Huei 教授团队[88]使用40 Hz 光+声疗法对轻度AD 患者进行为期3 月的治疗,显著改善了患者的认知功能、日常节律以及AD相关的病理结构和功能,同时也证实了光+声疗法的安全性。最近的一项研究表明,主观认知下降(subjective cognitive decline,SCD)和遗忘性轻度认知障碍(amnestic mild cognitive impairment,aMCI)患者在每天清晨醒来后接受连续蓝绿光(500 nm,LED)经眼治疗4周后,患者的认知、睡眠和情绪障碍有明显改善[89]。在小型临床研究中,PBM 均显示出良好的AD 治疗效果,也证实了PBM 在临床应用中的安全性,但PBM 要广泛应用于临床,仍需开展广泛而深入的研究。PBM在AD患者临床治疗方面的研究参数见表3。
4 展望
目前,尽管已经投入了大量成本用于AD治疗药物的开发,但其治疗效果仍未显示出重大突破。而PBM 对于AD 的疗效及其安全性已经在诸多临床前和临床研究中得到验证,表明PBM 未来可能成为治疗这些疾病的一种有效替代疗法。基于PBM 无创和无副作用的优点,其可作为当前有效治疗的辅助疗法,乃至发展成为一种预防性理疗手段。总的来说,PBM 在认知障碍的治疗和防治中颇具前景。目前已发表了大量的PBM 研究报告,包括对PBM 的作用机制和治疗效果评价方法的研究,为今后的临床试验提供了数据支持。然而,PBM 在成为一种广泛可及的治疗方法之前还有很长的路要走。在过去10 年间,PBM 已被广泛应用于多种疾病如AD等药物研发中,并取得了较好疗效;但同时也发现一些问题有待解决。目前,其作用机制及量效关系尚不清楚,特别是PBM 在AD治疗中的量效关系,还需要更全面和深入的临床试验来阐明临床上可采用的最佳治疗模式和剂量参数并完善临床评价体系。同时,需针对AD开发便携式PBM 治疗设备,为AD 临床治疗提供一种颇具潜力的新方向,并为缓解患者疾病护理和医疗负担提供一种可行的解决方案。
