“物质结构与性质”模块核心知识考查动向及备考启示
2023-08-11郭春红
王 春 郭春红
(1.北京教育学院;2.北京钱学森中学)
“物质结构与性质”模块是高中化学选择性必修部分的重要内容,也是高考考查的重点内容,近年来高考化学试题注重以新功能、新结构材料作为情境素材,考查核外电子排布规律、元素周期表“位—构—性”应用、杂化轨道类型和分子空间构型、电离能、电负性、晶体结构与性质、晶胞密度计算等核心内容,对学生的知识综合应用能力要求较高。本文就近年来高考化学试题中有关“物质结构与性质”模块常见核心考点的考查动向进行分类介绍,并提出几点备考建议,供广大师生进行参考。
一、核心知识考查动向
动向一 有关基态原子核外电子排布规律的考查
这类试题考查内容一般是要求考生根据所学的构造原理、能量最低原理、泡利原理、洪特规则等知识来书写电子排布式,高考命题形式一般是给出某一原子,要求写出电子排布式或电子排布图、价电子排布式中的某一种。解答此类试题时需要首先确定题目中给出的元素所对应的基态原子在元素周期表中的位置,并判断该原子是否为高中常见的特殊原子,注意书写特殊原子电子排布式一定要考虑电子进入能级的顺序。
【例1】(1)(2020年全国Ⅰ卷节选)基态Fe2+与Fe3+离子中未成对的电子数之比为________。
(2)(2022年广东卷节选)已知Se与S同族,基态硒原子价电子排布式为________。
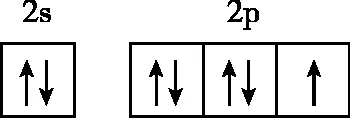
(3)(2022年全国甲卷节选)基态F原子的价电子排布图(轨道表示式)为________。
动向二 有关元素“位—构—性”知识综合应用的考查
这类试题的题干中主要提供元素的周期数及元素核外电子的数量关系,或者提供元素周期表的部分结构和部分元素在周期表中的位置等信息。解答此类试题时可先通过核外电子的排布特点及数量关系或根据周期表的片段结构确定所在周期,再确定试题中的相应元素,最后分析推断元素单质及其化合物的性质递变规律。
【例2】(2022年全国甲卷,12题)Q、X、Y、Z是原子序数依次增大的短周期主族元素,其最外层电子数之和为19。Q与X、Y、Z位于不同周期,X、Y相邻,Y原子最外层电子数是Q原子内层电子数的2倍。下列说法正确的是
( )
A.非金属性:X>Q
B.单质的熔点:X>Y
C.简单氢化物的沸点:Z>Q
D.最高价含氧酸的酸性:Z>Y
【解析】依题意知Q、X、Y、Z为原子序数依次增大的短周期主族元素,Q与X、Y、Z不在同一周期,Y原子最外层电子数为Q原子内层电子数的2倍,则Q应为第二周期元素,X、Y、Z位于第三周期,Y的最外层电子数为4,则Y为Si元素,X、Y相邻,且X的原子序数小于Y,则X为Al元素,Q、X、Y、Z的最外层电子数之和为19,则Q、Z的最外层电子数之和为19-3-4=12,主族元素的最外层电子数最多为7,若Q的最外层电子数为7,为F元素,Z的最外层电子数为5,为P元素,若Q的最外层电子数为6,为O元素,则Z的最外层电子数为6,为S元素,若Q的最外层电子数为5,为N元素,Z的最外层电子数为7,为Cl元素;综上所述,Q为N或O或F,X为Al,Y为Si,Z为Cl或S或P,据此分析解题。X为Al,Q为N或O或F,同一周期从左往右元素非金属性依次增强,同一主族元素非金属性从上往下依次减弱,故非金属性:Q>X,A选项错误;X为Al(属于金属晶体),Y为Si(属于共价晶体),故单质熔点Si>Al,即Y>X,B选项错误;含有氢键的物质沸点升高,由分析可知Q为N或O或F,其简单氢化物为NH3或H2O或HF,Z为Cl或S或P,其简单氢化物为HCl或H2S或PH3,由于前者物质中存在分子间氢键,而后者物质中不存在,故沸点Q>Z,C选项错误;元素的非金属性越强,其最高价含氧酸的酸性越强,P、S、Cl的非金属性均强于Si,因此最高价含氧酸的酸性:Z>Y,D选项正确;故本题正确答案为D。
【例3】(2022年广东卷,7题)甲~戊均为短周期元素,在元素周期表中的相对位置如图所示。戊最高价氧化物对应的水化物为强酸。下列说法不正确的是
( )
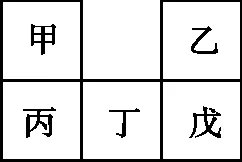
A.原子半径:丁>戊>乙
B.非金属性:戊>丁>丙
C.甲的氢化物遇氯化氢一定有白烟产生
D.丙的最高价氧化物对应的水化物一定能与强碱反应
【解析】依据题意知甲~戊是短周期元素,戊的最高价氧化物对应水化物为强酸,则可能是硫酸或高氯酸,若是高氯酸,则戊为Cl,甲为N、乙为F、丙为P、丁为S,若是硫酸,则戊为S,甲为C、乙为O、丙为Si、丁为P。根据同周期元素的原子从左到右,原子半径减小;同主族元素的原子从上到下,原子半径逐渐增大,则原子半径:丁>戊>乙,A选项正确;根据同周期元素从左到右非金属性逐渐增强,则非金属性:戊>丁>丙,B选项正确;甲的氢化物可能为氨气,也可能为甲烷、乙烷等,若是氨气,则遇氯化氢一定有白烟产生,若是甲烷、乙烷等,则遇氯化氢不反应,没有白烟生成,C选项错误;丙的最高价氧化物对应的水化物可能是硅酸也可能是磷酸,都能与强碱反应,D选项正确。综上所述本题正确答案为C。
动向三 有关主族元素第一电离能及电负性知识的考查
这类试题考查内容主要涉及主族元素之间的第一电离能、电负性的大小的相互比较。解答这类试题应注意考虑ⅡA、ⅤA族元素最外层s或p能级电子轨道处于全充满或半充满的状态,第一电离能比相邻族的要大。同一周期从左到右,元素的第一电离能从小到大的顺序是ⅠA<ⅢA<ⅡA<ⅣA<ⅥA<ⅤA<ⅦA,同一主族从上到下,元素的第一电离能逐渐减小,同一周期从左到右,元素的电负性逐渐增大(0族元素除外)。
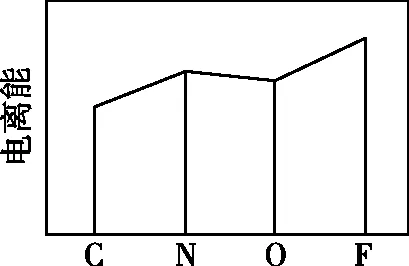
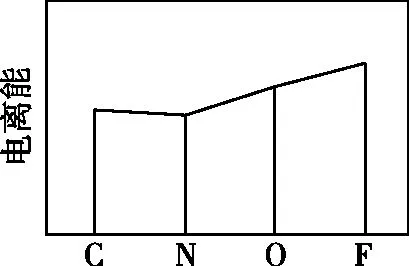
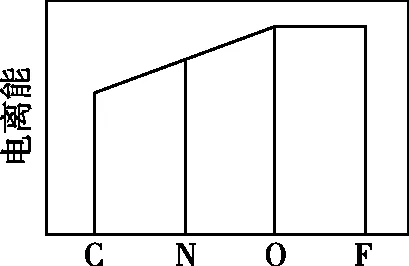
【例4】(1)(2022年全国甲卷节选)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是________(填标号),判断的根据是________;第三电离能的变化图是________(填标号)。
图a
图b
图c
(2)(2022年湖南卷节选)富马酸亚铁(FeC4H2O4)是一种补铁剂。富马酸分子的结构模型如图所示:
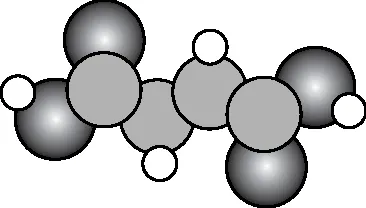
富马酸亚铁中各元素的电负性由大到小的顺序为________。
【解析】(1)C、N、O、F四种元素在同一周期,同一周期第一电离能的总体趋势是依次升高的,但由于N元素的2p能级为半充满状态,因此N元素的第一电离能较C、O两种元素高,因此C、N、O、F四种元素的第一电离能从小到大的顺序为C
动向四 有关杂化轨道及微粒空间构型知识的考查
这类试题考查内容主要涉及杂化轨道类型的判断、空间构型的判断、等电子体的书写与利用等电子体原理书写电子式和结构式、判断空间构型等内容。解答此类试题应注意首先运用价层电子对互斥理论确定中心原子价层电子对数,然后运用杂化轨道理论判断中心原子杂化类型,再依据中心原子价层电子对数和杂化类型推断粒子的空间构型。
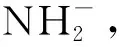
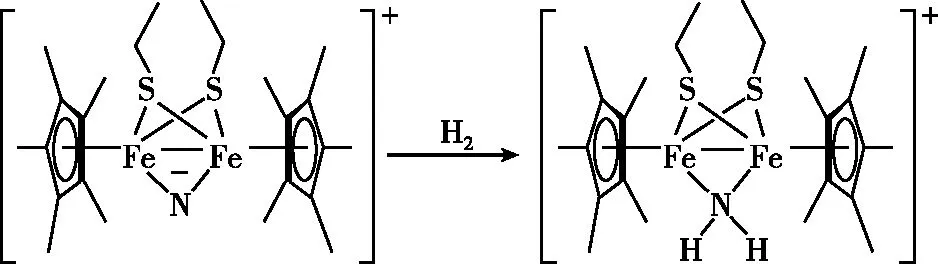
①产物中N原子的杂化轨道类型为________;


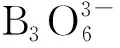
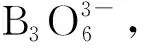
动向五 有关化学键与物质的性质知识的考查
这类试题考查内容主要涉及σ键和π键的数目判断、配位键与配合物、极性分子与非极性分子、范德华力与氢键对物质性质的影响等内容。解答此类试题应注意重点掌握以下几点知识:(1)共价键按轨道重叠方式分为:σ键(“头碰头”重叠)和π键(“肩并肩”重叠);按两原子间成键的数目分为单键(单键、配位键全是σ键)、双键(一个是σ键,另一个是π键)、三键(一个是σ键,另两个是π键)。(2)由极性键构成的非极性分子在结构上要高度对称,如直线形、平面正三角形、正四面体形这样才能使正负电荷的中心重合。(3)氢键是当氢原子与电负性较大(N、O、F)的原子以共价键结合时产生的特殊分子间作用力,使物质的熔沸点升高,溶解性变大。
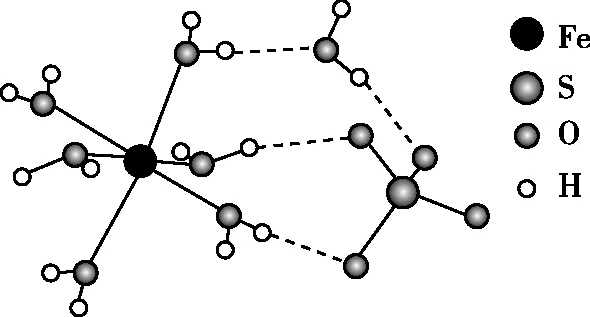
【例6】(1)(2022年北京卷节选)已知FeSO4·7H2O 结构示意图如图。
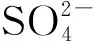
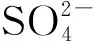
(2)(2020年山东卷节选)NH3、PH3、AsH3的沸点由高到低的顺序为__________________(填化学式,下同),还原性由强到弱的顺序为______________,键角由大到小的顺序为________。
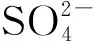
动向六 有关晶体类型与晶胞的计算知识的考查
这类试题考查内容主要涉及晶体与晶胞的关系、晶胞中粒子数目的计算,试题考查形式一般为确定化学式、计算晶体密度、计算晶体中微粒间距离和确定原子的分数坐标等。解答此类试题首先应注意掌握典型晶体类型、晶胞模型及相关性质,学会应用“均摊法”计算晶胞中粒子数目,并运用相关数学思维和计算公式对典型晶体进行相关计算。
【例7】(1)(2022年广东卷节选)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图甲,沿x、y、z轴方向的投影均为图乙。
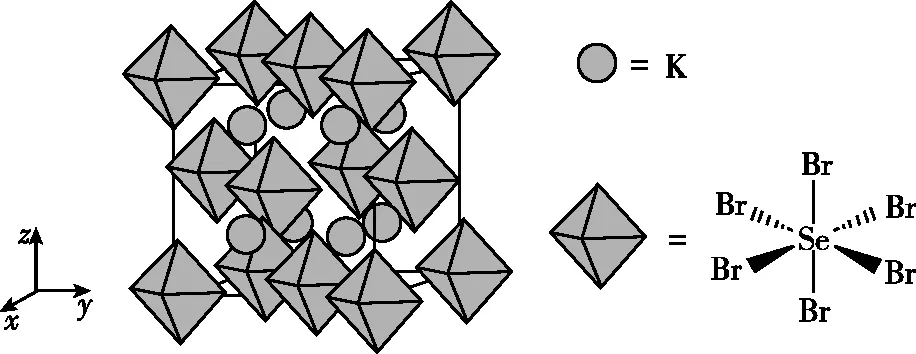
图甲
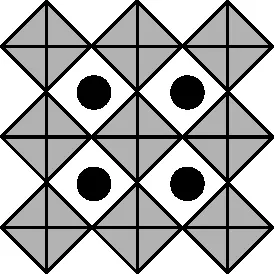
图乙
①X的化学式为________。
②设X的最简式的式量为Mr,晶体密度为ρg·cm-3,则X中相邻K之间的最短距离为________nm(列出计算式,NA为阿伏加德罗常数的值)。
(2)(2021年海南卷节选)MnS晶胞与NaCl晶胞属于同种类型,如图所示。
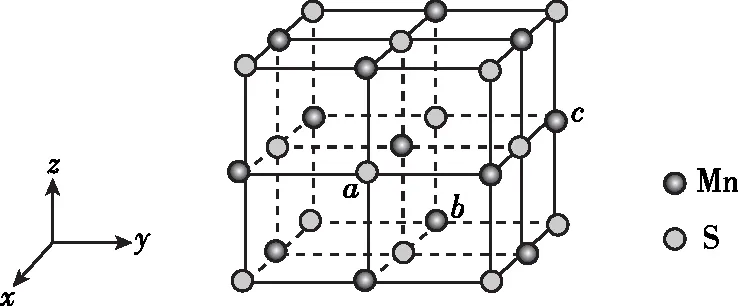
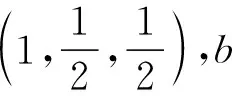

二、复习备考几点启示
(一)教学中注重联系生活实际,合理选取情境素材
近年来高考试卷中“物质结构与性质”试题情境的创设紧密联系学生的学习和生活实际,体现了科学、技术、社会和环境发展的成果,有利于培养学生的“科学态度与社会责任”。物质结构的内容比较抽象,在教学中应尽量联系与学生生活密切相关的问题,激发学生对物质结构与性质的学习兴趣。教学内容还应该注重融入体现时代性的生活情境素材,如手性药物设计、催化材料、超导材料、纳米材料等新型材料,拓宽学生的知识视野,培养学生的创新思维能力。
(二)教学中注重建模推理,发展学生对概念的理解及辨析
近年来高考试卷中“物质结构与性质”试题提供了大量的文字信息和新图表信息,要求学生基于相关信息,运用模型推测或解释物质的微观结构特点,推测物质的性质。解答此类题目需要学生具备一定的信息加工能力、归纳推理能力和模型认知能力。因此,在“物质结构与性质”模块教学中,应该注重促进学生理解物质结构相关概念的内涵,对相似的化学基本概念进行比较和辨析,体会物质结构研究的基本思路和方法,发展学生证据推理与模型认知的化学学科核心素养。
(三)教学中注重构建常考题型解题模型,提炼解题方法和策略
近年来高考试卷中“物质结构与性质”试题考查的核心知识点较为零散,试题对学生的空间思维能力和计算能力要求较高。教师在教学中应注意借助多种手段,如模型、动画等手段,让学生加强对空间结构的认识与理解,从而提升分析与计算能力。结合近年来高考化学试题进行专题训练,针对易失分题型,重点突破,构建各类题型的答题模板、解题模型,提炼试题的解题方法和解题策略。
