[N1,8,8,8][Ac]萃取精馏分离环己烷-正丙醇共沸体系研究
2023-08-10邢庆浩李文秀张弢
邢庆浩,李文秀,张弢
(沈阳化工大学 化学工程学院,辽宁省化工分离技术重点实验室,辽宁 沈阳 110142)
醇类化合物作为重要的化工原料,在生产生活中有着重要的作用,随着生物发酵技术的发展,醇类化合物被认为是未来替代石油燃料的一种新的可再生燃料[1]。同时醇类化合物还是生产醛类化合物、酯类化合物、酰胺类化合物的重要原料。目前国内正丙醇的生产主要有两种方法,第一种由丙醛催化加氢制得,第二种由烯丙醇加氢副产正丙醇法。由于第一种生产工艺比较成熟完善,所以大部分国内企业采用第一种工艺生产。目前工业上大多数都采用苯加氢制备环己烷,环己烷在工业上应用范围十分广泛。由于其良好的溶解性,常用来作为各种有机化合物的溶剂和萃取剂,可以用于制备环己酮、环己醇、己内酰胺等,另外环己烷在医药中间体的合成方面也有应用,是十分重要的化工原料。在生物发酵和工业废水中存在大量的正丙醇和水的混合物,苯和环己烷作为夹带剂常用来分离醇和水,但由于苯具有致癌性,而环己烷的毒性较小,所以环己烷越来越受欢迎2-4]。然而环己烷和正丙醇会形成共沸物,如果不分离该共沸物将会造成资源浪费和环境污染。马春蕾利用Aspen Plus软件模拟了环己烷-正丙醇共沸物变压精馏工艺流程[5]。孙畅研究了DMF作为萃取剂萃取精馏分离环己烷-正丙醇共沸物[6]。萃取精馏是指向共沸物中投入第三组分(萃取剂)从而改变原共沸物组分之间的相互作用,当共沸物的相对挥发度大于1共沸现象被打破,从而实现分离共沸物。萃取精馏由于其处理能力强、操作简单、能耗低、夹带剂需求少等优点,近年来受到广泛关注[7-9]。萃取精馏能够采用的萃取剂种类很多,所以选择合适的萃取剂是至关重要的。优良的萃取剂应该具有较高的选择性,选择性越高的萃取剂消耗量越少,越能节约成本。同时还要有良好的溶解性,溶解性的好坏直接影响到萃取精馏过程中的传质效果。并且萃取剂的沸点要远高于共沸物,系避免生成新的共沸物。还需要具有较低的挥发性极强的稳定性。离子液体是一种完全由离子构成的液态熔融盐,根据离子液体的阳离子不同分类,主要有咪唑类离子液体,吡啶类离子液体,季胺类离子液体,季磷类离子液体等。离子液体能够充当萃取剂,它具有较低的蒸汽压、优异的热力学和化学稳定性、极强的设计能力等。因此,离子液体由于其优异的性能在分离工程中得到了广泛的应用。
测定了101.325 kPa下环己烷-正丙醇二元气液相平衡数据,并验证了实验仪器的准确性。通过COSMOthermX软件筛选出季胺类离子液体[N1,8,8,8][Ac]三辛基甲基乙酸铵盐作为萃取剂。测定了101.325 kPa下离子液体-环己烷-正丙醇三元气液相平衡数据,并使用NRTL模型对实验数据进行拟合。
1 离子液体的筛选
由于能够凑成离子液体的阴阳离子种类繁多,理论上通过阴阳离子排列组合而成的离子液体可达1018种。所以通过实验的方式筛选出最合适的离子液体几乎是不可能的。为了准确且高效的筛选出适合分离环己烷-正丙醇共沸物系的离子液体,采用真实溶剂类导体屏蔽模型(COSMO-RS)理论的COSMOthermX 软件,通过计算离子液体和环己烷-正丙醇之间的选择性和溶解度来选择最优的离子液体来充当萃取剂。
1995年,klamt提出一种统计热力学与COSMO理论结合的新理论,真实溶剂类导体屏蔽模型(COSMO-RS)。COSMO-RS是通过计算分子表面相互作用,实现预测离子液体热力学性质。在COSMO理论中,介电常数被看作是无穷大的,所有分子都可以被视为理想导体。对于理想导体,所有分子之间的相互作用都被屏蔽在溶质表面,通过极化电荷密度表示。COSMO-RS可以计算屏蔽电荷密度大小来预测分子间的相互作用。COSMO-RS的优势在于缺少实验数据的条件下可以对离子液体的活度系数、溶解度、相平衡、亨利常数等性质进行预测。COSMO-RS是目前最常用的预测离子液体热力学性质的方法。它基于量子化学的理论采用分子模拟的方法,实现对离子液体准确快速预测。
筛选了25种阳离子,25种阴离子,共计625种离子液体。结果表明,阳离子对于选择性的影响较小,阴离子对于选择性的影响较大,其中[Ac]-阴离子的分离能力最强。从溶解度的角度考虑,正丙醇易溶于离子液体,环己烷难溶于离子液体。阳离子对环己烷的溶解性影响较大,阴离子对于溶解性的影响较小,其中[N1,8,8,8]+阳离子的溶解性最好。最终选定[N1,8,8,8][Ac]三辛基甲基乙酸铵盐作为萃取剂。
2 实验材料与方法
2.1 实验试剂及仪器
环己烷、正丙醇均为分析纯购买自国药集团化学试剂有限公司,[N1,8,8,8][Ac]由兰州雨陆离子液体有限公司提供。离子液体在使用前在干燥箱中恒温干燥24 h,实验之前采用了卡尔费休滴定法测定离子液体含水量,使离子液体的含水量小于500×10-6。
电子天平(ATL-224-1,ACCULAB,中国),调压器(TDGC2-0.5,浙江正泰电器股份有限公司),精密温度计±0.01 ℃,气液相平衡釜CE-2型由北洋化工实验设备有限公司提供,使用气相色谱仪(GC7890A,安捷伦)对气液相药品进行分析。载气为氮气,流速为25 cm3/min,柱温、进样口和检测器的温度分别为348,493,523 K。
2.2 实验方法
使用电子天平配置2%,3.5%,5%固定物质量分数的环己烷和正丙醇溶液,将正丙醇溶液加入平衡釜中,使用玻璃棒搅拌将实验药品充分互溶,将溶液倒入气液平衡釜中。将冷凝管插入平衡釜中,通入冷凝水后启动加热装置,每隔8 min调节一次加热装置,对实验药品进行加热。待溶液沸腾后,向釜内加入1 mL环己烷离子液体溶液,每隔10 min记录一次温度变化。三次记录温度无变化且冷凝回流稳定可视为达到平衡状态。在气相平衡口取出微量药品,液相平衡口取出1 mL药品,取出的药品通过气液相色谱分析三次取平均值。再向平衡釜中加入2 mL环己烷离子液体溶液,记录温度变化,依此类推。当色谱分析出液相中不含离子液体的环己烷物质的量分数x1’大于90%时实验结束。
3 实验结果与讨论
3.1 实验装置可靠性验证
采用了两种方法验证实验装置的可靠性,通过实验的方法测量了101.325 kPa下环己烷-正丙醇二元气液相平衡数据(表1),并与文献值进行了比较如图1所示[10]。由图1可知实验结果和文献值基本一致,证明本实验装置可靠。为了进一步验证本实验的可靠性,本实验获得的二元实验数据由Wisniak’s L-W方法进行热力学一致性检验[11]。计算得到每个点的Fk<5,证明本实验符合热力学一致性。
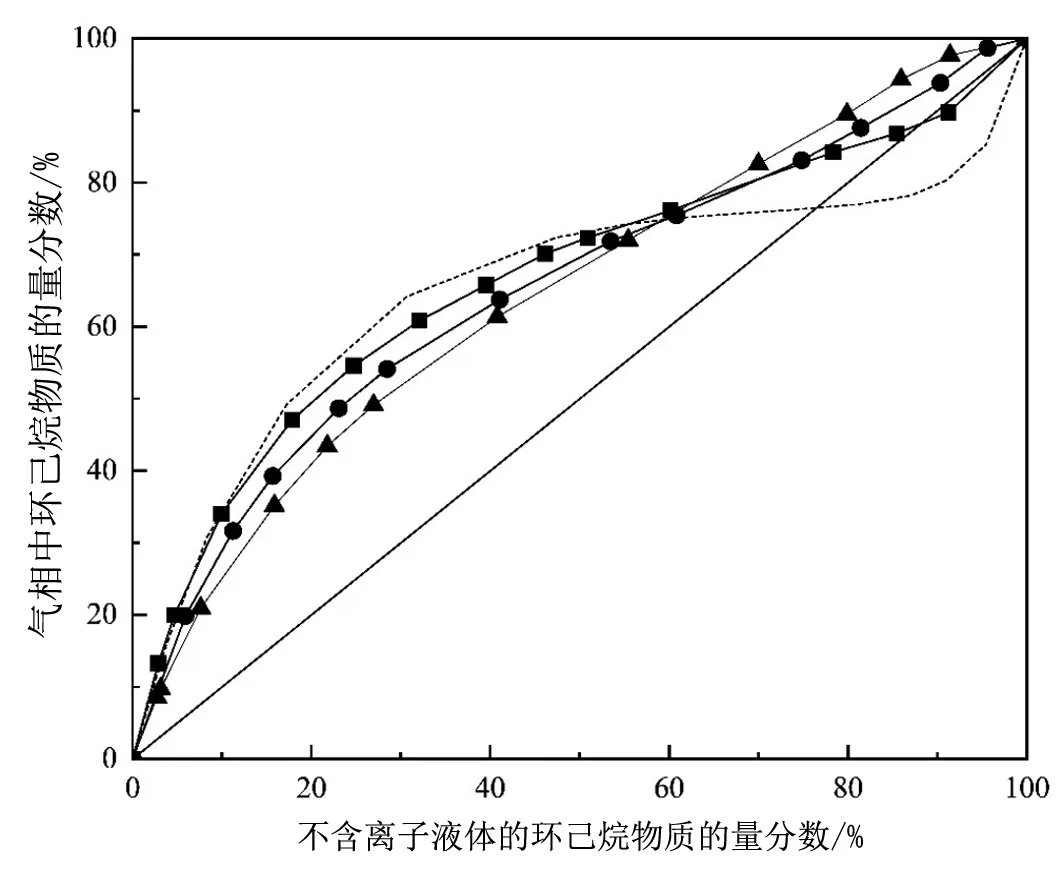
图1 101.325 kPa环己烷(1)-正丙醇(2)的x1-y1图

表1 101.325 kPa环己烷(1)-正丙醇(2)等压气液相平衡数据
3.2 三元气液相平衡数据的测定
环己烷(1)+正丙醇(2)+[N1,8,8,8][Ac](3),离子液体和共沸体系在101.325 kPa下的气液相平衡实验数据展示在表2中 。其中x3为液相中离子液体的物质的量分数,x1为气相中环己烷的物质的量分数x1’为液相中不含离子液体的环己烷物质的量分数,y1为气相中环己烷物质的量分数,α12为环己烷正丙醇之间的相对挥发度,T表示三元体系平衡后的平衡温度。

表2 环己烷(1)+正丙醇(2)+[N1,8,8,8][Ac](3)气液相平衡数据
3.3 气液相平衡数据的关联
含有离子液体的气液相平衡数据是现有热力学模型改进、研究离子液体微观作用机理和研究分离技术的基础。但是通过实验的方法获得气液相平衡数据是有限的,通过建立合适的气液相平衡模型能够得到含有离子液体的全浓度气液相平衡数据,从而极大的减少研究时间节约人力物力。NRTL模型具有拟合精度较高,比较广的适用范围,同时具有一定的预测能力,适用于部分互溶和全溶体系等特点,选用目前最常用的非随机双液相模型(NRTL)对实验数据进行关联[12]。NRTL 模型的所有参数均通过 Levenberg-Marquardt 方法最小化目标函数回归出最优参数,并使用平均相对偏差(ARD)判断模型关联好坏,所得结果如表3所示。

表3 环己烷(1)+正丙醇(2)+[N1,8,8,8][Ac](3)NRTL模型交互作用参数
3.4 结果讨论
图2是环己烷(1)-正丙醇(2)-[N1,8,8,8][Ac](3)三元体系的x'1-y1图。从图中我们可以看出实验值和NRTL拟合曲线相吻合,说明NRTL方程适合关联本体系。和不含离子液体的环己烷-正丙醇的二元体系相比,离子液体的加入使得共沸点向右上方移动,随着离子液体浓度增加,环己烷正丙醇之间的相对挥发度逐渐增大,直至打破共沸。由NRTL方程计算可得[N1,8,8,8][Ac]打破环己烷-正丙醇共沸体系所需最小物质的量分数为2.5%。

■,实验数据x3=2%;●,实验数据 x3=3.5%;▲,实验数据x3=5%; 实线,NRTL模型拟合曲线; 虚线,二元实验数据x3=0
4 分离机理探究
过量焓(HE)是溶液的主要热力学性质,用于描述分子之间的相互作用和溶液的非理想行为,它反映了混合过程中不同分子之间相互作用的变化[13]。如果过量焓大于零,溶解过程吸收热量。混合溶液新的相互作用释放的能量无法满足旧化学键断裂,即理想的纯组分比实际的混合溶液具有更少的能量并且更稳定。如果过量焓小于零,则表明溶解过程是放热的,混合后的实际溶液能量较小,并且发生了相互作用,混合后的溶液更加稳定。二元混合物的过量焓通过几种不同相互作用的贡献计算,包括静电错配 (MF)、范德华 (vdW) 和氢键 (HB)。本文用COSMOthermX软件计算了298.15 K下环己烷和正丙醇与[N1,8,8,8][Ac]相互作用的过量焓数据,结果如表4所示。
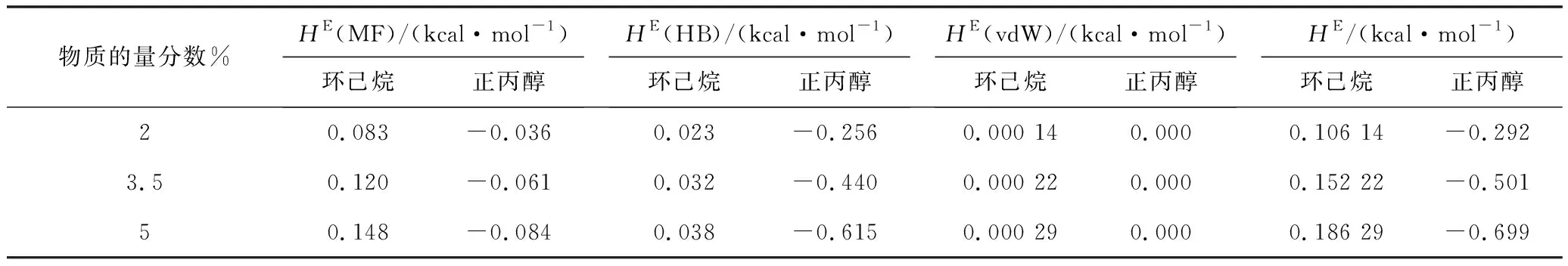
表4 298.15 K[N1,8,8,8][Ac]在不同的物质的量分数下和环己烷以及正丙醇之间过量焓
从表4可以看出环己烷与离子液体的结合是吸热过程,正丙醇与离子液体结合是放热过程,因此离子液体倾向于与正丙醇相互作用,三种贡献中的氢键(HB)是最大的,这表明氢键在正丙醇和离子液体之间的相互作用能中起主导作用。在实验过程中,正丙醇和离子液体留在釜底部,环己烷以气体形式从平衡釜中排出,又经冷凝管冷凝回流进平衡釜,过量焓分析和实验结果一致。从表4可以看出,正丙醇和离子液体之间的HE的绝对值随着离子液体浓度的增加而增加,表明正丙醇和离子液体的结合能力随着浓度的增加而增加,这与实验结果一致。
5 结论
在101.325 kPa下通过气液相平衡釜法测定了环己烷-正丙醇气液相平衡数据,通过二元实验数据和文献值数据的对比和Wisniak’s L-W方法验证了实验装置的可靠性。测定了101.325 kPa下环己烷-正丙醇-[N1,8,8,8][Ac]三元气液相平衡数据,探讨了[N1,8,8,8][Ac]对环己烷-正丙醇共沸体系的影响,结果表明:[N1,8,8,8][Ac]的加入会增大环己烷-正丙醇之间的相对挥发度,随着离子液体物质的量分数的增加现象越发明显,经计算当离子液体的物质的量分数达到2.5%时,环己烷-正丙醇之间的共沸现象被打破。通过NRTL模型对环己烷-正丙醇-[N1,8,8,8][Ac]的三元气液相平衡数据进行关联,结果实验值和拟合曲线相吻合,说明NRTL模型适合关联该体系。通过过量焓分析对[N1,8,8,8][Ac]离子液体分离过程的机理进行了探究。结果表明正丙醇-离子液体之间的结合能力强于环己烷-离子液体之间的结合能力,且正丙醇-离子液体之间氢键结合占主导作用。
