滇皂角米多糖提取工艺优化及其抗氧化活性
2023-08-08徐瑾钰彭小伟阚欢赵平全伟刘云
徐瑾钰,彭小伟,阚欢,赵平,全伟,刘云*
(1.西南林业大学生命科学学院,云南 昆明 650224;2.西南林业大学材料与化学工程学院,云南 昆明 650224;3.云南省农村科技服务中心,云南 昆明 650021)
滇皂角米又称皂角精、雪莲子,是滇皂荚(Gleditsia japonica)种子的外胚乳,其质量占种子的30%左右[1]。滇皂角米中蛋白质含量高、氨基酸种类齐全、矿物质元素丰富[2],被认为是唯一可食的皂荚种子外胚乳[3]。此外,皂角米中含有约80%的多糖胶,其主要由半乳糖、甘露糖、葡萄糖、阿拉伯糖等单糖组成[4]。植物多糖应用广泛,不仅可作为增稠剂、黏合剂、稳定剂等应用于造纸、印染等产业,还具有抗氧化、降血糖、降血脂、抗肿瘤等功能,可应用于食品医药制造领域[5]。
在植物多糖的研究与应用中,提取方法的选择是较重要的环节之一。提取方法的不同导致植物多糖的得率、结构与活性存在一定的差异[6]。热水浸提法是制备植物多糖最经典的方法,但因得率低、耗时长逐渐被其它方法所替代。与热水浸提相比,碱液提取法具有得率高、耗时短、节省原材料等优点。此外,氢氧化钠溶液能降低多糖胶的黏度、增大其溶解度,提高多糖胶的得率。
抗氧化能力是评价植物多糖生物活性的重要指标,体外抗氧化能力可通过对自由基清除效果来评价。自由基具有较高的氧化活性,在代谢过程中携带不对称电子,容易引起各种疾病。研究表明,体内大量的自由基会氧化、破坏正常细胞,引发身体疾病,如炎症、早衰、癌症、辐射损伤等[7]。
目前对于滇皂角米多糖提取工艺及活性研究较少,限制了其在食品医药、化工中的开发与利用。本试验以滇皂角米为研究对象,探究滇皂角米多糖提取工艺与抗氧化活性,为滇皂角米的开发利用提供理论基础。
1 材料与方法
1.1 材料与试剂
滇皂角米:片状,质地坚硬,色泽微黄,采自云南省梁河县,经粉碎后过60 目筛,备用。
VC、苯酚、硫酸、三氯甲烷、正丁醇、无水乙醇、碳酸氢钠、乙二胺四乙酸二钠:广东光华科技股份有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-联氨-双-(3-乙基苯并噻唑啉-6-磺酸)二胺盐[2,2'-azino-bis-(3-ethylbenzthiazoline-6-sulphonic acid),ABTS]:北京博奥拓达科技有限公司;葡萄糖、过硫酸钾:天津市风船化学试剂科技有限公司;以上试剂均为分析纯。
1.2 仪器与设备
真空冷冻干燥机(FD5-series):金西盟(北京)仪器有限公司;紫外可见分光光度计(UV-2600):岛津仪器(苏州)有限公司;离心机(TG16-WS):湖南迈克尔实验仪器有限公司;漩涡混合器(XH-C):常州越新仪器制造有限公司;增力电动搅拌器(JJ-1)、电热恒温水浴锅(XMTD-7000):北京市永光明医疗仪器有限公司。
1.3 试验方法
1.3.1 滇皂角米多糖提取
准确称取100 mg 滇皂角米粉末,在一定温度、体积、浓度的NaOH 溶液中提取一定时间,6 000 r/min 离心10 min,收集上清液,用其4 倍体积的95%乙醇沉淀,真空冷冻干燥,得滇皂角米粗多糖。
1.3.2 滇皂角米粗多糖脱蛋白、除杂
采用Sevag 法除去粗多糖中的蛋白质[8],透析袋法除去盐类及小分子杂质[9],经真空冷冻干燥得滇皂角米多糖。
1.3.3 葡萄糖标准曲线的绘制
葡萄糖标准曲线的绘制参照钱怡霖等[10]的方法并稍作修改。
1.3.4 滇皂角米多糖提取率的计算
采用苯酚-硫酸法测定滇皂角米多糖含量,滇皂角米多糖提取率(Y,%)按如下公式计算。
式中:m1为样品中滇皂角米多糖质量,g;m0为样品质量,g;N 为稀释倍数。
1.3.5 单因素试验设计
按照1.3.1 进行试验,选取液料比[100∶1、150∶1、200∶1、250∶1、300∶1(mL/g)]、提取时间(70、80、90、100、110 min)、NaOH 溶液浓度(0.05、0.10、0.15、0.20、0.25 mol/L)、提取温度(30、40、50、60、70 ℃)进行单因素试验,其中固定条件分别为液料比200∶1(mL/g)、提取时间90 min、NaOH 溶液浓度0.15 mol/L、提取温度50 ℃。
1.3.6 Box-Behnken 试验设计
基于单因素试验的结果,以多糖提取率(Y)为响应值,分别考察液料比(A)、NaOH 溶液浓度(B)、提取温度(C)对滇皂角米多糖提取率的影响。试验因素水平见表1。
1.3.7 滇皂角米多糖抗氧化活性测定
1.3.7.1 DPPH 自由基清除能力的测定
根据Huang 等[11]的方法并稍作修改,将滇皂角米多糖溶液浓度设置为2、4、6、8、10 mg/mL。分别取2 mL 不同浓度的多糖样品溶液和2 mL DPPH 溶液(0.1 mmol/L)均匀混合,在避光条件下反应30 min,于517 nm 处测定其吸光度A1,同时测定无水乙醇加滇皂角米多糖样液的对照组吸光度A2,以及蒸馏水加DPPH 溶液的空白组吸光度A0。以VC作为阳性对照,DPPH 自由基清除率(X,%)计算公式如下。
1.3.7.2 ABTS+自由基清除能力的测定
根据Bora 等[12]的方法并稍作修改,将滇皂角米多糖溶液浓度设置为2、4、6、8、10 mg/mL。分别取1 mL不同浓度的滇皂角米多糖样品溶液和3 mL ABTS 储备液均匀混合,在避光条件下反应6 min,于734 nm 处测定其吸光度A1,同时测定蒸馏水加滇皂角米多糖样液的对照组吸光度A2,以及蒸馏水加ABTS 储备液的空白组吸光度A0,以VC作为阳性对照,ABTS+自由基清除率(Y,%)计算公式如下。
1.4 数据处理
本研究每个处理均进行3 次重复,结果以平均值±标准差表示。采用SPSS Statistics 26 进行单因素组间多重比较,Design-Expert 12 进行试验设计与方差分析,GraphPad Prism 8 作图。
2 结果与分析
2.1 葡萄糖标准曲线的绘制
图1 为葡萄糖溶液标准曲线,其方程为y=9.596 1x+0.000 02,R2=0.999 6。
2.2 单因素试验
2.2.1 液料比对滇皂角米多糖提取率的影响液料比对滇皂角米多糖提取率的影响见图2。
由图2 可知,在100∶1~300∶1(mL/g)内,液料比对多糖提取率的影响显著(P<0.05)。液料比在100∶1~200∶1(mL/g)时,多糖提取率随提取液量的增加而升高,其原因是在这个范围内,滇皂角米多糖与溶液的接触面积随着提取液量的增加而扩大,有利于溶质多糖的溶出;提取液量在200∶1~300∶1(mL/g)时,滇皂角米多糖提取率随提取液量的增加反而降低,其原因可能是提取液量过大导致溶液中分子间相互作用力降低以及溶出其它非糖杂质,从而阻碍了多糖的溶出,滇皂角米多糖提取率降低。这与陈淑芳等[13]、郭杰等[14]探究液料比对多糖提取率影响的结论一致。当液料比为200∶1(mL/g)时,滇皂角米多糖提取率达到峰值,为(72.50±0.74)%,因此,选择液料比150∶1、200∶1、250∶1(mL/g)进行后续试验。
2.2.2 提取时间对滇皂角米多糖提取率的影响
提取时间对滇皂角米多糖提取率的影响见图3。

图3 提取时间对滇皂角米多糖提取率的影响Fig.3 Effect of extraction time on the extraction yield of polysaccharide from the seed of Gleditsia japonica
由图3 可知,当提取时间达到90 min 时,滇皂角米多糖提取达到峰值,为(70.16±1.02)%。但随着时间的进一步的延长,滇皂角米多糖的提取率稍有降低,但差异不显著(P>0.05),其原因可能是提取时间延长导致多糖碱降解和热降解,促使提取率下降。这与唐森等[15]在研究提取时间对软枣猕猴桃果胶提取率影响时得到的结论基本一致。提取时间在70~110 min 内对多糖提取率影响较液料比、NaOH 溶液浓度、提取温度小。综合考虑成本、效率,响应面优化过程将提取时间固定为90 min。
2.2.3 NaOH 溶液浓度对滇皂角米多糖提取率的影响
NaOH 溶液浓度对滇皂角米多糖提取率的影响见图4。
由图4 可知,在NaOH 溶液浓度低于0.15 mol/L时,滇皂角米多糖提取率较低。当NaOH 溶液浓度为0.15 mol/L 时,多糖提取率达到峰值(71.35±0.56)%。这与庞庭才等[16]探究碱法提取碱蓬多糖的试验结果一致。随着溶液的浓度继续增大,多糖提取率显著下降(P<0.05),其原因可能是NaOH 溶液浓度过高会破坏多糖结构、溶出非多糖类杂质,不利于多糖的提取[17]。综上,选择NaOH 溶液浓度0.10、0.15、0.20 mol/L 进行后续试验。
2.2.4 提取温度对滇皂角米多糖提取率的影响
提取温度对滇皂角米多糖提取率的影响见图5。

图5 提取温度对滇皂角米多糖提取率的影响Fig.5 Effect of extraction temperature on the extraction yield of polysaccharide from the seed of Gleditsia japonica
由图5 可知,提取温度从30 ℃升高到50 ℃,滇皂角米多糖提取率显著提高(P<0.05)。其原因可能是在一定范围内的温度升高会使提取液黏度降低,多糖传质速率变快,提取率提高[18]。当滇皂角米多糖提取温度达到50 ℃时,提取率最高,为(71.44±0.50)%。但温度高于50 ℃,多糖提取率下降明显,可能是因为高温破坏多糖结构,以及高温使水分蒸发、溶液黏度增大,不利于多糖的提取[19]。因此,选择提取温度40、50、60 ℃进行后续试验。
2.3 响应面试验
2.3.1 Box-Behnken 试验结果
基于单因素试验结果,进行三因素三水平Box-Behnken 响应面试验设计,试验结果见表2。

表2 Box-Behnken 试验设计与结果Table 2 Design and results of Box-Behnken experiments
运用Design-Expert 12 软件对表2 中试验数据进行回归方程拟合,得到实际值拟合方程(只包含显著项):Y=-763.320 6+2.195 6A+13.928 6C-0.022 9AC-16.170 3BC-0.004 7A2-6 125.598 5B2-0.065 4C2。
对模型进行方差分析,结果见表3。
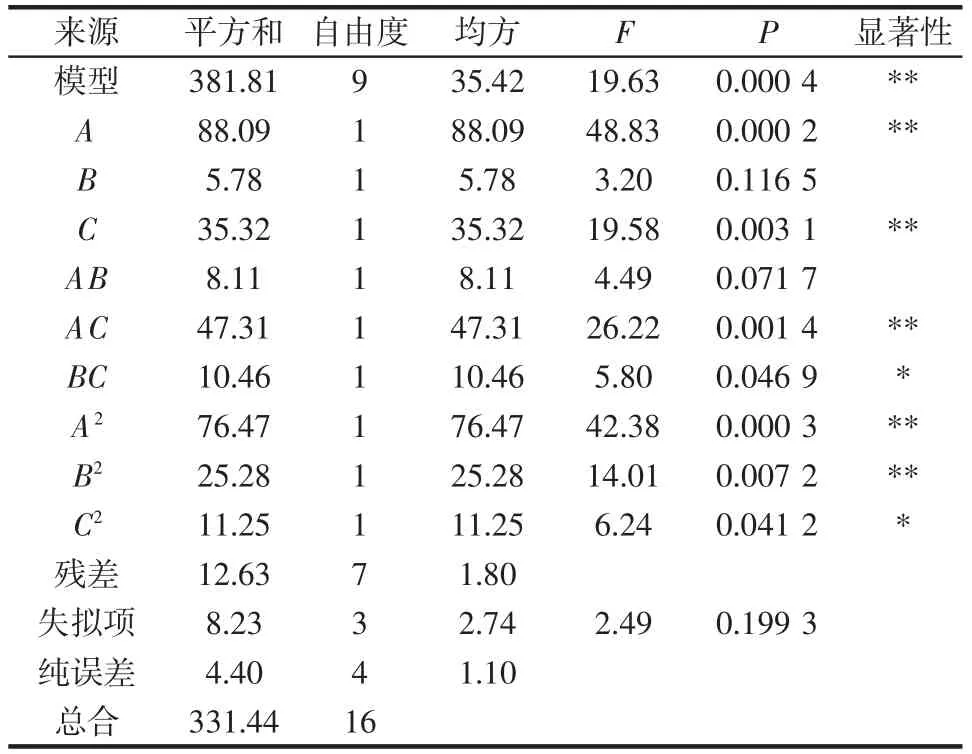
表3 Box-Behnken 试验方差分析Table 3 Variance analysis of Box-Behnken experiments
由表3 可知,该模型P=0.000 4<0.01,失拟项P=0.199 3>0.05,说明该模型极显著,并且模型选择正确。模型的决定系数R2=0.961 9,调整决定系数为RAdj2=0.912 9,说明该模型拟合良好,91.29%的响应值变化可以用该模型解释。根据F 值的大小可以判断出各因素对滇皂角米多糖提取率的影响大小为液料比(A)>提取温度(C)>NaOH 溶液浓度(B)。
2.3.2 各因素交互作用
液料比、NaOH 溶液浓度及提取温度两两之间交互作用的响应面图与等高线图如图6 所示。


图6 各因素交互作用的响应面图及等高线图Fig.6 Response surface and contour plots of interaction of various factors
从图6 中可以看出,液料比与提取温度、NaOH 溶液浓度与提取温度的交互作用响应曲面陡峭,等高线图为椭圆形,说明液料比与提取温度、NaOH 溶液浓度与提取温度的交互作用对滇皂角米多糖提取率的影响显著(P<0.05);而液料比与NaOH 溶液浓度的交互作用响应曲面较平缓,等高线图接近圆形,说明液料比与NaOH 溶液浓度的交互作用对滇皂角米多糖提取率的影响不显著(P>0.05)。
2.3.3 验证试验
通过响应面模型得到滇皂角米多糖提取最佳工艺:液料比219.16∶1(mL/g),NaOH 溶液浓度为0.16 mol/L,提取温度为51.21 ℃,预测多糖提取率为(74.19±1.34)%。为进一步验证响应面分析结果的可靠性,同时也为了试验操作的方便性,将工艺参数调整为液料比220∶1(mL/g)、NaOH 溶液浓度0.16 mol/L、提取温度51 ℃,在此条件下,进行3 次重复试验,测得滇皂角米多糖提取率为(73.64±0.56)%,与预测值相差0.55%。
2.4 体外抗氧化试验
滇皂角米多糖的DPPH 自由基、ABTS+自由基清除能力结果如图7 所示。
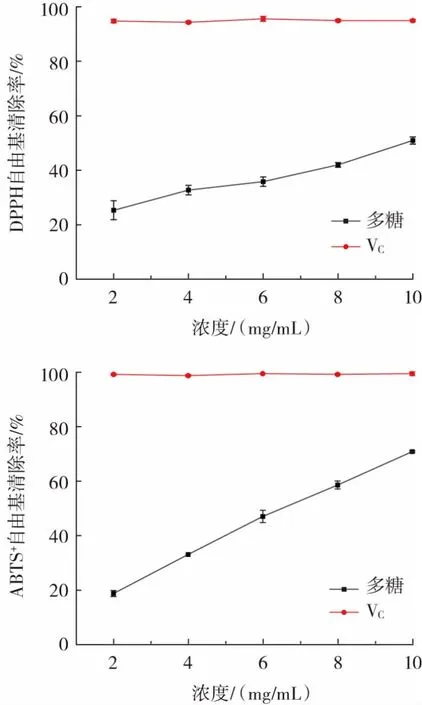
图7 滇皂角米多糖对DPPH、ABTS+自由基清除能力Fig.7 Clearance ability of DPPH and ABTS+free radical by polysaccharide from the seed of Gleditsia japonica
由图7 可知,在多糖浓度为2~10 mg/mL 内,DPPH自由基清除率为25.31%~50.93%,清除率随其浓度的增加而增加,存在明显的量效关系,这与高洁等[20]研究皂荚多糖对DPPH 清除效果的结论一致;在相同浓度下,ABTS+自由基清除率为18.69%~70.87%。本试验滇皂角米多糖对ABTS+自由基清除情况与柴美灵等[21]研究结论接近。滇皂角米多糖清除DPPH 自由基、ABTS+自由基的IC50值分别为10.87、6.67 mg/mL。
3 结论
本研究通过单因素试验与Box-Behnken 响应面试验对滇皂角米多糖碱提工艺进行优化,得到滇皂角米多糖碱提最佳工艺参数为液料比220∶1(mL/g)、NaOH 溶液浓度0.16 mol/L、提取温度51 ℃、提取时间90 min,在此条件下滇皂角米多糖的提取率为(73.64±0.56)%。滇皂角米多糖具有一定的体外抗氧化活性,清除DPPH、ABTS+自由基IC50值分别为10.87、6.67 mg/mL。本研究为滇皂角米多糖的开发利用提供了一定的理论基础。
