吉西他滨联合顺铂化疗在晚期非小细胞肺癌患者中的应用及对CYFRA21-1、VEGF 的影响分析
2023-08-07苏秋波
苏秋波
非小细胞肺癌是常见的肺癌类型, 占肺癌发病率的80%。其较小细胞癌生长分裂速度更慢, 扩散转移较晚, 但多数患者就诊时已步入疾病的晚期[1]。目前,针对晚期非小细胞肺癌临床主要采用化疗方案治疗,以期杀灭癌细胞, 控制病情进展, 最大程度的延长患者的生存时间[2]。然而, 一些研究认为晚期非小细胞肺癌使用不同化疗治疗获取到的效果存在明显的差异性[3]。顺铂是治疗恶性肿瘤的经典药物, 其对于癌细胞DNA 复制具有抑制作用, 继而发挥出显著的抗肿瘤功效。吉西他滨属于新型嘧啶类核苷酸药物, 能够使癌细胞DNA 断裂, 阻断细胞复制途径, 并促使其凋亡。2019 年1 月~2020 年12 月本院对47 例晚期非小细胞肺癌患者应用了吉西他滨联合顺铂化疗方案治疗, 通过观察其疗效、治疗前后肿瘤标志物变化与药物不良反应, 以期探讨吉西他滨联合顺铂化疗在晚期非小细胞肺癌患者中的应用效果, 旨在为此类疾病的治疗方案提供有利参考。
1 资料与方法
1.1 一般资料 选择2019 年1 月~2020 年12 月本院收治的94 例晚期非小细胞肺癌患者为研究对象。纳入标准:根据原发性肺癌诊疗规范(2018 年版)[4]中的标准诊断, 病理组织经实验室检查证实;国际抗癌联盟(UICC)原发肿瘤局部淋巴结远处转移(TNM)分期为Ⅲb~Ⅳ期;预计生存时间≥3 个月;卡氏功能评分(KPS)>60 分;所有患者均已签署研究相关知情同意书。排除标准:严重心脑血管疾病与肝肾功能障碍;存在化疗禁忌证;血液系统疾病。将患者以随机数字表法分为研究组与对照组, 各47 例。对照组中男29 例,女18 例;年龄39~78 岁, 平均年龄(58.60±6.54)岁;TNM 分期:Ⅲb 期32 例, Ⅳ期15 例;病理类型:鳞癌20 例, 腺癌27 例。研究组中男27 例, 女20 例;年龄39~78 岁, 平均年龄(58.47±6.49)岁;TNM 分期:Ⅲb 期31 例, Ⅳ期16 例;病理类型:鳞癌21 例, 腺癌26 例。两组患者一般资料比较差异无统计学意义(P>0.05), 具有可比性。本次研究内容已取得曹县人民医院伦理委员会的批准。
1.2 方法 对照组应用紫杉醇注射液(哈药集团生物工程有限公司, 国药准字H20059962, 规格:5 ml∶30 mg)联合注射用顺铂(齐鲁制药有限公司, 国药准字H37021357, 规格:20 mg)化疗方案, 即150 mg/m2紫杉醇, 静脉滴注, d1;60 mg/m2顺铂, 静脉滴注, d1~3。研究组应用注射用盐酸吉西他滨[齐鲁制药(海南)有限公司, 国药准字H20113285, 规格:0.2 g×8 支]联合顺铂化疗方案, 即1000 mg/m2吉西他滨, 静脉滴注,d1~8;60 mg/m2顺铂, 静脉滴注, d2~4。两组患者1 个疗程均为3 周, 持续治疗2 个疗程。
1.3 观察指标及判定标准 ①临床疗效:参照实体瘤疗效标准(RECIST)1.1[5]中的内容给予评估, 评价标准包括完全缓解(病灶完全消失)、部分缓解(病灶缩小≥30%)、稳定(病灶缩小<30%或增加<20%)以及进展(有新病灶或病灶增加≥20%)4 个级别。总有效率=完全缓解率+部分缓解率。②治疗前后肿瘤标志物:采集患者空腹状态下肘静脉血5 ml, 高速离心后取上清液, 以酶联免疫吸附法检测VEGF 与CYFRA21-1 水平,具体操作按照说明书内容执行。③观察并对比两组不良反应(消化道反应、脱发、肝功能损伤、骨髓抑制)发生情况。
1.4 统计学方法 采用SPSS23.0 统计学软件处理数据。计量资料以均数±标准差(±s)表示, 采用t检验;计数资料以率(%)表示, 采用χ2检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 两组疗效比较 研究组治疗总有效率59.57%高于对照组的38.30%, 差异有统计学意义(P<0.05)。见表1。

表1 两组疗效比较[n(%)]
2.2 两组治疗前后CYFRA21-1、VEGF 水平比较 治疗前, 两组CYFRA21-1、VEGF 水平比较差异无统计学意义(P>0.05);治疗后, 研究组CYFRA21-1、VEGF水平低于对照组, 差异有统计学意义(P<0.05)。见表2。
表2 两组治疗前后CYFRA21-1、VEGF 水平比较( ±s)
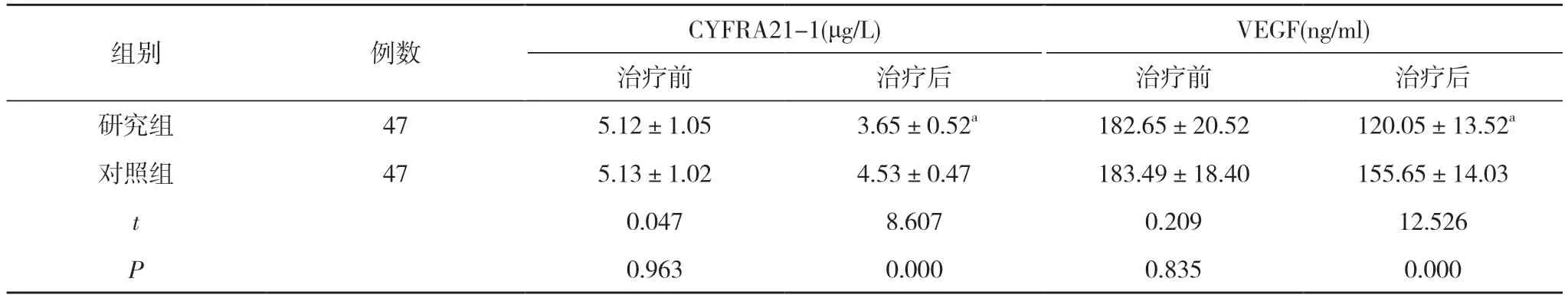
表2 两组治疗前后CYFRA21-1、VEGF 水平比较( ±s)
注:与对照组比较, aP<0.05
组别 例数 CYFRA21-1(μg/L) VEGF(ng/ml)治疗前 治疗后 治疗前 治疗后研究组 47 5.12±1.05 3.65±0.52a 182.65±20.52 120.05±13.52a对照组 47 5.13±1.02 4.53±0.47 183.49±18.40 155.65±14.03 t 0.047 8.607 0.209 12.526 P 0.963 0.000 0.835 0.000
2.3 两组不良反应发生情况比较 研究组不良反应发生率42.55%与对照组的57.45%比较, 差异无统计学意义(P>0.05)。见表3。

表3 两组不良反应发生情况比较[n(%)]
3 讨论
肺癌是危害人们健康与生命安全的常见恶性肿瘤,其中非小细胞肺癌占全部肺癌的80%[6]。由于多数患者确诊时已丧失了根治性手术的机会, 所以生存时间普遍较短[7]。目前, 含顺铂的化疗方案是治疗晚期非小细胞肺癌的首选方案, 包括:吉西他滨+顺铂、紫杉醇+顺铂等, 但不同药物所取得的临床效果却有不同[8]。顺铂作为非小细胞肺癌的主要化疗药物, 现已在临床得到了广泛的应用。该药通过与细胞核内DNA碱基结合并形成交叉链, 进一步阻断了癌细胞DNA 转录与复制, 且与核蛋白、胞浆蛋白结合后, 还能够抑制癌细胞分裂, 具有骨髓损伤小、广谱性高等优势[9,10]。吉西他滨属于去氧胞苷的水溶性类似物, 进入人体后快速分布至全身, 之后经代谢形成二磷酸双氟脱氧胞嘧啶核苷、二磷酸双氟脱氧胞嘧啶核苷, 继而阻断肿瘤细胞DNA 的复制作用, 促使肿瘤凋亡, 具有显著的抗肿瘤功效[11,12]。同时, 吉西他滨极少与蛋白质结合,可被肝脏、肾脏与其他组织快速代谢[13]。研究组治疗总有效率59.57%高于对照组的38.30%, 差异有统计学意义(P<0.05)。可见, 两种药物所组成的化疗方案能够有效提高晚期非小细胞肺癌患者的临床治疗效果。
在恶性肿瘤发生与进展期间, 肿瘤细胞物质脱落在血液中即可形成血清肿瘤标志物, 此类物质能够有效反映出肿瘤细胞的转化过程[14]。CYFRA21-1 作为一种细胞角蛋白19 可溶性片段, 主要在假复层与单层上皮细胞浆中分布, 能够有效反映出非小细胞肺癌的发生与进展情况[15]。VEGF 则通过自身肿瘤分泌形成新生血管, 并参与了肿瘤血管生成过程, 与肿瘤侵袭、转移密切相关[16]。本文研究结果显示, 治疗后,研 究 组CYFRA21-1(3.65±0.52)μg/L、VEGF(120.05±13.52)ng/ml 低于对照组的(4.53±0.47)μg/L、(155.65±14.03)ng/ml, 差异有统计学意义(P<0.01)。结果说明,吉西他滨联合顺铂化疗能够抑制肿瘤细胞生长途径,保障患者的治疗效果。从安全性来看, 研究组不良反应发生率42.55%与对照组的57.45%比较, 差异无统计学意义(P>0.05)。由此可见, 两种方案的应用安全性相当, 这与部分报道结果相符[13]。
总之, 晚期非小细胞肺癌患者接受吉西他滨联合顺铂化疗可以取得满意的效果, 且有效下调了CYFRA21-1 及VEGF 水平, 适于临床推广。
