一种新发生的玉米细菌性叶腐病病原菌分离鉴定
2023-08-05王春明郭成周天旺等
王春明 郭成 周天旺等


关键词 玉米;细菌性病害;短小芽胞杆菌;分离鉴定;16SrDNA;gyrB
中图分类号:S 435.131 文献标识码:A DOI:10.16688/j.zwbh. 2022445
玉米Zea mays由于其产量高,品质好,适应性强,不仅被作为重要的粮饲兼用型作物,而且被作为重要的工业原料等在生产中加以利用,在国民经济发展中起着至关重要的作用口]。随着玉米种植面积增加、新品种引进、气候条件变化及多年连作等,玉米病害的发生日渐严重,已成为制约玉米产业健康发展的主要因素之一[2]。据报道,每年因病害造成的玉米产量损失在一些省份可达到10%~15%,大发生时甚至超过30%[3]。玉米细菌性病害在局部地区发生严重,给当地玉米生产造成了不同程度的损失[4-9]。种子和病残体带菌是玉米细菌性病害传播的主要途径,加之细菌具有繁殖速度快的特点,一旦在田间发生,如未及时采取相应的防治措施,可能对大田和制种田造成毁灭性的损失[10]。
甘肃省作为我国玉米主产区之一,玉米已成为第一大粮食作物。据有关部门统计显示,至2020年甘肃省玉米种植面积已达到100萬hm,其中制种面积常年稳定在10万hm左右[11]。玉米病害已成为影响甘肃省玉米产量的重要因素。据调查,近年来一些玉米细菌性叶斑病在甘肃河西和陇中部分地区有逐年上升的趋势,对玉米生产产生了一定的影响。2021年7月,在白银市景泰县条山农场玉米种植区,出现一种新的玉米细菌性叶部病害,为了明确引发该病害的致病菌,本研究从发病玉米叶片中分离菌株,从形态学观察、致病性测定、生理生化测定、16SrDNA和gyrB基因序列分析等方面进行鉴定,为玉米叶部细菌性病害的流行规律及综合防治提供理论基础。
1材料与方法
1.1病样采集及病原菌分离纯化
于2021年7月在甘肃省白银市景泰县条山农场普通玉米种植区不同玉米田块,随机采集玉米叶腐病病样共计15份。参考方中达[12]的方法对病原菌进行分离和纯化。
1.2烟草过敏性试验
将分离菌株在NA培养基(蛋白胨5.0 g,牛肉浸膏3.0 g,酵母粉1.0 g,葡萄糖10.0 g,琼脂粉15.0 g,蒸馏水1000 mL,pH 7.0)上划线培养36 h后,分别刮下菌苔配成浓度为1×10 cfu/mL的菌悬液,用无菌注射器将菌悬液注射到6~8叶龄烟草叶片背面,以注射灭菌水为对照,室内套袋保湿,观察有无枯斑产生。
1.3病原菌致病性测定及再分离
玉米种子(品种为‘先玉335’)用75%乙醇表面消毒30 min后,用无菌水冲洗5遍,于35℃培养箱催芽。待胚芽长1cm左右时种植于装有灭菌蛭石的花盆中,每盆种植7株,3次重复,置于室温下正常管理。待玉米长到4~6叶期,将培养36 h的分离菌分别刮下菌苔配制成1×10 cfu/mL的菌悬液(加少量吐温- 20)分别喷雾接种于玉米叶片上,对照接NA培养液,套袋保湿培养24 h后,揭开塑料袋继续正常管理,逐天观察发病情况。对发病叶片上的病原进行再分离鉴定,完成柯赫氏法则验证。
1.4病原菌鉴定
1.4.1形态学鉴定及生理生化测定
将病原细菌在NA平板上划线培养,参照《植病研究方法》[12],观察菌落形态、生长速度和产生色素情况。采用革兰氏染色法,在100倍油镜下观察和测量病原细菌菌体大小、形状及产生芽胞情况。生理生化指标测定参照文献[12-14]的方法进行。
1.4.2病原菌16S rDNA和gyrB基因序列测定与分析
用天根生化科技(北京)有限公司细菌基因组DNA提取试剂盒提取代表性菌株B1-0和B2-1的全基因组DNA,选择细菌16S rDNA通用引物27F/1492R[15]和gyrB引物UPl/UP2r[16],参考荆卓琼等[17]和程勋辉[18]的方法对B2-0和B2-1的16SrDNA和gyrB序列分别进行PCR扩增。反应完成后,取3μL PCR产物进行1%琼脂糖凝胶电泳检测。将特异性条带亮度好、纯度高且无非特异性条带的PCR产物冷冻条件下送生工生物工程(上海)股份有限公司进行测序,测序结果在NCBI上用BLAST进行同源性比较,下载短小芽胞杆菌Bacil-lus pumilus标准菌株及近缘种和外群菌株的目的序列,采用ClustalX 2.0.10软件进行多序列比对后,利用Bioedit 5.0.6软件进行校正,用MEGA7.0软件以NJ法构建基于16S rDNA和gyrB序列的系统发育进化树。
2结果与分析
2.1田间发生情况调查及病样分离纯化结果
2021年7月,在甘肃省白银市景泰县玉米田中新发病害发生较为严重,田间病株率22.5%,表现为初期叶片产生不规则褪绿斑块(图1a,1b),病斑不受叶脉限制(图1c),后期病部连片,叶肉组织腐烂,裂开(图1d,1e)。发病严重的引起心叶卷曲,变褐腐烂(图1f,1g)。观察发现植株茎秆及根部正常。经对不同发病形状的病斑进行分离均得到比较单一的1种菌落。挑取代表性菌株B1-0和B2-1进行致病性测定。
2.2致病性测定结果
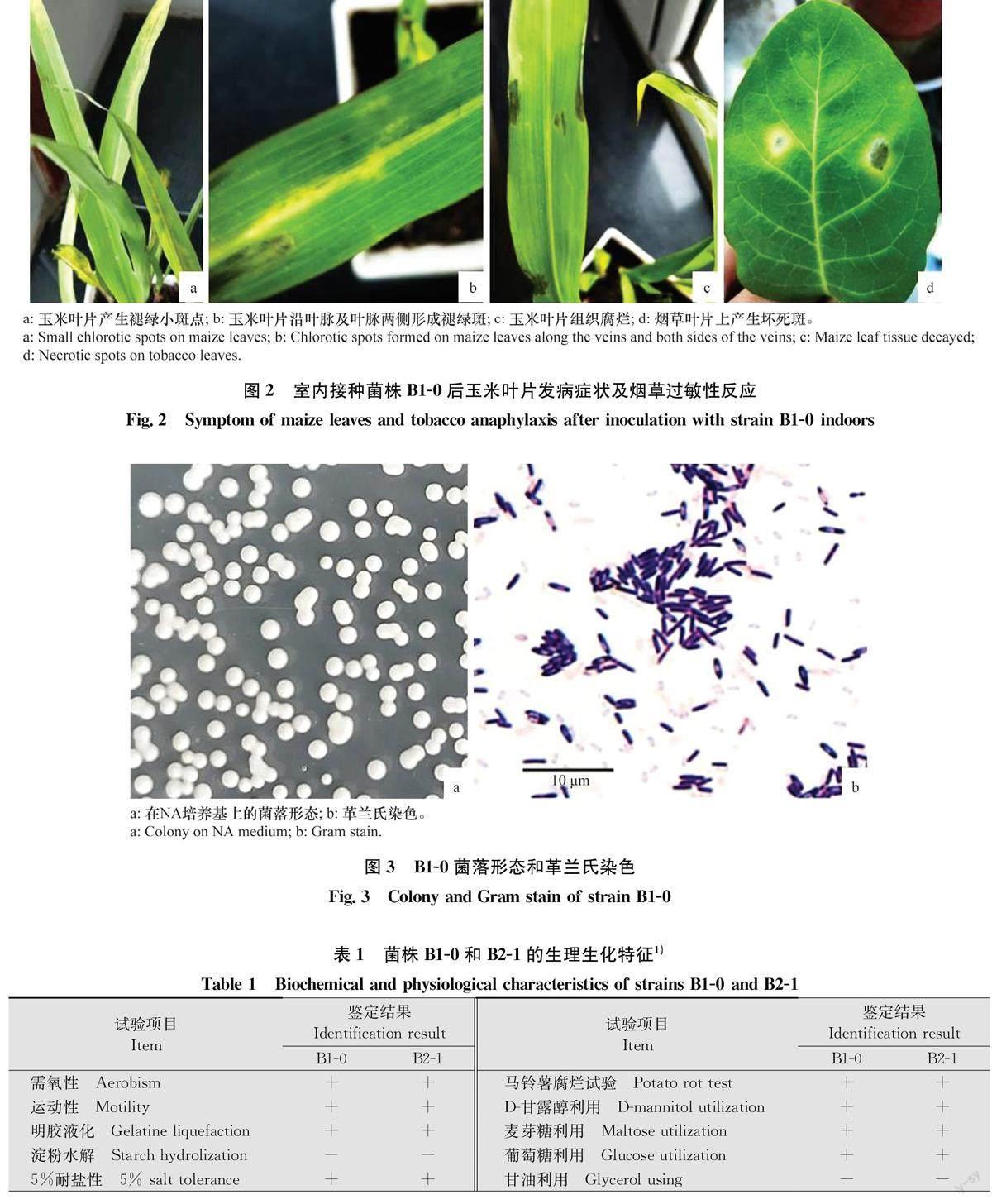
将菌株B1-0和B2-1回接到玉米叶片24 h后开始显症,初期叶片产生褪绿小斑块(图2a),随着病情的进一步发展,3d后病斑逐渐连片形成褪绿长斑块,形状不固定,且不受叶脉限制(图2b)。后期如湿度增加,发病叶片变褐腐烂(图2c)。接种Bl-0和B2-1的发病率均为100%,发病症状与田间自然发病症状相似,而对照叶片均未发病。对发病叶片进行再次分离得到与接种病原菌相同的分离物,符合柯赫氏法则。
2.3对烟草致病性测定结果
菌株Bl-0和B2-1接种烟草叶片24 h后开始显症,随后进一步发展形成黄色枯斑(图2d)。
2.4病原菌培养性状及形态特征
菌株在NA培养基上菌落为白色、圆形、隆起,表面光滑,不透明,边缘整齐(图3a)。培养24~48 h后在100倍油镜下观察显示,菌体短杆状,大小(0.53~0.71》μm×(1.62~2.93) μm;革兰氏染色阳性,芽胞中生(图3b),故从形态学初步判断其属于芽胞杆菌Bacillus sp.。
2.5生理生化特性测定结果
试验结果表明(表1),该病原菌需氧,能运动,能使明胶液化,在5% NaCl中可生长,不能水解淀粉,能利用柠檬酸盐,接触酶阳性,甲基红试验阴性,能使马铃薯腐烂,能利用D-甘露醇、麦芽糖和葡萄糖、不能利用甘油和肌醇,在4℃和40℃条件下均能生长。结合形态学及生理生化特性初步将其鉴定为短小芽胞杆菌B.pumilus。
2.6病原菌16S rDNA和gyrB基因序列分析
将测序结果经Blast相似性分析,菌株B1-0和B2-1的16S rDNA序列与短小芽胞杆菌B.pumilus同源性最高,相似性均在99%以上,且与登录号为MT065817.1、MT065814.1、MI102721.1、MT102722.1、MT102723.1、MT197380.1和MT065805.1的短小芽胞桿菌B.pumilus相似性达100.00%;gyrB基因序列与登录号为GU568184.1、KF194241.1、HM585095.1和MF784845.1的短小芽胞杆菌B.pumilus相似性均在99.00%以上。在GenBank中下载短小芽胞杆菌B.pumilus标准菌株及其近缘种和外群菌株的目的基因序列,比对后拼接,用MEGA 7.0软件构建基于16S rDNA和gyrB的系统发育树(图4),B1-0和B2-1与短小芽胞杆菌B.pumilus (ATCC7061、BKS1-108、AUEC29、BP-hd-1、NMTD17和17)聚在一个分支。说明菌株Bl-0和B2-1与短小芽胞杆菌B.pumilus遗传距离更近,结合形态学及分子生物学鉴定将其确定为短小芽胞杆菌B.pumilus。
3结论与讨论
目前国内外报道的引起玉米叶部病害的病原细菌主要有须芒草伯克霍尔德氏菌Burkholderia an-dropogonis(异名高梁假单胞菌Pseudomonas an-dropogonis)[14,19]、燕麦嗜酸菌燕麦亚种Acidovorax avenae subsp. avenae[4,20]、斯氏泛菌Pantoea stew-artii[19-20]、菠萝泛菌P.ananatis[5,21-22]、野油菜黄单胞菌绒毛草致病变种Xanthomonas campestrzs pv.holcicola E23]、丁香假单胞菌丁香致病变种P.syrin-gae pv. syringaeE23-24]、巨大芽胞杆菌Bacillus megaterium [25]等,分别可引起玉米叶片条纹病、叶疫病、枯萎病、叶斑病、褐斑病等,但未见短小芽胞杆菌能引起玉米叶部病害的报道。
短小芽胞杆菌作为芽胞杆菌属Bacillus的一种细菌,被作为生防菌在国内外研究居多。于婷等[26]筛选出一株短小芽胞杆菌对镰刀菌有较强的抑制作用;Agarwal等[27]研究结果显示短小芽胞杆菌MSUA3对供试的尖镰孢Fusarium oxysporum和立枯丝核菌Rhizoctonia solani抑制效果强;柳自清等[28]研究表明短小芽胞杆菌B102对棉花枯萎病具有较好的防治效果;冯永新等[29]发现短小芽胞杆菌AR03与噻菌铜联合复配后能增强对烟草青枯病的防效。同时查阅文献可知,其作为植物病原菌的相关报道也在不断增多,如有研究表明该病原菌能引起幼龄桃Prunus persica细菌性斑疹病[30]、芒果Mangifera indica枯萎病[31]、菜豆Phaseolus vul-garis叶片褐斑病[32]、马铃薯Solanum tuberosum贮藏期块茎软腐病[33]、生姜Zingiber of icinale根腐病[34],且侵染欧洲松树Pinus的茎和枝干造成发病部位变黄、枝干枯萎,针叶脱落等[35],还能引起甜瓜Cucumis melo果腐病[36]、雅榕Ficus concinna果腐病[37]和橡皮树Ficus elastica枝干凸起病等[38];曹慧英等[39]2010年研究发现该病原菌能引起玉米细菌性茎腐病,其典型症状为茎基处开裂,变黑、变褐并出现干腐。本研究在田间发现的玉米细菌性病害,发病玉米叶片可产生不同大小的不受叶脉限制的不规则褪绿斑块,随着病情的进一步发展出现叶片开裂、腐烂等症状,发病严重的植株心叶卷曲、腐烂,无法抽出,严重影响后期玉米的生长发育。挖出发病植株观察发现,植株茎基部及根部均正常,未出现变褐、开裂等症状,这与曹慧英等[39]的研究存在差异。通过形态学观察、生理生化测定、16S rDNA及gyrB基因序列测定结果,菌株B1-0和B2-1与短小芽胞杆菌相似度最高,且在基于16S rDNA和gyrB的系统发育树上与短小芽胞杆菌(ATCC 7061、BKS1-108、AUEC29、BP-hd-1、NMTD17和17)聚在一个分支,故将其鉴定为短小芽胞杆菌。但本研究获得的菌株在生理生化特性上与已报道的短小芽胞杆菌菌株存在一定的差异,如Song等[36]研究报道称短小芽胞杆菌不能使明胶液化,而本研究结果显示供试菌株均能使明胶液化;曹慧英等[39]研究表明短小芽胞杆菌能水解淀粉,能利用甘露醇,不能利用葡萄糖,而本研究结果表明供试菌株不能水解淀粉,不能利用甘露醇、能利用葡萄糖。分析产生这种差异的原因主要可能与其来源及生长环境等存在一定的差异相关,使得不同来源的同种病原菌即使在相同的培养基和相同的培养条件下,在生理生化特性方面也呈现差异。
傅俊范等[2]对玉米叶部病害流行成灾的原因分析发现,随着栽培制度和品种抗病性的改变、田间病原菌积累以及一些极端天气导致田间小气候更适宜病害发生,是玉米叶部病害流行成灾的根本原因。玉米细菌性病害的发生除与品种的抗病性有关外,还与环境温度和湿度条件有较大的关系,一般温暖多雨有利于细菌性病害的发生。对比2021年5月至7月上旬白银市景泰县的天气情况,降雨量较往年有所增加,气温略低,更适宜细菌性病害的发生,因此导致细菌性叶腐病在该地区发生严重。查阅国内外报道的玉米细菌性叶部病害文献,发现对玉米细菌性叶部病害的报道多停留在病害发生症状和病原菌的鉴定上,而对其发病规律、传播途径、品种抗性及综合防治等发面的系统研究较少,因此有待于后期进一步的研究。
本研究通过形态学观察、生理生化指标测定、16S rDNA和gyrB基因序列分析和致病性测定等研究,明确了引起甘肃省白银市景泰县玉米田一种细菌性叶腐病的病原菌为短小芽胞杆菌B.pumi-lus,该研究结果可为该病害的发生流行和综合防治提供参考。
