虎杖苷对角叉菜胶致肺水肿大鼠的干预作用研究
2023-08-05张钦钦曾梦楠张贝贝王茹冯卫生郑晓珂河南中医药大学河南郑州450046河南省中药开发工程技术研究中心河南郑州450046河南中医药大学呼吸疾病中医药防治省部共建协同创新中心河南郑州450046
张钦钦,曾梦楠,3,张贝贝,王茹,冯卫生,3,郑晓珂,3(1.河南中医药大学,河南 郑州 450046;2. 河南省中药开发工程技术研究中心,河南 郑州 450046;3. 河南中医药大学呼吸疾病中医药防治省部共建协同创新中心,河南 郑州 450046)
肺水肿是由于肺内组织液的生成以及回流平衡失调,造成肺通气与换气功能严重障碍[1-2],是急性肺损伤病理进程中的中心环节,也是引起各种呼吸道疾病的重要因素,其发病迅速、死亡率高。随着天然药物研究的不断发展,充分发挥其优势,积极找出安全有效的活性成分并阐明其作用机制,可能可为治疗肺水肿提供新的思路。虎杖苷是中药虎杖的主要活性成分,具有抗炎、镇咳、抗氧化应激及抗癌等多种药理作用[3]。研究发现,虎杖苷对慢性阻塞性肺疾病大鼠有一定改善作用,可能与抑制TLR4/NF-κB 信号通路有关[4];虎杖苷还能够减轻哮喘小鼠的气道炎症,其作用机制可能与SIRT1/NF-κB 通路有关[5]。角叉菜胶是一种具有较强致炎作用的硫酸多糖物质,胸腔注射角叉菜胶后,能够促进释放多种促炎因子[6],造成局部血管扩张,毛细血管通透性增强,出现肺损伤和肺水肿。故本研究拟观察虎杖苷对角叉菜胶致肺水肿大鼠的干预作用,及其对水通道蛋白1(AQP1)通路的影响,以期为虎杖苷治疗肺水肿的相关研究提供实验基础。
1 材料与方法
1.1 动物雄性SD 大鼠50 只,SPF 级,体质量180~220 g,购自济南朋悦实验动物繁育有限公司,实验动物生产许可证号:SCXK(鲁)20190003。动物饲养于清洁级动物房中,12 h 光照,恒温24 ℃,自由摄食、饮水,实验单位动物使用许可证号:SYXK(豫)2020-0004。本实验经河南中医药大学实验动物伦理委员会批准,批文号:DWLL2018080003。
1.2 药物及主要试剂虎杖苷(货号:SP8420)、活性氧(ROS)检测试剂盒(批号:CA1410),北京索莱宝科技有限公司;醋酸地塞米松片,上海金不换兰考制药有限公司,批号:20 201006;Annexin V-PE/7-AAD 凋亡试剂盒,美国BD 公司,批号: 559763;角叉菜胶,美国Sigma 公司,批号C1013-25G;免疫球蛋白E(IgE,货号:E-EL-R0517c)、白细胞介素4(IL-4,货号:E-EL-R0014c)、干扰素γ(IFN-γ,货号:E-EL-R0009c)检测试剂盒,武汉伊莱瑞特生物科技有限公司;总超氧化物歧化酶(T-SOD,货号:A001-1-1)、谷胱甘肽过氧化物酶(GSH-Px,货号:A005-1-2)及丙二醛(MDA,货号:A003-1-1)检测试剂盒,南京建成生物工程研究所;HiScript III RT SuperMix(货号: R323- 01)、 2 × ChamQ Universal SYBR qPCR Master Mix(货号:Q711-02),南京诺维赞生物科技股份有限公司;CD11b-APC(批号: 2311195)、 Ly6G- FITC(批号: 2440387)、CD11b-FITC(批号:2172513)、F4/80-PE(批号:2142861)抗体,均购自美国Invitrogen 公司;AQP1(货号:A15030)、AQP5(货号:A13861)、IL-1β(货号:A19635)、IL-10(货号:A12255)以及β-actin(货号:AC026)抗体,均购自武汉爱博泰克(ABclonal)生物科技有限公司。
1.3 主要仪器1905108 型酶标仪,美国伯腾仪器有限公司;BD FACS Aria Ⅲ型流式细胞仪,美国BD公司;Odessey 双色近红外成像系统,美国LI-COR公司;ABI QuantStudio 5 型实时荧光定量PCR 系统,美国Thermo Fisher 公司;PowerPacTM通用电泳仪、Trans-Blot®TurboTM半干转膜仪,美国Bio-Rad公司;Centrifuge-5804R 型小型高速冷冻离心机,德国Eppendorf 公司;MX63 型显微镜,日本Olympus公司。
1.4 分组、给药及模型复制将50 只SD 大鼠随机分为对照组、模型组、地塞米松组(0.075 mg·kg-1)及虎杖苷低、高剂量组(20、40 mg·kg-1),每组10 只。先按照上述剂量灌胃给药,对照组和模型组给予同等体积的蒸馏水,每日1 次,连续灌胃给药7 d。给药结束后,除对照组胸腔注射同等体积生理盐水外,其他各组大鼠从肋间肌处向胸膜腔注射1%角叉菜胶(20 mg·kg-1)溶液致炎48 h,建立肺水肿大鼠模型[7],然后进行相关指标检测。
1.5 测定大鼠肺组织含水量摘取大鼠肺组织,用生理盐水清洗后,用滤纸拭干表面液体;用天平精确称量左肺湿质量,然后将左肺组织在真空干燥箱中烘干72 h 至恒重,取出后准确称量肺组织干质量;计算:肺组织湿/干质量比=肺湿质量/肺干质量,肺组织含水量(%)=(肺湿质量-肺干质量)/肺湿质量×100%。
1.6 肺组织病理学观察取大鼠右肺上叶组织,于4%多聚甲醛固定液中浸泡24 h 后,采用乙醇梯度脱水,二甲苯透明,石蜡包埋,切成5 μm 薄片;二甲苯脱蜡,乙醇梯度洗脱后,进行HE 常规染色,封片后在显微镜下观察、拍照。
1.7 流式细胞术检测肺组织原代细胞凋亡及ROS水平取各组大鼠右肺下叶相同部位肺组织适量,经胰酶消化后,加入胎牛血清终止消化,用70 μm滤网过滤收集肺组织原代细胞;分别严格按照ROS试剂盒和细胞凋亡试剂盒说明书步骤操作,染色后采用流式细胞仪检测各组大鼠肺组织原代细胞凋亡及ROS 水平。
1.8 流式细胞术检测肺组织中巨噬细胞、中性粒细胞水平取各组大鼠右肺中叶相同部位肺组织适量,PBS 洗涤后剪碎,以胶原酶Ⅱ消化;过滤后以500×g离心5 min,收集细胞,然后用红细胞裂解液裂解,离心后用400 μL PBS 重悬;加入CD16/32 抗体阻断Fc-γR,冰上孵育后,分别加入其相应抗体(巨噬细胞:F4/80、CD11b 抗体;中性粒细胞:CD11b、Ly6G 抗体);孵育后每管加入1 mL PBS 洗涤1 次,PBS 重悬细胞后采用流式细胞仪检测。
1.9 肺泡灌洗液中IgE、IL-4、IFN-γ 水平测定打开大鼠胸腔,结扎肺左支气管,用PBS 重复灌洗右肺4 次,收集PBS 灌洗液,以3 000 r·min-1(离心半径10 cm)离心10 min,取上清液,即得肺泡灌洗液。严格按照试剂盒说明书步骤操作,采用ELISA 法检测肺泡灌洗液中IgE、IL-4 和IFN-γ水平。
1.10 肺组织中MDA、GSH-Px、T-SOD 水平测定取各组大鼠右肺相同部位肺组织适量,制备肺组织匀浆,严格按照试剂盒说明书步骤操作,测定肺组织中MDA、GSH-Px、T-SOD 水平。
1.11 RT-qPCR 法检测肺组织AQP1、AQP5、IL-10、TNF-α、IL-13 mRNA 表达取各组大鼠左肺相同部位肺组织适量,提取总RNA;使用HiScript III RT SuperMix 预混液进行逆转录得到cDNA;最后采用ChamQ 通用SYBR qPCR 预混液,以GAPDH 为内参基因,通过实时荧光定量PCR 法对AQP1、AQP5、IL-10、TNF-α 和IL-13 的mRNA 表达水平进行分析;采用2-△△Ct法计算目的基因mRNA 相对表达量。引物由武汉塞维尔生物有限公司设计合成,引物序列见表1。
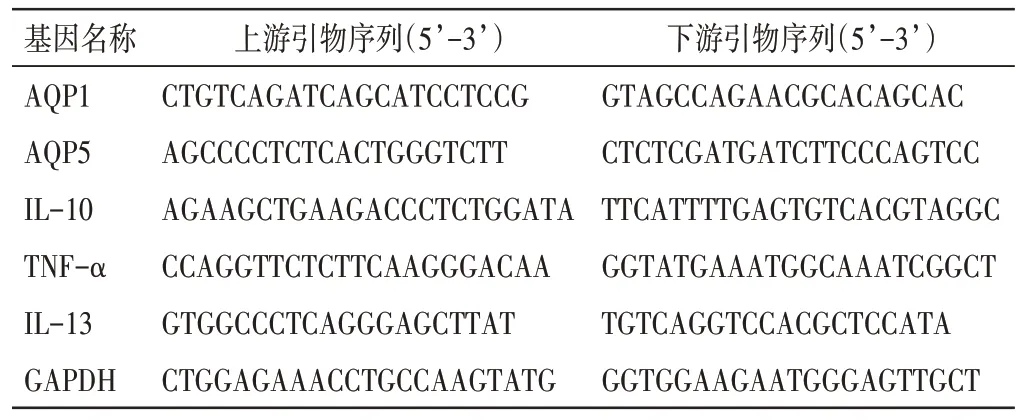
表1 PCR 引物序列Table 1 Primer sequences for PCR
1.12 虎杖苷与AQP1 分子对接采用分子对接验证虎杖苷与潜在靶点AQP1 之间的相互作用关系。通过Chem Office 软件绘制虎杖苷3D 结构;通过PDB 数据库(https://www.rcsb.org)下载AQP1 蛋白的3D 结构,PDB 编号为8CTE;采用PyMOL 软件对蛋白质进行去水、提取配体等处理;利用AutoDock 软件将关键蛋白及化合物的pdb 格式转换为pdbqt 格式,并寻找活性口袋;最后通过AutoDock Vina 软件进行分子对接验证。
1.13 免疫组化法测定肺组织中AQP1 蛋白表达将新鲜肺组织标本经组织固定液固定后制成蜡块,切片(5 μm),然后脱蜡、水化;柠檬酸盐缓冲液回收抗原,3% H2O2封闭内源性过氧化物酶20 min;冲洗后微波加热修复抗原,3% BSA 封闭30 min;滴加AQP1 一抗(1∶200)后,于4 ℃下孵育过夜;洗涤,滴加生物素标记的羊抗兔二抗(1∶2 000),室温下孵育1 h;DAB 显色,苏木精复染3 min;将切片依次经梯度乙醇脱水、二甲苯透明、晾干后,中性树胶封片;显微镜下观察并采集图像进行分析。
1.14 Western Blot 法检测肺组织中AQP1、AQP5、IL-1β、IL-10 蛋白表达取各组大鼠左肺相同部位肺组织适量,按照总蛋白提取试剂盒说明书步骤提取肺组织总蛋白;采用BCA 蛋白定量试剂盒测定蛋白浓度;经SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)后,将蛋白转移至PVDF 膜上;用5%封闭液封闭1.5 h 后,回收封闭液;加入一抗AQP1(1∶1 000)、AQP5(1∶1 000)、IL-1 β(1∶1 000)、IL-10(1∶1 000)、β-actin(1∶25 000)后,室温下孵育2.5 h,用PBST 洗涤4 次,每次5 min;加入兔源荧光二抗(1∶20 000),室温下避光孵育1 h 后,用PBST 洗涤3 次,PBS 洗涤1 次;采用Odyssey 双色红外激光成像系统进行扫描分析。
1.15 统计学处理方法采用SPSS 26.0 统计软件进行数据分析;计量资料以均数± 标准差(±s)表示;多组间比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD 法;以P<0.05 为差异有统计学意义。
2 结果
2.1 虎杖苷对肺水肿大鼠肺组织湿/干质量比及含水量的影响结果见表2。与对照组相比,模型组大鼠的肺组织湿/干质量比及含水量明显升高(P<0.05,P<0.01),说明肺水肿大鼠模型复制成功。与模型组比较,虎杖苷高、低剂量组大鼠的肺组织湿/干质量比及含水量明显降低(P<0.05,P<0.01)。
表2 虎杖苷对肺水肿大鼠肺组织湿/干质量比及含水量的影响(±s,n=6)Table 2 Effects of polydatin on wet/dry mass ratio of lung and lung water content in rats with pulmonary edema(x ± s,n=6)

表2 虎杖苷对肺水肿大鼠肺组织湿/干质量比及含水量的影响(±s,n=6)Table 2 Effects of polydatin on wet/dry mass ratio of lung and lung water content in rats with pulmonary edema(x ± s,n=6)
注:与对照组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01
剂量/(mg·kg-1)湿/干质量比2.10±0.29 2.50±0.15##2.14±0.17*2.14±0.23*1.89±0.30**组别对照组模型组地塞米松组虎杖苷低剂量组虎杖苷高剂量组--0.075 20 40含水量/%51.6±6.68 59.9±2.43#53.1±3.57*52.8±4.91*46.0±9.32**
2.2 虎杖苷对肺水肿大鼠肺组织病理变化的影响结果见图1。对照组大鼠肺组织结构完整,未见明显炎性细胞浸润和聚集,肺泡结构完整,肺泡腔及间质内无渗出物,肺组织无明显病变。与对照组比较,模型组大鼠肺组织可见明显的气道增厚,分泌物增多,肺泡结构破坏,有水肿液聚集。与模型组比较,虎杖苷高、低剂量组大鼠肺组织的病理变化均得到明显改善。
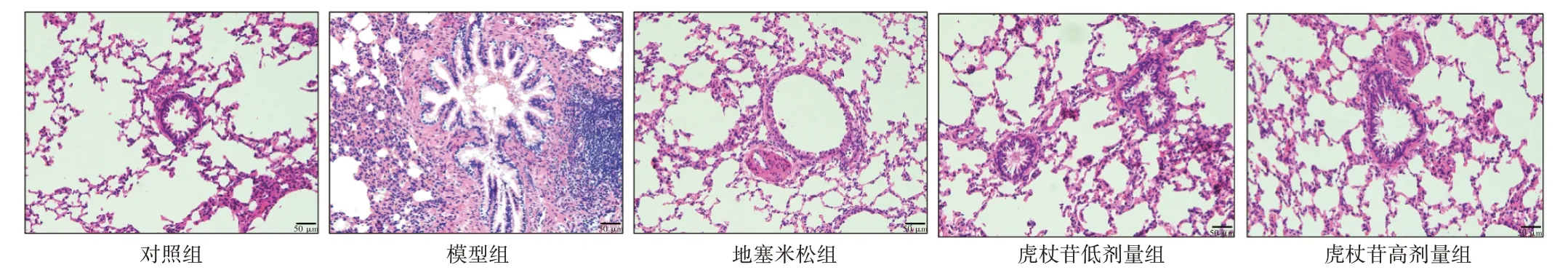
图1 虎杖苷对肺水肿大鼠肺组织病理变化的影响(HE 染色,×200)Figure 1 Effect of polydatin on the lung histopathology in rats with pulmonary edema(HE staining,×200)
2.3 虎杖苷对肺水肿大鼠肺组织原代细胞凋亡水平的影响结果见图2。与对照组相比,模型组大鼠肺组织原代细胞中的活细胞比例显著降低(P<0.01),死细胞、凋亡细胞比例显著升高(P<0.01)。与模型组比较,虎杖苷高剂量组大鼠肺组织原代细胞中的活细胞比例显著升高(P<0.01),死细胞比例显著降低(P<0.01),虎杖苷高、低剂量组的凋亡细胞比例显著降低(P<0.05,P<0.01)。结果表明,虎杖苷能够降低肺水肿大鼠肺组织原代细胞的凋亡水平。
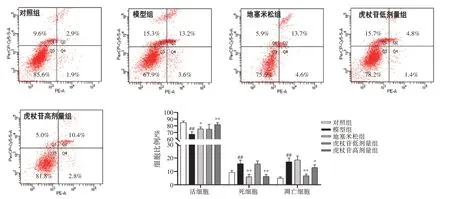
图2 虎杖苷对肺水肿大鼠肺组织原代细胞凋亡水平的影响(±s,n=3)Figure 2 Effect of polydatin on apoptosis of primary cells of lung tissue in rats with pulmonary edema(±s,n=3)
2.4 虎杖苷对肺水肿大鼠氧化应激水平的影响结果见图3、表3。与对照组相比,模型组大鼠肺组织原代细胞ROS 水平及肺组织MDA 水平显著升高(P<0.01),T-SOD、GSH-Px 水平显著降低(P<0.01)。与模型组比较,虎杖苷高、低剂量组大鼠肺组织原代细胞ROS 水平及肺组织MDA 水平显著降低(P<0.05,P<0.01),T-SOD、GSH-Px 水平显著升高(P<0.05,P<0.01)。
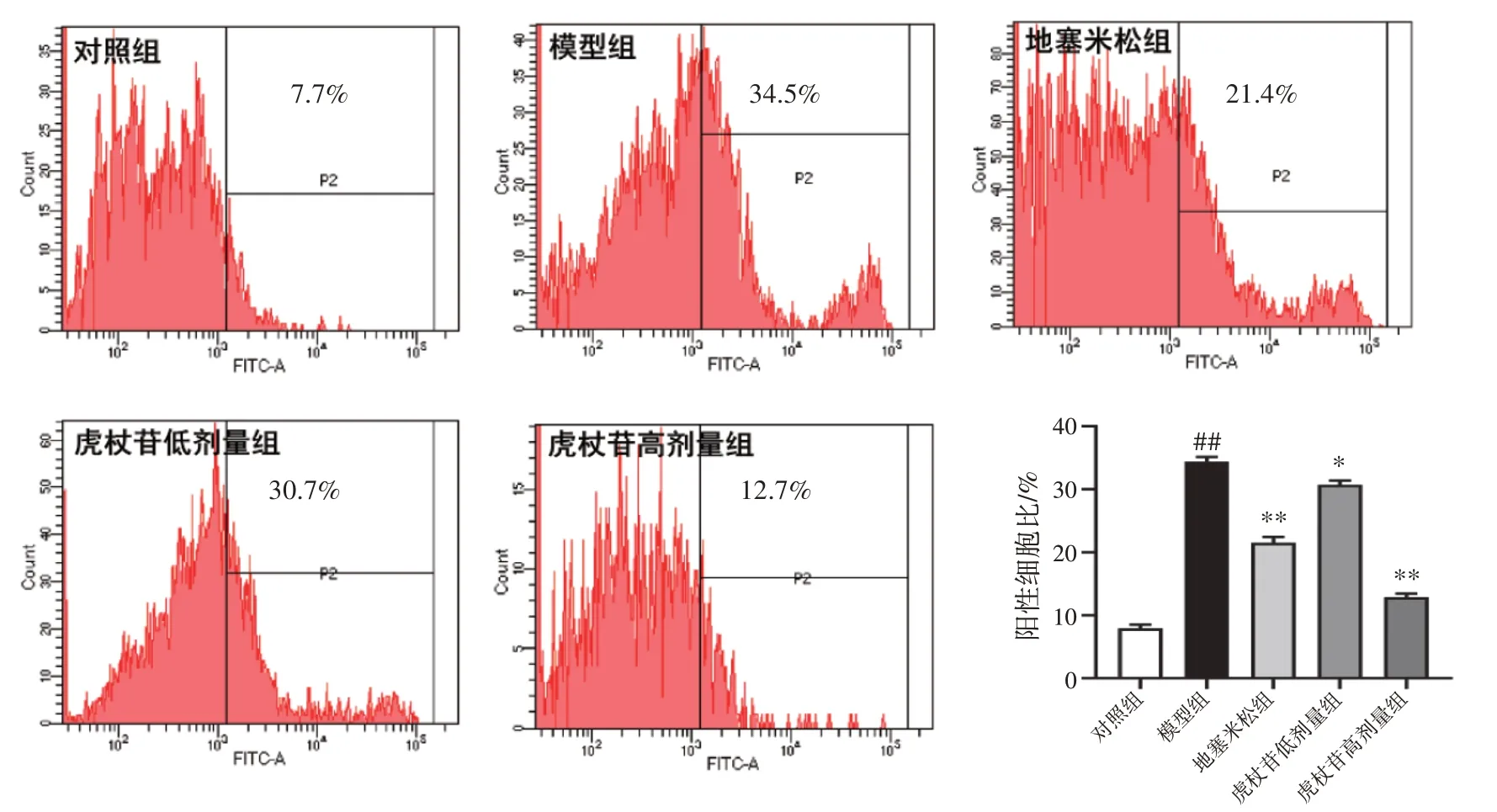
图3 虎杖苷对肺水肿大鼠肺组织原代细胞活性氧(ROS)水平的影响(±s,n=3)Figure 3 Effect of polydatin on reactive oxygen species(ROS)of primary cells of lung tissue in rats with pulmonary edema(±s,n=3)
表3 虎杖苷对肺水肿大鼠肺组织氧化应激水平的影响(±s,n=6)Table 3 Effect of polydatin on oxidative stress in lung tissue of rats with pulmonary edema(±s,n=6)

表3 虎杖苷对肺水肿大鼠肺组织氧化应激水平的影响(±s,n=6)Table 3 Effect of polydatin on oxidative stress in lung tissue of rats with pulmonary edema(±s,n=6)
注:与对照组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
GSH-Px/(U·mg-1)10.67±2.61 6.79±0.40##8.90±2.21**10.94±1.72*12.88±1.72**组别对照组模型组地塞米松组虎杖苷低剂量组虎杖苷高剂量组剂量/(mg·kg-1)--0.075 20 40 T-SOD/(U·mg-1)49.24±3.62 31.21±2.49##39.65±2.91**53.46±5.20**59.66±6.95**MDA/(nmol·mg-1)2.37±0.07 2.81±0.20##2.30±0.09**2.28±0.14**2.27±0.09**
2.5 虎杖苷对肺水肿大鼠肺组织中巨噬细胞、中性粒细胞水平的影响结果见图4、表4。与对照组相比,模型组大鼠肺组织中巨噬细胞、中性粒细胞水平显著升高(P<0.01)。与模型组相比,虎杖苷高、低剂量组大鼠肺组织中巨噬细胞、中性粒细胞水平显著降低(P<0.01)。
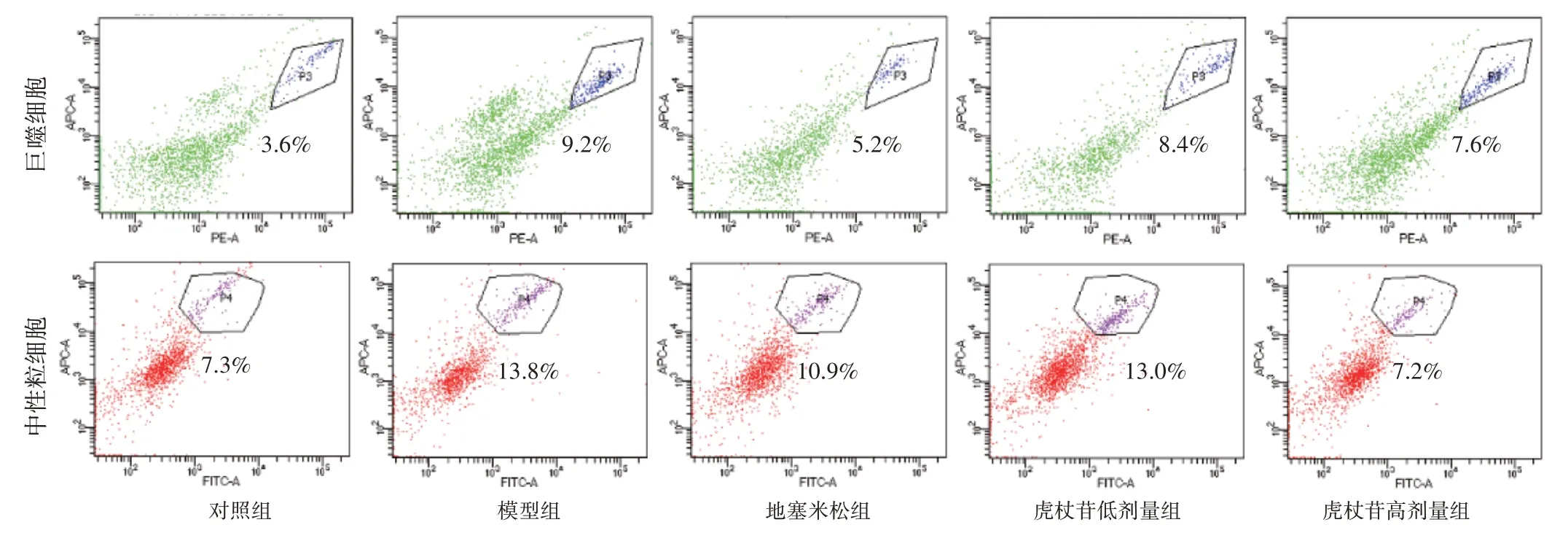
图4 虎杖苷对肺水肿大鼠肺组织中巨噬细胞、中性粒细胞水平的影响Figure 4 Effects of polydatin on neutrophils and macrophages in lung tissue of rats with pulmonary edema
表4 虎杖苷对肺水肿大鼠肺组织中巨噬细胞、中性粒细胞水平的影响(±s,n=3)Figure 4 Effects of polydatin on neutrophils and macrophages in lung tissue of rats with pulmonary edema(±s,n=3)
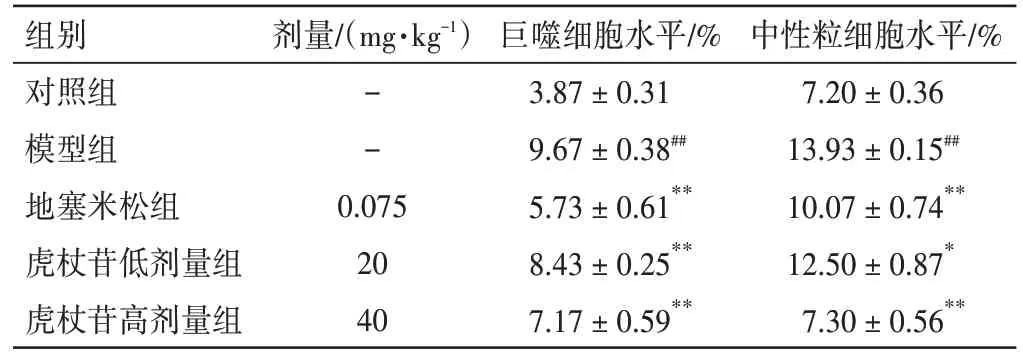
表4 虎杖苷对肺水肿大鼠肺组织中巨噬细胞、中性粒细胞水平的影响(±s,n=3)Figure 4 Effects of polydatin on neutrophils and macrophages in lung tissue of rats with pulmonary edema(±s,n=3)
注:与对照组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
中性粒细胞水平/%7.20±0.36 13.93±0.15##10.07±0.74**12.50±0.87*7.30±0.56**组别对照组模型组地塞米松组虎杖苷低剂量组虎杖苷高剂量组剂量/(mg·kg-1)--0.075 20 40巨噬细胞水平/%3.87±0.31 9.67±0.38##5.73±0.61**8.43±0.25**7.17±0.59**
2.6 虎杖苷对肺水肿大鼠肺泡灌洗液中炎症因子水平的影响结果见表5。与对照组比较,模型组大鼠肺泡灌洗液中IgE、IL-4 水平显著升高(P<0.01),IFN-γ 水平显著降低(P<0.01)。与模型组相比,虎杖苷高、低剂量组大鼠肺泡灌洗液中IgE、IL-4 水平显著降低(P<0.05,P<0.01),IFN-γ 水平显著提高(P<0.05,P<0.01)。
表5 虎杖苷对肺水肿大鼠肺泡灌洗液中炎症因子水平的影响(±s,n=6)Table 5 Effects of polydatin on inflammatory factors in bronchoalveolar lavage fluid of rats with pulmonary edema(±s,n=6)

表5 虎杖苷对肺水肿大鼠肺泡灌洗液中炎症因子水平的影响(±s,n=6)Table 5 Effects of polydatin on inflammatory factors in bronchoalveolar lavage fluid of rats with pulmonary edema(±s,n=6)
注:与对照组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
IFN-γ/(pg·mL-1)118.68±11.81 81.85±8.33##98.70±18.16**95.83±12.01*103.88±5.15**组别对照组模型组地塞米松组虎杖苷低剂量组虎杖苷高剂量组剂量/(mg·kg-1)--0.075 20 40 IgE/(ng·mL-1)0.82±0.29 2.08±0.50##0.83±0.34**1.27±0.25**0.94±0.14**IL-4/(pg·mL-1)8.42±1.96 13.4±1.40##9.22±1.29**11.46±1.74*8.14±1.10**
2.7 虎杖苷对肺水肿大鼠肺组织AQP1、AQP5、IL-10、TNF-α、IL-13 mRNA 表达的影响结果见图5。与对照组比较,模型组大鼠肺组织AQP1、AQP5、IL-10 mRNA 表达水平显著降低(P<0.01),TNF-α、IL-13 mRNA 表达水平显著升高(P<0.01)。与模型组相比,虎杖苷高、低剂量组大鼠肺组织AQP1、AQP5、IL-10 mRNA 表达水平显著升高(P<0.01),TNF-α、IL-13 mRNA 表达水平显著降低(P<0.01)。
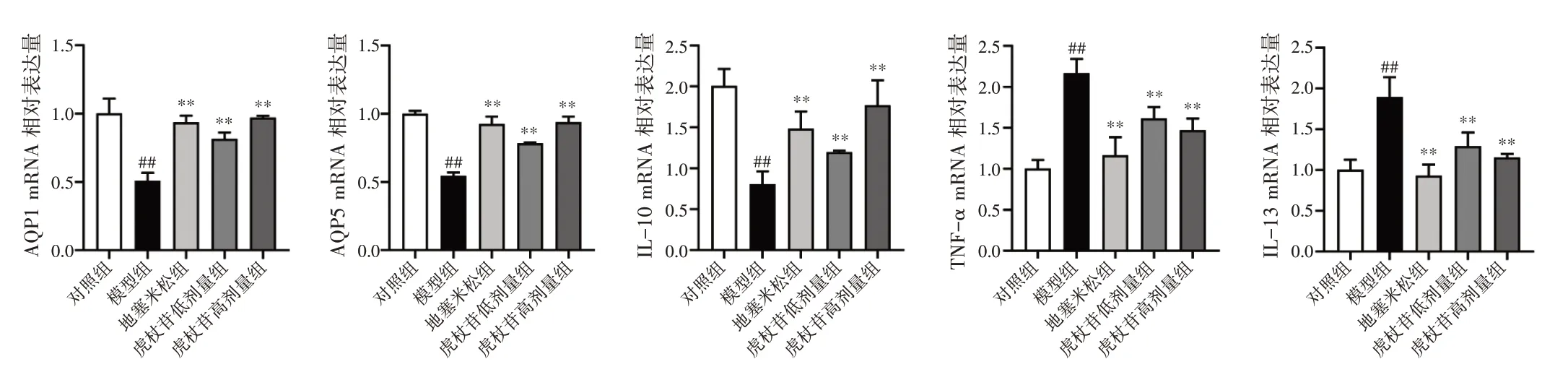
图5 虎杖苷对肺水肿大鼠肺组织AQP1、AQP5、IL-10、TNF-α、IL-13 mRNA 表达的影响(±s,n=3)Figure 5 Effects of polydatin on mRNA expressions of AQP1,AQP5,IL-10,TNF-α and IL-13 in lung tissue of rats with pulmonary edema(±s,n=3)
2.8 虎杖苷对肺水肿大鼠肺组织AQP1 蛋白表达的影响结果见图6、图7。虎杖苷与AQP1 分子对接的结合能为-7.9 kJ·mol-1,以结合能≤-5 kJ·mol-1为标准,表明虎杖苷与AQP1 靶点具有较强的结合活性。与对照组比较,模型组大鼠肺组织中AQP1 蛋白表达显著下调(P<0.01);与模型组比较,虎杖苷高、低剂量组大鼠肺组织中AQP1 蛋白表达显著上调(P<0.01)。

图6 虎杖苷与潜在靶点AQP1 的分子对接模式Figure 6 Molecular docking mode for polydatin and AQP1 target
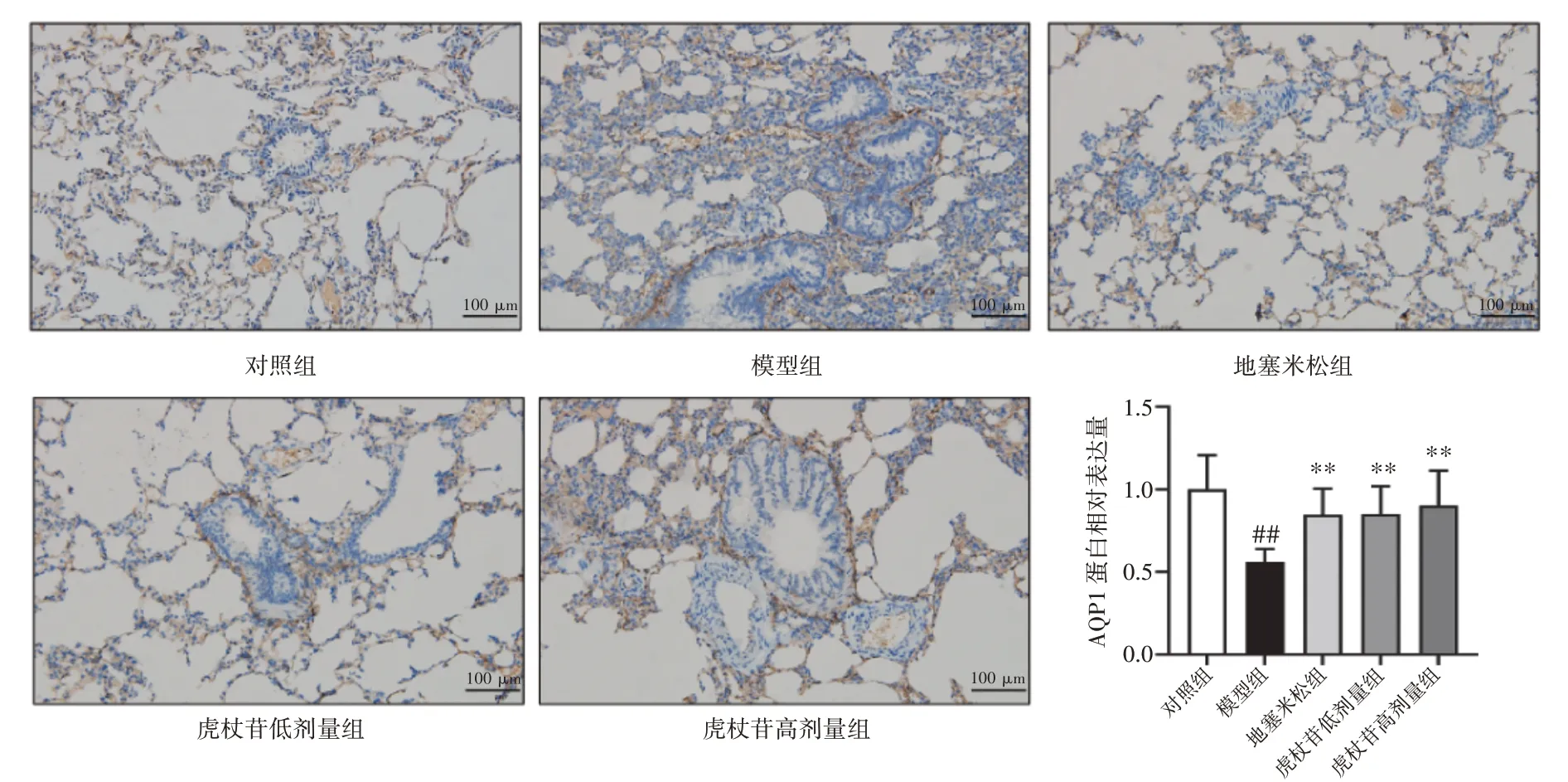
图7 虎杖苷对肺水肿大鼠肺组织中AQP1 蛋白表达水平的影响(±s,n=6)Figure 7 Effect of polydatin on AQP1 protein expression in lung tissue of rats with pulmonary edema(±s,n=6)
2.9 虎杖苷对肺水肿大鼠肺组织中AQP1、AQP5、IL-1β、IL-10 蛋白表达的影响结果见图8。与对照组比较,模型组大鼠肺组织中AQP1、AQP5、IL-10 蛋白表达量显著降低(P<0.01),IL-1β 蛋白表达量显著升高(P<0.01)。与模型组比较,虎杖苷高、低剂量组大鼠肺组织中AQP1、AQP5、IL-10 蛋白表达量显著升高(P<0.01),IL-1β 蛋白表达量显著降低(P<0.01)。
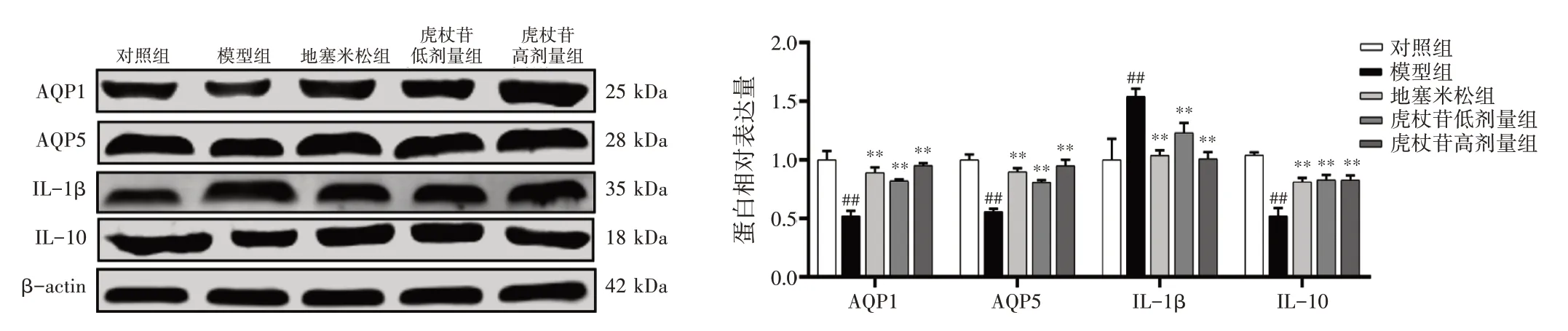
图8 虎杖苷对肺水肿大鼠肺组织中AQP1、AQP5、IL-1β、IL-10 蛋白表达的影响(±s,n=3)Figure 8 Effects of polydatin on protein expressions of AQP1,AQP5,IL-1β and IL-10 in lung tissue of rats with pulmonary edema(±s,n=3)
3 讨论
肺水肿是指肺血管内液体渗入到肺间质或肺泡中导致肺血管外液量增多的病理状态[8],其发病迅速、死亡率高,治疗不及时会导致病情恶化,甚至危及生命。研究表明,虎杖苷具有抗炎、抗氧化应激、镇咳、降血脂、抗休克等药理作用[9],其能够通过调控HMGB1/TLR4/NF-κB 信号通路改善脓毒症急性肺损伤[10]。研究[11]还发现,虎杖苷能够降低高原肺水肿模型大鼠的肺动脉高压,改善肺血管收缩状态及微循环,对抗低氧诱导的肺微血管内皮细胞氧化损伤,从而降低肺水肿程度。但虎杖苷对角叉菜胶致肺水肿的干预作用未见报道,因此本研究通过胸腔注射角叉菜胶复制肺水肿大鼠模型,探讨了虎杖苷对肺水肿的干预作用及可能的作用机制。
本研究结果显示,模型组大鼠的肺组织湿/干质量比及含水量明显升高,可见明显的肺泡结构破坏及炎症浸润,表明通过角叉菜胶成功诱导建立了肺水肿大鼠模型[7]。细胞凋亡是机体炎症调控的重要机制,在肺水肿发病过程中发挥着重要作用[12],氧化应激是细胞凋亡发生的重要原因之一[13],大量ROS 会引起机体代谢紊乱和器官衰竭,并对肺实质细胞直接造成氧化损伤,进而侵袭肺间质,导致肺水肿[14]。而虎杖苷能够降低肺水肿大鼠肺组织原代细胞的凋亡水平及ROS 水平,降低肺组织MDA 水平,升高T-SOD、GSH-Px 水平,明显降低肺组织湿/干质量比及含水量,改善肺组织的病理变化。
肺水肿发生时,会引起肺部组织出现大量炎性细胞,中性粒细胞集聚在炎症部位后,血液中的单核细胞被大量招募,然后分化为巨噬细胞和树突状细胞。巨噬细胞和中性粒细胞是2 种重要的天然免疫细胞,具有很强的病原识别、清除和吞噬能力。在炎症性疾病发展过程中,巨噬细胞分泌的炎症因子TNF-α、IL-1β 和IL-6 能加重体内的炎症反应。研究[15]发现,AQPs 具有调控炎症反应的作用,AQP1低表达与肺组织中IL-1β 释放和中性粒细胞积聚、分泌有关。AQPs 是一组细胞膜转运蛋白,在水的跨膜转运中发挥着重要作用,是维持体内水液代谢平衡的分子学基础[16]。研究表明,AQP1 是肺损伤的重要标记物,AQP1 表达水平降低,肺损伤程度加深[17],AQP5 与AQP1 相互协调对调节水分转运速率有着重要作用[18]。本研究结果表明,虎杖苷可上调肺水肿大鼠肺组织中的AQP1、AQP5 表达,降低中性粒细胞和巨噬细胞水平,抑制促炎细胞因子IL-1β、TNF-α 的释放,提高抗炎细胞因子IFN-γ、IL-10 的水平,进而改善肺损伤。
综上所述,虎杖苷与AQP1 靶点具有较强的结合活性,其对角叉菜胶诱导的肺水肿大鼠具有明显改善作用,可能与其通过调节体内炎症反应、氧化应激与细胞凋亡水平,以及上调AQP1、AQP5 表达有关。
