心脉康增强血管平滑肌细胞自噬改善ApoE-/-小鼠动脉粥样硬化
2023-08-05陈鑫叶小汉曹艳红郭依宁庄皓文王陵军冼绍祥王婷广州中医药大学东莞医院广东东莞52327广州中医药大学第一附属医院广东广州50405广州中医药大学第一临床医学院广东广州50405广州中医药大学岭南医学研究中心广东广州50405
陈鑫,叶小汉,曹艳红,郭依宁,庄皓文,王陵军,冼绍祥,王婷(.广州中医药大学东莞医院,广东 东莞 52327;2.广州中医药大学第一附属医院,广东 广州 50405;3.广州中医药大学第一临床医学院,广东 广州 50405;4.广州中医药大学岭南医学研究中心,广东 广州 50405)
心血管疾病是全球人类死亡的三大主要原因之一[1]。动脉粥样硬化(Atherosclerosis,AS)是各种心血管疾病如冠心病、心肌梗死等缺血性心脏病和中风的重要原因[2]。在AS 的发生、发展中,血管平滑肌细胞是一种重要的细胞类型[3];血管平滑肌细胞的自噬参与动脉粥样硬化斑块的形成,影响AS 晚期病变中斑块的不稳定性[4]。自噬是细胞在一定刺激条件下所表现出的一种高度保守的分解代谢过程,在能量缺失、饥饿等情况下可防止细胞损伤,改善细胞生存并对相应刺激做出一定反应[5]。在AS 的进程中,自噬可以通过降解受损的细胞内物质,特别是极化的线粒体,从而保护受损的平滑肌细胞;自噬的激活能够逆转平滑肌细胞表型向泡沫细胞、巨噬细胞样细胞、成骨样细胞等细胞表型转变,改善AS[6]。近年来越来越多的研究[6-8]表明,增强血管平滑肌细胞自噬能够稳定斑块、改善AS 及相关疾病的发生发展。
中医将AS 归纳为“痰浊”“瘀血”等范畴[9],其病位在脉,主要病理特点为气血运行不畅、停聚脉中形成斑块。基于此病理特点,本课题组叶小汉教授根据多年临床经验总结出“软坚散结”法的自拟方——心脉康,该方主要由鳖甲、三棱、莪术等药物组成,具有软坚散结、益气通脉的功效。前期临床研究发现,心脉康能够改善患者心绞痛症状、降低血脂[10];减少冠心病患者介入治疗后血清中炎症因子的表达[11]。
目前,心脉康改善AS 患者临床症状的具体作用机制尚不明确。本研究拟探讨心脉康对血管平滑肌细胞自噬的影响,探究心脉康是否通过增强血管平滑肌细胞自噬水平、降低血脂、稳定斑块,从而改善AS 的进展。
1 材料与方法
1.1 动物雄性ApoE-/-小鼠,72 只,SPF 级,6 周龄,体质量(22±3)g,购于北京维通利华公司,动物生产许可证号:SCXK(京)2021-0006;动物质量合格证号:110011211115012385。饲养于广州中医药大学实验动物中心,动物使用许可证号:SYXK(粤)2018-0001。饲养环境的湿度为50%~70%,温度为19~23 ℃,自由摄食饮水,昼夜各半。本实验通过广州中医药大学实验动物伦理委员会批准,动物伦理审批号:20211209002。
1.2 药物及试剂心脉康由鳖甲、三棱、莪术等组成,中药饮片购于广州中医药大学第一附属医院门诊部中药房,按常规方法煎煮,水煎液过滤、浓缩至含生药1.5 g·mL-1;阿托伐他汀钙片,辉瑞制药有限公司,批号:H20 051408;蛋白快速提取试剂盒,Invent 生物技术(北京)有限公司,批号:SD001;BCA 蛋白浓度测定试剂盒,碧云天生物科技有限公司,批号:P0010;SurePAGE™预制胶,金瑞斯生物科技有限公司,批号:M00656;自噬效应蛋白1(Beclin-1)抗体、平滑肌22 alpha 蛋白(Smooth muscle 22 α,SM22α)抗体,武汉三鹰生物技术有限公司,批号分别为:11306-1-AP、60213-1-lg;微管相关蛋白l 轻链3B(Microtubule-associated protein 1 light chain 3 alpha,LC3B)抗体、兔二抗、鼠二抗,美国CST 公司,批号分别为:12741、7074S、7076S;总胆固醇(Total cholesterol,TC)、甘油三酯(Triacylglycerol,TG)、高密度脂蛋白胆固醇(High density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(Low density lipoprotein cholesterol,LDL-C)测定试剂盒,南京建成生物医学工程研究所,批号分别为:A110-1-1、A111-1-1、A112-1-1、A113-1-1。
1.3 主要仪器165-8001 电泳仪、1703935 转膜仪、ChemiDoc XRS+全自动凝胶成像系统,美国Bio-Rad公司;Varioskan LUX 多功能酶标仪、QuantStudio 5 ABI 实时荧光定量PCR 仪器,美国Thermo 公司;TCS SPEⅡ激光共聚焦显微镜,德国Leica 公司。
1.4 分组、模型复制及给药将72 只小鼠随机分成空白组、模型组、阳性药物(阿托伐他汀钙片)对照组及心脉康低、中、高剂量组,每组12 只;空白组小鼠喂养常规饮食12 周,余下各组喂养高脂饮食12 周。高脂喂养12 周之后测定小鼠血清TC、TG、LDL-C、HDL-C 含量,通过实验结果及文献资料均证实高脂喂养12 周后能够成功建立动脉粥样硬化模型[12]。模型建立成功后,进行给药,给药体积为8 mL·kg-1,每日1 次,连续6 周。根据体表面积换算法[小鼠每日灌胃剂量=W×成人每日剂量(g·kg-1),W=7.8]计算,按照60 kg 成人每日临床用药量为230 g,心脉康的小鼠等效剂量是每日相当于生药量30 g·kg-1,故设置心脉康低、中、高给药剂量分别为30、60、90 g·kg-1;阳性药物对照组给予阿托伐他汀钙片的剂量为2.6 mg·kg-1;其余组灌胃等量蒸馏水。
1.5 小鼠血清TC、TG、HDL-C、LDL-C 含量测定末次给药后,将小鼠禁食不禁水12 h,眼球摘除术采血,4 ℃静置12 h 后以500×g离心15 min 取血清,-80 ℃备用。根据试剂盒说明书检测小鼠血清中TC、TG、HDL-C、LDL-C 水平。
1.6 主动脉根部油红O 染色称取小鼠体质量后,以2%戊巴比妥钠腹腔麻醉小鼠后脱颈椎处死,迅速剪开胸腹暴露心脏与主动脉,用冰生理盐水灌注去除主动脉内残余血液后,摘取心脏与主动脉。小鼠主动脉根部组织脱水,OCT 包埋,冰冻切片机切片,厚度为7 μm,进行油红O 染色。切片置于室温15 min,PBS 缓冲液浸洗3 次,60%异丙醇浸洗5 min,油红O 工作液染色30 min,60%异丙醇极化5~7 s,纯水充分漂洗;苏木素染色液染核,水洗返蓝,用纯水漂洗1~2 遍;甘油明胶封片,显微镜下观察实验结果。
1.7 小鼠血管组织HE 染色和Masson 染色心脏与主动脉取材方法同“1.6”项,4%多聚甲醛固定小鼠主动脉根部血管组织24 h 后逐步对组织进行脱水、透明处理,石蜡包埋切片,厚度为7 μm。HE 染色:将制备好的切片经脱蜡、苏木精、伊红染色,染色后置于无水乙醇脱水,二甲苯透明,甘油明胶封片。Masson 染色:切片经脱蜡、苏木精染色、Masson 丽春红染色、醋酸苯胺蓝复染后无水乙醇浸洗,二甲苯透明,甘油明胶封片,镜下观察组织病理改变。
1.8 免疫荧光法检测小鼠血管组织中LC3B 和SM22α 蛋白的表达组织切片用PBS 缓冲液浸洗3 遍,4%多聚甲醛固定20 min,PBS 缓冲液浸洗3 遍,0.5%Triton-x-100 透膜10 min,3%BSA 溶液(0.5%Triton-x-100 的溶液配置BSA 溶液)室温封闭非特异性抗原1 h,去除封闭液将配置好的一抗LC3B(1∶150)和SM22α(1∶200)滴加到样本,4 ℃孵育过夜;次日,除去一抗,PBS 缓冲液浸洗3 遍,配置山羊抗兔与山羊抗鼠荧光二抗(1∶500)滴加至样本,二抗孵育1 h;PBS 缓冲液浸洗3 遍,加入细胞核染色液DAPI 孵育5 min;PBS 缓冲液浸洗3 遍晾干,封片,共聚焦显微镜观察各组小鼠血管组织荧光变化。
1.9 Western Blot 法检测小鼠血管组织中LC3B、Beclin-1、SM22α 蛋白表达将小鼠血管组织剪碎,采用Invent 蛋白快速提取试剂盒。每100 mg 组织加入1 mL 的裂解液,研磨棒充分研磨,于4 ℃、600×g离心15 min,取上清。BCA 法进行蛋白定量,-80 ℃备用。SDS-PAGE 电泳后将蛋白转印至PVDF 膜,采用快速封闭液封闭15 min 后,TBST 洗3 次。置于抗体盒中,4 ℃孵育过夜。第2 天,TBST洗3 次,加入相应的二抗,室温孵育1 h,使用ECL显色液显色。
1.10 qRT-PCR 法检测各组小鼠血管组织中mRNA水平表达小鼠血管组织总RNA 提取采用RNA TRIzol 提取法,测定RNA 浓度。使用Fast King RT反逆转录试剂盒将总RNA 逆转录成cDNA,SYBR Select Master Mix 试剂盒进行荧光定量分析,ABI 实时荧光定量PCR 检测仪进行检测。反应条件:50 ℃, 2 min;95 ℃,2 min;95 ℃,15 s;60 ℃,1 min;40 个循环。引物由上海生工生物工程股份有限公司合成,引物序列见表1。

表1 qRT-PCR 引物序列Table 1 Primer sequences for qRT-PCR
1.11 统计学处理方法以GraphPad Prism 5 软件用于本研究实验分析数据以及作图,满足正态分布数据使用均数± 标准差(±s)表示,若满足正态性及方差齐性时,选用单因素方差分析(One-way ANOVA),Bonferroni 法进行事后检验;若符合正态分布,不满足方差齐性则选用非参数法分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 心脉康对ApoE-/-小鼠血清中TC、TG、HDL-C、LDL-C 水平的影响见图1。与空白组比较,模型组血清中TC、TG、LDL-C 水平均升高,HDL-C 水平降低,差异均有统计学意义(P<0.05);与模型组比较,心脉康各剂量组和阳性药物对照组血清中TC、TG、LDL-C 水平均降低,HDL-C 水平升高,差异均有统计学意义(P<0.05)。
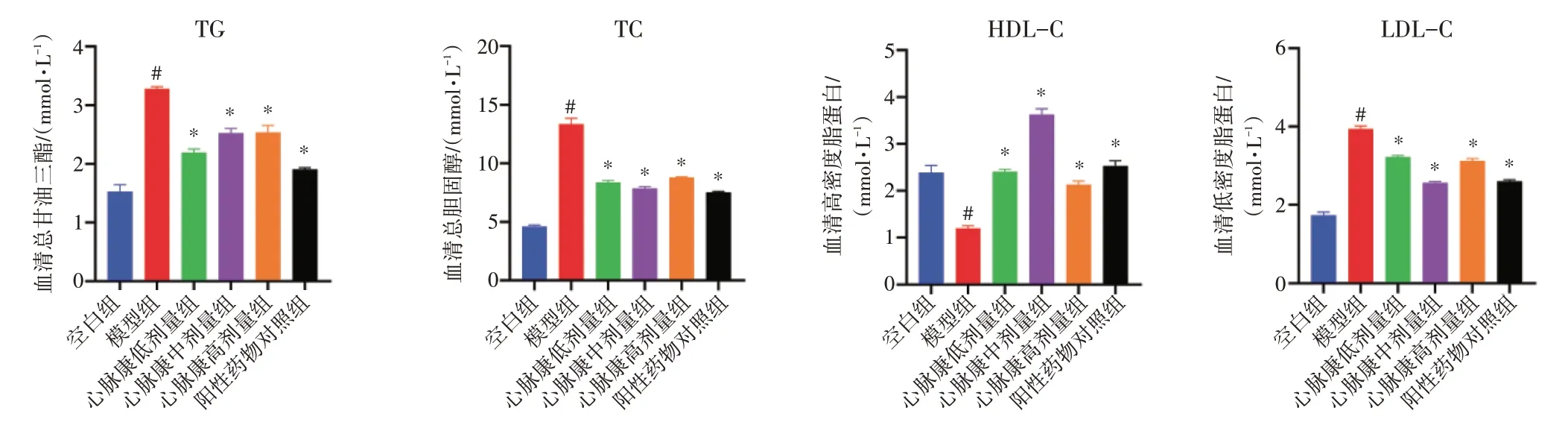
图1 心脉康对Apoe-/-小鼠血清中总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-c)、低密度脂蛋白胆固醇(LDL-c)水平的影响(±s,n=6)Figure 1 Effects of Xinmaikang on serum levels of TC,TG,HDL-c and LDL-c in Apoe-/- mice(±s,n=6)
2.2 心脉康对ApoE-/-小鼠血管组织病理变化的影响见图2。小鼠血管组织油红O 染色结果显示,空白组主动脉根部无明显斑块;模型组主动脉根部油红染色阳性区域较多,可见明显动脉粥样斑块病变;心脉康各剂量组和阳性药物对照组病变斑块明显减少。Masson 染色结果显示,空白组血管组织内膜光滑平整;模型组血管组织内膜增厚,胶原纤维减少;心脉康各剂量组和阳性药物对照组胶原纤维含量明显增多。HE 染色结果显示,空白组血管组织内平滑肌细胞排列整齐,未见异常;模型组血管组织可见大量炎症浸润、胆固醇结晶和泡沫细胞堆积,心脉康各剂量组和阳性药物对照组的表现较模型组明显减少。
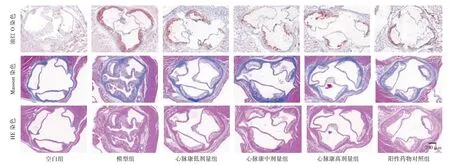
图2 心脉康对ApoE-/-小鼠血管组织病理变化的影响(油红O、Masson、HE 染色,×40)Figure 2 Effect of Xinmaikang on pathological changes of vascular tissues in ApoE-/- mice(Oil red O,Masson and HE staining,×40)
2.3 心脉康对ApoE-/-小鼠血管组织相关蛋白表达的影响图3 的LC3B 和SM22α 免疫荧光共定位染色结果显示,与空白组比较,模型组LC3B 和SM22α共定位面积百分比降低,差异均有统计学意义(P<0.05);与模型组比较,心脉康各剂量组和阳性药物对照组LC3B 和SM22α 共定位面积百分比均增大,差异均有统计学意义(P<0.05)。

图3 心脉康对ApoE-/-小鼠血管组织LC3B 和SM22α 蛋白的影响(免疫荧光,×40)Figure 3 Effects of Xinmaikang on LC3B and SM22α proteins from vascular tissues in ApoE-/- mice(IF,×40)
图4 的Western Blot 结果显示,与空白组比较,模型组LC3B、Beclin-1、SM22α 蛋白表达量减少,差异均有统计学意义(P<0.05);与模型组比较,心脉康各剂量组和阳性药物对照组LC3B、Beclin-1 和SM22α 蛋白表达量均明显增多,差异均有统计学意义(P<0.05)。

图4 心脉康对ApoE-/-小鼠血管组织LC3B、Beclin-1 和SM22α 蛋白表达的影响(±s,n=6)Figure 4 Effects of Xinmaikang on the protein expressions of LC3B,Beclin-1 and SM22 α from vascular tissues in ApoE-/- mice(x ± s,n=6)
2.4 心脉康对ApoE-/-小鼠血管组织相关mRNA 表达影响见图5。qRT-PCR 结果显示,与空白组比较,模型组LC3B、Beclin-1、SM22α mRNA 表达均明显降低,差异均有统计学意义(P<0.05);与模型组比较,心脉康各剂量组和阳性药物对照组LC3B、Beclin-1、SM22α mRNA 表达均明显升高,差异均有统计学意义(P<0.05)。
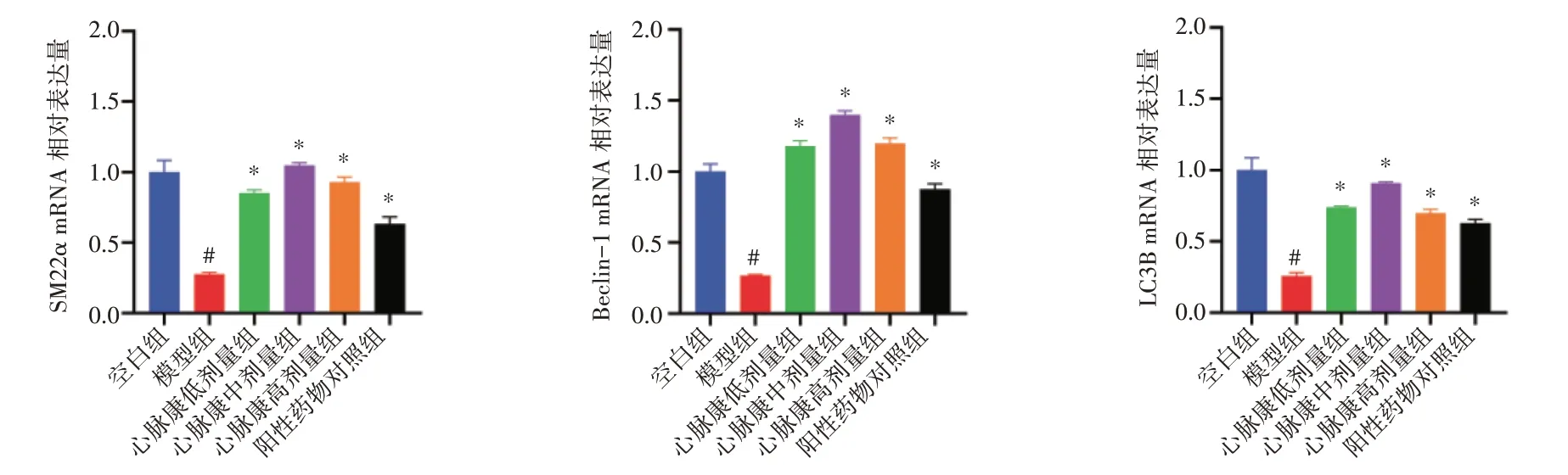
图5 心脉康对ApoE-/-小鼠血管组织LC3B、Beclin-1 和SM22α mRNA 表达的影响(±s,n=6)Figure 5 Effects of Xinmaikang on the mRNA expressions of LC3B,Beclin-1 and SM22α from vascular tissues in ApoE-/- mice(±s,n=6)
3 讨论
动脉粥样硬化(AS)以动脉内的炎细胞浸润和胆固醇沉积为主要特征。炎细胞浸润和胆固醇沉积会加剧内皮损伤、平滑肌细胞迁移,从而使含胆固醇的低密度脂蛋白颗粒能够进入并滞留血管壁逐渐形成斑块,进一步导致血管管腔变窄引起一系列心脑血管疾病[13]。目前临床上对AS 的治疗多以综合治疗(合理饮食、适当体力劳动和控制易患因素)、药物治疗(降血脂药物、扩张血管药物和抗血小板药物)和手术治疗为主。中医药治疗AS 能规避西药治疗中的药物副作用以及患者不耐受等情况,对AS 的治疗具有多成分、多靶点、多通路的特点,能够有效抑制血管平滑肌细胞增殖迁移、促进自噬[14],是AS 治疗的重要组成部分。中医学上认为AS 的病机多为邪气伏留于脉络,导致脉络癥积,阻碍气血[15],故多运用软坚散结法治疗该病。前期临床研究[16-19]证实,具有软坚散结作用的心脉康能够降低血脂水平、减轻炎症反应进而改善AS。
自噬是细胞的一种分解代谢过程,能够通过溶酶体降解细胞内受损的细胞器,在机体代谢中发挥重要作用[20-22]。斑块不稳定性和破裂的风险与小鼠体内自噬水平呈现负相关,平滑肌细胞的自噬水平降低可能导致胶原合成不足、增加斑块不稳定性和破裂风险[23]。自噬能够通过抑制平滑肌细胞迁移、增殖,减少斑块的形成,延缓AS 的进展[24]。因此本研究探讨了在AS 过程中,血管平滑肌细胞自噬的发展及变化,并进一步探讨了心脉康是否通过增强血管平滑肌细胞自噬从而改善AS。
本研究以高脂饮食喂养ApoE-/-小鼠成功复制AS动物模型。心脉康干预后,与模型组比较,心脉康各剂量组小鼠血清中TC、TG、LDL-C 水平明显降低,HDL-C 水平明显升高;小鼠血管组织斑块面积明显减少。以上结果提示心脉康能够降低血脂、改善AS。
在AS 的发展中,血管平滑肌细胞自噬缺陷会激活细胞凋亡,增加斑块的不稳定性与破裂的风险。因此,血管平滑肌细胞适度自噬对维持细胞内环境稳态,抑制AS 的进展有重要意义。本研究结果显示,与模型组比较,心脉康干预后,能明显上调LC3B,Beclin-1 和SM22α 蛋白以及mRNA 的表达,明显增加LC3B 和SM22α 共定位面积,进一步证明了心脉康能通过增强血管平滑肌细胞自噬改善AS。
综上所述,心脉康可逆转AS 小鼠的自噬缺陷、降低血脂、稳定斑块,延缓AS 的进展,其作用机制可能与增强血管平滑肌细胞自噬有关。这为具有软坚散结作用的心脉康在临床上治疗AS 以及血脂异常提供了相关实验依据。但心脉康增强血管平滑肌细胞自噬的上游作用机制通路还有待进一步实验研究加以验证。
