抗纤益心方调控线粒体质量控制对大鼠心肌细胞肥大模型的影响
2023-08-05冯尧伟刘舜禹黑炫鼎强祎彤常红波王振涛王占利河南中医药大学河南郑州450008河南省中医院河南郑州45000
冯尧伟,刘舜禹,黑炫鼎,强祎彤,常红波,王振涛,王占利(. 河南中医药大学,河南 郑州 450008;. 河南省中医院,河南 郑州 45000)
扩张型心肌病(Dilated cardiomyopathy,DCM)是以心室扩张和心肌收缩功能障碍为主要特征的非缺血性心肌疾病,临床常表现为进行性心力衰竭,其预后较差,5 年病死率为42.24%[1-2]。线粒体质量控制主要包括了线粒体动力学(融合/分裂)、线粒体自噬及线粒体生物合成,在DCM 的发展过程中存在线粒体质量控制失衡的状态[3-4]。沉默信息调节因子3(Silent Information Regulator 3,SIRT3)是线粒体中去乙酰化修饰酶,有多种底物参与线粒体的生物过程,在维持细胞内稳态及细胞存活方面发挥重要作用[5-6]。
抗纤益心方由升陷汤化裁而来,方由红参、丹参、泽兰、益母草、黄芪、茯苓、白术、升麻、麦冬等组成,具有益气升陷、活血利水之效。临床研究[7]表明,在常规治疗基础上联用抗纤益心方可显著抑制DCM 患者心室重构;基础研究[8-10]发现抗纤益心方能够通过调控线粒体介导的凋亡与自噬明显改善心功能,逆转心室重构。
本研究通过去甲肾上腺素(NE)诱导成年大鼠心肌细胞肥大模型,探讨抗纤益心方对线粒体质量控制相关因子的调控作用,明确抗纤益心方的作用机制,以期为DCM 的临床治疗提供新方向。
1 材料
1.1 动物SD 大鼠,雄性,SPF 级,8 周龄,体质量(200±20)g,济南朋悦实验动物繁育有限公司提供,动物生产许可证号:SCXK(鲁)20190003,动物质量合格证号:370726201100417315。动物饲养于河南省中医院动物实验中心,使用许可证为:SYXK(豫)2016-0009。本研究通过河南省中医院伦理委员会批准,批准号:PZ-HNSZYY-2019-004。
1.2 药物及试剂抗纤益心方的配方颗粒由四川新绿药业科技发展有限公司提供,主要由红参12 g、黄芪30 g、丹参15 g、泽兰15 g、益母草15 g、茯苓15 g、白术15 g、升麻9 g、麦冬12 g 组成,批号分别为:19080058、20100015、20040120、19110126、20040219、20100186、20090042、20060046、20060012,每克颗粒相当于生药8 g。给药前将颗粒溶解于生理盐水中,配为溶液备用。辅酶Q10片,购自河南省中医院,批号:H10 930021;异氟烷,深圳瑞沃德生命科技有限公司,批号:217 171101;去甲肾上腺素、左旋肉碱、层粘连蛋白,美国MedChemExpress 公司,批号分别为:HY-13715、HY-B0399、HYP0131;Joklik、牛血清白蛋白,美国Sigma 公司,批号分别为: M8028、 V 900933; M199 培养基、HEPES,美国Gibco 公司,批号分别为:11150067、11 344041;BCA 蛋白浓度测定试剂盒、增强型ATP检测试剂盒,上海碧云天生物技术有限公司,批号分别为: P0012、 A025; GAPDH、 SIRT3、PGC-1α、Pink1、Parkin 抗体,美国Proteintech 公司,批号分别为:60004-1-Ig、10099-1-AP、66369-1-Ig、23274-1-AP、14060-1-AP;Drp1、Mff 抗体,美国Cell signaling 公司,批号分别为:8570S、84580;ECL 化学发光液,北京索莱宝科技有限公司,批号:PE0010;山羊抗兔二抗、山羊抗鼠二抗,美国Proteintech 公司,批号分别为:15015、15014;反转录试剂盒,日本Takara 公司,批号:RR047A;PCR 引物依据NCBI 网站提供的引物序列设计,由生工生物工程(上海)股份有限公司合成,具体见表1。
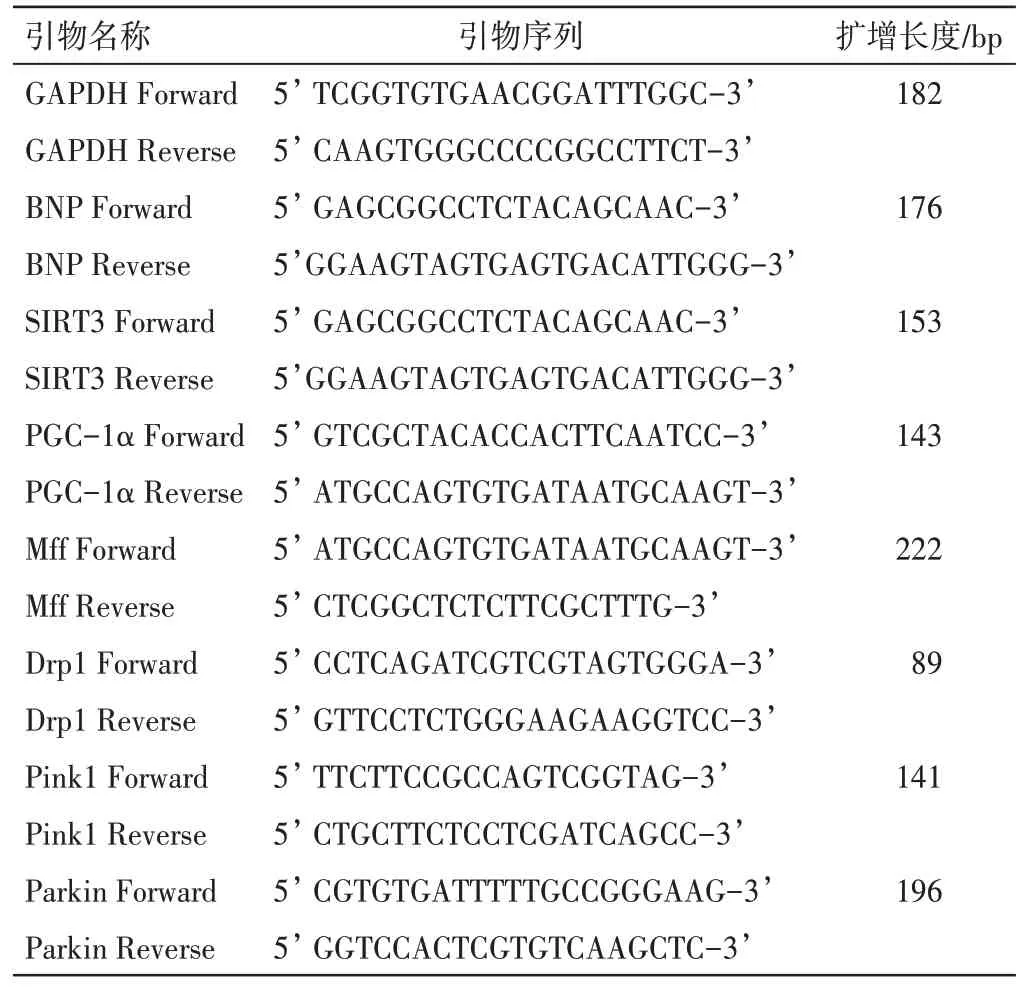
表1 引物序列Table 1 Primer sequences of target genes
1.3 仪器ML176-V 型离体心脏灌流系统,美国AD Instrument 公司;3110 型CO2培养箱,美国Thermo Scientific 公司; IncuCyte S3 型活细胞成像观察系统,美国Essen BioScience 公司;OD-2000+型超微量核酸蛋白测定仪,美国One-drop 公司;7500 FAST 型PCR 仪,赛默飞世尔(上海)仪器有限公司;185-2148 型基因扩增仪、164-5070 型蛋白垂直电泳仪、170-4070 型电转仪、Chemidoc XRS+型化学发光凝胶成像仪,美国Bio-RAD 公司。
2 方法
2.1 隔离成年大鼠心肌细胞运用改良Langendorff灌流法[11]隔离成年大鼠心肌细胞。给予异氟烷吸入麻醉后,解剖大鼠迅速取出心脏,放入冰的灌流液(Joklik 11.2 g,碳酸氢钠2 g,硫酸镁0.144 g,左旋肉碱0.198 g,加入1 000 mL 去离子水中,完全溶解,通氧30 min,调整pH 值至7.3)中,轻压排除残血,将主动脉悬挂到Langendorff 灌流装置,灌入37 ℃灌流液,将心脏内瘀血排出;5 min 后,将灌流液换为胶原酶消化液,约30 min 后心脏发白,即停止消化。剪下心室,将其放入培养皿内,滴管吸取心肌细胞悬液,用0.45 μm 微孔滤膜过滤,滤液收集到50 mL 离心管中,再将滤液离心(室温,离心半径15 cm,2 000 r·min-1,20 s),弃上清,使用不同浓度的含钙培养基梯度复钙。从培养箱中取出提前加入配制好的M199 培养基(0.5 g HEPES,0.05 g 左旋肉碱,1 g BSA,100 mL M199,1 mL 青链霉素)的培养皿,每个皿中加入300 μL 心肌细胞悬液,孵3 h 后更换培养基,即可进行下一步实验。
2.2 抗纤益心方含药血清制备60 只雄性SD 大鼠随机分为3 组:空白组、抗纤益心方组、辅酶Q10组。抗纤益心方组、辅酶Q10组分别给予相应的药物灌胃处理,空白组给予等量生理盐水灌胃。课题组前期研究[11]发现,抗纤益心方高剂量(3.6 g·kg-1)灌胃有较好疗效,故本实验选用此剂量。辅酶Q10给药剂量由以下公式计算: Dm=Dh/W·F,其中Dm 为当前小鼠抗纤益心方的给药剂量,Dh 为抗纤益心方的临床剂量,W 为人体质量,F 为小鼠与人的剂量转换因子,W 设置为70 kg,小鼠与人转换系数为6.3。故辅酶Q10灌胃量为(2.67 mg·kg-1)。大鼠连续灌胃7 d,每天1 次,在末次灌胃后2 h 内经腹主动脉采血,室温静置2 h,离心半径13.5 cm,3 000 r·min-1,离心15 min,取上清即为含药血清。于56 ℃水浴30 min灭活,0.22 μm 微孔滤膜过滤除菌后,分装保存。
2.3 细胞分组、给药及模型复制原代心肌细胞培养于M199 培养基中,置于37 ℃、5% CO2培养箱孵育,待细胞生长至80% 融合时进行实验。细胞分为正常组、模型组(NE)、中药组(NE+抗纤益心方)、西药组(NE+辅酶Q10)。在进行NE 造模前1 h,弃培养基,将中药组和西药组换成含有10% 相应含药血清的培养基培养,其余组用含10% 正常血清的培养基培养,置于37 ℃、5% CO2培养箱孵育。1 h 后,根据文献报道方案[12]及预实验结果,选定0.5 μmol·L-1的NE 再处理24 h,诱导成年大鼠心肌细胞肥大模型。
2.4 心肌细胞表面积测定心肌细胞按照“2.3”项下分组、干预后于培养箱中培养24 h,于显微镜下观察并且拍照,用ImageJ 图像专业分析软件,测量单个活细胞的面积。每组取5 个视野,每个视野按20 个细胞进行统计分析。
2.5 Real-time PCR 法测定BNP 及线粒体质量控制相关指标mRNA 的表达水平心肌细胞按照“2.3”项下分组、干预后,于培养箱中培养24 h,用PBS清洗2 遍。加入Buffer Rlysis-AG 裂解,按照生工RNA 抽提纯化试剂盒说明书提取总RNA,根据Takara 反转录试剂盒说明书配置反转录反应液。反转录反应条件设定为:37 ℃15 min,85 ℃5 s,4 ℃冷却后取出cDNA 模板。基于cDNA 模板,采用TB GreenTM Premix EX Ta q TM Ⅱ试剂盒配制荧光定量PCR 反应液。反应条件:95 ℃预变性30 s 后进行PCR 循环,95 ℃变性5 s,60 ℃退火31 s,共40 个循环。以GAPDH 为内参校正,采用2-△△Ct相对定量法计算各组基因表达情况并进行结果分析。
2.6 荧光素酶检测细胞ATP 水平大鼠心肌细胞按照“2.3”项下分组、干预后,于培养箱中培养24 h,PBS 洗2 遍,每孔中加入400 μL 裂解液,收集裂解细胞于1.5 mL EP 管中,4 ℃12 000 r·min-1离心5 min(离心半径5 cm),取上清。冰上融解待用试剂,将ATP 标准溶液用裂解液稀释成不同的浓度梯度。按照说明书配制ATP 工作液,每孔加100 μL ATP 检测工作液,室温静置5 min,以清除本底性的ATP,减少误差。在待检测孔中加入20 μL 待测样品溶液,迅速混匀后化学发光仪测定ATP 含量。
2.7 Western Blot 法检测线粒体质量控制相关蛋白表达水平大鼠心肌细胞干预后使用裂解液(RIPA∶PMSF 为100∶1)提取蛋白,4 ℃,12 000 r·min-1离心5 min(离心半径5 cm)后取上清,BCA 法检测蛋白浓度;取相同蛋白量制备上样样本进行电泳、转膜(湿转)2 h,5% 脱脂奶粉封闭1 h;置于相应一抗(1∶1 000)中4 ℃孵育过夜,次日TBST 洗膜5 次,每次5 min;室温孵育二抗(1∶4 000)1 h,TBST 洗膜5 次(每次5 min)后置于ECL 化学发光液中,利用凝胶成像系统检测。以GAPDH 为内参蛋白,以目标蛋白与内参的比值作为蛋白的相对表达量。
2.8 统计学处理方法采用SPSS 22.0 软件进行数据统计,采用GraphPad Prism 6.0 软件进行作图。数据以均数± 标准差(±s)表示。采用单因素方差分析,两两比较采用TurKey 法。以P<0.05 为差异有统计学意义。
3 结果
3.1 NE 诱导成年大鼠心肌细胞肥大模型的建立见图1、表2。通过显微镜下观察可见多数贴壁生长的心肌细胞呈梭形,部分心肌细胞可观察到自发性收缩。成年大鼠心肌细胞经过NE 处理后,细胞表面积有所增加,差异有统计学意义(P<0.05);Real-Time PCR 检测显示,经NE 处理后,心肌细胞肥大标志基因BNP mRNA 变化明显增加,差异有统计学意义(P<0.05)。以上表明模型复制成功。

图1 去甲肾上腺素(NE)诱导的成年大鼠心肌细胞肥大(×100)Figure 1 Norepinephrine(NE)-induced cardiomyocytes hypertrophy of adult rats(×100)
表2 去甲肾上腺素(NE)诱导的肥大心肌细胞表面积及BNP mRNA 水平变化(±s,n=6)Table 2 Surface area and mRNA level of BNP in NE induced hypertrophic cardiomyocytes(±s,n=6)

表2 去甲肾上腺素(NE)诱导的肥大心肌细胞表面积及BNP mRNA 水平变化(±s,n=6)Table 2 Surface area and mRNA level of BNP in NE induced hypertrophic cardiomyocytes(±s,n=6)
注:与正常组比较,*P<0.05
BNP mRNA 1.00 ± 0.00 2.15 ± 0.09*正常组模型组表面积/μm2 1.00 ± 0.00 1.41 ± 0.13*
3.2 抗纤益心方对成年大鼠心肌细胞肥大模型的影响见图2、表3。与正常组比较,模型组心肌细胞表面积增加,BNP mRNA 表达增加,差异均有统计学意义(P<0.05);与模型组比较,中药组大鼠心肌细胞表面积减小,BNP mRNA 表达降低,差异均有统计学意义(P<0.05);西药组较模型组大鼠心肌细胞表面积有所减少,BNP mRNA 表达有所下降,但差异均无统计学意义(P>0.05)。
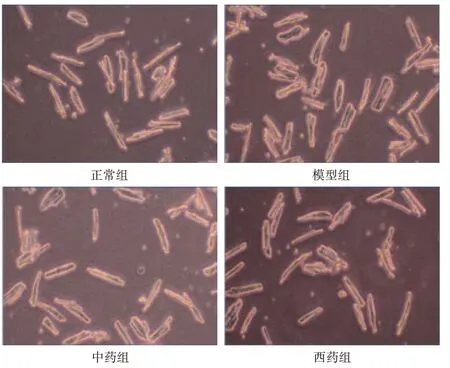
图2 抗纤益心方对大鼠心肌细胞表面积变化的影响(×400)Figure 2 Effect of Kangxian Yixin Decoction on surface area in rat cardiac myocytes(×400)
表3 抗纤益心方对大鼠心肌细胞表面积及BNP mRNA、ATP 含量的影响(±s,n=6)Table 3 Effect of Kangxian Yixin Decoction on surface area,mRNA level and ATP level of BNP in rat cardiac myocytes(±s,n=6)

表3 抗纤益心方对大鼠心肌细胞表面积及BNP mRNA、ATP 含量的影响(±s,n=6)Table 3 Effect of Kangxian Yixin Decoction on surface area,mRNA level and ATP level of BNP in rat cardiac myocytes(±s,n=6)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
ATP/(nmol·mg-1)1.00 ± 0.00 0.51 ± 0.11*0.74 ± 0.09*0.70 ± 0.11#正常组模型组中药组西药组表面积/μm2 1.00 ± 0.00 1.49 ± 0.11*1.27 ± 0.14#1.38 ± 0.17 BMP mRNA 1.00 ± 0.00 2.29 ± 0.18*1.61 ± 0.21#1.97 ± 0.23
3.3 抗纤益心方对成年大鼠心肌细胞肥大模型的ATP 水平的影响见表3。与正常组比较,模型组ATP 含量有所降低,差异有统计学意义(P<0.05),与模型组比较,中药组与西药组大鼠心肌细胞ATP含量有所增加,差异有统计学意义(P<0.05);中药组与西药组之间比较,差异无统计学意义(P>0.05)。
3.4 抗纤益心方对心肌细胞肥大模型线粒体质量控制相关蛋白的影响见图3、表4。与正常组比较,模型组SIRT3、PGC-1α、Mff、Pink1、Parkin 蛋白表达明显降低,差异有统计学意义(P<0.05);Drp1 蛋白表达有所降低,但差异无统计学意义(P>0.05)。与模型组比较,中药组大鼠心肌细胞中SIRT3、PGC-1α、Mff、Pink1、Parkin 蛋白表达有所升高,差异有统计学意义(P<0.05);Drp1 蛋白表达无明显变化,差异无统计学意义(P>0.05)。西药组与模型组比较,SIRT3、Mff、Parkin 蛋白表达明显升高,差异有统计学意义(P<0.05);PGC-1α、Drp1、Pink1 蛋白表达相对有所增加,但差异无统计学意义(P>0.05)。
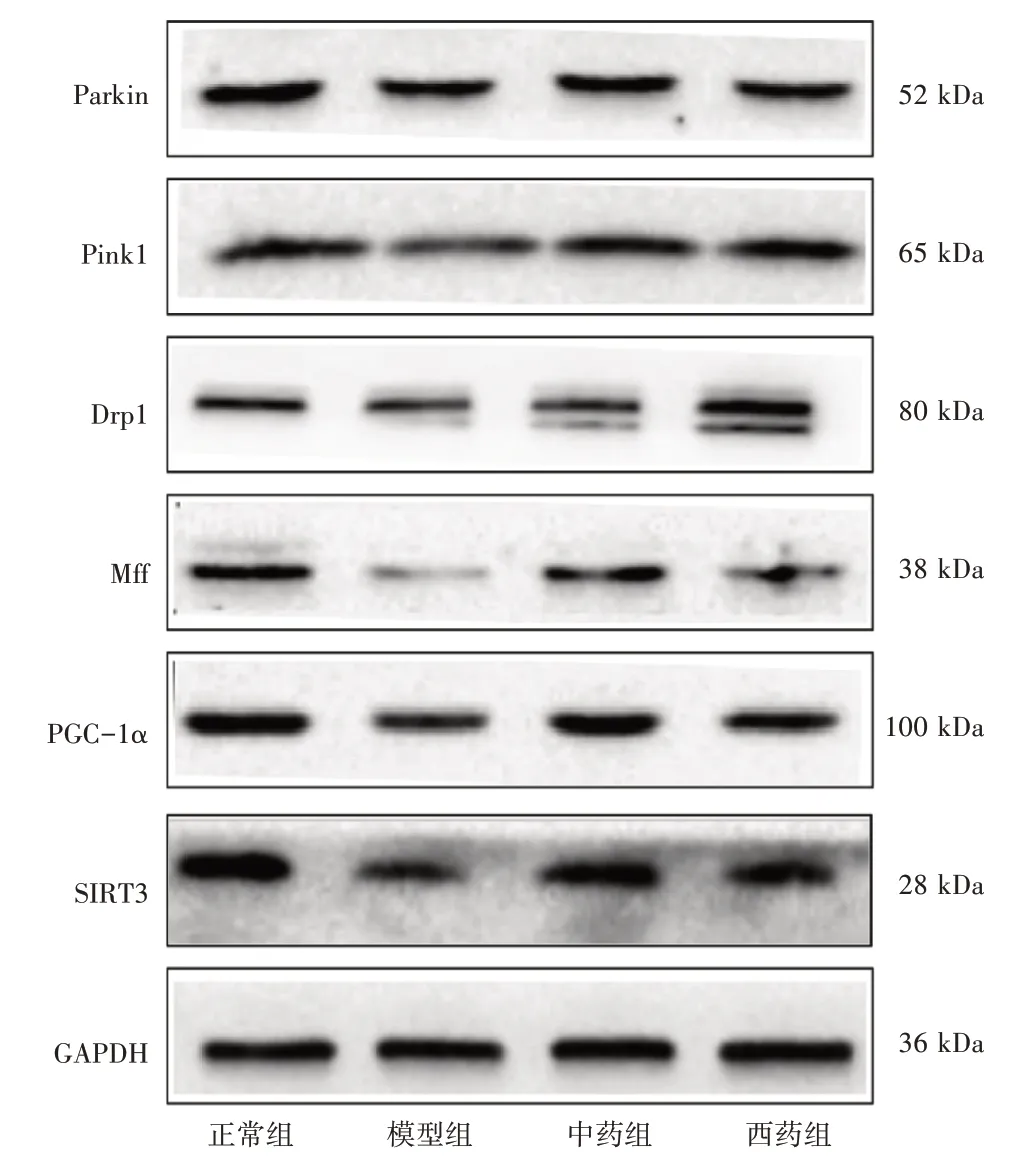
图3 各组心肌细胞线粒体质量控制相关蛋白条带Figure 3Electrophoresis of mitochondrial quality controlrelated proteins in cardiomyocytes
表4 抗纤益心方对心肌细胞线粒体质量控制相关蛋白表达的影响(±s,n=6)Table 4 Effect of Kangxian Yixin Decoction on the protein expression of mitochondrial quality control-related proteins in cardiomyocytes(±s,n=6)

表4 抗纤益心方对心肌细胞线粒体质量控制相关蛋白表达的影响(±s,n=6)Table 4 Effect of Kangxian Yixin Decoction on the protein expression of mitochondrial quality control-related proteins in cardiomyocytes(±s,n=6)
注:与正常组比较,*P<0.05,与模型组比较,#P<0.05
Parkin 1.00 ± 0.00 0.53 ± 0.02*1.02 ± 0.22#1.19 ± 0.21#组别正常组模型组中药组西药组SIRT3 1.00 ± 0.00 0.57 ± 0.06*0.79 ± 0.03#0.73 ± 0.11#PGC-1α 1.00 ± 0.00 0.41 ± 0.03*0.57 ± 0.09#0.45 ± 0.05 Mff 1.00 ± 0.00 0.43 ± 0.08*0.69 ± 0.12#0.70 ± 0.13#Drp1 1.00 ± 0.00 0.70 ± 0.09 0.96 ± 0.25 1.00 ± 0.06 Pink1 1.00 ± 0.00 0.59 ± 0.05*0.84 ± 0.17#0.75 ± 0.12
3.5 抗纤益心方对心肌细胞肥大模型线粒体质量控制相关指标mRNA 的影响见表5。与正常组比较,模型组SIRT3、PGC-1α、Mff、Pink1、Parkin 的mRNA 表达明显降低,差异有统计学意义(P<0.05);Drp1 mRNA 表达有所降低,差异无统计学意义(P>0.05)。与模型组比较,中药组大鼠心肌细胞中SIRT3、PGC-1α、Mff、Pink1、Parkin mRNA 表达有所升高,差异有统计学意义(P<0.05); Drp1 mRNA表达有所升高,差异无统计学意义(P>0.05)。西药组与模型组比较,SIRT3、Mff、Parkin mRNA 表达明显升高,差异有统计学意义(P<0.05),PGC-1α、Drp1、Pink1 mRNA 表达无明显变化,差异无统计学意义(P>0.05)。
表5 抗纤益心方对心肌细胞线粒体质量控制相关指标mRNA 水平的影响(±s,n=6)Table 5 Effect of Kangxian Yixin Decoction on the mRNA expression of mitochondrial quality control-related proteins in cardiomyocytes(±s,n=6)

表5 抗纤益心方对心肌细胞线粒体质量控制相关指标mRNA 水平的影响(±s,n=6)Table 5 Effect of Kangxian Yixin Decoction on the mRNA expression of mitochondrial quality control-related proteins in cardiomyocytes(±s,n=6)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
Parkin 1.00 ± 0.00 0.48 ± 0.04*0.67 ± 0.13#0.69 ± 0.15#组别正常组模型组中药组西药组SIRT3 1.00 ± 0.00 0.49 ± 0.09*0.73 ± 0.06#0.85 ± 0.12#PGC-1α 1.00 ± 0.00 0.52 ± 0.11*0.68 ± 0.10#0.62 ± 0.05 Mff 1.00 ± 0.00 0.58 ± 0.14*0.83 ± 0.17#0.60 ± 0.08#Drp1 1.00 ± 0.00 0.78 ± 0.20 0.88 ± 0.21 0.70 ± 0.18 Pink1 1.00 ± 0.00 0.47 ± 0.15*0.79 ± 0.16#0.59 ± 0.07
4 讨论
扩张型心肌病(DCM)可归属于中医“心胀”“心悸”“心水”等范畴,属本虚标实证,以正气虚为核心病机,血瘀、水湿、痰浊等为主要病理现象[13]。河南省中医院王振涛教授总结多年临床经验认为宗气下陷为本病核心病机,以升阳举陷为根本大法,兼以益气活血自拟治疗DCM 的专方——抗纤益心方。该方以黄芪、红参为君药,大补元气,使心肺之气充沛,宗气充足,气旺则血行;丹参、茯苓、益母草、泽兰等共为臣药,活血化瘀,兼以利水;白术运脾强胃,使气血化生有源,并助黄芪、红参补气;升麻升阳举陷,助黄芪升举宗气;麦冬清心安神,并有佐制方中药物温燥作用。诸药合用,共奏益气升陷、活血利水之功。前期临床研究[14-15]表明,抗纤益心方可改善患者心功能,抑制心室重构;基础研究[16]通过蛋白组学鉴定,发现抗纤益心方对DCM 的治疗作用与线粒体质量密切相关。此外,现代药理学研究[17-19]证实抗纤益心方中所含有的黄芪、红参、丹参等药物及其有效成分可以通过多途径、多靶点调控线粒体质量控制,发挥心肌保护作用,改善心功能。
线粒体质量控制是维持心肌细胞线粒体稳态的重要机制。研究[20]发现,缺氧会引起心肌细胞线粒体结构的改变及线粒体分裂、融合相关蛋白功能的失常,导致线粒体功能障碍、ATP 供应减少和细胞死亡途径的激活。特异性敲除线粒体自噬相关基因Parkin 会导致异常线粒体过度累积、氧化应激、细胞凋亡的发生,最终导致左心室功能障碍[21];在应激状态下,线粒体自噬适当清除受损线粒体可以保护机体免受氧化应激和细胞凋亡的影响维持心脏正常生理功能[22]。过氧化物酶体增殖物激活受体γ 辅助因子1α(peroxisome proliferators activated receptor-γ coactivator-1α,PGC-1α)是线粒体生物合成的关键因子,PGC-1α 基因缺失导致小鼠心肌氧化应激标志物增加,左心室扩大,导致心脏收缩功能障碍;而过表达PGC-1α 能够减少ATP 缺失及线粒体膜电位耗散,从而减轻心脏肥大和重塑[23-24]。
SIRT3 具有很强的NAD 依赖性脱乙酰基酶活性,在病理过程中通过修饰多种线粒体相关蛋白的活性来调节线粒体功能[25-26]。SIRT3 能够通过调控线粒体自噬从而改善阿霉素对心肌细胞的损伤,而针对线粒体生物合成的影响,则有文献支持其通过对PGC-1α 的调控作用发挥对心肌肥大的保护作用[27-28]。同时有研究[29-30]表明SIRT3 缺失介导的线粒体紊乱参与了DCM 的发生、发展。通过比较健康老年人和患有心血管疾病的老年人的样本发现,患有心血管疾病的患者血清中SIRT3 表达明显降低;随着SIRT3 基因敲除小鼠年龄的增长,会使心脏加速衰老,出现明显的心肌肥大和纤维化表现,最终发展为心力衰竭,过表达SIRT3 能够明显降低心肌纤维化损伤[31-33]。
本研究发现,抗纤益心方能明显降低离体成年大鼠心肌细胞肥大模型中BNP mRNA 的表达水平,明显恢复线粒体分裂水平,加快受损线粒体的清除,提高线粒体生物合成水平;还能够上调成年大鼠心肌细胞肥大模型中SIRT3 mRNA 及蛋白表达水平,提示抗纤益心方可能通过调控线粒体质量控制改善心肌细胞肥大,其机制可能与SIRT3 密切相关。SIRT3 是否为抗纤益心方调控线粒体质量控制的重要靶点,将是我们下一步研究的重点。
