补肾调泡周期疗法组方对大鼠原代卵巢颗粒细胞增殖、分泌及AMH、AMHR2、Smad4表达的影响
2023-08-05王茜何忆清苏艳红余歌星杨硕湖南中医药大学湖南长沙40208湖南中医药大学中西医结合心脑疾病防治湖南省重点实验室湖南长沙40208
王茜,何忆清,苏艳红,余歌星,杨硕(. 湖南中医药大学,湖南 长沙 40208;2. 湖南中医药大学中西医结合心脑疾病防治湖南省重点实验室,湖南 长沙 40208)
卵泡发育障碍引起的无排卵性不孕占女方因素不孕的25%~30%,严重影响了妇女的生殖健康[1]。卵巢颗粒细胞在卵泡发育中担当重要角色,颗粒细胞的增殖与分化能够促进卵泡发育与排卵,而颗粒细胞的凋亡与退化则会引起卵泡闭锁[2]。卵巢颗粒细胞与卵母细胞形成缝隙连接,能与卵母细胞进行双向代谢物及信息交换,这对卵母细胞的成熟和卵巢颗粒细胞增殖都至关重要,此外,颗粒细胞还能产生多种营养物质支持卵母细胞生长成熟[1,3-4]。抗苗勒氏管激素(Anti-Müllerian hormone,AMH)是转化生长因子β(transforming growth factorβ,TGF-β)家族的一员,由生长卵泡的颗粒细胞产生,是卵巢储备的标志物,对卵母细胞的成熟有重要作用[5-6];Smad4是介导TGF-β 信号通路的核心蛋白,在信号转导中起枢纽作用[7-8];TGF-β 信号通路对颗粒细胞的增殖、分化以及卵泡发育均有重要调控作用,在女性生殖方面有重要意义。
中医学认为卵泡发育异常的主要病机为肾虚血瘀、肝郁血虚,临床常用补肾疏肝法,疗效显著[9-12]。补肾调泡周期疗法是国家级名中医尤昭玲教授结合数十年临床经验提出的针对引起卵泡发育异常的原发痼疾如多囊卵巢综合征、卵巢早衰和不孕症等妇科疑难病症的经验疗法,以调周促孕为目的分期调治,即月经周期第1~6 d 以逍遥散为底方调经疗疾,月经周期第7~16 d 以经验方“三子汤”为底方补肾助卵、调泡促孕[13-14]。本课题组前期临床研究[15]表明补肾调泡周期疗法能改善卵巢局部血运、细胞分子微环境及相关受体表达,调整卵泡形态、大小、数量、长速,从而促进卵泡发育成熟,提高周期排卵率,最终提高临床妊娠率,但其作用机理、靶点有待进一步阐明。
原代细胞可以最大程度地保持细胞初始特性,本研究以大鼠原代卵巢颗粒细胞为受试对象,深入探讨补肾调泡周期疗法组方逍遥散和三子汤分别对卵巢颗粒细胞增殖、分泌功能的作用及其相关性,阐释其调控卵泡发育和恢复卵巢功能的分子机制,以期为完善中医生殖理论,并为补肾调泡周期疗法的临床发展应用提供科学依据。
1 材料与方法
1.1 实验动物SPF 级雌性SD 大鼠,6~8 周龄20 只,体质量220~250 g;21~25 日龄120 只,体质量40~60 g,均购自湖南斯莱克景达实验动物有限公司,实验动物生产许可证号:SCXK(湘)2019-0004,动物质量合格证号:430727211100876658。动物饲养于湖南中医药大学实验动物中心,昼夜交替12 h,温度22~26 ℃,湿度40%~50%。动物实验经湖南中医药大学实验动物伦理委员会批准,批准号:LL2021042802。
1.2 药物及试剂逍遥散汤剂组方:柴胡6 g,当归10 g,白芍10 g,白术10 g,茯苓10 g,生姜3 g,薄荷3 g,炙甘草5 g。三子汤组方:菟丝子10 g、覆盆子10 g、桑葚子10 g、生地黄10 g、熟地黄10 g、北沙参10 g、麦冬10 g、炙甘草5 g。以上饮片均购自湖南中医药大学第一附属医院门诊部中药房。 注射用垂体促卵泡素(follicle stimulating hormone,FSH),100 IU/支,购自北京索莱宝科技有限公司,批号:20210401。大鼠卵巢颗粒细胞完全培养基,批号:CM-R050,购自武汉普诺赛生命科技有限公司;孕马血清促性腺激素(PMSG),批号:hor-272,购自以色列PROSPE 公司;CCK-8 试剂盒(批号:BS350B)、红细胞裂解液(批号:BL503A),购自安徽合肥白鲨生物科技有限公司;蛋白酶抑制剂混合物,批号:CW2200S,购自江苏康为世纪生物科技股份有限公司;ECL 高效化学发光试剂盒,批号:GE2301-100,购自美国Genview 公司;戊巴比妥钠,批号:20210522,购自德国Merck KGaA 公司;AMH、E2、P ELISA 试剂盒,批号:20220601,购自上海抚生生物科技有限公司;卵泡刺激素受体(FSHR)抗体,批号:22665-1-AP,购自中国武汉Proteintech 公司;抗苗勒氏管激素Ⅱ型受体(AMHR2)抗体、 Smad4 抗体, 批号分别为: ab64762、ab40759,购自美国Abcam 公司;抗苗勒氏管激素(AMH)抗体, 批号: NBP2- 43670, 购自美国NOVUS 公司;GAPDH 抗体,批号:AF7021,购自美国Affinity 公司;HRP 标记的山羊抗兔IgG 抗体(批号:E-AB-1003)、BCA 蛋白定量试剂盒(批号:E-BC-K318-M),购自武汉伊莱瑞特生物科技股份有限公司; 超纯总RNA 提取试剂盒, 批号:5003050,购自杭州新景生物试剂开发有限公司;逆转录试剂盒、扩增试剂盒,批号:E047-01B、E096-01A,购自上海近岸科技有限公司;AMH、AMHR2、Smad4、GAPDH 引物,由北京擎科生物科技有限公司合成。
1.3 仪器CO2培养箱,德国Heraeus 公司;SW-CJ-1FD 超净工作台,苏州苏净仪器自控设备有限公司;Axio Vert.A1 倒置显微镜,德国ZEISS 公司;Heraeus Fresco 17 型超速冷冻离心机,美国Thermo Fisher Scientific 公司;Cytation 3 型多功能酶标仪、T100 Thermal Cycler qRT- PCR 仪、 Chemi- DoCXRS+化学发光成像分析仪,美国Bio-Tek 公司;Mini-PROTEAN Tetra 型电泳槽、Mini Trans-Blot 型转印槽,美国Bio-Rad 公司。
1.4 大鼠原代卵巢颗粒细胞提取与培养选取21~25 日龄SPF 级雌性SD 大鼠(每次4~6 只),适应性喂养3 d,每只腹腔注射PMSG 80 IU,48 h 后颈椎脱臼法处死。将处死的大鼠置于75% 的酒精中浸泡3 min,剖开腹腔肉眼可见双侧卵巢表面大量发育的卵泡;无菌条件下迅速取出双侧卵巢,放入预冷含1% 双抗的PBS 液中,迅速移至超净工作台;在生物放大镜下分离卵巢的被膜和脂肪,PBS 清洗两遍,移入含1% 双抗的DMEM/F12 培基中。用1 mL 注射器针头刺破发育成熟的卵泡,充分释放卵巢颗粒细胞。收集释放出来的细胞,吹打成单细胞悬液用200 目细胞过滤器过滤,将颗粒细胞与细胞团和卵母细胞分离;收集过滤后的细胞悬液到15 mL 离心管中,1 000 r·min-1离心5 min(离心半径17.8 cm);弃上清,加入1 mL 大鼠卵巢颗粒细胞完全培养基,再加入4 mL 红细胞裂解液,轻吹混匀,室温裂解1~2 min,1 000 r·min-1离心5 min(离心半径17.8 cm),弃上清;加入5 mL 完全培养基重悬,轻吹混匀,进行细胞计数,置于37 ℃、5% CO2培养箱中进行培养。
1.5 大鼠原代卵巢颗粒细胞鉴定将提取的大鼠原代卵巢颗粒细胞制成2×104个·mL-1的细胞悬液,在12 孔板中先放置好细胞爬片,取1 mL 即2×104个细胞接种于孔板中,37 ℃、5% CO2培养箱中进行培养。当细胞培养至70%融合时,从培养箱中取出培养板进行大鼠卵巢颗粒细胞鉴定。弃去原培养基,PBS 清洗3 次,每次5 min;加入4%多聚甲醛,室温固定30 min;PBS 缓冲液将固定好的细胞再清洗3 次,每次5 min;加入5% BSA 缓冲液室温下封闭30 min,倒掉封闭液,不需要洗涤;使用5% BSA 按照1∶200 配制一抗FSHR,加入一抗,摇床1 h,4 ℃孵育过夜,弃去一抗,PBS 清洗3 次,每次5 min;加入相应的荧光二抗,避光室温孵育1 h,弃去二抗,PBS 清洗3 次,每次5 min;使用DAPI 对细胞核进行染色,5 min 后PBS 清洗两次;用抗荧光衰减封片剂进行封片。最后使用倒置荧光显微镜,卤素灯光源激发绿色荧光或红色荧光,进行观察并拍照。
1.6 含药血清制备按上述“1.2”项中剂量分别称取逍遥散汤剂组方及三子汤组方,将两方中除薄荷、生姜以外的饮片分别混合并浸泡30 min,煎煮2 次。第1 次加10 倍量水,煎煮30 min,第2 次加8 倍量水,煎煮30 min,在煎煮结束前5 min 加入薄荷、生姜,合并两次煎液过滤,滤液减压分别浓缩至含生药浓度为1.5、1.2 g·mL-1。FSH 用生理盐水配制成10 IU·mL-1溶液。参照国锦等[16]的方法,20 只SPF 级SD 雌性大鼠,常规适应性喂养1 周后,按随机数字表法分为空白组、阳性药物(FSH)组、逍遥散组,三子汤组,每组5 只。逍遥散、三子汤均以临床等效剂量的2 倍进行灌胃,给药剂量分别为12、16 g·kg-1;FSH 组以7.8 IU·kg-1皮下注射给药(剂量按体表面积法根据临床等效剂量换算而得);同时,空白组、阳性药物组给予与中药组等体积的生理盐水灌胃,连续4 d。各组大鼠均在末次给药后1 h,腹腔注射2%戊巴比妥钠麻醉,腹主动脉采血,随后颈椎脱臼处死。全血3 000 r·min-1离心15 min,离心半径为17.8 cm,取上层血清,于恒温水浴锅56 ℃灭活30 min,经0.22 μm 过滤器过滤后分装,于-80 ℃保存。
1.7 CCK-8 法筛选各组含药血清最佳干预浓度提取大鼠原代卵巢颗粒细胞,制成2×104个·mL-1的细胞悬液,每孔100 μL 细胞悬液接种于96 孔板,在37 ℃、5% CO2箱中培养48 h。吸去完全培养基,PBS 清洗1 遍,每孔分别加入100 μL 含有5%、10%、15%、20%含药血清的DMEM/F12 培养基,每组设置3 个复孔。干预24 h 后取出96 孔板;吸去旧培养液,PBS 清洗1 遍,将DMEM/F12 培养基与CCK-8 反应溶液以9∶1 配制,每孔加入100 μL 在37 ℃、5% CO2箱中继续孵育2 h;用酶标仪测量450 nm 处的吸光度(OD),判断各浓度下细胞的增殖活性,以此选择适当浓度的含药血清。若20%为最佳浓度则继续设置含有5%、10%、15%、20%、25%、30%含药血清的浓度,进一步筛选。
1.8 CCK-8 法检测各组细胞增殖情况并绘制生长曲线大鼠原代卵巢颗粒细胞,以2×104个·mL-1的浓度接种于96 孔板,每孔100 μL,在37 ℃、5%CO2箱中培养48 h。吸去完全培养基,PBS 清洗1 遍,每孔分别加入200 μL 各组最佳干预浓度(“1.7”项筛选的结果)的含药血清培养基,每组设置3 个复孔。干预24、48、72、96 h 后取出96 孔板;吸去旧培养液,PBS 清洗1 遍,将DMEM/F12 培养基与CCK-8反应溶液以9∶1 配制,每孔加入100 μL 在37 ℃、5% CO2箱中继续孵育2 h;用酶标仪测量450 nm 处的吸光度(OD),以吸光度值为纵坐标,以时间为横坐标,绘制各组细胞生长曲线。
1.9 细胞分组及相应含药血清培养大鼠原代卵巢颗粒细胞,细胞计数后调整浓度至1×106个·mL-1接种于6 孔板中,并在每个孔上随机标记空白组、阳性药物组、逍遥散组、三子汤组,每组3 个复孔。观察细胞贴壁情况,待细胞长至70% 融合时,分别加入2 mL 各组最佳干预浓度的含药血清培养基,放置于37 ℃、5% CO2的培养箱中继续培养48 h,收集各组样本检测。
1.10 ELISA 法检测各组大鼠卵巢颗粒细胞培养液上清中AMH、E2、P 的浓度按“1.9”项下方法分组处理细胞,收集各组细胞培养液,离心后分装入冻存管,-80 ℃冻存待用。ELISA 法检测细胞培养液上清中AMH、E2、P 的浓度,所有操作均严格按照试剂盒说明书进行。
1.11 Western Blotting 法检测各组含药血清对大鼠原代卵巢颗粒细胞AMH、AMHR2 和Smad4 蛋白表达的影响按“1.9”项下方法分组处理细胞,吸去六孔板中原培养基,PBS 润洗2~3 次,加入含蛋白酶抑制剂的RIPA 裂解液,冰上裂解30 min,用细胞刮单方向将裂解液连同细胞一同刮下后转移至1.5 mL EP 管中,提取细胞总蛋白。按BCA 蛋白定量试剂盒说明书操作进行蛋白浓度测量,然后配制上样体系。蛋白样品经SDS-聚丙烯酰胺凝胶电泳,转至PVDF 膜上,加入5% 牛奶室温封闭60 min,分别加入GAPDH(1∶8 000)、AMH(1∶4 000)、AMHR2(1∶4 000)和Smad4(1∶4 000)抗体,4 ℃孵育过夜;TBST 清洗3 次,加入山羊抗兔二抗(1∶10 000),37 ℃孵育60 min,TBST 清洗3 次;采用ECL 高效化学发光试剂盒显影,采用Image Lab 软件分析条带灰度值。
1.12 qRT-PCR 法检测各组含药血清对大鼠原代卵巢颗粒细胞AMH、AMHR2 和Smad4 mRNA表达的影响按“1.9”项下方法分组处理细胞,吸去六孔板中原培养基,PBS 润洗2~3 次,按照试剂盒说明书提取细胞总RNA,然后转录成cDNA,运用qRT-PCR 法检测各组中各mRNA 的表达。以GAPDH为内参计算上述关键基因的相对表达量,计算公式:ΔΔCt =(样品Ct 均值-内参照Ct 均值)-(对照样品Ct 均值-对照内参照Ct 均值),将各组获得目的基因和对照基因Ct 值求平均值,采用相对定量法计算各组相对于空白组的2-ΔΔCt值。qRT-PCR 引物信息见表1。

表1 qRT-PCR 引物信息Table 1 qRT-PCR primer information
1.13 统计学处理方法采用SPSS 25.0 统计软件进行统计学分析。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD 检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 大鼠原代卵巢颗粒细胞的形态观察刚提取的大鼠卵巢颗粒细胞呈圆形,悬浮在培养液中;37 ℃、5% CO2培养24 h 后,颗粒细胞开始贴壁生长、增殖;培养48 h 后,颗粒细胞长至60%,长出突触并相互衔接;培养72 h 后,颗粒细胞长至80%,呈梭形并聚集性生长。具体细胞形态见图1。

图1 大鼠原代卵巢颗粒细胞形态(×40)Figure 1 Morphology of primary rat ovarian granulosa cells(×40)
2.2 大鼠原代卵巢颗粒细胞纯度鉴定的结果见图2。运用FSHR 免疫荧光特异性染色鉴定大鼠卵巢颗粒细胞纯度。FSHR 阳性染色定位于细胞浆,呈红色或绿色;DAPI 将细胞核染成深蓝色。镜下可见FSHR 的阳性率>95%,由此可知提取的大鼠卵巢颗粒细胞纯度达到95%以上,符合实验要求。
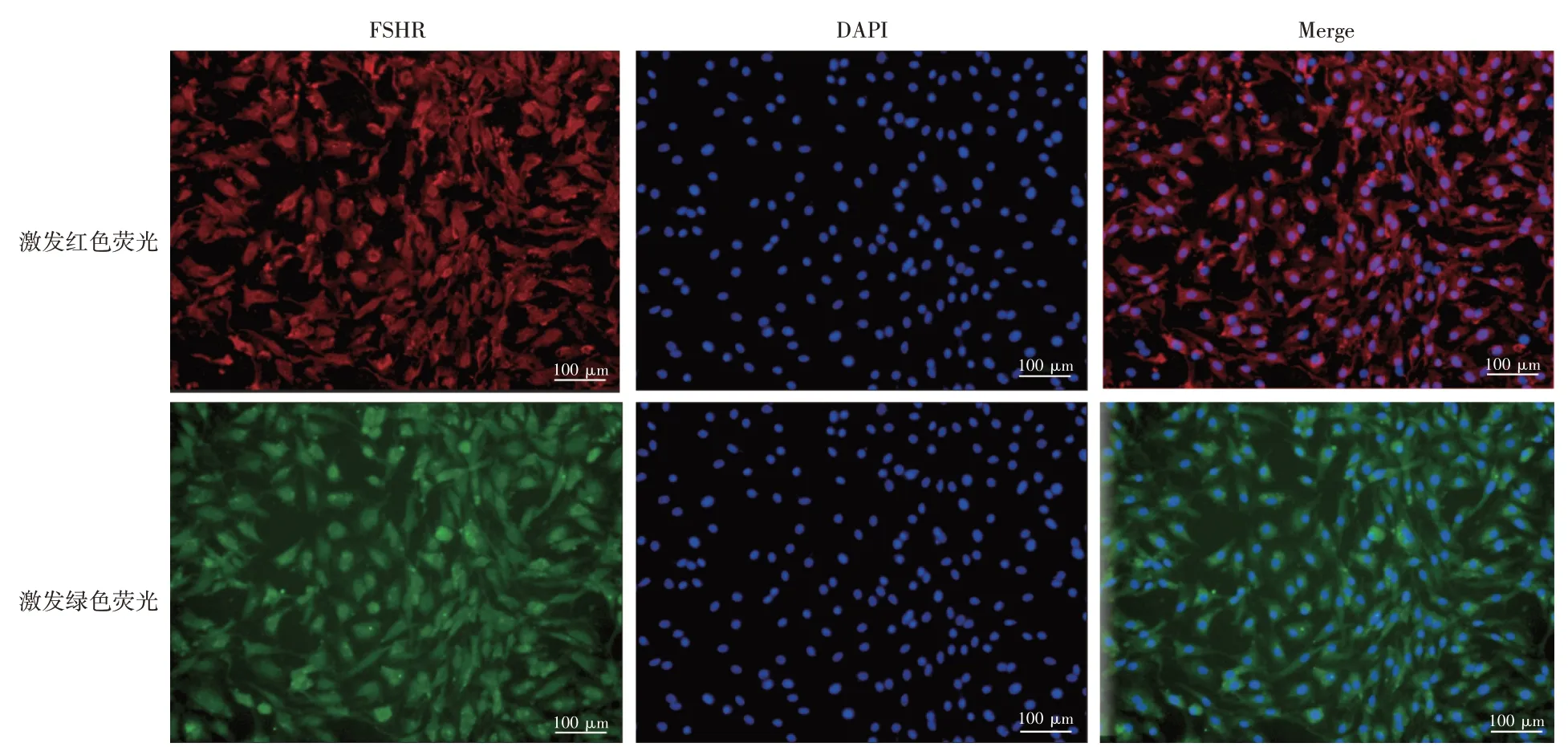
图2 大鼠原代卵巢颗粒细胞鉴定(×40)Figure 2 Identification of primary ovarian granulosa cells in rats(×40)
2.3 各组含药血清最佳浓度筛选的结果见图3。CCK-8 法检测结果表明,阳性药物组含药血清浓度在15%、逍遥散组含药血清浓度在10%、三子汤组含药血清浓度在20% 时OD 值最大,促进大鼠卵巢颗粒细胞增殖的效果最佳(P<0.01,P<0.05)。因此在后续的实验中空白组用20% 空白血清干预;阳性药物组用15% FSH 含药血清+5% 空白血清干预;逍遥散组用10% 逍遥散含药血清+10% 空白血清干预;三子汤组用20% 的三子汤含药血清干预。
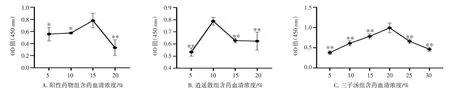
图3 各组含药血清最佳浓度筛选(±s,n=3)Figure 3 Screening of the optimal concentration of drug-containing serum in each group(±s,n=3)
2.4 各组含药血清对大鼠原代卵巢颗粒细胞增殖的动态影响选用“2.3”项下筛选的各组含药血清最佳浓度干预大鼠原代卵巢颗粒细胞,CCK-8 动态监测96 h 细胞增殖曲线变化来观察细胞增殖过程,见图4。24 h 各组细胞增殖慢,各组间增殖无差异(P>0.05)。48 h 各组含药血清开始启动细胞增殖,各组间增殖出现差异,逍遥散组细胞增殖活性开始高于空白组(P<0.05);三子汤组细胞增殖活性开始高于其他3 组(P<0.01);阳性药物组细胞增殖活性与空白组、逍遥散组暂无差异(P>0.05)。72 h 各含药血清组细胞增殖活性均高于空白组(P<0.01);三子汤组细胞增殖活性高于逍遥散组与阳性药物组(P<0.01);逍遥散组与阳性药物组细胞增殖活性相当(P>0.05)。96 h 各含药血清组细胞增殖活性明显高于空白组(P<0.01);逍遥散组细胞增殖活性高于阳性药物组(P<0.05);三子汤组细胞增殖活性明显高于阳性药物组与逍遥散组(P<0.01)。以上结果提示,三子汤组促进大鼠原代卵巢颗粒细胞增殖作用明显优于其他组,逍遥散组次之;各组颗粒细胞增殖与含药血清干预时间呈正相关,干预48 h 启动细胞增殖活性,96 h 细胞增殖达到高峰。因此选择含药血清干预48 h 即颗粒细胞增殖启动时间节点开展后续试验指标检测。

图4 各组含药血清对大鼠原代卵巢颗粒细胞增殖的动态影响(±s,n=3)Figure 4 Dynamic effect of drug-containing serum of each group on proliferation of primary ovarian granulosa cells in rats(x ± s,n=3)
2.5 各组含药血清对大鼠原代卵巢颗粒细胞培养液上清AMH、E2、P 浓度的影响见表2。大鼠原代卵巢颗粒细胞长至70% 融合时,加入各组最佳干预浓度的含药血清培养基干预48 h,收集各组细胞培养液上清进行检测。与空白组比,阳性药物组、逍遥散组、三子汤组卵巢颗粒细胞培养液上清中AMH、E2、P 浓度均明显升高(P<0.05,P<0.01);逍遥散组、三子汤组与阳性药物组AMH、E2浓度两两比较的差异无统计学意义(P>0.05);逍遥散组P浓度与阳性药物组、三子汤组比较,差异均有统计学意义(P<0.05)。
表2 各组含药血清对大鼠原代卵巢颗粒细胞AMH、E2、P浓度的影响(±s,n=3)Table 2 Effects of the drug containing serum of each group on AMH, E2 and P concentrations of primary ovarian granulosa cells in rats(±s,n=3)
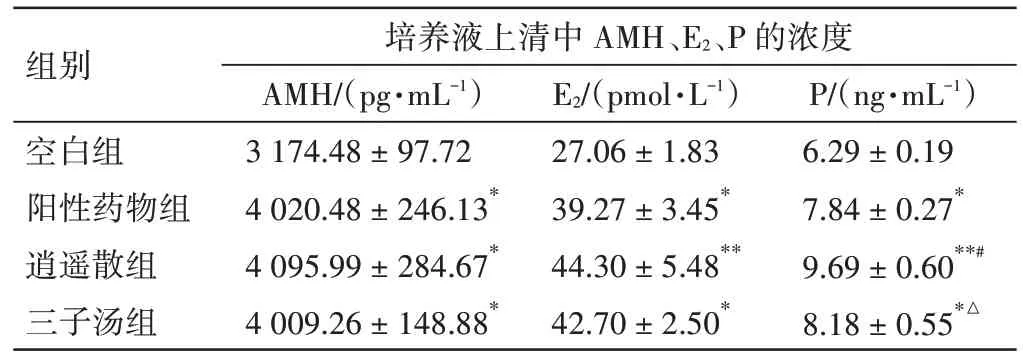
表2 各组含药血清对大鼠原代卵巢颗粒细胞AMH、E2、P浓度的影响(±s,n=3)Table 2 Effects of the drug containing serum of each group on AMH, E2 and P concentrations of primary ovarian granulosa cells in rats(±s,n=3)
注:与空白组比较,*P<0.05,**P<0.01;与阳性药物组比较,#P<0.05;与逍遥散组比较,△P<0.05
组别空白组阳性药物组逍遥散组三子汤组培养液上清中AMH、E2、P 的浓度AMH/(pg·mL-1)3 174.48±97.72 4 020.48±246.13*4 095.99±284.67*4 009.26±148.88*P/(ng·mL-1)6.29±0.19 7.84±0.27*9.69±0.60**#8.18±0.55*△E2/(pmol·L-1)27.06±1.83 39.27±3.45*44.30±5.48**42.70±2.50*
2.6 各组含药血清对大鼠原代卵巢颗粒细胞AMH、AMHR2、Smad4 蛋白表达的影响大鼠原代卵巢颗粒细胞长至70%融合时,加入各组最佳干预浓度的含药血清培养基干预48 h,收集各组细胞进行蛋白表达检测。与空白组比较,阳性药物组、逍遥散组、三子汤组卵巢颗粒细胞中AMH、AMHR2、Smad4 蛋白表达水平均明显升高(P<0.05,P<0.01);三子汤组AMH、Smad4 蛋白表达水平较阳性药物组、逍遥散组升高,但组间两两比较差异无统计学意义(P>0.05);阳性药物组AMHR2 蛋白表达较逍遥散、三子汤组升高,差异均有统计学意义(P<0.01),见图5 和表3。
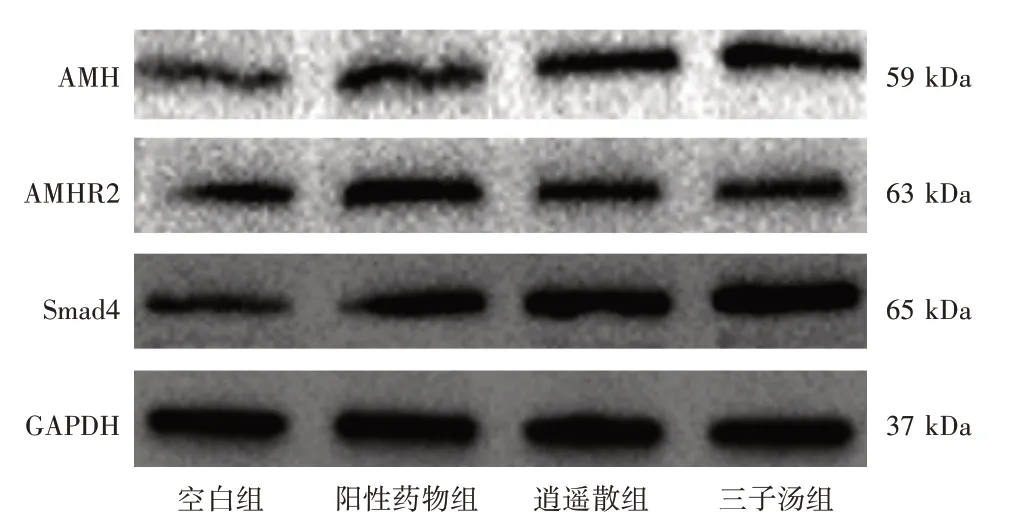
图5 各组大鼠原代卵巢颗粒细胞AMH、AMHR2、Smad4蛋白的表达Figure 5 Effects of the drug-containing serum of each group on the protein expressions of AMH,AMHR2 and Smad4 of primary ovarian granulosa cells in rats
表3 各组含药血清对大鼠原代卵巢颗粒细胞AMH、AMHR2、Smad4 蛋白表达的影响(±s,n=3)Table 3 Effects of drug-containing serum of each group on the protein expressions of AMH,AMHR2 and Smad4 of primary ovarian granulosa cells in rats(±s,n=3)
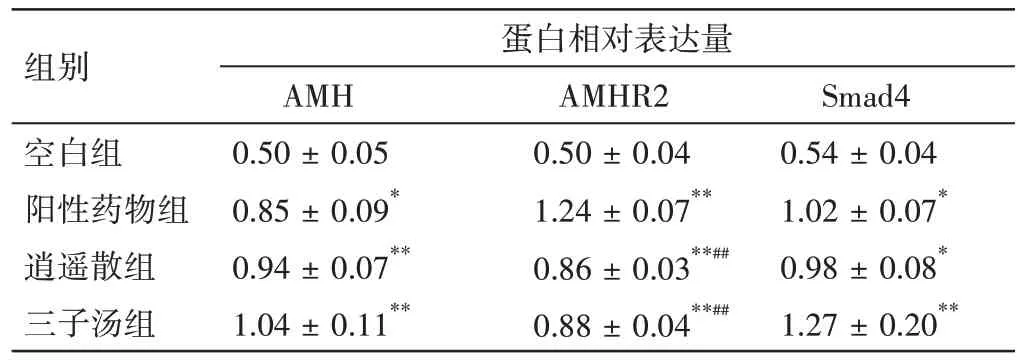
表3 各组含药血清对大鼠原代卵巢颗粒细胞AMH、AMHR2、Smad4 蛋白表达的影响(±s,n=3)Table 3 Effects of drug-containing serum of each group on the protein expressions of AMH,AMHR2 and Smad4 of primary ovarian granulosa cells in rats(±s,n=3)
注:与空白组比较,*P<0.05,**P<0.01;与阳性药物组比较,##P<0.01
组别空白组阳性药物组逍遥散组三子汤组蛋白相对表达量Smad4 0.54 ± 0.04 1.02 ± 0.07*0.98 ± 0.08*1.27 ± 0.20**AMH 0.50 ± 0.05 0.85 ± 0.09*0.94 ± 0.07**1.04 ± 0.11**AMHR2 0.50 ± 0.04 1.24 ± 0.07**0.86 ± 0.03**##0.88 ± 0.04**##
2.7 各组含药血清对大鼠原代卵巢颗粒细胞AMH、AMHR2、Smad4 mRNA 表达的影响见表4。大鼠原代卵巢颗粒细胞长至70% 融合时,加入各组最佳干预浓度的含药血清培养基干预48 h,收集各组细胞进行mRNA 表达检测。与空白组比较,阳性药物组、逍遥散组、三子汤组卵巢颗粒细胞中AMH、AMHR2、Smad4 mRNA 表达水平均明显升高(P<0.01,P<0.05);三子汤组AMH、AMHR2 mRNA 表达水平明显高于阳性药物组及逍遥散组,且差异有统计学意义(P<0.01);逍遥散组与阳性药物组比较AMH、AMHR2 mRNA 表达水平没有差异性(P>0.05);逍遥散组、三子汤组与阳性药物组间,Smad4 mRNA 表达的差异无统计学意义(P>0.05)。
表4 各组含药血清对大鼠卵巢颗粒细胞AMH、AMHR2、Smad4 mRNA 表达的影响(±s,n=3)Table 4 Effects of drug-containing serum of each group on the mRNA expressions of AMH,AMHR2 and Smad4 in primary ovarian granulosa cells in rats(±s,n=3)
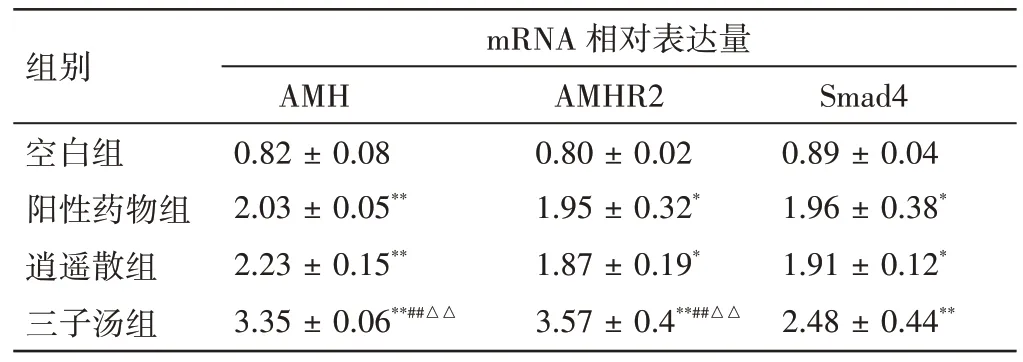
表4 各组含药血清对大鼠卵巢颗粒细胞AMH、AMHR2、Smad4 mRNA 表达的影响(±s,n=3)Table 4 Effects of drug-containing serum of each group on the mRNA expressions of AMH,AMHR2 and Smad4 in primary ovarian granulosa cells in rats(±s,n=3)
注:与空白组比较,*P<0.05,**P<0.01;与阳性药物组比较,##P<0.01;与逍遥散组比较,△△P<0.01
组别空白组阳性药物组逍遥散组三子汤组mRNA 相对表达量Smad4 0.89 ± 0.04 1.96 ± 0.38*1.91 ± 0.12*2.48 ± 0.44**AMH 0.82 ± 0.08 2.03 ± 0.05**2.23 ± 0.15**3.35 ± 0.06**##△△AMHR2 0.80 ± 0.02 1.95 ± 0.32*1.87 ± 0.19*3.57 ± 0.4**##△△
3 讨论
卵泡是卵巢的功能单位,卵巢颗粒细胞是卵泡外层最丰富的细胞,是卵泡内主要的功能细胞之一,卵泡发育和闭锁受到复杂的基因网络的严格调控,颗粒细胞在卵泡发育过程中有重要作用[17]。颗粒细胞的增殖与分化,可以促进卵泡的生长和发育,颗粒细胞可通过旁分泌/自分泌作用,为卵母细胞成熟创造有利的微环境,帮助卵母细胞摄取小分子代谢底物,同时参与调节卵母细胞的成熟分裂[18-21]。颗粒细胞的凋亡和退化是导致卵泡闭锁的重要原因,卵母细胞退化可发生在卵泡闭锁的任何阶段[22]。卵母细胞是女性生殖的重要组成部分,其生长发育也与颗粒细胞密切相关[23]。体外培养卵母细胞时,保留颗粒细胞能促进更多的卵母细胞发育成熟,且生长率远远高于无颗粒细胞包裹的卵母细胞[24],此结果表明卵母细胞的生长需要特异性地与颗粒细胞接触。
许多研究[25-28]表明,TGF-β 超家族成员在早期卵泡发育、颗粒细胞增殖和分化中发挥重要作用,同时TGF-β 超家族成员引起的信号转导能调控卵泡的生长发育。AMH 是一种由小窦卵泡颗粒细胞分泌的二聚体糖蛋白,是TGF-β 超家族的成员之一[29-30],AMH 抑制窦状卵泡的发育,在卵泡成熟和发育过程中具有十分重要的作用[31]。AMH 在卵巢中起到平衡生长卵泡过度募集的作用,防止卵泡储备过早耗尽,调控卵泡生长发育、促进优势卵泡成熟并排出,通过自/旁分泌调节颗粒细胞的增殖分化[32],是评估卵巢反应性和储备功能的标志[33]。有实验研究[34]表明沉默体外培养的小鼠卵巢颗粒细胞的AMH 基因后,发现颗粒细胞的增殖降低,细胞凋亡明显增加,细胞周期阻滞在G1 期。AMHR2 是一种跨膜糖蛋白,是AMH 的特异性受体,主要分布于细胞膜,在卵巢中主要分布于颗粒细胞表面,AMH 调控卵泡发育与成熟主要通过与其受体结合而发挥作用[35-36]。TGF-β/Smad 通路是调控颗粒细胞增殖的重要信号通路,Smad4 是该信号通路的核心下游信号转导分子,是超家族信号由胞质传递至胞核的必需因子。Smad4和Smad4 依赖性TGF-β 信号通路已经被证实与卵泡发育有关,尤其与卵泡闭锁关系密切[37-38], Smad4 减少会降低颗粒细胞的增殖潜能并导致细胞凋亡,导致滤泡萎缩[39-40]。实验研究[41]表明沉默颗粒细胞的Smad4 可以明显抑制颗粒细胞增殖,阻滞细胞周期进程,Smad4 的正常表达是颗粒细胞顺利通过G1/S 检验点的必要条件,Smad4 表达下降,将导致颗粒细胞的多种周期基因不能正常表达,从而阻滞细胞周期进程,抑制颗粒细胞增殖。
祖国医学并无“卵泡发育异常”的病名记载,根据其临床表现可将其归属于中医月经后期、月经量少、闭经、不孕等范畴。肾为先天之本,元气之根,既藏先天之精,又藏后天之精,为生殖发育之源,肾之精气阴阳是卵泡生长发育的基本物质与动力。肝藏血,主疏泄,是调节女性生殖的主要枢纽。女子以血为本,卵泡发育成熟也离不开肝血的濡养,肾精能生血,血能养精,精血同源互化,共同促进卵泡发育成熟。逍遥散出自宋《太平惠民和剂局方》,是临床治疗月经病、不孕症等妇科疾病的常用方,被叶天士称赞为“女科圣药”,方由柴胡、当归、白芍、白术、茯苓、生姜、薄荷、甘草组成,诸药合用,可使肝郁得疏,血虚得养,脾弱得复,气血兼顾,肝脾同调,以达肝经、冲任气血调畅之功。三子汤为全国名中医尤昭玲教授的自拟经验方,方由菟丝子、覆盆子、桑葚子、生地黄、熟地黄、北沙参、麦冬、炙甘草等组成,全方相合,肾肝脾同补,护卵养泡以助孕。夏冰等[42]实验研究表明补肾调冲方含药血清能促使颗粒细胞由G0/G1 期向S 期转化,从而促进颗粒细胞的增殖,增强甾体激素的分泌功能。有动物实验研究[12]表明补肾调经方、逍遥丸通过影响促排卵小鼠排卵前卵巢卵母细胞分泌因子GDF-9、BMP-15 mRNA 及蛋白的表达,促进卵泡颗粒细胞增殖、卵丘扩散、卵母细胞成熟,进而诱发排卵;范丽洁[43]用逍遥丸和补肾调经方体外培养小鼠卵母细胞,发现逍遥丸可通过上调GDF-9Ⅱ型受体蛋白表达来调控卵泡发育,补肾调经方可通过调控SmadsⅠ型受体蛋白表达影响下游信号分子来调控卵泡发育。上述大量研究从动物、颗粒细胞、卵母细胞不同层面,不同分子信号转导路径,不同实验方法多方面验证了补肾疏肝可以促进卵泡发育成熟。本研究以大鼠原代卵巢颗粒细胞为载体,深入探讨补肾调泡周期疗法组方促进卵泡发育与颗粒细胞增殖、甾体激素分泌以及与AMH、AMHR2、Smad4 之间可能的关系,进一步阐释其可能的分子生物学机制。
本实验初步筛选了补肾调泡周期疗法组方逍遥散、三子汤含药血清的最佳干预浓度、促进颗粒细胞增殖启动时间,初步证实逍遥散、三子汤含药血清均能促进大鼠原代卵巢颗粒细胞增殖,作用明显优于阳性药物(FSH)组,其中三子汤组作用最佳,逍遥散次之,并与干预时间呈正相关性。ELISA 实验结果表明逍遥散、三子汤均能促进卵巢颗粒细胞对AMH、E2、P 的合成与分泌,其中促进AMH 和E2合成与分泌作用与阳性药物效果相当。Western Blot 及PCR 检测结果表明,逍遥散、三子汤均可上调大鼠原代卵巢颗粒细胞AMH、AMHR2、Smad4 蛋白及mRNA 表达,其中三子汤组AMH、AMHR2 mRNA表达水平明显高于阳性药物(FSH)组与逍遥散组;除阳性对照组AMHR2 蛋白表达明显外,其余各组作用与阳性药物组相当。
综上所述,补肾调泡周期疗法组方逍遥散、三子汤能促进大鼠原代卵巢颗粒细胞增殖并与干预时间呈正相关性,促进颗粒细胞分泌甾体激素和AMH,并可能通过上调AMH、AMHR2、Smad4 蛋白及mRNA 表达,促进卵泡发育和成熟。此为项目组进一步开展补肾调泡周期疗法对“卵泡发育异常”调控机制及量效关系研究提供了实验依据。
