以甘草酸为稳定剂的姜黄素-水飞蓟宾共载纳米混悬剂的制备及体外评价
2023-08-03罗开沛严春梅李秋霞李芝蓓施明毅李小芳
罗开沛,严春梅,杨 露,古 环,李秋霞,李芝蓓,施明毅,李小芳∗
以甘草酸为稳定剂的姜黄素-水飞蓟宾共载纳米混悬剂的制备及体外评价
罗开沛1,严春梅1,杨 露2,古 环1,李秋霞1,李芝蓓1,施明毅3∗,李小芳1∗
1. 成都中医药大学药学院西南特色中药资源国家重点实验室,四川 成都 611137 2. 成都中医药大学中医药创新研究院,四川 成都 611137 3. 成都中医药大学智能医学学院,四川 成都 611137
以甘草酸为稳定剂制备新型姜黄素-水飞蓟宾共载纳米给药系统,研究其制剂学性质和稳定机制。采用简易的反溶剂沉淀法制备姜黄素-水飞蓟宾共载纳米混悬剂(curcumin and silybin co-loaded nanosuspension,Cur&Sil-Np),以稳定剂质量浓度、药物质量浓度、稳定剂与药物的比例以及搅拌速度为考察因素,以平均粒径和多分散系数(polydispersity index,PDI)为指标,采用单因素实验优化处方工艺。利用动态光散射法和透射电子显微镜表征Cur&Sil-Np的粒径、分布和形态。为提高Cur&Sil-Np的稳定性,以3%甘露醇为冻干保护剂,通过冷冻干燥法将Cur&Sil-Np制成冻干粉。采用差示扫描量热法和X射线衍射法分析冻干粉中药物的晶型。进一步评价Cur&Sil-Np的体外释放特性和稳定机制。最优处方工艺为甘草酸质量浓度1.5 mg/mL,药物质量浓度8 mg/mL,药物与稳定剂的比例5∶3,搅拌转速600 r/min。制备的Cur&Sil-Np的平均粒径为(226.5±11.1)nm,PDI为0.038±0.021,呈均一的圆球形;制备成纳米混悬剂后,药物的晶型发生了改变;体外释放结果显示,Cur&Sil-Np可分别将姜黄素和水飞蓟宾的体外累积溶出率从游离药物的23.3%和15.1%提高至82.7%和70.9%。稳定机制研究发现,静电斥力是甘草酸稳定Cur&Sil-Np的机制之一。天然表面活性剂甘草酸稳定的Cur&Sil-Np制备工艺简便可行、制剂性质良好、释药快速,是一种潜在的新型给药系统。
姜黄素;水飞蓟宾;共载纳米混悬剂;甘草酸;天然稳定剂;溶出度;稳定机制
姜黄素是从中药姜黄、莪术等分离的一种多酚类化合物,在关节炎、神经退行性疾病、肥胖症和癌症等疾病中有所应用[1],并已被美国国立肿瘤研究所列为第3代抗癌药物[2]。水飞蓟宾为菊科植物水飞蓟的有效成分,具有肝保护、抗氧化、抗炎、抗糖尿和抗肿瘤等多种生物学活性[3]。研究表明,姜黄素联合水飞蓟宾能协同发挥治疗作用,如抑制结直肠癌[4]和乳腺癌[5-6]的增殖,防止肠息肉的形成[7],抗耐药菌[8]等。然而,二者均存在溶解性差、溶出速率慢、生物利用度低等缺点[9-10],限制了其开发应用。
纳米混悬剂(nanosuspension)是由稳定剂如表面活性剂或聚合物制备的亚微米体系,具有载药量高、制备简易、适用范围广等优点[11-12]。由于合成稳定剂的长期使用会对人体产生副作用,因此,挖掘毒性低、生物相容性好的天然稳定剂成为研究热点[13]。甘草酸,是中药“国老”甘草的主要药效成分,具有表面活性剂特性,能够在水溶液中自发形成胶束而对难溶性成分进行增溶[14-15]。除了作辅料外,甘草酸还具有促进药物吸收、减少化疗毒副作用和逆转耐药等作用[16]。因此,将甘草酸用于制剂的构建,体现了中药制剂“药辅合一”的特色。课题组前期以甘草酸为稳定剂成功制备了水飞蓟素纳米混悬剂[17]、葛根素纳米乳[18]和黄芩苷固体纳米晶体[19],显著提高了难溶性药物的溶出度。目前,甘草酸作为天然稳定剂多用于单一药物的增溶,而制备荷载2种药物的纳米混悬剂却鲜有报道,值得进一步研究。
为了解决姜黄素和水飞蓟宾直接应用的局限,同时探索天然表面活性剂甘草酸制备双药纳米混悬剂的潜力,本研究以甘草酸替代传统稳定剂,制备姜黄素和水飞蓟宾共载纳米混悬剂(curcumin and silybin co-loaded nanosuspension,Cur&Sil-Np),筛选其最佳处方和制备工艺,评价其制剂学性质,并探究其稳定机制。
1 仪器与材料
Agilent1200型高效液相色谱仪,美国Agilent公司;Nicomp 380 ZLS Zeta型电位/粒度仪,美国PSS公司;RC-3型溶出度测试仪,济南欧莱博生物科技有限公司;SJIA-10N-50型冷冻干燥机,宁波市双嘉仪器有限公司;MS-280-H型磁力搅拌器,杭州旌斐仪器科技有限公司;TGA-21型高速冷冻离心机,四川蜀科仪器有限公司;SuPerMax3100型多功能酶标仪,上海闪谱生物科技有限公司;DDS-11C型电导率仪,上海仪电科学仪器股份有限公司;STD650型同步综合热分析仪,美国TA公司;Bruker D8型X射线衍射仪,德国布鲁克公司;JEM-2100F型透射电子显微镜,日本电子株式会社。
甘草酸,批号20210302,质量分数98%,西安格林生物科技有限责任公司;姜黄素,批号O0904A,质量分数97%,深圳市浩博世纪生物有限公司;水飞蓟宾,批号S0916B,质量分数97%,大连美仑生物技术有限公司;对照品姜黄素(批号MUST-22022111,质量分数98.88%)、水飞蓟宾(批号MUST-21031607,质量分数98.95%),成都曼斯特生物科技有限公司;氯化钠,分析纯,重庆茂业化学试剂有限公司;盐酸,分析纯,四川西陇科学有限公司。
2 方法与结果
2.1 Cur&Sil-Np的制备及粒径测定
称取稳定剂甘草酸15.00 mg溶于去离子水中,制得稳定剂溶液。称取姜黄素10.80 mg和水飞蓟宾14.18 mg(参考文献报道[6,20],设定药物物质的量比1∶1),溶于适量乙醇溶液中,制得药物溶液。稳定剂溶液在25 ℃、适宜转速条件下搅拌,缓慢加入药物溶液直至加完,持续搅拌1 min,减压蒸发挥去乙醇,即得Cur&Sil-Np。将Cur&Sil-Np用去离子水稀释,利用激光粒度仪测定其粒径和多分散系数(polydispersity index,PDI)。
2.2 Cur&Sil-Np处方工艺单因素考察
2.2.1 稳定剂甘草酸质量浓度的考察 固定药物与稳定剂甘草酸比例为5∶3,搅拌转速600 r/min,设置稳定剂甘草酸质量浓度为0.5、1.0、1.5、2.0、2.5 mg/mL,考察稳定剂甘草酸质量浓度对Cur&Sil-Np粒径和PDI的影响,结果见表1。随着稳定剂甘草酸质量浓度的增加,Cur&Sil-Np的粒径和PDI呈先降低后增加的趋势。当稳定剂甘草酸的质量浓度为1.5 mg/mL时,平均粒径及PDI较小。因此,选择1.5 mg/mL为制备Cur&Sil-Np的稳定剂甘草酸质量浓度。
2.2.2 药物质量浓度的考察 固定药物与稳定剂比例为5∶3,稳定剂甘草酸质量浓度为1.5 mg/mL,搅拌转速为600 r/min,设置药物质量浓度分别为4、6、8、10 mg/mL,考察药物质量浓度对Cur&Sil-Np粒径和PDI的影响,结果见表2。随着药物质量浓度的增加,Cur&Sil-Np的粒径和PDI呈先降低后增加的趋势。当药物质量浓度为8 mg/mL时,平均粒径及PDI较小。因此,选择8 mg/mL为制备Cur& Sil-Np的药物质量浓度。

表1 稳定剂甘草酸质量浓度对Cur&Sil-Np平均粒径和PDI的影响(, n = 3)

表2 药物质量浓度对Cur&Sil-Np平均粒径和PDI的影响(, n = 3)
2.2.3 药物与稳定剂甘草酸比例的考察 固定药物质量浓度为8 mg/mL,搅拌转速600 r/min,稳定剂甘草酸质量浓度为1.5 mg/mL,设置药物与稳定剂甘草酸比例为5∶4、10∶7、5∶3、2∶1、5∶2,考察药物与稳定剂比例对Cur&Sil-Np粒径和PDI的影响,结果见表3。当药物和稳定剂比例为5∶3时,Cur&Sil-Np的平均粒径及PDI较小。因此,以药物与稳定剂比例5∶3制备Cur&Sil-Np。

表3 药物与稳定剂甘草酸的比例对Cur&Sil-Np平均粒径和PDI的影响(, n = 3)
2.2.4 搅拌速度的考察 固定药物质量浓度为8 mg/mL,药物与稳定剂比例为5∶3,稳定剂甘草酸质量浓度为1.5 mg/mL,搅拌转速为400、600、800、1000 r/min,考察搅拌转速对Cur&Sil-Np粒径和PDI的影响,结果见表4。转速为400、600 r/min时,Cur&Sil-Np的平均粒径和PDI接近,但转速较小会延长稳定剂溶解和混悬剂形成时间,导致制备效率低,故选择600 r/min为制备Cur&Sil-Np的搅拌速度。
2.2.5 验证试验 称取甘草酸15.00 mg溶于10 mL去离子水中,制得稳定剂甘草酸溶液。称取姜黄素10.80 mg和水飞蓟宾14.18 mg,溶于适量乙醇溶液中,得到8 mg/mL药物溶液。在25 ℃、600 r/min磁力搅拌条件下,将药物溶液缓慢滴加到稳定剂溶液中,混合均匀,持续搅拌1 min,减压蒸发挥去乙醇,即得。平行制备3批样品。利用动态光散射(dynamic light scattering,DLS)测定样品的平均粒径和PDI,结果见表5和图1。Cur&Sil-Np的粒径在140~300 nm,平均粒径为(226.5±11.1)nm,PDI为0.038±0.021,ζ电位为(−25.4±1.6)mV。3批Cur&Sil-Np的平均粒径和PDI接近,表明该处方工艺重复性较好,可用于Cur&Sil-Np的制备。

表4 搅拌速度对Cur&Sil-Np平均粒径和PDI的影响(, n = 3)
2.3 外观形态观察
采用透射电子显微镜(transmission electron microscope,TEM)观察Cur&Sil-Np的形态和大小。将Cur&Sil-Np溶液滴于含有碳膜的铜网上,静置5 min,干燥后观察,结果见图2。Cur&Sil-Np呈光滑的圆球形,分布较为均匀,粒径为200~250 nm,与DLS结果基本一致。

表5 Cur&Sil-Np最佳工艺条件验证(, n = 3)

图1 Cur&Sil-Np的粒径分布
图2 Cur&Sil-Np的TEM图
Fig. 2 TEM image of Cur&Sil-Np
2.4 Cur&Sil-Np冻干粉的制备
为了便于纳米混悬剂的贮存和运输,通常采用固化的方式提高其稳定性。通过冷冻干燥法固化Cur&Sil-Np,考察冻干保护剂用量对于冻干后粒径和PDI的影响。以再分散系数(redispersibility index,RDI)和PDI为冻干粉再分散性的评价指标,其中RDI的计算公式为RDI=冻干再分散后的粒径/冻干前的粒径,RDI越接近1,表明冻干后“固化损伤”越小。Cur&Sil-Np冻干前、后的外观见图3,实验结果见表6。如图3所示,Cur&Sil-Np冻干前为带有乳光的黄色透明溶液,冻干后为蓬松、均匀、细腻的黄色粉末。如表6所示,无冻干保护剂时,Cur&Sil-Np的粒径增加最多。冻干保护剂用量的不同,复溶后的平均粒径和PDI也有所变化,其中,以3%甘露醇作为冻干保护剂时,RDI最接近1,且PDI值最小。故最佳冻干工艺为Cur&Sil-Np中加入3%甘露醇,−80 ℃冰箱预冻24 h,再置于冷冻干燥机中干燥48 h,即得冻干粉。
2.5 冻干粉的表征
2.5.1 差示扫描量热(differential scanning calorimetry,DSC)分析 为考察Cur&Sil-Np中药物的结晶状态,对姜黄素原料药、水飞蓟宾原料药、甘草酸原料药、物理混合物(姜黄素+水飞蓟宾+甘草酸,取处方量的甘草酸、姜黄素和水飞蓟宾直接混合均匀,即得)和Cur&Sil-Np冻干粉进行DSC分析。

图3 Cur&Sil-Np (A) 及其冻干粉(B) 的外观

表6 Cur&Sil-Np冻干前、后的平均粒径、PDI和RDI(, n = 3)
测定参数:升温速率10 ℃/min,升温范围35~350 ℃,空铝盘作为空白对照,测定载气为氮气,氮气体积流量50 mL/min,结果见图4。由图4可知,甘草酸在290 ℃附近存在微弱的放热峰;水飞蓟宾分别在168 ℃和300 ℃附近有放热峰和吸热峰;姜黄素在180 ℃附近出现放热峰;在物理混合物中仍然存在168 ℃和180 ℃附近的放热峰;而Cur&Sil-Np中仅存在168 ℃附近的放热峰,290 ℃的放热峰和300 ℃附近的吸热峰均消失,说明Cur&Sil-Np中姜黄素和水飞蓟宾的晶型均发生了改变。
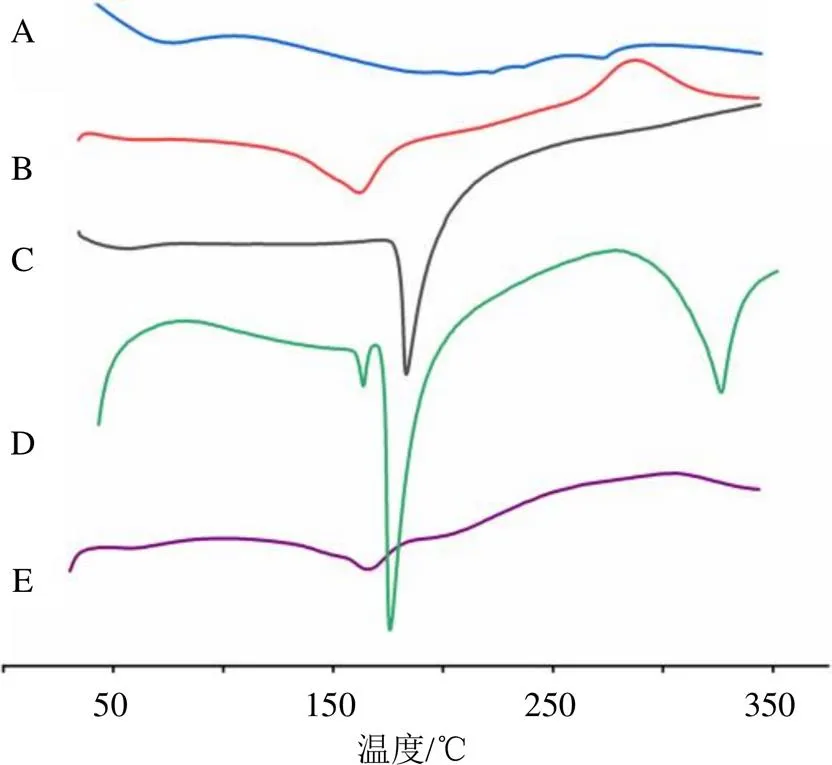
图4 甘草酸(A)、水飞蓟宾(B)、姜黄素(C)、物理混合物(D) 和Cur&Sil-Np冻干粉(E) 的DSC分析
2.5.2 X射线衍射(X-ray diffraction,XRD)分析 取适量姜黄素原料药、水飞蓟宾原料药、甘草酸原料药、物理混合物和Cur&Sil-Np冻干粉,利用X射线衍射仪进行衍射图谱分析。
分析参数:工作电流40 mA,工作电压40 kV,扫描范围5°~50°,步长0.02°,扫描速率3°/min,结果见图5。姜黄素和水飞蓟宾分别在5°~30°和10°~30°出现很强的特征晶体衍射峰,可见姜黄素原料药和水飞蓟宾原料药均以结晶态形式存在;甘草酸原料药有微弱的衍射峰,说明甘草酸原料药为晶体结构;在物理混合物中,姜黄素及水飞蓟宾晶体特征仍存在;而在Cur&Sil-Np中,尽管存在药物的部分衍射特征峰,但其强度明显减弱、消失或增强,推测姜黄素和水飞蓟宾在制备成Cur&Sil-Np后,药物晶型发生了变化。

图5 甘草酸(A)、水飞蓟宾(B)、姜黄素(C)、物理混合物(D) 和Cur&Sil-Np冻干粉(E) 的XRD分析
2.6 体外释放测定
2.6.1 对照品溶液制备 精密称取姜黄素对照品5.09 mg,水飞蓟宾对照品2.53 mg,加3 mL甲醇溶解,定容至25 mL量瓶中,混匀即得混合对照品储备液(姜黄素203.6 μg/mL、水飞蓟宾101.2 μg/mL)。
2.6.2 供试品溶液制备 取0.125 mL Cur&Sil-Np置于25 mL量瓶中,加适量甲醇超声溶解定容。取上述溶液1 mL置于10 mL量瓶中,甲醇定容,混匀,即得供试品溶液。
2.6.3 色谱条件
(1)水飞蓟宾色谱条件:色谱柱为Diomomsil C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇-乙腈-1%冰乙酸水溶液(40.4∶9.6∶50);体积流量为0.8 mL/min;进样量为10 μL;柱温为30 ℃;检测波长为287 mm。色谱图见图6,图中显示2个特征峰,这是由于水飞蓟宾存在非对映异构体。
(2)姜黄素色谱条件:流动相为乙腈-0.5%冰乙酸水溶液(52∶48);检测波长为430 mm,其余同水飞蓟宾。色谱图见图7。
2.6.4 线性关系考察 精密吸取混合对照品溶液,用流动相稀释,得到水飞蓟宾质量浓度分别为0.26、0.51、1.02、2.56、12.78、30.66、40.88 μg/mL,姜黄素质量浓度为0.51、1.02、2.04、5.09、25.45、61.08、81.44 μg/mL的系列对照品溶液。经HPLC检测,以峰面积()对药物质量浓度()进行线性回归,得回归方程:水飞蓟宾=34.92+30.249,2=0.999 1;姜黄素=103.54+35.416,2=0.999 1;结果显示,水飞蓟宾在0.26~40.88 μg/mL,姜黄素在0.51~81.44 μg/mL线性关系良好。

图6 阴性样品(A)、水飞蓟宾对照品(B)和Cur&Sil-Np样品(C)的HPLC图

图7 阴性样品(A)、姜黄素对照品(B)和Cur&Sil-Np样品(C)的HPLC图
2.6.5 精密度考察 取混合对照品溶液,滤膜滤过,滤液置于进样瓶中,连续进样6次,记录水飞蓟宾和姜黄素峰面积,计算其RSD分别为0.48%和0.64%,表明仪器精密度良好。
2.6.6 稳定性考察 取供试品溶液,滤膜滤过,滤液置于进样瓶中,分别于制备后0、3、6、9、12、24 h进样,HPLC测定,水飞蓟宾和姜黄素的RSD分别为0.50%和0.67%,表明供试品溶液在24 h内稳定性良好。
2.6.7 重复性考察 取适量Cur&Sil-Np,分别制备6份供试品溶液,HPLC测定,水飞蓟宾和姜黄素的RSD分别为1.28%和0.73%,表明该方法的重复性良好。
2.6.8 加样回收率试验 取适量Cur&Sil-Np,制备6份供试品溶液,分别加入已测定质量浓度的混合对照品溶液,HPLC测定,水飞蓟宾和姜黄素的平均加样回收率分别为101.27%、100.44%,RSD分别为3.04%、0.68%,表明该方法回收率较好。
2.6.9 体外释放实验 称取游离姜黄素、游离水飞蓟宾和Cur&Sil-Np冻干粉,分别置于250 mL释放介质(0.1%聚山梨酯-80的中性磷酸盐缓冲液)中,设置溶出装置的转速为75 r/min,温度为37.0 ℃,分别于预定时间点取样1 mL,并立即补足等量介质,取出样品按“2.6.3”项下色谱条件进行测定,计算不同时间的累积释放率,结果见图8。在120 min时,游离姜黄素和游离水飞蓟宾累积释放率分别为23.3%和15.1%;而在Cur&Sil-Np中,姜黄素和水飞蓟宾累积释放率分别达到82.7%和70.9%,二者的累积溶出度显著提高(<0.05)。
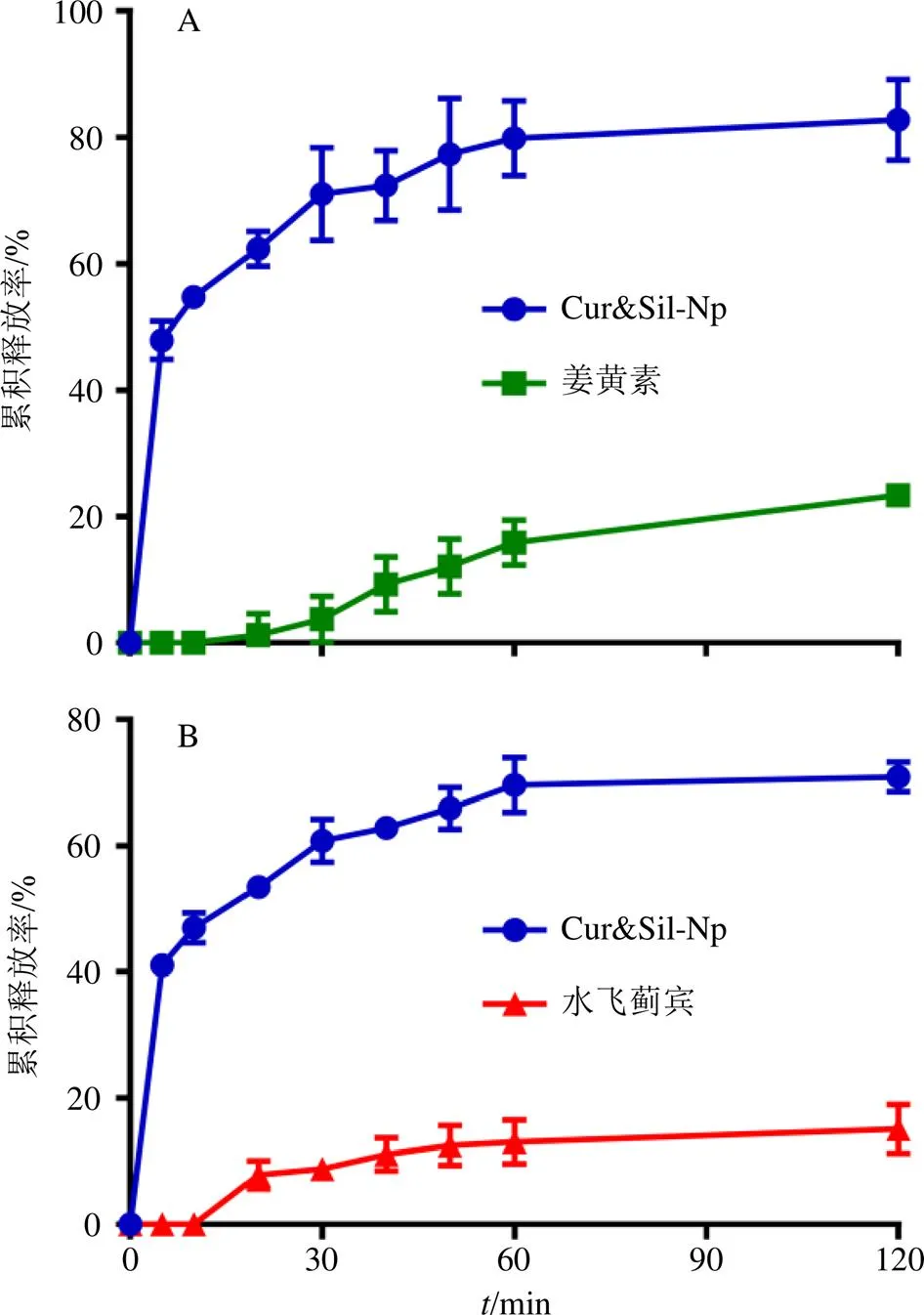
图8 姜黄素(A)和水飞蓟宾(B)的体外释放曲线(, n = 3)
2.7 稳定性影响因素
2.7.1 pH值的影响 按照最佳处方工艺制备Cur& Sil-Np,用稀氢氧化钠或稀盐酸调整pH值分别为3、4、5、6、7,观察其现象,测定平均粒径和PDI,结果见图9和表7。
如图9所示,当pH值为3~6时,Cur&Sil-Np仍呈黄色乳光,而当pH值为7时,制剂为橙色,出现悬浮颗粒,并且过滤膜后药物几乎全部被滤膜截留,滤液呈透明淡黄色,无乳光。以上结果提示,pH≥7时Cur&Sil-Np性质不稳定。

图9 pH值对Cur&Sil-Np稳定性的影响

表7 pH值对Cur&Sil-Np的平均粒径和PDI的影响(, n = 3)
如表7所示,当pH值为3~6时,随着pH值的增大,Cur&Sil-Np的粒径呈现增大趋势,而当pH值为7时,Cur&Sil-Np发生浑浊,出现沉淀,无法测得粒径和PDI,这意味着Cur&Sil-Np在此条件下不稳定。究其原因,一般来说,如果粒径随着体系pH值变化而改变,那么静电作用则是稳定纳米结构的主要机制[21-22]。
具体而言,甘草酸中的3个羧基(pa1=3.98、pa2=4.59、pa3=5.15),以及姜黄素和水飞蓟宾中的酚羟基,使得体系性质呈酸性,而pH值的变化会影响甘草酸的质子化程度和电荷密度,从而破坏稳定保护层。因此,甘草酸的稳定机理与静电斥力有关。
2.7.2 离子强度的影响 稳定剂的静电作用还与离子强度(ionic strength,IS)因素密切相关。若离子强度对粒径没有变化,则说明无静电斥力的参与,反之亦然。按照最佳处方工艺制备Cur&Sil-Np,用氯化钠调节离子强度分别为0.01、0.02、0.03、0.04、0.05 mol/L,观察其现象,测定平均粒径和PDI,结果见图10和表8。
如图10所示,当IS≤0.03 mol/L时,Cur&Sil- Np仍具有乳光,而IS≥0.04 mol/L时,制剂颜色变深,药物悬浮于液体表面,过滤膜后药物大部分被截留,滤液无乳光。

图10 离子强度对Cur&Sil-Np稳定性的影响

表8 离子强度对Cur&Sil-Np的平均粒径和PDI的影响(, n = 3)
如表8所示,当离子强度为0.01~0.03 mol/L时,Cur&Sil-Np的粒径呈现递增趋势,而IS≥0.04 mol/L时,无法测得粒径和PDI,与外观现象一致。以上结果表明,Cur&Sil-Np的粒径随离子强度的变化而变化,这可能是由于离子强度会影响粒子周围双电极层的形成和厚度,进而影响纳米结构的形成,进一步证明了静电作用介导的稳定机制。
3 讨论
联合给药,又称“鸡尾酒”疗法,是临床疾病治疗的主要趋势,其目的是增强药物的治疗效果或减轻药物的毒副作用[23]。而联合用药的最佳比例是需面临的首要问题。目前,联合比例通常是通过细胞实验或动物实验筛选而得出[24-25]。
文献证实,姜黄素和水飞蓟宾物质的量比为1∶1时,能够起到协同增效的作用[6,20]。实际上,药物联用比例的不同,也会影响制剂的处方工艺[26]。前期预实验研究了姜黄素和水飞蓟宾物质的量比(4∶1、2∶1、1∶1、1∶2、1∶4)对共载纳米混悬剂制剂性质的影响。结果发现,当药物物质的量比不同时,Cur&Sil-Np的粒径和PDI也有所变化,但幅度不大,平均粒径在210~270 nm,PDI在0.054~0.137。因此,本研究根据文献报道的联用比例(姜黄素和水飞蓟宾物质的量比为1∶1)进行了后续处方工艺考察。
在前期预试验中,对天然稳定剂种类包括甘草酸、绞股蓝皂苷和茶皂素进行了考察。结果发现,以绞股蓝皂苷为稳定剂时,药物颗粒沉降,其原因可能是姜黄素和水飞蓟宾中的酚羟基在水中电离,使体系pH值约为4.5,而绞股蓝皂苷结构中存在羧基(pa≈3.25),此时体系的pH值与绞股蓝皂苷的pa接近,导致绞股蓝皂苷的质子化程度较高,难以提供良好的排斥稳定性[27]。而以甘草酸和茶皂素为稳定剂时,均能成功制备纳米混悬剂,两者的平均粒径较为接近,但甘草酸为稳定剂时的PDI较小,且ζ电位较高,提示Cur&Sil-Np的分布更均匀,性质更加稳定。因此,本实验选择甘草酸作为制备纳米混悬剂的稳定剂。
产业化是制药行业面临的关键问题。越简单的制备工艺,越能实现成果转化。反溶剂沉淀法、介质研磨法、沉淀法-高压均质法联合技术和沉淀法-高剪匀质法联合技术是纳米混悬剂制备的常用方法。其中,反溶剂沉淀法操作简便,无需昂贵、精密的制药设备,但存在纳米粒子粒径较大、分布较宽的问题[11],导致其单独应用受到限制。本实验通过该方法制备的Cur&Sil-Np,其粒径小于250 nm,PDI小于0.1,外观形态呈现圆整的球形,分布均一,有效避免了上述问题,兼顾了制备工艺简便、生产成本不高和成品性质良好等诸多优点,体现了“绿色制造”理念,易于实现工业化的大规模生产。
为便于制剂的贮存和运输,本实验采用冷冻干燥法进一步将纳米混悬剂制成固体粉末。利用差示扫描量热法和X射线衍射法对Cur&Sil-Np粉末中姜黄素和水飞蓟宾的晶体状态进行了分析。结果表明,2种药物的晶型均发生了一定程度的改变。体外释放结果发现,姜黄素和水飞蓟宾制备成纳米混悬剂后,120 min内累积溶出度显著提高,分别为游离姜黄素和游离水飞蓟宾的3.5倍和4.7倍。根据稳定机制考察结果可知,pH值和离子强度会影响Cur&Sil-Np的稳定性,其机制与静电作用有关。有文献报道,空间作用可能是甘草酸稳定作用的另一机制[28]。这是由于甘草酸的分子结构为两亲性,一方面,基于此结构对药物微粒的高亲和力,甘草酸可吸附于药物外层,另一方面,可通过分子间作用力形成网状结构,抑制纳米粒的团聚和沉降。但该机制是否真正参与了Cur&Sil-Np的形成,有待进一步探索。
总之,本研究提出了一种简单可行的策略,以甘草酸为天然稳定剂制备了负载2种药物的纳米混悬剂。Cur&Sil-Np具有较小的粒径、均匀的分布和快速的释药特性,为其他中药组分纳米混悬剂的制备提供了示范,同时拓展了甘草酸的应用。然而,与传统稳定剂相比,甘草酸作为“辅料”是否影响姜黄素和水飞蓟宾的药动学性质,甘草酸是否还存在其他稳定机制,以及甘草酸作为“药物”能否与姜黄素和水飞蓟宾产生协同治疗作用等系列问题,还需进一步的研究。
利益冲突 所有作者均声明不存在利益冲突
[1] Obeid M A, Alsaadi M, Aljabali A A. Recent updates in curcumin delivery [J]., 2023, 33(1): 53-64.
[2] Zoi V, Galani V, Lianos G D,. The role of curcumin in cancer treatment [J]., 2021, 9(9): 1086.
[3] Ashrafizadeh M, Ahmadi Z, Mohammadinejad R,. Nano-soldiers ameliorate silibinin delivery: A review study [J]., 2020, 17(1): 15-22.
[4] Sayyed A, Ezekiel U. Anticancer activity of curcumin and curcumin degradation products in combination with silibinin [J]., 2020, 34(S1): 1.
[5] 沈君怡. 水飞蓟宾与姜黄素共载口服纳米粒的构建及体内外性质评价 [D]. 上海: 上海中医药大学, 2020.
[6] Nasiri M, Zarghami N, Koshki K N,. Curcumin and silibinin inhibit telomerase expression in T47D human breast cancer cells [J]., 2013, 14(6): 3449-3453.
[7] Alfonso-Moreno V, López-Serrano A, Moreno-Osset E. Chemoprevention of polyp recurrence with curcumin followed by silibinin in a case of multiple colorectal adenomas [J]., 2017, 109(12): 875.
[8] Omer F H, Al-Khafaji N S K, Al-Alaq F T,. Synergistic effects of silybin and curcumin on virulence and carbapenemase genes expression in multidrug resistant[J]., 2022, 15(1): 330.
[9] Pan-On S, Dilokthornsakul P, Tiyaboonchai W. Trends in advanced oral drug delivery system for curcumin: A systematic review [J]., 2022, 348: 335-345.
[10] Takke A, Shende P. Nanotherapeutic silibinin: An insight of phytomedicine in healthcare reformation [J]., 2019, 21: 102057.
[11] 罗开沛, 李小芳, 罗佳, 等. 纳米混悬技术在中药制剂中的应用及发展趋势 [J]. 中草药, 2016, 47(6): 865-871.
[12] Singhal M, Baumgartner A, Turunen E,. Nanosuspensions of a poorly soluble investigational molecule ODM-106: Impact of milling bead diameter and stabilizer concentration [J]., 2020, 587: 119636.
[13] He W, Lu Y, Qi J P,. Food proteins as novel nanosuspension stabilizers for poorly water-soluble drugs [J]., 2013, 441(1/2): 269-278.
[14] Chen Y C, Liu Y, Xu J N,. A natural triterpenoid saponin as multifunctional stabilizer for drug nanosuspension powder [J]., 2017, 18(7): 2744-2753.
[15] Malamatari M, Somavarapu S, Taylor K M G,. Solidification of nanosuspensions for the production of solid oral dosage forms and inhalable dry powders [J]., 2016, 13(3): 435-450.
[16] Su X T, Wu L, Hu M M,. Glycyrrhizic acid: A promising carrier material for anticancer therapy [J]., 2017, 95: 670-678.
[17] 唐海龙, 李小芳, 龙家英, 等. 以甘草酸为稳定剂制备水飞蓟素纳米混悬剂及稳定机制研究 [J]. 中草药, 2020, 51(4): 971-977.
[18] 张琳琳, 李小芳, 谢龙, 等. 星点设计-效应面法优化基于甘草酸的葛根素纳米乳及其体外释放研究 [J]. 中草药, 2020, 51(12): 3180-3186.
[19] 刘罗娜, 李小芳, 仲粒, 等. 以甘草酸为稳定剂制备黄芩苷固体纳米晶体 [J]. 中草药, 2019, 50(9): 2057-2064.
[20] Liu Y, Shen J Y, Shi J P,. Functional polymeric core-shell hybrid nanoparticles overcome intestinal barriers and inhibit breast cancer metastasis [J]., 2022, 427: 131742.
[21] 龙家英, 李小芳, 王娴, 等. 茶皂素用于稳定橙皮苷纳米混悬剂及其机制研究 [J]. 药学学报, 2021, 56(11): 3159-3165.
[22] 耿宇婷, 张晓雪, 康荷笛, 等. 甘草次酸修饰细菌纤维素包载紫杉醇口服胶束的构建与评价 [J]. 中草药, 2022, 53(20): 6451-6461.
[23] Hu Q Y, Sun W J, Wang C,. Recent advances of cocktail chemotherapy by combination drug delivery systems [J]., 2016, 98: 19-34.
[24] Huo M R, Wang H L, Zhang Y,. Co-delivery of silybin and paclitaxel by dextran-based nanoparticles for effective anti-tumor treatment through chemotherapy sensitization and microenvironment modulation [J]., 2020, 321: 198-210.
[25] Sun D D, Zou Y F, Song L,. A cyclodextrin-based nanoformulation achieves co-delivery of ginsenoside Rg3and quercetin for chemo-immunotherapy in colorectal cancer [J]., 2022, 12(1): 378-393.
[26] Wang H, Wang S L, Wang R F,. Co-delivery of paclitaxel and melittin by glycopeptide-modified lipodisks for synergistic anti-glioma therapy [J]., 2019, 11(27): 13069-13077.
[27] Chen Z, Shu G F, Taarji N,. Gypenosides as natural emulsifiers for oil-in-water nanoemulsions loaded with astaxanthin: Insights of formulation, stability and release properties [J]., 2018, 261: 322-328.
[28] Ma Y, Gao Y X, Zhao X,. A natural triterpene saponin-based pickering emulsion [J]., 2018, 24(45): 11703-11710.
Preparation andevaluation of curcumin and silibinin co-loaded nanosuspension with glycyrrhizic acid as stabilizer
LUO Kai-pei1, YAN Chun-mei1, YANG Lu2, GU Huan1, LI Qiu-xia1, LI Zhi-bei1, SHI Ming-yi3, LI Xiao-fang1
1. State Key Laboratory of Southwestern Chinese Medicine Resources, School of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China 2. Innovative Institute of Chinese Medicine and Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China 3. School of Intelligent Medicine, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China
The nano-drug delivery system co-loaded with curcumin and silybin was prepared with glycyrrhizic acid as stabilizer as well as its pharmaceutical properties and stability mechanism were explored.A curcumin and silybin co-loaded nanosuspension (Cur&Sil-Np) was prepared by anti-solvent precipitation method. The mass concentration of stabilizer, drug concentration, proportion of stabilizer and drug, and stirring speed were used as investigative factors, while particle size and polydispersity index (PDI) were used as indicators. Based on above, the formulation and preparation process of Cur&Sil-Np were optimized by single factor test. Particle size, distribution, and morphology of Cur&Sil-Np were characterized by dynamic light scattering and transmission electron microscopy, respectively. To improve the stability of Cur&Sil-Np, Cur&Sil-Np was lyophilized by freeze-drying method with 3% mannitol as lyophilized protective agent. Both differential scanning calorimetry (DSC) and X-ray diffraction (XRD) were applied to analyze the crystal form of drugs in freeze-dried powder. The dissolution characteristics and stability mechanism of Cur&Sil-Np were further evaluated.The optimal process parameters were as follows: the mass concentration of glycyrrhizic acid was 1.5 mg/mL, the drug concentration was 8 mg/mL, the ratio of drug to stabilizer was 5:3, and the stirring speed was 600 r/min. The average particle size and PDI of Cur&Sil-Np were (226.5 ± 11.1) nm and 0.038 ± 0.021, respectively. Cur&Sil-Np presented a spherical shape with a uniform distribution. The crystal form of drugs in Cur&Sil-Np altered. The cumulative release of curcumin and silybin in Cur&Sil-Np was significantly increased from 23.3% and 15.1% of free drugs to 82.7% and 70.9%, respectively. Moreover, electrostatic repulsion was one of the stabilization mechanisms of Cur&Sil-Np stabilized by glycyrrhizic acid.Cur&Sil-Np stabilized by natural surfactant glycyrrhizic acid is a potential new drug delivery system with simple and feasible preparation process, good properties and rapid drug release.
curcumin; silybin; co-loaded nanosuspension; glycyrrhizic acid; natural stabilizer; dissolution rate; stabilization mechanism
R283.6
A
0253 - 2670(2023)15 - 4823 - 09
10.7501/j.issn.0253-2670.2023.15.007
2023-02-05
国家自然科学基金资助项目(82204633);中国博士后科学基金资助项目(2021M700550);四川省自然科学基金资助项目(2022NSFSC0634);四川省自然科学基金资助项目(2023NSFSC1782);四川省中医药管理局中医药科研专项(2020JC0038)
罗开沛,博士,讲师,从事中药纳米给药系统研究。E-mail: luokaipei@126.com
通信作者:施明毅,硕士,讲师,从事中药学、中药信息化教学及科研。E-mail: 394540370@qq.com
李小芳,教授,博士生导师,从事中药新制剂、新剂型、新技术研究。E-mail: lixiaofang@cdutcm.edu.cn
[责任编辑 郑礼胜]
