国内外混悬剂质量控制要求及建议
2019-05-23李雪洪建文
李雪,洪建文
(广东省药品检验所,广州 510663)
口服混悬剂系指难溶性固体原料药物均匀分散在液体介质中制成的供口服的混悬液体制剂。干混悬剂是将难溶性固体药物加入适宜的辅料制成颗粒或直接混粉,加入分散介质后分散相以微粒状态分散于分散介质中形成分散均匀的液体制剂,既解决了难溶性药物的溶解问题,又解决了液体制剂的稳定性问题。干混悬剂因其矫味、易服、易携带、稳定、制备方便等优点为国内外药剂工作者所喜好,尤其广泛用于儿童。本文通过对国内外药典和国内外产品质量情况的梳理分析,针对仿制混悬剂的质量与疗效一致性评价工作提出参考意见和建议。
1 各国药典中混悬剂的分类及相关规定
现行各国药典(中国药典、美国药典、欧洲/英国药典、日本药局方)均收载了混悬剂,各国药典中混悬剂的分类各不相同,且质量控制的要点也不相同,本文对各国药典干混悬剂进行了逐一梳理。各国混悬剂制剂通则要求详情见表1。
1.1 中国药典中混悬剂的分类及相关规定
中国药典中口服混悬剂系指难溶性固体原料药物分散在液体介质中制成的供口服的混悬液体制剂(通则0123),包括混悬液、干混悬剂及浓混悬液;有单剂量包装和多剂量包装两类。单剂量包装的干混悬剂应检查装量差异;多剂量包装的口服混悬液和干混悬剂应检查最低装量;干混悬剂应检查干燥失重,减失重量不得>2.0%。另外口服混悬剂除另有规定外,应检查沉降体积比。

表1 各国混悬剂制剂通则要求
中国药典收载了混悬颗粒(通则0104),系指难溶性原料药物与适宜辅料混合制成的颗粒剂,临用前加水或与其他适宜的液体振摇即可分散成混悬液[3]。其应符合颗粒剂(通则0104)项下的规定,应检查粒度。
1.2 美国药典中混悬剂的分类及相关规定
美国药典中混悬剂(<1151>Pharmaceutical dosage forms)系指固体颗粒分散在液相中的两相制剂,包含混悬液和干混悬剂。制成混悬剂的药物通常为难溶性原料药,或为了掩味和提高病人顺应性。混悬剂在制剂各论下未规定与剂型相关的检查项,但考虑到其在放置过程中会沉淀,可能会导致絮凝且搅拌后不能重新分散,采用触变性来计算其沉淀的趋势;且温度的变化会导致分散相粒径的变化,因此应考察温度的变化对制剂稳定性的影响。其规定多剂量包装中应加入抑菌剂[4]。
干混悬剂(Suspension for reconsitution)是固体粉末或颗粒混合物,在使用前需用水或其它稀释剂稀释。做成干混悬剂通常是由于原料药的化学或物理稳定性在效期内无法达到要求,为了延长效期制成干混悬剂,服用时需加分散介质稀释,并贮藏在冰箱中。美国药典中未收载混悬颗粒。
1.3 欧洲药典/英国药典中混悬剂的分类及相关规定
欧洲药典/英国药典中混悬剂归属于口服液体制剂(Monograph 0672 Liquid PREPARATIONS FOR ORAL USE),而干混悬剂既要符合粉末或颗粒的要求(powders and granules),又要符合口服液体制剂的要求[5-6]。但未明确规定需要检测哪些项目。
1.4 日本药局方中混悬剂的分类及规定
日本药局方中混悬剂系指活性成分均匀分散在介质中的口服液体制剂,包括混悬液和干混悬剂。混悬剂中通常加入助悬剂或其他辅料,通过合适的方法使其均匀混悬。除另有规定外,混悬剂应检查溶出度[7]。
2 国内外干混悬剂的比较
各国药典中均收载了干混悬剂各论及通则,通过对比发现同一品种的质量标准要求各不相同,主要在性状描述、项目的设置及检测方法、限度等方面有差异,本文以头孢克洛干混悬剂为例,通过对比其性状、处方工艺、质量控制、使用的差异及中国药典中干混悬剂存在的问题等方面来讨论各国药典对干混悬剂规定的优缺点。质量标准对比表见表2,各国橙皮书收载情况见表3。
2.1 性状

表2 各国药典中头孢克洛干混悬剂质量标准对比表

表3 头孢克洛干混悬剂美日橙皮书收载情况
中国药典2015年版中规定干混悬剂的性状为细小颗粒或粉末;USP40及BP2010未规定性状;JP16及BP2018中未收载干混悬剂。
2.2 处方工艺
通过FDA,EMC网站查阅头孢克洛干混悬剂说明书,根据其说明书中描述的辅料,发现其加入的辅料基本相同,规格上中国仅有单剂量包装,美国有单剂量和多剂量两种,欧洲为多剂量包装。详情见表4。
2.3 质量控制
2.3.1 含量测定
含量测定过程中,中国药典为称取部分固体,稀释后测定;USP则规定先将整瓶稀释,量取部分稀释后测定。患者在使用多剂量干混悬剂过程中也是先整瓶稀释,再量取部分服用,因此USP的检测方法与使用方法一致,更能体现患者在使用时每次服用的剂量是否均匀。而中国药典在取样时为固体,考虑取样均匀性的问题,可能造成结果偏高或偏低。

表4 国内外头孢克洛干混悬剂处方和规格对比表
2.3.2 沉降体积比
中国药典规定多剂量干混悬剂应检查体积比,而其他药典未规定该项目。
2.4 使用过程中的差异
根据查询国内头孢克洛干混悬剂的批准文号共有19个,规格有0.125g、0.25g、0.375g、0.75g和1.5g,其中包含苏州礼来的一个批准文号,规格为0.125g,商品名为希克劳。查询其说明书用法用量项,其成人为一次0.25g,一日3次;小儿按体重一日20~40mg/kg,分3次给予。
而查询FDA网站上的说明书,头孢克洛有单剂量和多剂量两种,一般成人使用单剂量包装,儿童使用多剂量包装,成人一般一次1~2包,儿童按体重给药,一般一次1/2杯/或1杯。其在用法上有差异,用量上基本一致。详情见表5,表6。
2.5 中国药典中干混悬剂存在的问题
2.5.1 干混悬剂与混悬颗粒[8]
中国药典制剂通则中收载了干混悬剂和混悬颗粒,干混悬剂属于混悬剂,应符合混悬剂项下要求,性状描述一般为颗粒或粉末,可制粒也可直接混粉,多剂量干混悬剂要求检查沉降体积比,以保证混悬剂的分散均匀性及物理稳定性;混悬颗粒属于颗粒剂,应符合颗粒剂项下要求,性状描述为颗粒,必需制粒(干法制粒或湿法制粒),应检查粒度。两种剂型在性状描述及工艺上有交叉,处方中加入的辅料不同,检查的项目中与剂型相关的检测项目不同,但两种剂型在加入分散介质混匀使用时均为混悬液,属于同一剂型,详情见表7。
由于制剂通则有交叉,中国药典个论中部分品种存在既有混悬颗粒又有干混悬剂,两种剂型加分散介质稀释后均为混悬液,但由于其归属于不同制剂通则,对其的质量控制要求也不相同。混悬颗粒需要检查粒度而无需检查沉降体积比;干混悬剂需要检测沉降体积比而无需检查粒度,造成同一剂型药物(使用剂型)质量控制要求不同。建议中国药典将混悬颗粒归为混悬剂,在混悬剂中性状描述为颗粒的增加粒度的检测,控制其物理稳定性,以保证产品的质量,从而保证给药剂量的准确性,详情见表8。
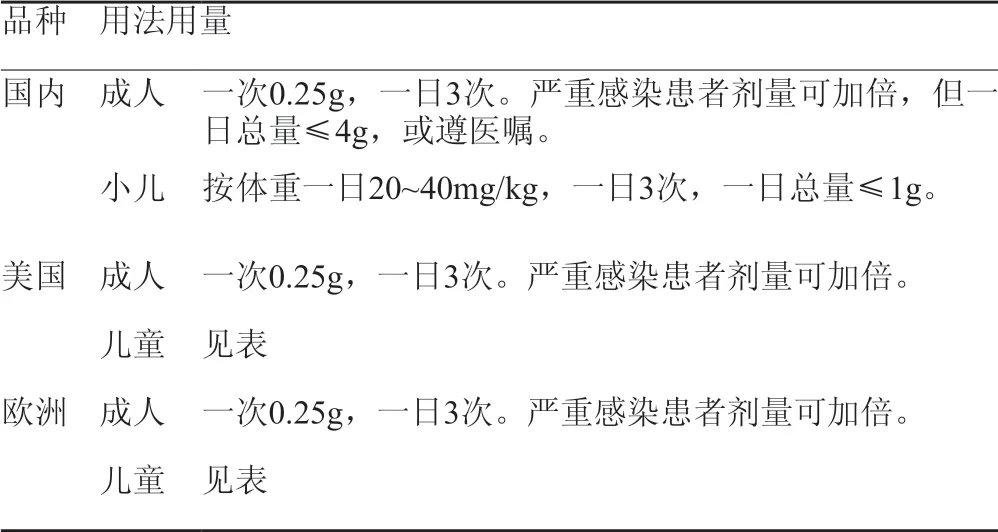
表5 国内外单剂量包装干混悬剂用法用量

表6 国外头孢克洛儿童用多剂量干混悬剂

表7 干混悬剂和混悬颗粒的对比
2.5.2 沉降体积比[9-10]
沉降体积比一般用来评价混悬剂的沉降稳定性及稳定剂的使用效果,检查该项目用以保证混悬剂的物理稳定性。《中国药典》要求“用具塞量筒量取供试品50mL,密塞,用力振摇1min,记下混悬物的开始高度H0,静置3h,记下混悬物的最终高度H,按下式计算:沉降体积比=H/H0;干混悬剂按各品种项下规定的比例加水,应均匀分散,并照上法检查沉降体积比,应符合规定。

表8 干混悬剂和混悬颗粒检测项目的对比
在实际操作中发现,振摇1min后,混悬物均匀分散,液面处存在许多泡沫,此时读数可能<50mL,静置3h后,泡沫消失,混悬物的最终高度可能高于开始高度,造成计算结果不准确,建议将混悬物的开始高度H0定为50mL,以便更准确的评价混悬液的稳定性。
干混悬剂由于沉降体积比未规定浓度,当浓度不同时,沉降速度不同,造成同一产品沉降体积比结果不同,因此建议干混悬剂按照服用方法加入规定量的稀释剂,以保证检测结果的稳定。
2.5.3 多剂量干混悬剂含量计算的问题[11]
由于多剂量干混悬剂主成分含量较高,含量测定时采用部分取样检测来计算整瓶的含量,容易造成取样不均匀而导致检测结果有偏差;而美国药典含量测定采用加入一定量溶剂将整瓶分散均匀后,精密量取一定体积稀释后测定,如此可以避免由于取样不均匀导致的检测结果偏差,也可以考察制成溶液后的均匀性,保证使用过程中的用量准确性。
2.5.4 标示量表达的格式
表达方式不统一,中国药典中部分品种以标示装量相对于主药标示量进行表达,部分品种只有主药标示量,如头孢拉定干混悬剂的规格表示为(1)0.125g (2)0.25g (3)1.5g (3)3.0g。如果生产厂家的处方、工艺是在《药品生产管理规范》的严格要求下进行的,那其产品无论是单剂量还是多剂量,均应标有标示装量和主药标示量,且生产企业在生产过程中应按此规格对产品进行质控,以确保处方、工艺的稳定、准确和可靠。
3 小结
仿制药是与被仿制药具有相同的活性成分、剂型、规格、给药途径和治疗作用的替代药品。通过对比国内外混悬剂,发现在剂型分类、质量要求、包装、规格及用法上国内外标准要求及产品均有差异,而国内企业在仿制过程中要达到与被仿制药生物等效,应注意以下几个问题。
3.1 仿制药再评价过程中参比制剂选择存在的问题
由于中国药典中干混悬剂和混悬颗粒在性状描述、制备工艺上有交叉,在国内药品质量和疗效一致性评价中企业在选择参比制剂时,出现拟评价药品与参比制剂剂型不同的情况,如阿奇霉素国内有颗粒和干混悬剂,企业备案的参比制剂为阿奇霉素干混悬剂、小儿用阿奇霉素细粒剂;阿莫西林克拉维酸钾颗粒、克拉霉素颗粒、头孢丙烯颗粒、头孢呋辛酯颗粒,由于国外无上述品种的颗粒剂,企业备案的参比制剂均为干混悬剂;阿莫西林颗粒,企业备案的参比制剂为颗粒、干混悬剂和细粒剂;头孢克洛颗粒,企业备案的参比制剂为颗粒、干混悬剂。
从企业备案情况看,主要情况是当国外无颗粒剂时,只能选择干混悬剂作为参比制剂。但由于中国药典中颗粒剂分为混悬颗粒和非混悬颗粒,当企业为非混悬颗粒时,选择干混悬剂为参比制剂,其处方工艺及质量质控的要求不同,选择其作为参比制剂需考虑是否科学合理。而当企业为混悬颗粒时,选择干混悬剂作为参比制剂,又需考虑是否需要将名称由颗粒剂改为干混悬剂。因此为了科学、合理、有效地管理混悬剂,建议将颗粒剂中混悬颗粒合并到混悬剂中,同时明确规定检测项目,如为颗粒状的干混悬剂,应控制粒度。如为多剂量干混悬剂,应控制沉降体积比。
3.2 处方工艺及规格合理性的问题
由于国外产品处方中使用的辅料在说明书上能够查到[12,13],国内企业可以以此为参考选择合适的辅料,因此发现国内外产品处方差异不大,但需关注相关辅料质量和功能性指标的差异。生产工艺方面则有一定差异,如国外产品多采用制粒工艺,性状多为颗粒,而国内许多产品采用直接混粉的工艺,性状多为粉末,在混合过程中由于原辅料粒径的差异,粉末的流动性不如颗粒,容易导致混合不均匀。建议企业在选定工艺时应充分考虑原料药的理化性质及用药目的,考察生产工艺对其稳定性、均匀性、溶出速率及对用药是否有影响。
用法方面由于国内外用药习惯的差异,其包装规格与国外相比差异较大,国内多采用单剂量包装,成人服用量一般为整包的倍数,儿童使用时多按体重给药,通常为1/2包或1/3包,且无量具测量,仅靠目测,造成给药的不准确。而国外儿童用药多为多剂量包装,整瓶溶解后用带刻度的小杯量取服用,给药的准确度高于国内的单剂量包装。建议企业对干混悬剂包装规格的合理性进行考察,如儿童用药,给药剂量与体重相关时,可采用多剂量包装,以便提高给药的准确性。
