四君子汤非多糖功效组分的体外人源肠、肝微粒体代谢研究
2023-08-03董邦健彭崇胜李晓波
沈 怡,马 萍,董邦健,彭崇胜,李晓波
四君子汤非多糖功效组分的体外人源肠、肝微粒体代谢研究
沈 怡,马 萍,董邦健,彭崇胜,李晓波*
上海交通大学药学院,上海 200240
对四君子汤非多糖组分的主要活性成分进行人源肠、肝微粒体中的代谢过程研究,明确其在肠、肝中的代谢轮廓及代谢差异,为其临床应用提供科学证据。应用Acquity UPLC I-class/VION IMS QTOF技术分析四君子汤非多糖组分中主要活性成分(异甘草苷、甘草素、甘草酸、甘草次酸、人参皂苷Rb1、人参皂苷CK、白术内酯III)在人源肠、肝微粒体孵育体系下的代谢产物以及代谢转化途径。甘草酸、甘草次酸在人源肠、肝微粒体中均以I相代谢为主;而甘草素、异甘草苷、人参皂苷Rb1、人参皂苷CK则以肠II相代谢为主。白术内酯III在肠、肝微粒体中代谢均不显著,而四君子汤非多糖功效组分中其他化合物在肠微粒体中代谢速度均比在肝微粒体中更快。此外,甘草皂苷、人参皂苷主要进行脱糖基反应;异甘草苷以脱糖、羟基化等反应为主;甘草素则以葡萄糖醛酸结合为主;白术内酯III则主要发生水解、羟基化反应。阐明了四君子汤非多糖组分中主要活性成分在人体肠道及肝脏中的代谢轮廓及代谢差异,为后续进行四君子汤非多糖功效组分的药效研究提供了数据支持,也为中药复方的功效组分研究提供了思路和策略。
四君子汤;人源肠微粒体;人源肝微粒体;体外代谢;异甘草苷;甘草素;甘草酸;甘草次酸;人参皂苷Rb1;人参皂苷CK;白术内酯III
四君子汤由人参、白术、茯苓、炙甘草组成,为中医临床治疗脾虚证的经典方剂。现代药理学研究证实,四君子汤主要具有胃肠道调节及免疫调节作用,包括改善胃肠运动、降低胃肠道炎症及调节肠道菌群平衡等[1]。课题组前期研究表明,四君子汤中的多糖和非多糖组分均是改善脾虚证的重要物质基础,其中多糖活性组分S-3通过调节肠道菌群组成及短链脂肪酸含量从而增强肠道免疫功能[2],非多糖组分则显著改善脾虚证大鼠的免疫低下、激素分泌异常及肠道菌群紊乱现象[3]。四君子汤非多糖组分化学组成复杂,主要包括黄酮、皂苷、萜类等成分,前期已定性鉴定了449个化合物,并定量分析了19个主要成分[4]。药动学研究发现[5]人参皂苷Rb1、Rb2、Rc、Rd等在体内保留时间较长,可能经过多重代谢;而甘草素等黄酮苷元类成分具有明显的肝肠循环,提示其在肠、肝中可能发生差异代谢;网络药理学及药效学实验证明甘草素、甘草次酸、异甘草苷、人参皂苷CK、白术内酯I、白术内酯II能通过调节局部黏着斑激酶(focal adhesion kinase,FAK)/磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路发挥显著的肠上皮修复作用;其中,具有显著生物活性的人参皂苷CK为人参皂苷Rb1的代谢产物,甘草次酸为甘草酸的代谢产物,白术内酯I、白术内酯II和白术内酯III发生相互转换[4-5]。因此推测甘草酸、甘草次酸、异甘草苷、甘草素、人参皂苷Rb1、人参皂苷CK、白术内酯III可能为四君子汤非多糖组分针对脾虚证引起的“纳少、神失”起主要治疗作用的功效物质。但其在肠、肝中具体代谢过程及差异研究尚不完善。本研究对上述7个活性成分(异甘草苷、甘草素、甘草酸、甘草次酸、人参皂苷Rb1、人参皂苷CK、白术内酯III)进行人源肠微粒体(human intestine microsomes,HIM)、人源肝微粒体(human liver microsomes,HLM)中的I相和II相代谢研究,阐明其在HIM、HLM中的代谢轮廓以及二者的代谢差异,为临床四君子汤治疗脾虚证的物质基础研究提供参考。
1 材料
1.1 药品与试剂
异甘草苷对照品(批号wkq17051906)购自四川省维克奇生物科技有限公司;对照品甘草素(批号DSTDG001001)、甘草酸(批号DST210620-006)、甘草次酸(批号DST180314-007)、人参皂苷Rb1(批号DSTDR000601)、白术内酯III(批号DSTDB001601)、人参皂苷CK(批号DSTDR003001)均购自成都德思特生物技术有限公司,上述对照品质量分数均大于98%;3-[(3-胆固醇氨丙基)二甲基氨基]-1-丙磺酸(3-[(3-cholamidopropyl)dimethyl-amm-onio]-1-propane sulfonate,CHAPS,批号HY-15435)购自上海皓元生物医药科技有限公司;β-烟酰胺腺嘌呤二核苷酸磷酸盐水合物(β-nicotinamide adenine dinucleotide phosphate hydrate,NADP,批号SLCG0842)、葡萄糖-6-磷酸钠脱氢酶(glucose-6-phosphate dehydrogenase,G-6-P-DH,批号SLCK2790)购自美国Sigma-Aldrich公司;六水合氯化镁(批号20200509)购自国药集团化学试剂有限公司;尿苷二磷酸葡萄糖醛酸(uridine 5′-diphospho-glucuronic acid trisodium salt,UDPGA,批号C12209586)、-葡萄糖-6-磷酸二钠盐(-glucose-6-phosphate sodium salt,G-6-P,批号C12766997)均购自上海麦克林生化科技有限公司;磷酸盐缓冲液(批号GP21040152242)购自武汉赛维尔生物科技有限公司;色谱级甲醇(批号203398)购自美国Fisher Chemical;HIM(批号1610314)、HLM(批号2010065)购自Xeno Tech有限责任公司(美国)。
1.2 仪器
Acquity I-class超高效液相-VION离子淌度四极杆-飞行时间质谱联用仪(美国Waters公司);5417R型低温高速离心机、恒温震荡器(德国Eppendorf公司);G-560E型涡旋仪(美国BOHEMIA公司);SPD2010型真空离心浓缩仪(美国Thermo Fisher Scientific公司)。
2 方法
2.1 样品储备液配制
取G-6-P-DH、NADP、G-6-P、UDPGA、CHAPS适量,并用100 mmol/L磷酸缓冲液(pH 7.4)溶解,分别制备浓度为100 mmol/L、75 mmol/L、50 U/mL、42 mmol/L、62.5 mmol/L的储备液;取六水合氯化镁适量,用超纯水溶解后制备得到浓度为833 mmol/L的储备液;取对照品异甘草苷、甘草素、甘草酸、甘草次酸、人参皂苷Rb1、人参皂苷CK、白术内酯III适量,以70%甲醇溶解制备得到混合储备液(ECS),其中甘草次酸浓度为1 mmol/L、白术内酯III浓度为2 mmol/L,其他化合物浓度均为1.25 mmol/L。
2.2 I相代谢孵育体系配制
向1.5 mL离心管中分别加入100 mmol/L磷酸盐缓冲液(pH 7.4)190 μL、HIM或HLM储备液20 μL、NADP储备液5 μL、G-6-P储备液10 μL、六水合氯化镁储备液3 μL、供试品储备液2 μL,将离心管放入恒温振荡器内(37 ℃、300 r/min)预孵育5 min,再加入G-6-P-DH储备液20 μL,形成I相反应体系共250 μL。以空白溶剂作为阴性对照。样品分别孵育0、15、30、60、90、120 min。其中反应体积中有机相甲醇(由供试品储备液引入)的质量分数低于1%。加入1 mL正丁醇(水饱和)并置于冰中终止反应,再将样品涡旋1 min后,4 ℃、14 000 r/min离心20 min;吸取上清液在真空离心机中浓缩挥干,以甲醇-水溶液(70∶30)80 μL复溶,复溶液于4 ℃、12 000 r/min离心20 min,取上清液7 μL进样分析。
2.3 II相代谢孵育体系配制
向1.5 mL离心管中依次加入100 mmol/L磷酸盐缓冲液(pH 7.4)165 μL、HIM或HLM储备液20 μL、NADP储备液5 μL、G-6-P储备液10 μL、氯化镁储备液3 μL、供试品储备液2 μL、G-6-P-DH储备液20 μL,形成250 μL的I相反应体系从而启动I相代谢反应,将其置于恒温振荡器中,于37 ℃、300 r/min振荡孵育20 min。再加入CHAPS储备液5 μL,置于恒温振荡器中37 ℃、300 r/min振荡预孵育10 min。最后加入UDPGA储备液20 μL,于37 ℃、300 r/min振荡孵育0、60、90、120 min。以空白溶剂作为阴性对照。其中反应体积中有机相甲醇(由供试品储备液引入)的质量分数低于1%。加入1 mL正丁醇(水饱和)并置于冰中终止反应,再将样品涡旋1 min后,4 ℃、14 000 r/min离心20 min;吸取上清液在真空离心机中浓缩挥干,以甲醇-水溶液(70∶30)80 μL复溶,复溶液于4 ℃、12 000 r/min离心20 min,取上清液7 μL进样分析。
2.4 液质联用分析条件
2.4.1 色谱条件 Waters BEH C18UPLC色谱柱(100 mm×2.1 mm,1.7 μm);流动相为0.1%甲酸水溶液(A)-0.1%甲酸乙腈溶液(B),洗针液90%乙腈水溶液;梯度洗脱:0~3 min,5%~20% B;3~12 min,20%~100% B;12~19 min,100%~95% B;进样体积7 μL;柱温45 ℃;体积流量0.4 mL/min。
2.4.2 质谱条件 采用MSE(低能量/高能量切换扫描)的采集模式;离子源为电喷雾正离子模式(ESI+);毛细管电压2.0 kV;锥孔电压40 V;雾化气温度450 ℃;雾化气体积流量900 L/h;锥孔反吹气体积流量50 L/h;离子源温度115 ℃;扫描范围/50~1500;扫描速度0.2 s;采集间隔0.5 s;采集时间0.5 s;碰撞能量6 eV。
2.5 数据处理及分析方法
采集的所有质谱信息利用UNIFI软件(美国Waters公司)进行数据处理,通过文献以及Chemspider等数据库检索ECS中所有原型成分及可能存在的代谢产物,建立ECS代谢产物库(包含化合物名称、分子式、精确相对分子质量及化学结构),将数据库导入UNIFI软件并与质谱信息比对。
将ECS中各化合物在肠、肝微粒体体系下孵育不同时间后的含量(峰面积)变化,以不同时间点各化合物含量(峰面积)/各化合物初始浓度即剩余底物浓度百分比对孵育时间作图,得I、II相代谢消除曲线。
3 结果
3.1 ECS在HLM体系中相对含量随时间的变化
ECS储备液(甘草次酸终浓度为8 μmol/L、白术内酯III终浓度为16 μmol/L,其余化合物均为10 μmol/L)经HLMI、II相体系孵育后,空白对照、混合对照品以及不同孵育时间下ECS的总离子流见图1。结果显示,混合对照品中各单体化合物分离明显且分离度良好,说明该色谱质谱条件较为合适,可用于后续样品检测。
3.1.1 ECS在HLM I相孵育体系下各成分相对含量的变化 ECS中各化合物在肝微粒体下I相体系中孵育120 min的代谢消除曲线如图2所示。人参皂苷Rb1在0~120 min内含量持续下降,终浓度仅为初始浓度的15.99%,提示其在肝中发生显著的I相代谢消除,生成多种I相代谢产物[6];而人参皂苷CK在孵育时间段内呈现出“降低-升高-降低”的变化趋势,这提示可能存在人参皂苷CK作为中间代谢产物的复杂生物转化[7]。人参皂苷CK孵育90 min后相较于30 min,相对含量增加了2.33%,推测人参皂苷CK可能由人参皂苷Rb1脱糖基转化而来。甘草酸在0~120 min内相对含量呈下降趋势,且其在0~30 min内变化较快,30 min时相对含量相较于初始浓度减少46.8%,而后在30~120 min内含量变化幅度较小,提示其进入肝脏后迅速发生I相代谢,而甘草次酸在30~60 min内相对含量增加,并在孵育60 min后相较于30 min含量增加5.88%,这可能源于甘草酸在I相体系中代谢生成。异甘草苷在0~120 min内表现出缓慢的下降趋势,而甘草素整体波动不大,但甘草素在15~90 min内相对含量略有上升,推测异甘草苷在15~60 min内可能水解、异构化后生成甘草素[8]。
逆城市化作为一种趋势并没有严格意义上的好坏之分,与之相随的既有机遇也有挑战。逆城市化是城市化进程的必然结果,任何区域都需要一个人口阈值来规划区域发展。只要没有大幅超过或者低于这个阈值,人口的微小变化不会对区域发展规划和空间结构产生太大影响,但是一旦出现大规模或突然的变化,可能会因人均分担的市政设施和公共服务成本太高或者市政设施和公共服务规模无法满足现有需要而导致城市崩溃。

1-异甘草苷 2-甘草素 3-人参皂苷Rb1 4-甘草酸 5-白术内酯III 6-人参皂苷CK 7-甘草次酸,图4同

图2 ECS孵育后在HLM中的I相代谢消除曲线
人参皂苷、甘草皂苷类成分在体内代谢率较大且发生初始反应时间较短,而甘草中的黄酮类成分代谢周期较长,其中皂苷类成分大部分需经代谢转化后再吸收入血发挥药效作用[9]。
3.1.2 ECS在HLM II相孵育体系下各成分相对含量的变化 ECS中各化合物在肝微粒体II相体系中孵育后的代谢消除曲线如图3所示。人参皂苷Rb1在0~120 min内相对含量明显减少,终浓度为初始浓度的58.91%,提示其在肝中继续进行II相结合,而人参皂苷CK在HLM II相体系下含量变化较小,推测是因为人参皂苷CK作为次生代谢产物在体内直接被吸收利用,较少发生II相结合[10]。甘草酸在0~120 min内相对含量持续降低;甘草酸在0~120 min也呈现出明显的下降趋势,尤其是在60~120 min内,其在孵育120 min后相对含量减少了34.30%(相较于60 min),提示甘草酸进入体内后先经I相代谢后进行II相结合;而甘草次酸在孵育全过程中代谢幅度不大,推测甘草次酸可能以I相代谢为主,或可能与其作为甘草酸的代谢产物有关。异甘草苷及甘草素的相对含量均呈现降低趋势,前者终浓度为初始浓度的83.73%,后者终浓度为初始浓度的73.04%,提示甘草素可能较依赖II相代谢[11]。

图3 ECS孵育后在HLM中的II相代谢消除曲线
综上,ECS中各化合物在HLMI相和II相孵育体系中的含量变化结果显示,甘草酸及甘草次酸在I相体系下代谢消除更为显著,尤其是甘草酸在HLM I相体系孵育120 min时剩余底物浓度为初始浓度的47.87%,而其在II相体系相同时间剩余底物浓度为初始浓度的65.19%。人参皂苷Rb1和人参皂苷CK在I相和II相体系下表现出一定差异,孵育120 min后,人参皂苷Rb1在I相孵育下终浓度仅为初始浓度的15.99%而在II相体系下终浓度却为初始浓度的58.91%,提示其可能较为依赖I相代谢。异甘草苷在HLM I相体系下消除更为明显,提示其作为黄酮苷主要以I相代谢为主;甘草素则在HLM II相体系下代谢更为显著,最大消除量出现在120 min时为26.96%,而甘草素在I相体系下其最大消除量为16.94%,提示甘草素在体内可能以II相代谢为主[11]。白术内酯III在I相及II相体系下含量变化幅度较小,提示其经口服进入体内绝大部分以原型吸收[12]。提示四君子汤经肝脏代谢时,甘草皂苷、人参皂苷类成分可能以I相代谢为主,而甘草黄酮类成分以II相代谢为主。
3.2 ECS在HIM体系中不同孵育时间点下相对含量的变化
将ECS(甘草次酸终浓度为8 μmol/L、白术内酯III终浓度为16 μmol/L,其余化合物均为10 μmol/L)储备液经肠微粒体I、II相代谢孵育后,空白对照、混合对照品以及待测样品在不同孵育时间下的总基峰色谱图见图4。结果显示,混合对照品中各单体化合物分离明显且分离度良好,说明该色谱质谱条件较为合适,可用于后续样品检测。
3.2.1 ECS在HIM I相孵育体系下各成分相对含量的变化 ECS中各化合物在HIM I相体系中孵育120 min后的代谢消除曲线如图5所示。甘草酸在HIM I相孵育120 min内相对含量持续下降,终浓度仅为初始浓度的11.21%,而甘草次酸在孵育90 min后相对含量相较于初始浓度减少13.04%,而在孵育120 min后其相对含量相较于90 min增加8.59%,其微弱的变化可能与甘草酸水解生成甘草次酸有关。异甘草苷在0~120 min内的相对含量持续降低,至120 min时相对含量比初始浓度减少了69.68%,说明其代谢周期较长,而在此过程中异甘草苷则生成多种代谢产物,这些代谢产物或许能够直接对机体产生相应的药效作用[13-14]。而甘草素在HIM I相孵育体系中的整体代谢幅度较小(最大消除量为20.37%)。就人参皂苷类成分而言,人参皂苷Rb1在孵育30 min后相对含量较其初始浓度减少了42.27%,同时人参皂苷CK在孵育30 min后相对含量相较于15 min增加4.15%,推测可能是因为人参皂苷Rb1在此时脱糖基生成人参皂苷CK。上述结果表明,甘草皂苷类成分在肠微粒体中I相反应速度较快,而黄酮类成分代谢周期则相对较长。

图4 ECS在HIM I(A)、Ⅱ (B)相体系下经不同时间点孵育下总基峰色谱图

图5 ECS孵育后在HIM中的I相代谢消除曲线
3.2.2 ECS在HIM II相孵育体系下各成分相对含量的变化 ECS中各化合物经HIM II相体系孵育后的代谢消除曲线如图6所示。人参皂苷Rb1在孵育120 min时仅余初始浓度的24.07%,说明其可能在肠道中继续发生II相代谢,而人参皂苷CK在HIM II相体系下变化不大,提示人参皂苷CK可能直接被机体吸收并发挥药效作用[15]。异甘草苷孵育至120 min时仅余初始浓度的25.55%,而甘草素的相对含量在孵育时间内持续降低至原始浓度的39.32%,提示甘草素可能以II相代谢为主。甘草酸在0~120 min内相对含量持续下降且其在90~120 min内下降速度更快,提示甘草酸在体内由I相至II相代谢;而甘草次酸在孵育120 min内含量变化不大,与其本身在体内吸收利用度较高相符[16]。

图6 各化合物在HIM中的II相代谢消除曲线
比较ECS中各化合物在HIM I相和II相孵育体系中的代谢趋势,以揭示其在不同代谢阶段中的代谢差异。结果显示,甘草酸在I、II相体系下均呈现持续下降趋势,但其在I相中的转变时间早于II相,推测其在体内可能由I相至II相代谢;而甘草次酸在体内能够直接被吸收利用,结果也表明它在I、II相中相对含量幅度波动较小。人参皂苷Rb1在HIM II相中相对含量呈现较为明显的变化,尤其孵育60 min后Rb1大量消除,提示其在肠道中以II相代谢转化为主;而人参皂苷CK在HIM体系下相对含量变化较小,据研究,人参皂苷CK能够直接对人体产生相应的药效作用[17]。异甘草苷在HIM I、II相孵育体系下均表现出持续性的代谢消除(I相120 min最大消除率为69.68%,II相120 min最大消除率为74.45%);而甘草素则主要以HIM中的II相代谢消除为主(I相中最大消除量为20.37%,II相为60.68%)。综上,在HIM中甘草酸先进行I相代谢后再进行II相代谢而甘草次酸作为其I相产物,在体内能够被大量吸收利用并发挥药效作用。与之相反的是,人参皂苷Rb1、甘草素在HIM II相孵育下均表现出更为显著的消除趋势。
3.3 ECS经HIM、HLM孵育后相对含量变化的比较
进一步分析ECS中各化合物在HIM、HLM I、II相体系下的代谢差异。如图7所示,ECS经HIM、HLM I相孵育后,其组成成分中人参皂苷Rb1在HIM、HLM I相体系下均于0~30 min内快速发生代谢消除(30 min相较于初始浓度分别减少了42.27%、30.00%),其后代谢趋为平缓;而其代谢产物人参皂苷CK在HIM、HLM I相体系下变化有所不同,它在HIM中15~30 min相对含量增加,并在HLM中30~90 min呈现出相对含量增加的趋势,提示人参皂苷CK经口服到达肠道后先在肠道发生I相代谢后经肠肝循环继续进入肝脏代谢[18]。ECS中的甘草酸在HIM I相体系下发生显著代谢,而其在肝微粒体中I相代谢主要发生在0~30 min,表明其主要在肠道中发生相关代谢[19];其水解产物甘草次酸在HIM、HLM I相体系中的变化却不显著。异甘草苷的相对含量在HIM、HLM I相孵育体系中均呈降低趋势,但它在HIM中的最大消除量(初始浓度的69.68%)尤为显著,说明它I相孵育时以肠道代谢为主;而其代谢产物甘草素在肠、肝微粒体中仅发生少量代谢,提示甘草素可能以II相代谢为主。

图7 ECS中各化合物在HIM、HLMI相体系下相对含量变化
如图8所示,ECS经HIM、HLM II相孵育后,人参皂苷Rb1在HIM体系下相对含量变化更为显著,120 min时剩余底物浓度仅为初始浓度的24.07%,而其在HLM体系下终浓度为初始浓度的58.91%,提示其在肠道中更容易发生II相代谢;而其代谢产物人参皂苷CK在HIM、HLM II相体系下波动不大。异甘草苷和甘草素在HIM、HLM II相体系下孵育120 min内均呈现持续性消除现象,而二者均于HIM体系中代谢消除更为显著(异甘草苷在HLM、HIM体系最大消除量均出现在120 min,分别为16.27%、74.45%;甘草素在HLM、HIM体系下最大消除量同样出现在120 min时,分别为26.96%、60.68%),这与文献中异甘草苷及甘草素可能以肠微粒体中II相结合为主的结果一致[20]。相较于HLM体系,甘草酸在HIM II相体系下代谢更为显著。推测其经口服后大部分在肠道内发生代谢,小部分入血后在肝脏中进行II相反应;而甘草次酸变化幅度较小。

图8 ECS中各化合物在HIM、HLM Ⅱ相体系下相对含量变化
综上,HIM、HLM I相孵育体系下,甘草酸、人参皂苷Rb1、异甘草苷均以肠道代谢为主;而人参皂苷CK、甘草次酸、甘草素在I相体系中代谢不明显。HIM、HLM II相孵育体系下,甘草皂苷、人参皂苷类、甘草黄酮类成分主要以HIM中II相代谢为主,而白术内酯III在HIM、HLM中相对含量波动幅度较小。由此提示,四君子汤经口服进入体内,原型皂苷、黄酮类成分先经肠道代谢,后经肝肠循环进入肝脏代谢;极性大、相对分子质量小的内酯类成分可直接进入机体发挥作用;而代谢产物受原型成分代谢转换的影响,消除量低、消除时间长,提示它们可能是体内延长功效的主要活性物质。
3.4 ECS中各化合物在HIM、HLM体系中的I、II相代谢产物及其代谢途径
ECS分别经HIM、HLM孵育后,共检测到35个原型及代谢产物,其中分别在肠微粒体中检测到30个(原型成分7个、代谢成分23个)、肝微粒体中检测到32个(原型成分7个、代谢成分25个),二者共有成分27个。I相体系下主要发生氧化、脱氢、水解反应,II相体系下发生葡萄糖醛酸结合,与前人研究相符合[21-23]。ECS在HIM、HLM I、II相体系孵育下的代谢产物及碎片离子见表1。
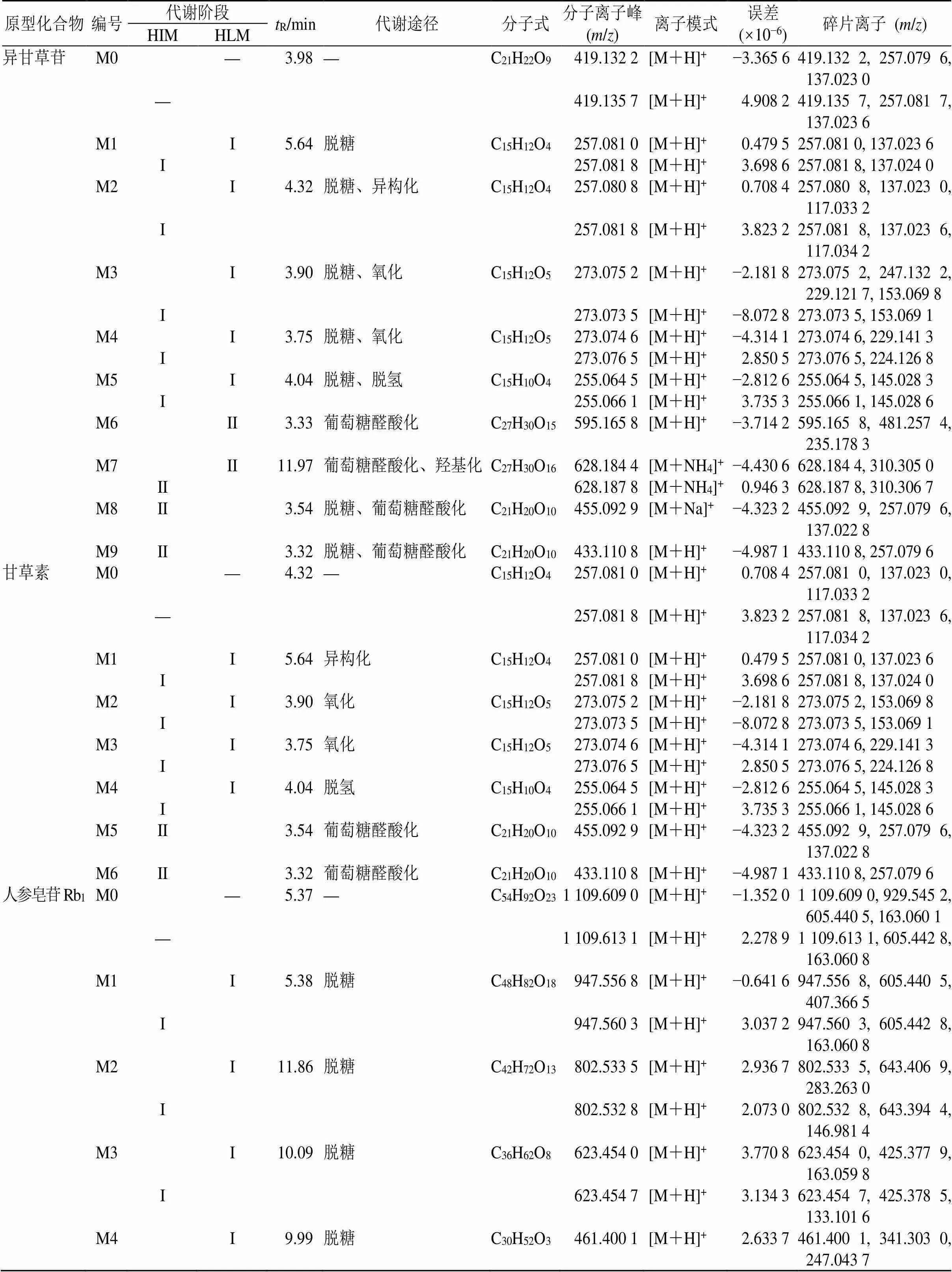
表1 ECS中各化合物在HIM、HLM体系内的代谢产物

续表1

续表1
M0为原型化合物,“—”代表原型化合物未进入代谢阶段,空格则代表未发现其进行I/II相阶段的代谢,*代表此前未见报道的、新发现的代谢产物
M0 is a prototype compound, “—” means that the prototype compound has not entered the metabolic stage, blank space means that it has not been found to undergo I/II phase metabolism, and * means a newly discovered metabolite that has not been reported before
3.4.1 异甘草苷代谢产物鉴定 异甘草苷及甘草素经HIM、HLM体系孵育后,其二者的代谢途径如图9所示。M0的R为3.98 min,准分子离子峰为/419.133 7 [M+H]+,分子式为C21H22O9,与对照品比对后确定为异甘草苷。M1~M5均为其I相代谢产物,主要的代谢方式包括脱氢、羟基化等。M6~M9则为其II相代谢产物,主要进行了葡萄糖醛酸化结合反应。M1的R为5.64 min,主要碎片离子包括/257.081 0、137.023 6 [M+H]+,经文献对比后确定其为异甘草苷脱糖产物异甘草素[24]。M2的R为4.32 min,由准分子离子峰/257.080 8 [M+H]+,分子式为C15H12O4,并根据甘草素对照品的R、准分子离子峰及主要碎片离子,确认M2为甘草素。M3的R为3.90 min,准分子离子峰为273.075 2 [M+H]+,主要碎片离子包括273.075 2、247.132 2、229.121 7、153.069 8 [M+H]+;M4的R为3.75 min,准分子离子峰为/273.074 6 [M+H]+,主要碎片离子包括/273.074 6、229.141 3 [M+H]+,M3、M4相较于甘草素都增加了16,推测二者为M2的羟基化产物,且M3中碎片离子/153.069 8 [M+H]+比甘草素A环特征碎片多16,提示其为A环羟基化产物。M5的R为4.04 min,准分子离子峰/255.065 2 [M+H]+确定其分子式为C15H10O4,结合文献报道[8],推测其可能在甘草素C环2、3位脱氢形成双键。M6的R为3.33 min,准分子离子峰为/595.163 5 [M+H]+,比异甘草苷多176,推测其为异甘草苷葡萄糖醛酸产物,且其仅在HLM体系中检测到。M7的R为11.97 min,准分子离子峰为/628.184 4 [M+NH4]+,比异甘草苷多192(包括加合离子NH4+),提示其在异甘草苷的结构基础上发生了葡萄糖醛酸化及羟基化反应。M8、M9的R分别为3.54、3.32 min,准分子离子峰分别为/455.092 9 [M+Na]+、433.112 9 [M+H]+,与甘草素/257.080 8 [M+H]+对比后推测其进行了葡萄糖醛酸结合,同时它们都具有特征性中性丢失176的离子/257.079 6 [M+H]+,推测M8、M9均为甘草素的葡萄糖醛酸结合产物,且其只在HIM孵育体系中发现。

图9 异甘草苷在HIM、HLM体系下可能的代谢途径
3.4.2 人参皂苷Rb1代谢产物鉴定 人参皂苷Rb1以及人参皂苷CK经HIM、HLM体系孵育后,二者的代谢途径如图10所示。M0的R为5.37 min,准分子离子峰1109.611 6 [M+H]+,推测其分子式为C54H92O23,经对照品比对后确定其为人参皂苷Rb1。M1的R为5.38 min,准分子离子峰/947.556 8[M+H]+确定其分子式为C48H82O18,其特征碎片离子/605.440 5为其脱去1个糖基生成,判断其可能为人参皂苷Rd[25];M2的R为11.86 min,准分子离子峰/802.533 5 [M+H]+确定其分子式为C42H72O13,碎片离子643.406 9为其丢失GluA片段,与人参皂苷F2相符[25]。M3的R为10.09 min,准分子离子峰/623.454 0 [M+H]+确定其分子式为C36H62O8,与对照品对比后确定其为人参皂苷CK[18,25];M4的R为9.99 min,准分子离子峰/461.400 1 [M+H]+确定其分子式为C30H52O3,据文献报道推测其为人参皂苷Rb1阶段性脱糖的终产物PPD[25]。

图10 人参皂苷Rb1在HIM、HLM体系下可能的代谢途径
3.4.3 甘草酸代谢产物鉴定 甘草酸以及甘草次酸经HIM、HLM体系孵育后,二者的代谢途径如图11所示。M0的R为6.43 min,准分子离子峰823.409 4 [M+H]+确定其分子式为C42H62O16,与对照品比对后确定其为甘草酸。M1的R为10.42 min,准分子离子峰471.348 7 [M+H]+,确定其分子式为C30H46O4,与对照品比对后确定其为甘草次酸。M2、M3的R分别为9.01、7.35 min,准分子离子峰分别为487.343 9、487.344 0 [M+H]+,相比甘草次酸的相对分子质量多了16,据报道甘草次酸在体内代谢过程中极易发生羟基化反应[24],因此推测它们为甘草次酸羟基化产物。M4的R为9.02 min,准分子离子峰469.333 1 [M+H]+,相比M1减少2,可能为甘草次酸的脱氢产物;M5的R为9.58 min,具有485.327 6 [M+H]+准分子离子峰,比M4大16,推测其为甘草次酸发生脱氢、加氧后的产物;M6的R为3.84 min,准分子离子峰647.380 5 [M+H]+,比甘草次酸多176,推测其可能为甘草次酸葡糖醛酸结合产物,或者为甘草酸脱去1分子葡萄糖醛酸基团所得。

图11 甘草酸在HIM、HLM体系下可能的代谢途径
3.4.4 白术内酯III代谢产物鉴定 白术内酯III在经HIM、HLM孵育后检测到8个代谢成分,其代谢途径如图12所示。M0的R为7.92 min,准分子离子峰/249.149 8 [M+H]+确定其分子式为C15H20O3,与对照品比对后确定其为白术内酯III。M1的R为7.91 min,准分子离子峰/231.139 3 [M+H]+,确定其分子式为C15H18O2,据文献可知其为白术内酯III脱水后的产物白术内酯I[26]。M2~M4的R分别为3.91、4.77、4.55 min,准分子离子峰分别为/265.142 6、265.142 4、265.142 7 [M+H]+,均比白术内酯III的相对分子质量大16;且M2~M4的主要碎片离子/265.142 6、247.135 3、229.121 7 [M+H]+同样比M0特征碎片离子/249.149 8、231.138 7、213.128 7 [M+H]+大16。将M2~M4中的特征性碎片离子/247.135 3、229.121 7 [M+H]+与M0的A、B环特征性离子进行对比后,发现其氧原子应该加成在白术内酯III的A、B环上[26]。M5的R为9.39 min,准分子离子峰/289.142 2 [M+Na]+,比M0多40(包括加合离子Na+),推测其可能为M0的水解产物;M6的R为2.90 min,具有/321.129 9 [M+Na]+准分子离子峰,比M0多72(包括加合离子Na+),推测其可能为白术内酯III发生水解及二氧化后的产物。M7的R为7.17 min,准分子离子峰/283.153 0 [M+H]+,相比M0增加34,推测为M0单氧化及水解后产物,且其为白术内酯III新出现的代谢产物。它的碎片离子/201.046 9 [M+H]+比M0的A环特征性离子/185 [M+H]+大16,提示其在A环发生单氧化,该化合物首次检测得到,且仅在HLM体系中检测得到。M8的保留时间为6.93 min,准分子离子峰/425.180 0 [M+H]+,比M0大176,推测其在M0上加成1个葡萄糖醛酸基团,为其II相葡萄糖醛酸化产物。

图12 白术内酯III在HIM、HLM体系下可能的代谢途径
4 讨论
中药以口服为主,通过胃肠道处置后再经血液循环到达肝脏等器官进行代谢而发挥作用。在这个过程中,80%药物的代谢主要发生在肝脏或其他组织的内质网中;滑面内质网中含有丰富的药物代谢酶,如细胞色素P450酶(cytochrome P450,CYP450s)和葡萄糖醛酸转移酶(uridine diphosphoglucuronosyl transferases,UGTs),它们不仅存在于肝脏,小肠也是其主要部位,提示药物在进入肝脏代谢前可能首先经过肠道代谢。但目前关于四君子汤代谢的研究以动物模型为主,这与人体代谢可能存在一定差异。本研究采用HIM、HLM孵育技术,探究ECS在HIM、HLM中的代谢轮廓及二者间代谢差异,发现ECS中甘草皂苷类成分主要进行肠I相代谢,而人参皂苷类、甘草黄酮类成分则以肠II相代谢为主,此外,白术内酯类成分在肠、肝中代谢均不显著。
药物在体内代谢包括I相及II相2个阶段,I相反应包括氧化、还原以及水解,II相反应以结合为主。化合物在I相反应中暴露出极性基团、极性增强并在II相体系下与内源性物质结合并排出体外。研究表明甘草酸、人参皂苷Rb1作为原型化合物因相对分子质量较大,口服进入胃肠道后难以被直接吸收利用,生物利用度很低[24-25],大多倾向于在肠道内发生阶梯式脱糖反应[27];而甘草次酸、人参皂苷CK作为它们的I相活性产物,也是它们在体内重要吸收利用形式。同时有文献提出甘草素主要以II相葡萄糖醛酸结合为主[11],从而发挥抗炎等药理活性。本研究结果显示ECS在微粒体孵育体系下,甘草皂苷可能以I相代谢为主,且在肠道中代谢消除更为显著,而甘草次酸作为其次级代谢产物在I相体系下相对含量变化不明显,可能是因为它作为苷元经皂苷母核水解后生成,极性增强,I相反应减弱。此外,白术内酯III在HIM、HLM体系下含量变化较小,这可能是因为其能够直接被吸收并发挥改善神经细胞损伤等作用[28]。研究表明,ECS中各化学成分原型以及代谢产物对于肠道修复、神经保护均具有一定的作用。如人参皂苷Rb1及其I相代谢产物人参皂苷CK能够通过改变肠道菌群的组成比例进而对肠道起到一定的保护作用[29-30];也有报道提到甘草酸、甘草次酸(甘草酸水解产物)、异甘草苷、白术内酯III对于减轻神经毒性、改善神经细胞损伤具有一定的作用[13-14,31-33]。四君子汤亦被证实具有保护肠道、减少神经损伤作用[34],这更体现出ECS作为其功效组分的重要意义。由此推测,四君子汤中的ECS经口服进入人体到达胃肠道后,皂苷类成分包括人参皂苷Rb1、甘草酸均先在肠道内发生脱糖基反应,后再吸收入血到达肝脏,此二者分别与其代谢产物人参皂苷CK、甘草次酸共同发挥抗炎、保护肠道等作用;异甘草苷进入肠道后发生水解等反应,生成相应代谢产物,且其与代谢产物甘草素均能够对神经细胞损伤起到一定的修复作用。
另外,本研究对ECS在HIM、HLM中的代谢轮廓也进行了分析。ECS中化合物以脱氢、羟基化、氧化、水解、葡萄糖醛酸化为主[26,35-36],与实验结果相符。一直以来针对白术内酯III的报道较少,M7为本研究新发现的I相代谢产物,为白术内酯III发生单氧化及水解后生成,且仅在HLM体系中检测发现,这可能源于肝脏中含有大量CYP450s供其结合并发生相应代谢[37],其生理活性有待进一步研究。与此同时,在甘草素的代谢过程中,仅在HIM体系下发现了2种甘草素葡萄糖醛酸化产物,提示甘草素经口服到达胃肠道后能够快速发生代谢,且有研究发现,相较于肝脏,甘草素在肠道中更易产生多种葡萄糖醛酸结合产物[38]。此外,四君子汤中人参皂苷Rb1、甘草酸等糖苷类物质含量较高,且具有较强的修复肠道损伤等作用[39-40],而苷元类成分虽在方剂中含量较低,却能够直接对机体发挥作用。本研究发现,上述糖苷类物质在肠道及肝脏中能够与苷元发生相应转化,使得体内苷元含量增加,进而起到保护肠道、改善神经损伤等作用,这体现了中药多成分的协同作用及建立功效组分群的意义,也潜在证明了ECS或许能够在很大程度上代表四君子汤非多糖物质的药效基础。
本研究为更好地阐明ECS在人体内的真实代谢过程,以ECS在HIM、HLM中的代谢过程为重要研究对象,阐明其代谢轮廓差异并预测其在人体内的代谢路径,为四君子汤非多糖功效组分的体内研究提供了切实可靠的证据,同时也推动了其治疗脾虚证的药效物质基础研究。
利益冲突 所有作者均声明不存在利益冲突
[1] 王瑞君. 白术和四君子汤复方活性多糖的筛选、结构表征及体外胃肠代谢研究 [D]. 上海: 上海交通大学, 2017.
[2] Gao B B, Wang R J, Peng Y,. Effects of a homogeneous polysaccharide from Sijunzi Decoction on human intestinal microbes and short chain fatty acids[J]., 2018, 224: 465-473.
[3] Guan Z B, Wang M, Cai Y,. Rapid characterization of the chemical constituents of Sijunzi Decoction by UHPLC coupled with Fourier transform ion cyclotron resonance mass spectrometry [J]., 2018, 1086: 11-22.
[4] Dong B J, Peng C S, Ma P,. An integrated strategy of MS-network-based offline 2DLC-QTOF-MS/MS coupled with UHPLC-QTRAP®-MS/MS for the characterization and quantification of the non-polysaccharides in Sijunzi Decoction [J]., 2021, 413(13): 3511-3527.
[5] Dong B, Ma P, Chen X,. Drug-polysaccharide/herb interactions and compatibility rationality of Sijunzi Decoction based on comprehensive pharmacokinetic screening for multi-components in rats with spleen deficiency syndrome [J]., 2023, 302: 115871.
[6] Zhang X Y, Chen S, Duan F P,. Prebiotics enhance the biotransformation and bioavailability of ginsenosides in rats by modulating gut microbiota [J]., 2021, 45(2): 334-343.
[7] Guo Y P, Shao L, Wang L,. Bioconversion variation of ginsenoside CK mediated by human gut microbiota from healthy volunteers and colorectal cancer patients [J]., 2021, 16(1): 28.
[8] 李元元, 江振作, 张蕾, 等. UPLC-Q-TOF/MS法鉴定大鼠体内甘草素的代谢产物 [J]. 天津中医药, 2015, 32(12): 757-762.
[9] 宋玮, 郑伟, 张洁, 等. 中药皂苷类成分的体内代谢研究进展 [J]. 药学学报, 2018, 53(10): 1609-1619.
[10] Lee J Y, Choi H Y, Park C S,. Total saponin extract, ginsenoside Rb1, and compound K alleviate peripheral and central neuropathic pain through estrogen receptors on rats [J]., 2021, 35(4): 2119-2132.
[11] 樊慧蓉, 董世奇, 李全胜, 等. 甘草素在体外不同种属肝微粒体中的代谢差异研究 [J]. 中草药, 2017, 48(2): 320-326.
[12] 朱钊铭, 李汉成, 罗佳波. HPLC-MS法同时测定白术内酯I、Ⅱ、III及其在大鼠体内的药动学 [J]. 中药药理与临床, 2013, 29(6): 25-29.
[13] Li Y J, Song W, Tong Y,. Isoliquiritin ameliorates depression by suppressing NLRP3-mediated pyroptosis via miRNA-27a/SYK/NF-κB axis [J]., 2021, 18(1): 1.
[14] He Y F, Ci X Y, Xie Y,. Potential detoxification effect of active ingredients in liquorice by upregulating efflux transporter [J]., 2019, 56: 175-182.
[15] Tang M S, Xie X, Yang Y Y,. Ginsenoside compound K-a potential drug for rheumatoid arthritis [J]., 2021, 166: 105498.
[16] Yan M, Guo L, Yang Y,. Glycyrrhetinic acid protects α-naphthylisothiocyanate-induced cholestasis through regulating transporters, inflammation and apoptosis [J]., 2021, 12: 701240.
[17] Zhang M M, Li Y X, Wang X Y. Recent studies on the pharmacological activities and structural modifications of compound-K [J]., 2022, 22(22): 2847-2863.
[18] Wang B, Dong J X, Xu J,. Ginsenoside CK inhibits obese insulin resistance by activating PPARγ to interfere with macrophage activation [J]., 2021, 157: 105002.
[19] Akao T. Distribution of enzymes involved in the metabolism of glycyrrhizin in various organs of rat [J]., 1998, 21(10): 1036-1044.
[20] Zhang L, Wang C X, Wu J,. Metabolic profiling of mice plasma, bile, urine and feces after oral administration of two licorice flavonones [J]., 2020, 257: 112892.
[21] Seong S J, Kang W Y, Heo J K,. A comprehensiveandassessment of the drug interaction potential of red ginseng [J]., 2018, 40(8): 1322-1337.
[22] Deng M, Chen H J, Long J Y,. Atractylenolides (I, II, and III): A review of their pharmacology and pharmacokinetics [J]., 2021, 44(7): 633-654.
[23] Negreira N, Erratico C, Kosjek T,.Phase I and Phase II metabolism of α-pyrrolidinovalerophenone (α-PVP), methylenedioxypyrovalerone (MDPV) and methedrone by human liver microsomes and human liver cytosol [J]., 2015, 407(19): 5803-5816.
[24] 郭一婷, 程瑶, 邵云云, 等. 芍药甘草汤主要成分在正常及多囊卵巢综合征大鼠尿液和粪便中的代谢产物分析 [J]. 中国实验方剂学杂志, 2020, 26(6): 103-112.
[25] Tan J S, Yeo C R, Popovich D G. Fermentation of protopanaxadiol type ginsenosides (PD) with probioticand[J]., 2017, 101(13): 5427-5437.
[26] Jiang Z H, Peng C Y, Huang W P,. A high throughput three-step ultra-performance liquid chromatography tandem mass spectrometry method to study metabolites of atractylenolide-III [J]., 2019, 57(2): 163-176.
[27] Yang L, Zou H C, Gao Y C,. Insights into gastrointestinal microbiota-generated ginsenoside metabolites and their bioactivities [J]., 2020, 52(1): 125-138.
[28] Zhao H, Ji Z H, Liu C,. Neuroprotection and mechanisms of atractylenolide III in preventing learning and memory impairment induced by chronic high-dose homocysteine administration in rats [J]., 2015, 290: 485-491.
[29] Yang X Y, Dong B J, An L J,. Ginsenoside Rb1ameliorates glycemic disorder in mice with high fat diet-induced obesityregulating gut microbiota and amino acid metabolism [J]., 2021, 12: 756491.
[30] Chen H M, Shen J J, Li H F,. Ginsenoside Rb1exerts neuroprotective effects through regulation ofabundance and GABAAreceptor expression [J]., 2020, 44(1): 86-95.
[31] Yang G Y, Li J, Cai Y L,. Glycyrrhizic acid alleviates 6-hydroxydopamine and corticosterone-induced neurotoxicity in SH-SY5Y cells through modulating autophagy [J]., 2018, 43(10): 1914-1926.
[32] Du Y X, Luo M, Du Y H,. Liquiritigenin decreases aβ levels and ameliorates cognitive decline by regulating microglia M1/M2 transformation in AD mice [J]., 2021, 39(2): 349-358.
[33] Zhou K C, Chen J, Wu J Y,. Atractylenolide III ameliorates cerebral ischemic injury and neuroinflammation associated with inhibiting JAK2/STAT3/Drp1-dependent mitochondrial fission in microglia [J]., 2019, 59: 152922.
[34] 高蓓蓓, 彭颖, 李晓波. 四君子汤复方多糖肠道免疫调节作用及其机制研究进展[J]. 中草药, 2018, 49(2): 462-467.
[35] Li X, Sun R, Liu R. Natural products in licorice for the therapy of liver diseases: Progress and future opportunities [J]., 2019, 144: 210-226.
[36] Li L, Chen X Y, Zhou J L,.studies on the oxidative metabolism of 20()-ginsenoside Rh2in human, monkey, dog, rat, and mouse liver microsomes, and human liver S9 [J]., 2012, 40(10): 2041-2053.
[37] Lim H, Jeon H, Hong S,. Catalytic approach tometabolism of atractylenolide III using biomimetic iron-porphyrin complexes [J]., 2021, 11(52): 33048-33054.
[38] Zhang L, Zhao H Y, Liu Y,. Metabolic routes along digestive system of licorice: Multicomponent sequential metabolism method in rat [J]., 2016, 30(6): 902-912.
[39] Zeeshan M, Atiq A, Ain Q U,. Evaluating the mucoprotective effects of glycyrrhizic acid-loaded polymeric nanoparticles in a murine model of 5-fluorouracil-induced intestinal mucositis via suppression of inflammatory mediators and oxidative stress [J]., 2021, 29(5): 1539-1553.
[40] 孟欢, 侯晓婷, 张华敏, 等. 中药天然产物治疗炎症性肠病的研究进展[J]. 中草药, 2023, 54(10): 3349-3369.
metabolism of non-polysaccharide components in Sijunzi Decoction by human intestinal and liver microsomes
SHEN Yi, MA Ping, DONG Bang-jian, PENG Chong-sheng, LI Xiao-bo
School of Pharmacy, Shanghai Jiao Tong University, Shanghai 200240, China
To study the metabolism of non-polysaccharide components of Sijunzi Decoction (四君子汤) in human intestinal and liver microsomes, clarify their metabolic profiles and metabolic differences, and provide support for their clinical application.Acquity UPLC I-class/VION IMS QTOF was applied to analyze the metabolites and metabolic transformation of non-polysaccharide components (isoliquiritin, liquiritigenin, glycyrrhizic acid, glycyrrhetinic acid, ginsenoside Rb1, ginsenoside CK, atractylenolide III) of Sijunzi Decoction in human intestinal and liver microsomes.Glycyrrhizic acid and glycyrrhetinic acid were mainly metabolized by phase I in human intestinal and liver microsomes, while isoliquiritin, liquiritigenin, ginsenoside Rb1, and ginsenoside CK were mainly metabolized by phase II in human intestinal microsomes. Atractylenolide III was less metabolized in both intestinal and liver microsomes, while other compounds in the non-polysaccharide components of Sijunzi Decoction were metabolized more rapidly in human intestinal microsomes than in liver microsomes. Glycyrrhizic acid and ginsenoside mainly underwent deglycosylation. Isoliquiritin mainly underwent deglycosylation and hydroxylation. Liquiritigenin mainly took combination reaction with glucuronic acid. Atractylenolide III mainly underwent hydrolysis and hydroxylation.This study elucidates the metabolic profiles and metabolic differences of the non-polysaccharide components of Sijunzi Decoction in human intestinal and liver microsomes, which is important for clarifying the metabolic transformation process of Sijunzi Decoction in the body, and also provides ideas and strategies for traditional Chinese medicine prescriptions.
Sijunzi Decoction; human intestinal microsome; human liver microsome;metabolism; isoliquiritin; liquiritigenin; glycyrrhizic acid; glycyrrhetinic acid; ginsenoside Rb1; ginsenoside CK; atractylenolide III
R285.61
A
0253 - 2670(2023)15 - 4905 - 15
10.7501/j.issn.0253-2670.2023.15.016
2023-02-08
国家自然科学基金资助项目(81973441)
沈 怡(1998—),女,硕士研究生,研究方向为生药学。E-mail: shenyi-2020@sjtu.edu.cn
通信作者:李晓波,女,博士,从事生药学研究。E-mail: xbli@sjtu.edu.cn
[责任编辑 李亚楠]
