黄芪-莪术药对及其活性成分抗肝癌作用机制研究进展
2023-08-03陈子超赵春芹刘名玉蔡梅超
鲍 宁,陈子超,赵春芹,刘名玉,张 振,李 肖*,蔡梅超*
黄芪-莪术药对及其活性成分抗肝癌作用机制研究进展
鲍 宁1,陈子超2,赵春芹3,刘名玉3,张 振3,李 肖3*,蔡梅超1*
1. 山东中医药大学药学院,山东 济南 250355 2. 山东中医药大学实验中心,山东 济南 250355 3. 山东中医药大学中医药创新研究院,山东 济南 250355
原发性肝癌为我国高发恶性肿瘤,中医认为肝癌的主要病因是“气虚血瘀”,其治法以“益气活血”为主。黄芪-莪术为益气活血法代表性药对,已有研究表明该药对及其活性成分具有明确的抗肝癌作用。通过对黄芪-莪术药对及其活性成分抗肝癌作用机制相关文献进行梳理,从抑制细胞增殖、诱导细胞凋亡、抑制细胞迁移和侵袭、抑制新血管生成、改善免疫微环境、逆转多药耐药等角度对其抗肝癌作用机制进行综述,为黄芪-莪术药对的临床用药和抗肝癌中药新药研发提供依据。
黄芪;莪术;药对;肝癌;免疫微环境;黄芪甲苷;毛蕊异黄酮;莪术醇;吉马酮;姜黄素
原发性肝癌是最常见的恶性肿瘤之一,其中肝细胞癌约占90%[1]。世界卫生组织数据显示,2020年全球肝癌新发病例近90万,中国约占45.3%[2]。原发性肝癌是当前我国第4位常见恶性肿瘤及第2位肿瘤致死病因,对人类的生命健康造成了严重威胁[3]。中药作为我国原创性药物资源在肝癌治疗领域已有较多应用,其与放疗、化疗、手术等联合使用不仅可提高疗效,还可改善机体免疫系统功能,减轻患者的不良反应,提高患者生存质量[4-6]。中药药对作为中药复方的特色之一,是历代医家根据临床经验凝练提取的精华所在[7]。黄芪-莪术配伍源于张锡纯所著《医学衷中参西录》中的理冲汤,其用药比为1∶1,该方主治气虚血瘀证,莪术以消冲瘀血,而党参、黄芪以保护气血,则瘀血去而气血不至伤损;且黄芪能补气,得莪术以流通之,则补而不滞,而元气愈旺;元气既旺,愈能鼓舞莪术之力以消癥瘕,此其所以效也[8]。中医认为肝癌的发病机制多为正气亏虚、瘀血凝滞,黄芪扶益正气,莪术破血消癥,二者配伍不仅互补弊端,更有利于发挥各自优势,起到破瘀不伤正、行气不留瘀的作用。本文首先从不同层面对黄芪-莪术配伍理论进行研究,进一步整合国内外相关研究,对黄芪-莪术药对中可能的抗肝癌有活性成分及其作用机制进行总结,为研究黄芪-莪术药对抗肝癌提供理论基础及思路指导。
1 配伍理论研究
1.1 基于用药经验的配伍研究
古今医家认为正气亏虚为肝癌的发病内因和前提,瘀血凝滞是肝癌发病的基本病理因素,正气不足、瘀血阻滞伴随着肝癌的发生、发展和转移[9]。武嫣斐等[10]和李永健等[11]发现在脾气虚型、肝血瘀阻型、肝郁气滞型等原发性肝癌患者中,以气滞血瘀、肝郁脾虚为常见主要证型,并提出将理气、活血化瘀法贯穿于肝癌治疗的始终。已有研究指出在治疗肝癌过程中不仅要辅助正气,还要同时行气活血,二者兼顾方能共凑扶正祛邪之效[12]。早在《伤寒杂病论》中已将益气药与活血药配伍使用,益气活血法目前为临床治疗肿瘤的常用方法之一,其中黄芪-莪术为益气活血法代表性药对[12-18]。窦永起教授指出益气活血法是肿瘤临床不可或缺的抑制肿瘤生长和转移的有效治法,其中益气药物常选生黄芪、党参(15~30 g),气虚甚者可增至50 g;活血药物常用莪术、郁金、土鳖虫、片姜黄等(10~15 g),其拟定的扶正散结方可改善肿瘤患者生存质量、提高患者的放化疗完成率、延缓肿瘤的复发和转移[19-20]。国医大师朱春良进一步指出:“黄芪得莪术,补气而不壅中,攻破并不伤正”,2药配伍则“破中有补、补中有行、相得益彰”,并进一步指出临证时以气虚为主应重黄芪用量(30~60 g),若以血瘀为主则加重莪术用量(10~15 g)[21]。孙桂芝教授擅用桃红芪术软肝煎起益气活血之效,认为黄芪-莪术配伍在治疗肝癌时可补脾胃、破癥消积,对肝癌有很好的抑制作用,并在临床实践中将益气活血法与化疗相结合,可显著提高肝癌患者的生存质量,在提高肝癌远期疗效上具有一定优势[22-24]。侯智通等[25]以益气活血汤(其中黄芪-莪术2∶1)辨证配合肝动脉化疗栓塞术可有效降低早期原发性肝癌患者肿瘤供血和供血速度。杜相宇[26]通过总结在临床常用莪术配黄芪为主治疗各种癌症及肉瘤,认为莪术虽行气活血消积之力强,而耗散正气之弊反而不大,与黄芪合用,尤善于破积,针对血瘀气虚型病机颇有成效。
1.2 基于体外成分相互作用的配伍研究
中药活性成分是中药发挥疗效的物质基础,配伍后产生的成分变化是研究中药配伍机制的基础,药对经过配伍后,由于2药间发生化学反应使活性成分溶出率发生变化达到增效或减毒的目的,目前多采用质谱与色谱结合的方法对药对配伍前后的成分变化进行分析,探讨其配伍规律,为临床用药提供指导[27-28]。吴佳菲等[29]通过高效液相色谱法对黄芪单煎、莪术单煎、共煎有效成分含量进行测定,结果显示黄芪单煎时黄芪甲苷、黄芪皂苷I、黄芪皂苷II、毛蕊异黄酮、芒柄花素含量分别为0.094 3、0.383 6、0.377 0、0.080 3、0.034 9 mg/g;莪术单煎时莪术二酮、莪术醇含量分别为0.924 2、0.523 0 mg/g;2药共煎时这些成分含量为单煎的2~3倍,推测黄芪中皂苷类及黄酮类成分对莪术中的脂质成分有一定的助溶作用。Yin等[30]应用超高效液相色谱-三重四极杆串联质谱法测定黄芪、莪术中17种活性成分,发现与单煎相比,共煎莪术烯醇、莪术二酮、异莪术烯醇、莪术呋喃二烯酮、莪术醇和吉马酮(0.279、0.830、0.006、0.106、0.571、0.017 mg/g)等脂溶性成分含量均显著增加,表明黄芪-莪术配伍可以促进活性成分的溶出。
1.3 基于体内生物效应的配伍研究
中药配伍后相互作用可影响生化指标、组织形态及引起内源性代谢物发生变化,且这些相互作用受配伍比例的影响,比例关系的改变会导致作用效果的改变[27,31]。药对配伍后的药效学评价是判断2药配伍是否合理的重要考察内容[28]。许成勇等[32]通过研究黄芪-莪术不同配比(0∶1、1∶1、2∶1、3∶1)的抗肿瘤效果及其抗肿瘤血管生成机制,发现黄芪-莪术3∶1对肿瘤大小及血管生成的抑制作用最好,推测黄芪可增强莪术下调血管生成相关蛋白转化生长因子-β(transforming growth factor-β,TGF-β)、缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)的表达。近年来代谢组学技术已被广泛应用于药对配伍机制研究,Sun等[33]基于超高效液相色谱四极杆飞行时间质谱的代谢组学方法检测黄芪-莪术不同配伍比例对结直肠癌荷瘤小鼠血清内源性代谢物和代谢途径的影响,发现黄芪-莪术配伍后可通过调节缬氨酸、亮氨酸、异亮氨酸、氨酰-tRNA生物合成,咖啡因代谢和视黄醇代谢发挥抗肿瘤作用,且黄芪-莪术2∶1效果最佳。
2 抗肝癌的作用机制研究
2.1 抑制细胞增殖
恶性肿瘤的发生、发展与细胞增殖密切相关,阻滞肿瘤细胞周期进而抑制增殖是抗肿瘤的一个重要策略[34-35]。研究表明黄芪、莪术中的多种成分黄芪总黄酮、黄芪多糖、毛蕊异黄酮、莪术油、莪术醇、莪术二酮均可通过阻滞肝癌细胞周期发挥抗肿瘤作用[36-39]。细胞周期的调控与细胞周期蛋白(Cyclin)、Cyclin依赖性激酶(Cyclin-development protein kinases,CDKs)等相关[40]。Liu等[41]发现黄芪中的黄酮类成分毛蕊异黄酮100 μmol/L可有效促进人肝癌HepG2细胞周期停滞在G0/G1期,其机制是通过降低细胞中CDK2/4/6、Cyclin D1和Cyclin E蛋白的表达;芒柄花素0.006 μmol/mL可通过环氧合酶-2(cyclooxygenase-2,COX-2)/Cyclin D轴促进人肝癌Bel-7402细胞和HepG2细胞周期停滞在G0/G1期[29,42]。吉马酮是莪术的主要活性成分之一,HepG2和BEL-7402细胞经吉马酮80、160、200 μmol/L处理24 h后,其细胞周期停滞于G2/M期,其机制为激活p21的表达,促使其与CDK1、Cyclin B1和增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)的竞争性结合,避免细胞分裂周期蛋白25催化的CDK1去磷酸化,从而抑制CDK1活性[43]。此外,黄芪、莪术中的非特异性成分如芦丁、异鼠李素、异甘草素等都对肝癌细胞的周期有一定的影响[44-46]。
2.2 诱导细胞凋亡
细胞凋亡是细胞为维持稳定的内环境而发生的自主有序的死亡,诱导细胞凋亡是抗肿瘤的常见手段,导致细胞凋亡的主要途径有线粒体应激参与的内源性途径和死亡受体介导的外源性途径[34]。黄芪、莪术中的有效成分主要通过线粒体途径诱导细胞凋亡,黄芪多糖0.1、0.5、1.0 mg/mL可下调B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)和上调Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)的表达,激活半胱氨酸天冬氨酸蛋白酶-3(cystein- asparate protease-3,Caspase-3)和Caspase-9的级联反应产生,从而诱导小鼠肝癌H22细胞凋亡[47];毛蕊异黄酮100 μmol/L可靶向线粒体途径,通过丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)和核因子-κB(nuclear factor-κB,NF-κB)信号通路促进活性氧的产生进而诱导细胞凋亡,且对正常细胞无毒性[41];黄芪多糖100、200 mg/L和莪术中的β-榄香烯20、50、100 μg/mL可通过抑制HepG2细胞中的Wnt/β-连环蛋白(β-catenin)信号通路促进细胞凋亡[48-49]。黄芪水煎剂、黄芪甲苷也可以通过抑制NF-κB信号通路来增强细胞免疫功能,进而诱导HepG2细胞凋亡[50-51]。
2.3 抑制细胞迁移和侵袭
肝细胞癌具有较高的侵袭、转移性,是导致临床肿瘤治疗失败的主要原因之一[52]。黄芪-莪术配伍水煎液0.60、0.30、0.15 g/mL通过下调、的表达发挥抗肝癌侵袭、转移的作用[53]。黄芪多糖300 mg/L通过下调人肝癌SMMC-7721细胞中Janus激酶(Janus kinases,JAK)/STAT通路相关蛋白表达起到抑制迁移和侵袭的作用[54]。大量研究表明上皮间质转化(epithelial-mesenchymal transition,EMT)在肿瘤迁移和侵袭过程中发挥重要作用[55-56]。研究表明黄芪甲苷10、50、100 μg/mL可上调具有低转移潜能和高转移潜能的人肝癌Huh-7细胞和MHCC97-H细胞中E-cadherin的蛋白表达,促进其在细胞膜上积累,使细胞间连接更加紧密从而降低转移扩散能力。此外黄芪甲苷50、100 μg/mL还可以通过降低蛋白激酶B(protein kinase B,Akt)磷酸化,抑制其对糖原合成酶激酶-3β(glycogen synthasekinase-3β,GSK-3β)的降解作用,进而促进β-catenin磷酸化,抑制EMT过程。姜黄素10、20、30 μmol/mL通过白细胞介素-6受体α(interleukin-6 receptor α,IL6-Rα)/JAK2/Akt/GSK-3β抑制HepG2细胞的EMT过程;β-榄香烯20、50、100 μg/mL可通过降低HepG2细胞内Wnt1的表达抑制GSK-3β的表达,进而抑制EMT过程[49,57-58]。研究表明毛蕊异黄酮与姜黄素均可以通过影响TGF-β/Smad2的表达影响EMT过程[41,59]。黄芪有效成分也可通过调控长链非编码RNA(long non-coding RNA,lncRNA)的表达而抑制肿瘤细胞的EMT过程,黄芪甲苷20、40、80、160 μg/mL可呈剂量相关性下调lncRNA-的表达抑制SMMC-7721细胞的EMT过程,从而抑制肝癌细胞的迁移和侵袭[60]。Huang等[47]研究发现在肝细胞癌细胞中存在Notch1过表达,Notch1会改善肝细胞癌细胞的生存时间和血管生成拟态,黄芪多糖0.1、0.5、1.0 mg/mL可降低H22细胞中Notch1的表达,进而下调基质金属蛋白酶9(matrix metalloprotein 9,MMP9)和COX-2水平从而抑制迁移。
2.4 抑制肿瘤新血管生成
恶性肿瘤的生长、浸润和转移依赖于血管生成,血管内皮生长因子(vascular endothelial growth factor,VEGF)能够促进内皮细胞增殖,诱导肿瘤附近的正常毛细血管转变为新的毛细血管,从而促进肿瘤的生长[61-62]。黄芪-莪术水煎液3、6、12 g/kg能够降低人肝癌裸鼠原位移植瘤中VEGF的表达使肿瘤新生血管生成受到抑制[63]。Zhang等[64]研究表明黄芪甲苷和姜黄素单独使用及联合使用均能抑制HepG2原位裸鼠模型中的肿瘤生长和血管生成,且黄芪甲苷20 mg/kg与姜黄素100 mg/kg联用对VEGF、MMP2、成纤维细胞生长因子-2(fibroblast growth factor-2,FGF-2)和肝细胞生长因子(hepatocyte growth factor,HGF)及血栓形成相关因子组织因子(tissue factor,TF)和凝血因子VII(coagulation factor VII,FVII)有协同抑制作用。HIF-1在促进肿瘤血管的生成方面也起到重要作用,决定HIF-1活性的HIF-1α已被证实与肿瘤血管新生密切相关,臧文华等[63]和骆殊等[65]发现黄芪、莪术水煎液及黄芪甲苷与姜黄素配伍使用可降低人肝癌裸鼠原位移植瘤中HIF-1α的表达抑制肿瘤新血管的生成。CD147是位于肿瘤细胞膜表面的跨膜糖蛋白,有研究表明CD147可通过HIF-2α通路调节VEGF及VEGF-R2的表达进而刺激肿瘤血管的生成[66-67]。黄芪、莪术水煎液6、12 g/kg及同剂量联合顺铂可下调人肝癌裸鼠移植瘤中的CD147的表达抑制肿瘤新血管的生成,且呈剂量相关性[68]。
2.5 改善肿瘤免疫微环境
肿瘤免疫微环境可动态调控肝癌的发生、发展及转移[69-70]。黄芪水煎液40 mg/mL能够刺激人外周血单个核细胞(peripheral blood mononuclear cell,PBMC)分泌γ-干扰素、肿瘤坏死因子(tumor necrosis factor,TNF),从而使PBMC活化增强对肿瘤细胞的杀伤能力[71]。巨噬细胞是具有多种功能的免疫细胞,巨噬细胞吞噬外来异己细胞后,诱导主要组织相容性复合物II(major histocompatibility complex II,MHCII)和MHCⅠ及协同刺激分子如CD40、CD86等,这些分子参与T细胞活化的第1信号通路和第2信号通路,促进抗原的递呈从而激活T细胞[72]。黄芪甲苷联合β-榄香烯100、150 μg/mL可增强小鼠巨噬细胞J447A.1Mφ的吞噬能力,并且可以增强巨噬细胞表面MHCII、MHCI类分子及共刺激因子CD40、CD86的表达,促进巨噬细胞递呈外源性抗原及激活T细胞从而使机体更好的发挥免疫应答能力[73]。树突状细胞(dendritic cells,DCs)可以通过分泌细胞因子发挥免疫应答作用,细胞因子IL-2和IL-6的靶细胞主要是T细胞和自然杀伤细胞(natural killer cell,NK),一方面可以增强CD8 T细胞的杀伤作用,增强DCs细胞抗原呈递功能,另一方面可以增强NK细胞的杀伤能力,从而增强固有免疫功能,因此IL-2和IL-6是连接固有免疫和获得性免疫的一个重要纽带[74-75]。黄芪总皂苷80 mg/mL、黄芪多糖100、200、400 mg/kg可促进H22荷瘤小鼠体内的IL-2、IL-6的产生[76-77];黄芪甲苷和β-榄香烯10 μg/mL联用能够促进DCs细胞分泌IL-2、IL-6等细胞因子从而增强细胞的免疫功能[78]。
2.6 逆转肿瘤多药耐药(multidrug resistance,MDR)
MDR是临床肿瘤化疗失败的主要原因之一,据统计90%肝癌患者化疗失败的原因与细胞的MDR密切关联,干扰或阻止药物耐药是目前癌症治疗需要攻克的难题,中药治疗或可以提供解决这一障碍的新方法[79]。多项研究表明黄芪、莪术有效成分在体内外均能增加化疗药物的治疗效果、减少化疗药物对机体的损伤[80-81]。多药耐药相关蛋白1(multidrug resistance-associated protein 1,MRP1)是引起MDR的一种跨膜蛋白[82-83]。黄芪多糖50、100、200 mg/kg能够通过下调MRP1的蛋白表达,并且与顺铂-多柔比星化疗干预相比,黄芪多糖与其联合使用MRP1的蛋白表达下调作用更为显著,表明黄芪多糖在一定程度上能够拮抗肿瘤细胞的耐药性,增强对化疗药物的敏感性[84]。
黄芪-莪术药对及其活性成分抗肝癌主要分子机制见图1。其他活性成分如黄芪皂苷II、黄芪多糖、姜黄素等能够通过介导死亡受体途径诱导凋亡、干涉自噬溶酶体途径、调节miRNA表达、调节免疫因子等发挥抗肝癌作用,见表1。
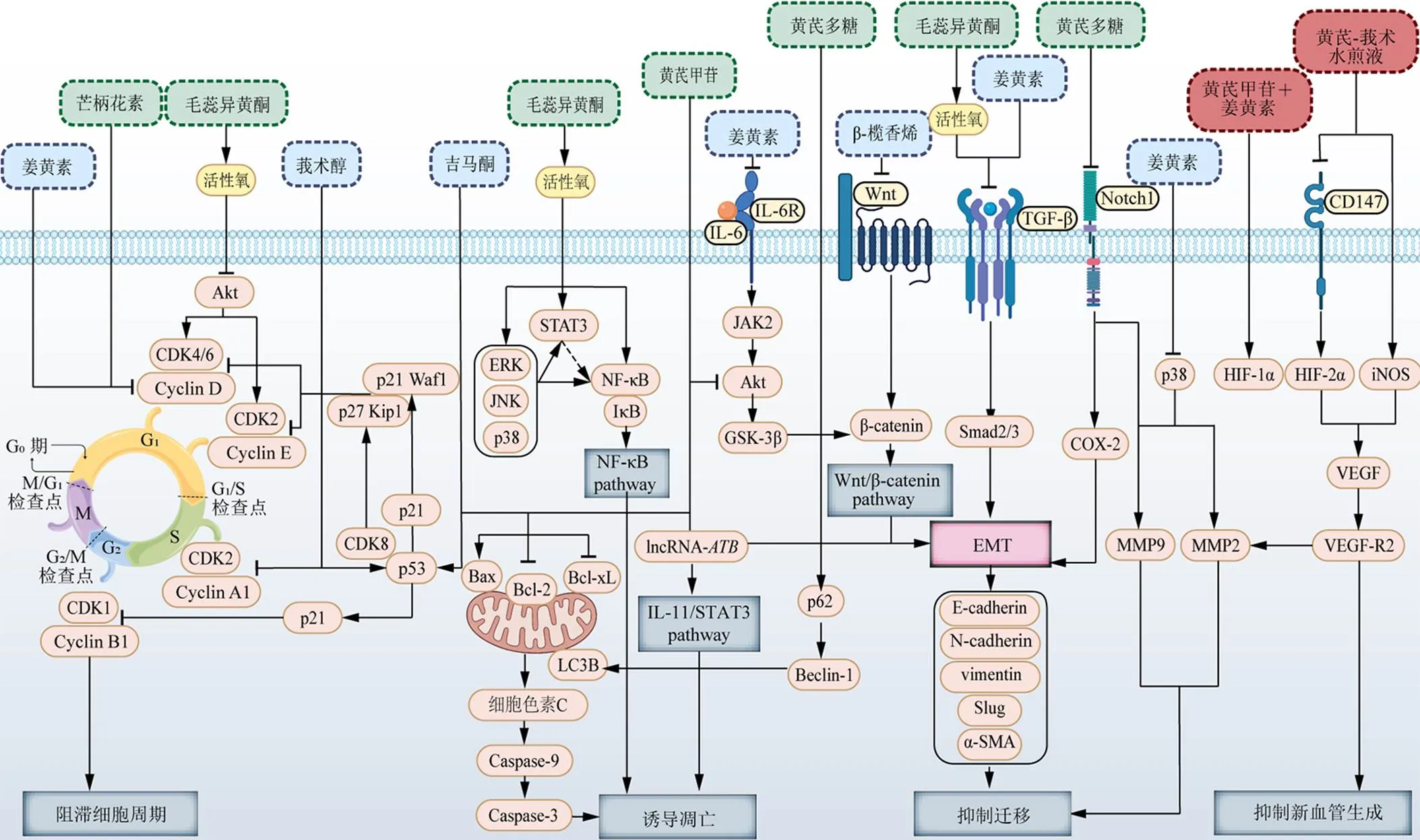
图1 黄芪-莪术药对及其有效成分抗肝细胞癌的作用机制

表1 黄芪-莪术药对及其有效成分抗肝细胞癌作用机制
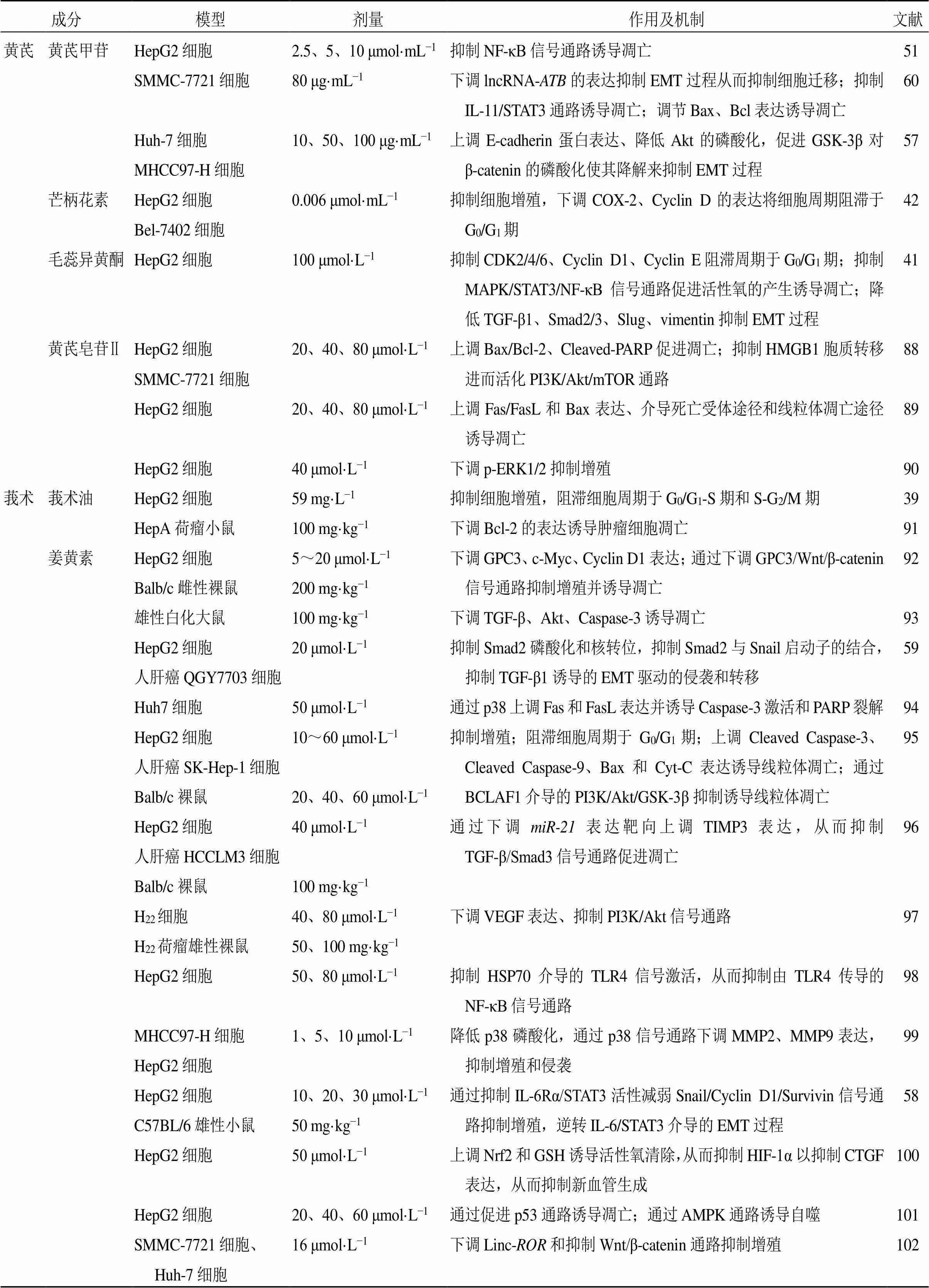
续表1

续表1
3 结语与展望
黄芪-莪术作为我国传统药对,具有悠久的用药历史,其配伍使用被广泛应用于抗肿瘤治疗。现代研究发现黄芪总黄酮、黄芪多糖、黄芪甲苷、姜黄素、莪术醇等成分在抗肿瘤方面发挥重要作用。首先,通过阻滞肝癌细胞的周期进程抑制细胞增殖;其次,通过线粒体途径等诱导肿瘤细胞凋亡;此外,通过抑制EMT过程、调节Wnt/β-catenin信号通路来抑制肿瘤细胞迁移和侵袭。黄芪、莪术中的活性成分还能在抑制新血管生成、改善肿瘤免疫微环境、逆转MDR等方面发挥重要作用。
尽管目前对黄芪、莪术抗肝癌机制的研究取得了一定进展,但仍有多方面的问题有待进一步的探索:(1)现阶段对黄芪-莪术药对抗肝癌配伍的科学内涵阐释不清,多数研究集中在单味药及单个成分的作用机制上,对药对配伍及多成分协同抗肝癌研究较少。(2)目前该药对抗肝癌研究主要集中在药理机制层面,多学科间关联性研究较少。针对上述存在的问题,综合现阶段的研究成果,笔者认为,以体外成分为切入点,从配伍前后体内外化学成分变化、药动学行为及作用机制3个层面进行系统研究,有助于阐明二者配伍的协同增效机制。如单煎与共煎是否影响成分在体内的含量及其药动学行为。目前成分配伍主要集中在黄芪多糖、黄芪甲苷、姜黄素、β-榄香烯,更多成分的配伍有待进一步研究。其次是应注重多学科间的关联发展,注重整体性研究。如网络药理学、生物信息学与转录组学、蛋白组学、代谢组学等多组学整合系统研究方法,有助于全面阐释黄芪-莪术药对及其有效成分抗肝癌的多成分、多靶点、多通路的作用机制。
另外中药的多成分作用广泛,难以明确其唯一作用途径,因此在临床使用时与现代医学理论的融合尚有欠缺,笔者认为应以中医药辨证论治结合现代医学知识和科技手段,深入研究药物作用机制并实现传统医学理论与现代科技手段的相互交融,以促进临床应用与基础研究的紧密结合,为中药抗肿瘤的进一步发展提供依据。以上问题的解决将为更准确寻找、确认和优化黄芪、莪术发挥抗肝癌效应的有效成分与靶点的作用,推动临床应用提供新的见解,为肝癌治疗提供新的方法。
利益冲突 所有作者均声明不存在利益冲突
[1] Vogel A, Meyer T, Sapisochin G,. Hepatocellular carcinoma [J]., 2022, 400(10360): 1345-1362.
[2] Sung H, Ferlay J, Siegel R L,. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]., 2021, 71(3): 209-249.
[3] 原发性肝癌诊疗指南 (2022年版) [J]. 肿瘤综合治疗电子杂志, 2022, 8(2): 16-53.
[4] Qi F H, Zhao L, Zhou A Y,. The advantages of using traditional Chinese medicine as an adjunctive therapy in the whole course of cancer treatment instead of only terminal stage of cancer [J]., 2015, 9(1): 16-34.
[5] 何志军, 张健, 王佩, 等. 补中益气汤加减改善肝癌患者肝动脉化疗栓塞术后疲劳状态及生活质量临床观察 [J]. 湖北中医药大学学报, 2020, 22(1): 105-108.
[6] 郭京华. 中药方剂缓解肝癌化疗后症状的临床研究 [J]. 北方药学, 2018, 15(5): 18-19.
[7] 袁海建, 李国银, 姜俊, 等. 半夏-厚朴药对抗肿瘤功效物质基础及作用机制研究新思路 [J]. 中草药, 2018, 49(8): 1924-1931.
[8] 王惠. 理冲汤加减方联合5-氟尿嘧啶对肝癌上皮间质转化影响的实验研究 [D]. 南京: 南京中医药大学, 2019.
[9] 臧文华, 唐德才. 益气活血法治疗原发性肝癌的理论探讨 [J]. 中国中医基础医学杂志, 2015, 21(12): 1498-1500.
[10] 武嫣斐, 王素萍, 孙健民, 等. 原发性肝癌中医证型临床分布及证型标准 [J]. 山西中医学院学报, 2007, 8(2): 21-23.
[11] 李永健, 方肇勤, 邸若虹, 等. 2492例肝癌辨证分型临床报道的统计分析 [J]. 中国中医基础医学杂志, 2001, 7(6): 69-71.
[12] 卢冬雪, 祁明浩, 薛恬, 等. 刘沈林治疗晚期消化道肿瘤用药经验 [J]. 世界中西医结合杂志, 2017, 12(8): 1064-1068.
[13] 孙颖, 孙彬栩, 贾英杰. 贾英杰教授辨治恶性肿瘤血瘀证经验 [J]. 天津中医药大学学报, 2020, 39(2): 135-137.
[14] 张新华. 段凤舞老师运用参赭培气逐淤汤治疗原发性肝癌的经验 [J]. 黑龙江中医药, 1988, 17(1): 7-8.
[15] 唐德才. 活血化瘀药在抗肿瘤及转移中的运用思考 [J]. 南京中医药大学学报, 2019, 35(1): 1-4.
[16] 陈吉全, 刘冉女. 庞景三教授运用黄芪-党参-三棱-莪术药串经验 [J]. 中医研究, 2012, 25(9): 40-42.
[17] 宋希朋. 乳腺癌术后常规化疗辅以中药治疗对患者远期转移复发率及生活质量的影响 [J]. 现代中西医结合杂志, 2016, 25(33): 3670-3672.
[18] 倪俊刚. 黄芪抗癌汤干预乳腺癌术后复发转移的临床观察 [J]. 中国中医药科技, 2016, 23(5): 599-600.
[19] 许成勇. 窦永起教授治疗肿瘤学术思想总结及黄芪-莪术配伍抗肿瘤血管生成机制研究 [D]. 北京: 中国人民解放军医学院, 2018.
[20] 徐冉. 窦永起教授诊治恶性肿瘤学术经验总结与研究 [D]. 北京: 中国人民解放军医学院, 2019.
[21] 张勤华, 齐聪, 黄宗瀚. 气虚血瘀证卵巢癌大鼠的预后及其与肿瘤新生血管形成的相关性 [J]. 上海中医药杂志, 2007, 41(6): 73-75.
[22] 王靖思, 陈兰羽, 刘玉琴, 等. 孙桂芝从补脾胃、治未病论治肝癌经验 [J]. 中医杂志, 2015, 56(13): 1096-1098.
[23] 王靖思. 从桃红芪术软肝煎抗肝纤维化探讨孙桂芝教授防治肝癌经验内涵 [D]. 北京: 中国中医科学院, 2015.
[24] 王靖思, 孙桂芝, 赵杰. 孙桂芝“益气活血软坚解毒法”论治原发性肝癌经验介绍 [J]. 中华中医药杂志, 2015, 30(1): 112-114.
[25] 侯智通, 马晓霞, 仪孝臣. 益气活血汤剂配合介入治疗早期原发性肝癌影像学疗效分析 [J]. 中国实验方剂学杂志, 2011, 17(17): 303-304.
[26] 杜相宇. 以β-catenin为中心研究芪术抗癌方联合五氟尿嘧啶对CT26.WT原位移植瘤小鼠肝转移的影响 [D]. 南京: 南京中医药大学, 2020.
[27] 郑雁雪, 王圆圆, 王琳, 等. 中药配伍减毒增效的现代研究及思考 [J]. 中草药, 2023, 54(2): 386-395.
[28] 宋佳, 高晓霞, 田俊生, 等. 中药药对配伍机制的现代研究 [J]. 中草药, 2017, 48(21): 4367-4374.
[29] 吴佳菲, 姚映芷, 尹刚, 等. HPLC对黄芪和莪术单煎、单煎后合并及共煎的有效成分含量分析 [J]. 中华中医药杂志, 2018, 33(4): 1567-1570.
[30] Yin G, Cheng X L, Tao W W,. Comparative analysis of multiple representative components in the herb pair-and its single herbs by UPLC-QQQ-MS [J]., 2018, 148: 224-229.
[31] 刘佳宁, 李遇伯, 王玉丽, 等. 基于配伍相互作用的中药合理用药研究进展及监管思考 [J]. 中草药, 2023, 54(2): 375-385.
[32] 许成勇, 徐冉, 王毓国, 等. 不同剂量配比黄芪-莪术抑制Lewis肺癌生长转移及其对TGF-β1、HIF-1α表达的影响 [J]. 北京中医药, 2018, 37(11): 1069-1072.
[33] Sun R L, Gu J F, Chang X W,. Metabonomics study on orthotopic transplantion mice model of colon cancer treated with-in different proportions via UPLC-Q-TOF/MS [J]., 2021, 193: 113708.
[34] 徐世一, 刘秀波, 陆佳欣, 等. 黄芪活性成分抗肿瘤作用机制的研究进展 [J]. 中草药, 2022, 53(23): 7613-7623.
[35] 刘晓燕, 龙凤, 赵玉, 等. 蒲公英中有效成分抗肿瘤作用机制的研究进展 [J]. 中草药, 2023, 54(10): 3391-3400.
[36] 张慧蓉, 钱敏, 李萌. 黄芪多糖通过线粒体自噬抑制肝癌肿瘤细胞 [J]. 西北药学杂志, 2021, 36(3): 426-429.
[37] 张冬青. 黄芪总黄酮及其活性成分对肿瘤细胞的抑制作用与机理研究 [J]. 北京: 中国人民解放军医学院2010.
[38] 黄岚珍, 王娟, 卢菲婷, 等. 莪术醇抑制人肝癌细胞HepG2增殖的机制 [J]. 中国中药杂志, 2013, 38(11): 1812-1815.
[39] 王佳丽, 王秀, 夏泉, 等. 莪术油中3种倍半萜类化合物对肝癌HepG2细胞增殖抑制作用的研究 [J]. 中成药, 2014, 36(7): 1535-1539.
[40] 刘洋. 毛蕊异黄酮诱导肝癌细胞凋亡机制的研究 [D]. 大庆: 黑龙江八一农垦大学, 2021.
[41] Liu Y, Piao X J, Xu W T,. Calycosin induces mitochondrial-dependent apoptosis and cell cycle arrest, and inhibits cell migration through a ROS-mediated signaling pathway in HepG2 hepatocellular carcinoma cells [J]., 2021, 70: 105052.
[42] 焦文鹏, 焦文静, 张金艳. 刺芒柄花素通过COX-2/ cyclin D1轴调控肝癌的发生和发展 [J]. 中国肿瘤生物治疗杂志, 2021, 28(9): 877-884.
[43] Liu Y Y, Wang W, Fang B,. Anti-tumor effect of germacrone on human hepatoma cell lines through inducing G2/M cell cycle arrest and promoting apoptosis [J]., 2013, 698(1/2/3): 95-102.
[44] 沈钦海, 马臻, 陈国民. 芦丁对HepG2细胞生长的影响 [J]. 第三军医大学学报, 2006, 28(18): 1885-1887.
[45] 蒋晨春, 向义, 钟勇. 异鼠李素对人肝癌HepG-2细胞增殖与凋亡影响的实验研究 [J]. 西南军医, 2012, 14(3): 432-435.
[46] 赵参军, 黄晓峰. 异甘草素抑制人肝癌细胞株HepG-2增殖的机制探讨 [J]. 武警后勤学院学报: 医学版, 2019, 28(5): 1-6.
[47] Huang W H, Liao W R, Sun R X.polysaccharide induces the apoptosis of human hepatocellular carcinoma cells by decreasing the expression of Notch1 [J]., 2016, 38(2): 551-557.
[48] 吕君, 朱鹏飞, 刘艳民, 等. 黄芪多糖通过Wnt/β- catenin信号通路促进肝癌细胞凋亡研究 [J]. 中草药, 2018, 49(21): 5155-5160.
[49] 叶兴涛, 史国军, 陆宁, 等. 莪术提取物介导Wnt/β- catenin信号通路对人肝癌Hep-G2细胞的影响 [J]. 解剖学杂志, 2020, 43(6): 472-476.
[50] 安方玉, 史旭锋, 颜春鲁, 等. 黄芪水煎剂对荷H22肝癌小鼠瘤组织凋亡及肝损伤调控的作用机制 [J]. 华西药学杂志, 2020, 35(4): 392-396.
[51] 安小翠, 朱瑞雪, 蔺淑梅, 等. 黄芪甲苷抑制ROS NF-κB信号通路促进肝癌细胞增殖、凋亡的作用机制 [J]. 现代消化及介入诊疗, 2019, 24(12): 1399-1403.
[52] Stuelten C H, Parent C A, Montell D J. Cell motility in cancer invasion and metastasis: Insights from simple model organisms [J]., 2018, 18(5): 296-312.
[53] 臧文华, 黄显章, 唐德才, 等. 黄芪-莪术联合顺铂诱导肝癌细胞凋亡及其对,,表达的影响 [J]. 中国实验方剂学杂志, 2016, 22(17): 87-91.
[54] 徐放, 安铁洙, 朴善花, 等. 黄芪多糖通过Janus激酶/信号转导与转录激活子信号通路对肝癌细胞SMMC-7721侵袭和转移的影响 [J]. 中国临床药理学杂志, 2020, 36(11): 1499-1502.
[55] Brabletz T, Kalluri R, Nieto M A,. EMT in cancer [J]., 2018, 18(2): 128-134.
[56] Dongre A, Weinberg R A. New insights into the mechanisms of epithelial-mesenchymal transition and implications for cancer [J]., 2019, 20(2): 69-84.
[57] Qin C D, Ma D N, Ren Z G,. Astragaloside IV inhibits metastasis in hepatoma cells through the suppression of epithelial-mesenchymal transition via the Akt/GSK-3β/β-catenin pathway [J]., 2017, 37(3): 1725-1735.
[58] Cao W Y, Zhang Y C, Li A M,. Curcumin reverses hepatic epithelial mesenchymal transition induced by trichloroethylene by inhibiting IL-6R/STAT3 [J]., 2021, 31(8): 589-599.
[59] Cao M T, Liu H F, Liu Z G,. Curcumin downregulates the expression of Snail via suppressing Smad2 pathway to inhibit TGF-β1-induced epithelial- mesenchymal transitions in hepatoma cells [J]., 2017, 8(65): 108498-108508.
[60] Li Y L, Ye Y, Chen H Y. Astragaloside IV inhibits cell migration and viability of hepatocellular carcinoma cells via suppressing long noncoding RNA ATB [J]., 2018, 99: 134-141.
[61] Goel H L, Mercurio A M. VEGF targets the tumour cell [J]., 2013, 13(12): 871-882.
[62] Lippman S M, Hawk E T. Cancer prevention: From 1727 to milestones of the past 100 years [J]., 2009, 69(13): 5269-5284.
[63] 臧文华, 唐德才, 尹刚, 等. 黄芪莪术配伍对人肝癌裸鼠原位移植瘤新生血管生成的影响 [J]. 时珍国医国药, 2014, 25(3): 516-518.
[64] Zhang S, Tang D C, Zang W H,. Synergistic inhibitory effect of traditional Chinese medicine astragaloside IV and curcumin on tumor growth and angiogenesis in an orthotopic nude-mouse model of human hepatocellular carcinoma [J]., 2017, 37(2): 465-474.
[65] 骆殊, 尹刚, 唐德才. 黄芪甲苷与姜黄素配伍对人肝癌裸鼠原位移植瘤新生血管生成的影响 [J]. 中华肿瘤防治杂志, 2016, 23(S1): 12-13.
[66] Xiong L J, Edwards C K 3rd, Zhou L J. The biological function and clinical utilization of CD147 in human diseases: A review of the current scientific literature [J]., 2014, 15(10): 17411-17441.
[67] Bougatef F, Quemener C, Kellouche S,. EMMPRIN promotes angiogenesis through hypoxia-inducible factor- 2α-mediated regulation of soluble VEGF isoforms and their receptor VEGFR-2 [J]., 2009, 114(27): 5547-5556.
[68] 臧文华, 胡久略, 唐德才, 等. 黄芪、莪术联合顺铂对人肝癌裸鼠CD147、iNOS表达的影响 [J]. 时珍国医国药, 2020, 31(4): 785-788.
[69] Gajewski T F, Schreiber H, Fu Y X. Innate and adaptive immune cells in the tumor microenvironment [J]., 2013, 14(10): 1014-1022.
[70] Binnewies M, Roberts E W, Kersten K,. Understanding the tumor immune microenvironment (TIME) for effective therapy [J]., 2018, 24(5): 541-550.
[71] 王金全, 陈启助, 黄树林, 等. 黄芪总提取物促进PBMC对肝癌细胞的体外杀伤作用 [J]. 广东药学院学报, 2016, 32(1): 66-70.
[72] 王丹, 张玉民, 刘金剑, 等. 巨噬细胞与肿瘤治疗的研究进展 [J]. 河北医科大学学报, 2023, 44(5): 606-611.
[73] 林琳, 沈洪, 王立新. 黄芪甲苷、β-榄香烯增强小鼠巨噬细胞免疫功能的体外实验研究 [J]. 临床检验杂志, 2011, 29(2): 129-131.
[74] Connolly M K, Ayo D, Malhotra A,. Dendritic cell depletion exacerbates acetaminophen hepatotoxicity [J]., 2011, 54(3): 959-968.
[75] Seruga B, Zhang H B, Bernstein L J,. Cytokines and their relationship to the symptoms and outcome of cancer [J]., 2008, 8(11): 887-899.
[76] Lai X Y, Xia W B, Wei J,. Therapeutic effect ofpolysaccharides on hepatocellular carcinoma H22-bearing mice [J]., 2017, 15(1): 1559325816685182.
[77] 安方玉, 刘雪松, 颜春鲁, 等. 黄芪总皂苷对H22荷瘤小鼠肿瘤抑制作用及机制 [J]. 中国公共卫生, 2017, 33(4): 596-598.
[78] 林琳, 沈洪, 王立新, 等. 黄芪甲苷、β-榄香烯对小鼠树突状细胞免疫功能的影响 [J]. 东南大学学报: 医学版, 2011, 30(2): 294-297.
[79] 喻贡金. 艾迪注射液对人肝癌多药耐药细胞的逆转作用研究 [D]. 贵阳: 贵州医科大学, 2017.
[80] 杨洁真, 王晶, 宋永红, 等. 脂质体莪术醇逆转卵巢癌顺铂耐药作用的机制 [J]. 安徽医科大学学报, 2022, 57(7): 1106-1111.
[81] 谢海媚, 李华超, 陈前军. 探讨黄芪甲苷对乳腺癌干细胞化疗增敏作用的体外研究 [J]. 中医肿瘤学杂志, 2022, 4(5): 43-49.
[82] 吴泓. pSUPER载体介导的siRNA抑制肝癌多药耐药基因的表达 [D]. 成都: 四川大学, 2007.
[83] 王新平. 单基因转入人肝癌耐药细胞株的建立及RNA干扰靶向MRP1逆转多药耐药的实验研究 [D]. 成都: 四川大学. 2006.
[84] 潘东山. 黄芪多糖对肝癌化疗的增效减毒作用及其机制的研究 [D]. 牡丹江: 牡丹江医学院, 2020.
[85] 张秀云, 陈建业, 杨映雪, 等. 黄芪总黄酮对肝癌HepG-2细胞凋亡的诱导作用 [J]. 中华中医药学刊, 2013, 31(6): 1320-1322.
[86] 刘礼, 袁昌劲, 郭敬杰, 等. 黄芪多糖抑制HepG2细胞增殖及可能机制研究 [J]. 实用预防医学, 2018, 25(4): 385-387.
[87] 林霄月, 宋高臣. 注射液黄芪多糖对HepG2荷小鼠化疗过程中Ki-67、HIF-1α、VEGF表达的影响研究 [J]. 北方药学, 2020, 17(8): 71-72.
[88] 武超. 黄芪皂苷II通过调控HMGB1-PI3K/Akt/mTOR-溶酶体功能增加顺铂诱导的人肝癌细胞凋亡 [D]. 合肥: 安徽医科大学, 2016.
[89] 陈彦清. 黄芪皂苷II联合5-氟尿嘧啶处理抑制肝癌细胞增殖的实验研究 [J]. 海南医学院学报, 2016, 22(17): 2035-2038.
[90] 武超, 许杜娟, 杨翠, 等. 黄芪皂苷II增加5-氟尿嘧啶对人肝癌细胞株HepG2增殖抑制作用 [J]. 安徽医科大学学报, 2016, 51(1): 78-82.
[91] 张维彬, 谭敏, 肖刚, 等. 莪术油诱导小鼠HepA肝癌细胞凋亡及其对Bcl-2蛋白表达的影响 [J]. 现代中西医结合杂志, 2009, 18(4): 370-371.
[92] Hu P, Ke C Z, Guo X R,. Both glypican-3/Wnt/ β-catenin signaling pathway and autophagy contributed to the inhibitory effect of curcumin on hepatocellular carcinoma [J]., 2019, 51(1): 120-126.
[93] Abouzied M M M, Eltahir H M, Abdel Aziz M A,. Curcumin ameliorate DENA-induced HCC via modulating TGF-β, Akt, and Caspase-3 expression in experimental rat model [J]., 2015, 36(3): 1763-1771.
[94] Wang W Z, Li L, Liu M Y,. Curcumin induces FasL-related apoptosis through p38 activation in human hepatocellular carcinoma Huh7 cells [J]., 2013, 92(6/7): 352-358.
[95] Bai C H, Zhao J Q, Su J L,. Curcumin induces mitochondrial apoptosis in human hepatoma cells through BCLAF1-mediated modulation of PI3K/Akt/GSK-3β signaling [J]., 2022, 306: 120804.
[96] Li J T, Wei H L, Liu Y G,. Curcumin inhibits hepatocellular carcinoma via regulating miR-21/TIMP3 axis [J]., 2020, 2020: 1-13.
[97] Pan Z R, Zhuang J M, Ji C H,. Curcumin inhibits hepatocellular carcinoma growth by targeting VEGF expression [J]., 2018: 4821-4826.
[98] Ren B Q, Luo S D, Tian X F,. Curcumin inhibits liver cancer by inhibiting DAMP molecule HSP70 and TLR4 signaling [J]., 2018: 895-901.
[99] Zhang K, Rui X J, Yan X. Curcumin inhibits the proliferation and invasiveness of MHCC97-H cells via p38 signaling pathway [J]., 2014: 463-468.
[100]Shao S, Duan W X, Xu Q H,. Curcumin suppresses hepatic stellate cell-induced hepatocarcinoma angiogenesis and invasion through downregulating CTGF [J]., 2019, 2019: 1-12.
[101]Chen Y, Li Q A, Ren S S,. Investigation and experimental validation of curcumin-related mechanisms against hepatocellular carcinoma based on network pharmacology [J]., 2022, 23(8): 682-698.
[102]Shao J, Shi C J, Li Y,. LincROR mediates the suppressive effects of curcumin on hepatocellular carcinoma through inactivating Wnt/β-catenin signaling [J]., 2020, 11: 847.
[103]Tang D C, Zhang S, Shi X X,. Combination of astragali polysaccharide and curcumin improves the morphological structure of tumor vessels and induces tumor vascular normalization to inhibit the growth of hepatocellular carcinoma [J]., 2019, 18: 153473541882440.
Research progress on anti-hepatocellular carcinoma mechanisms ofRhizoma herb pair and its active ingredients
BAO Ning1, CHEN Zi-chao2, ZHAO Chun-qin3, LIU Ming-yu3, ZHANG Zhen3, LI Xiao3, CAI Mei-chao1
1. College of Pharmacy, Shandong University of Traditional Chinese Medicine, Jinan 250355, China 2. Experimental Center, Shandong University of Traditional Chinese Medicine, Jinan 250355, China 3. Innovation Institute of Chinese Medicine and Pharmacy, Shandong University of Traditional Chinese Medicine, Jinan 250355, China
Primary hepatocellular carcinoma is a highly prevalent malignant tumor in China. According to traditional Chinese medicine, the main cause of hepatocellular carcinoma is “deficiency and blood stasis”, and its treatment is based on “benefittingand invigorating blood”. Huangqi-Ezhu (-) is a representative herb pair of herbal medicines that benefitand invigorate blood, and studies have shown that this pair and its active ingredients have clear anti-hepatocellular carcinoma effects. In this paper, we have reviewed the literature on the anti-hepatocellular carcinoma mechanism of the-pair and its active ingredients, and reviewed its anti-hepatocellular carcinoma mechanism of action from the aspects of inhibiting proliferation, inducing apoptosis, inhibiting cell metastasis and invasion, inhibiting neoangiogenesis, improving the immune microenvironment, and reversing multidrug resistance, etc., to provide the basis for the clinical use of-pair and the research and development of new Chinese medicine against liver cancer.
;; herb pair; hepatocellular carcinoma; immune microenvironment; astragaloside Ⅳ; calycosin; curcumol; germacrone; curcumin
R285
A
0253 - 2670(2023)15 - 5101 - 11
10.7501/j.issn.0253-2670.2023.15.033
2023-03-04
国家自然科学基金资助项目(82204656);山东省高等学校青创人才引育计划(2021505031);山东中医药大学青年创新团队支持计划(22202105)
鲍 宁,硕士研究生,研究方向为中药效物质基础与新药创新。E-mail: bn990918@163.com
通信作者:李 肖,讲师,从事中药药效物质基础与作用机制研究。E-mail:lixiaoedu@126.com
蔡梅超,副教授,从事中药药效物质基础与新药创新研究。E-mail: 304521130@qq.com
[责任编辑 赵慧亮]
