miR-223对高糖环境培养的视网膜微血管内皮细胞NLRP3/IL-1β通路的调控作用①
2023-07-28董雪松宿星杰齐艳秀
董雪松,刘 丹,宿星杰,张 剑,齐艳秀
(佳木斯大学附属第一医院眼科,黑龙江 佳木斯 154003)
糖尿病视网膜病变(DR)是一种由糖尿病引发的视网膜微血管损害性病变,是严重影响视力,甚至致盲的慢性进行性疾病,是导致50岁以上人群致盲眼病的因素之一。多数学者认为其发病与糖代谢、血液、生长激素、神经退行性变、免疫和慢性炎症等多种因素相关[1]。根据微血管变性和缺血损害程度,糖尿病视网膜病变(DR)可分为增殖性DR(PDR)和非增殖性DR(NPDR)。增殖性DR(PDR)的主要病理特征表现为血管生成和玻璃体视网膜表面纤维化,其机制是巨噬细胞导致的炎症和血管损伤[2]。炎性小体是固有免疫的重要效应分子,由细胞内模式识别受体(PRRS)、衔接蛋白和Caspase酶组成,它们可以促进IL-1β和IL-18促炎性因子释放。目前研究较多的是核苷酸结合寡糖化结构域样受体蛋白-3(NLRP3)炎性小体[3]。既往研究[4]显示,NLRP3异常激活与痛风、动脉粥样硬化、年龄相关性黄斑变性、阿尔茨海默病、肥胖等疾病密切相关。研究[5]显示,早期糖尿病大鼠视网膜中发现高表达NLRP3、Caspase-1、IL-1β和IL-18,沉默NLRP3表达后视网膜血管通透性降低。微小RNA(microRNA,miRNA)是一种长度约20~23个核苷酸的小非编码RNA,miRNA通过与编码蛋白(mRNA)3’UTR上碱基互补配对,在转录后水平上调控基因的表达。既往研究[5]显示,miR-223可通过调节人血管平滑肌细胞NLRP3炎性小体表达,调控动脉粥样硬化的发生,但miR-223在糖尿病视网膜病变(DR)形成过程中是否可通过抑制NLRP3炎性小体发挥保护作用目前未见报道。本文通过将miR-223模拟物和抑制剂以及相对应的miR-NC转入经高糖环境培养的人视网膜微血管内皮细胞(HRMECS),通过与模型组或对照组相比较,探讨miR-223对HRMECS的NLRP3炎性小体、炎性因子表达的影响。本课题旨在研究miR-223通过NLRP3炎性小体对糖尿病视网膜病变(DR)的保护作用的分子机制。
1 材料与方法
1.1 材料与试剂
Invitrogen、胎牛血清、M199组织培养基、链霉素/青霉素、Trizol试剂购自碧云天;人视网膜微血管内皮细胞(HRMECS)购自北京北纳创联生物技术研究院。miR-223阴性对照(miR-NC)、mimcs-miR-223、inhibitor-miR-223由大连宝生物工程公司测序合成。IL-1β、IL-18酶联免疫反应法(ELISA)试剂盒购自伊莱瑞特生物科技股份有限公司(武汉)。NLRP3、ASC、Caspase-1一抗购自赛默飞世尔。
1.2 方法
1.2.1细胞培养
人视网膜微血管内皮细胞(HRMECS)培养于含20%胎牛血清、3ng/mLbFGF、10U/mL肝素和1%链霉素/青霉素的M199培养基,培养条件为37℃、5%CO2,取对数生长期细胞进行实验。
1.2.2实验分组
采用0.25%胰蛋白酶对HRMECS细胞进行消化,计数后接种于6孔板(1×105个/孔)。分组:正常基培养的对照组、高糖环境培养的模型组、高糖环境下转染miR-NC、mimics-miR-223和inhibitor-miR-223的miR-223阴性组、miR-223组以及miR-223抑制组。
1.2.3细胞转染
采用LipofectamineTM3000试剂依据说明书进行转染,对照组和模型组转染空白试剂,miR-223阴性组转染miR-NC,miR-223组转染mimics-miR-223,miR-223抑制组转染inhbitor-miR-223,转染完毕后对照组用正常培养进行培养,模型组、miR-223阴性组、miR-223组和miR-223抑制组用D-葡萄糖以30mmol/L的最终浓度添加到培养基中模拟高糖环境。培养48h后,收集各组细胞,进行后续实验。
1.2.4实时荧光定量PCR(qRT-PCR)检测
miR-233的表达利用Trizol试剂提取各组总RNA,使用紫外分光光度计检测总RNA的浓度。参照反转录试剂盒(生工,中国上海)说明书将RNA进行反转录,以反转录产物cDNA为模板,按照miRNA荧光定量PCR检测试剂盒说明书进行PCR扩增(生工,中国上海)。使用反转录试剂(碧云天,中国上海)合成NLRP3、ASC和Caspase-1的cDNA,使用荧光定量PCR检测NLRP3、ASC和Caspase-1的mRNA水平。分别以U6和β-actin为内参。采用2-ΔΔCt的方法处理数据,见表1。
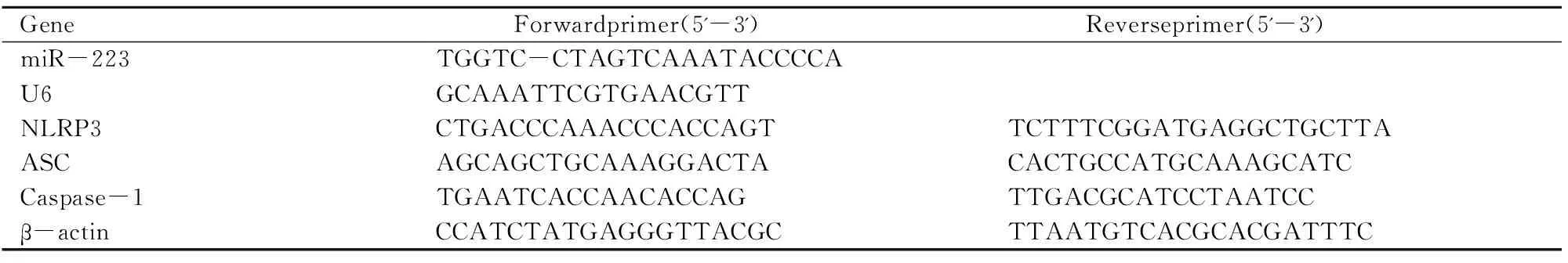
表1 qRT-PCR引物序列
1.2.5酶联免疫吸附法
收集各组细胞上清液,置于-80℃冰箱保存,采用ELISA法检测各组IL-1β、IL-18水平,检测步骤严格遵循试剂盒说明书。
1.2.6Western blot
收集转染后各组HRMECS细胞,提取蛋白样品。取20μL总蛋白上样于10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-poly acrylamide gelel ectrophoresis,SDS-PAGE)上电泳分离蛋白,转膜。室温下,采用5%脱脂牛奶封闭1h。洗膜后,加入一抗在4℃下孵育过夜,洗膜,加入二抗在室温下孵育1.5h。洗膜后,ECL显影,采用图像分析软件Image J对Western blot实验所得结果图像进行灰度分析。
1.3 统计学方法
2 结果
2.1 miR-223的表达情况
荧光定量PCR检测miR-223组中miR-223表达水平为(2.98±0.23)高于对照组(0.98±0.06)、模型组(0.48±0.06)、miR-223阴性组(1. 02±0.06)和miR-223抑制组(0.18±0.09)。miR-223抑制组中miR-223表达趋势低于对照组、模型组、miR-223阴性组、miR-223组,差异均有统计学意义(P<0.05),见图1。
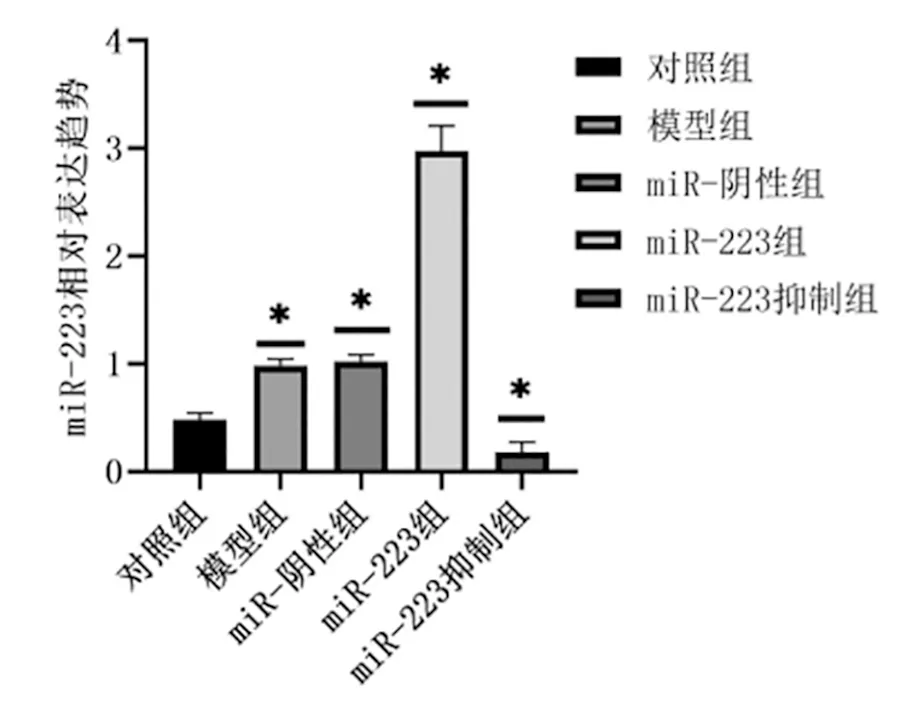
图1 miR-233在各组中的表达趋势(*P<0.05)
2.2 IL-1β和IL-18浓度比较
miR-223组IL-1β、IL-18浓度(6.85±0.48,8.96±1.43pg/mL)均高于对照组(2.73±1.14,3.48±1.08pg/mL),低于模型组(18.67±3.67,22.03±4.15pg/mL)、miR-223阴性组(19.03±4.48,22.62±5.06pg/mL)和miR-223抑制组(34.08±8.23,40.69±7.43pg/mL),差异均有统计学意义(F=51.248,P<0.001)。
2.3 NLRP3、ASC、Caspase-1mRNA表达
模型组和miR-223阴性组NLRP3、ASC、Caspae-1表达水平均高于对照组,miR-223组NLRP3、ASC、Caspase-1表达水平均低于miR-223阴性组和模型组,差异均有统计学意义(P<0.05),见表2。
表2 各组NLRP3、ASC、Caspase-1表达
2.4 NLRP3、ASC、Caspase-1蛋白表达
模型组和miR-223阴性组NLRP3、ASC、Caspae-1蛋白表达水平均高于对照组,miR-223组NLRP3、ASC、Caspase-1蛋白表达水平均低于miR-223阴性组和模型组,差异均有统计学意义(P<0.05),见表3和图2。

图2 各组细胞NLRP3、ASC、Caspase-1蛋白的表达
表3 各组NLRP3、ASC、Caspase-1蛋白表达
3 讨论
近年来随着老龄化进程加速、生活水平提高和工作生活方式转变,糖尿病发病率逐年升高,DR发病人数和致盲人数随之上升。流行病学研究显示,我国DR发生率约占总人群的1.3%和糖尿病人群的23.0%[6]。DR的发生发展是复杂的病理过程,涉及到细胞因子、糖基化终末期产物堆积、多元醇通路异常、炎症、氧化应激、蛋白激酶C等多种机制,其中炎症反应是DR发生发展的关键因素[7]。
固有免疫反应在驱动慢性炎症及糖尿病相关并发症中发挥重要作用,炎性小体家族是机体固有免疫反应的组成部分,在DR的发生发展中起促进作用[8]。NLRP3是一种胞浆模式识别受体分子,作为炎性小体家族一员,可与凋亡相关蛋白颗粒样蛋白(ASC)和半胱氨酸天冬氨酸特异性蛋白酶-1(Caspase-1)形成炎性复合物,活化的Caspase-1可剪切IL-1β和IL-18前体,促进活性IL-1β和IL-18生成,启动炎性反应级联反应,加速DR的发生发展过程[9]。研究[10]显示,增生性糖尿病视网膜病变患者的玻璃体液中NLRP3表达明显升高,并且在PDR患者纤维血管膜中检测到高表达的NLRP3、Caspase-1和IL-1β。对糖尿病视网膜病变动物模型的研究[11]同样显示,NLRP3参与病理性新生血管生成。本研究结果显示,模型组NLRP3、ASC、Caspase-1的mRNA和蛋白表达水平均较对照组显著升高,细胞上清液IL-1β和IL-18水平高于对照组,结果提示,在高糖环境下,HRMECS细胞NLRP3/IL-1β信号通路激活,炎性因子表达增加,加快DR病变进程,与临床和动物模型研究结果一致。
miR-223定位于X染色体Xq12上,高表达于血液系统尤其是骨髓系,如粒细胞、单核细胞,参与粒细胞的分化与成熟过程,参与免疫细胞分化。在动脉粥样硬化基础研究中显示,miR-223可通过直接负性调控下游NLRP3炎性靶基因延缓粥样硬化的发展[12]。Bauernfeind等人[13]研究显示,NLRP3在限制条件下表达,需要额外的启动信号常使其表达,miR-223通过NLRP3的3’非翻译区内的保守结合位点抑制NLRP3表达,减少NLRP3炎症反应活性。对miR-223缺陷小鼠的研究中则可观察到NLRP3/IL-1β激活的特征[14]。Neudecker等人[15]对炎症性肠病的研究中显示,miR-223缺失动物NLRP3/IL-1β通路表达增加,炎性细胞因子水平显著升高,阻断NLRP3可降低动物模型炎性肠病的严重程度。虽然在炎症性肠病、动脉粥样硬化等基础研究中观察到miR-223对NLRP3炎症通路激活的影响,但在DR中较少见相关报道。本研究对高糖环境培养的视网膜微血管内皮细胞研究显示,高糖诱导可降低miR-223表达,模型组在miR-223降低的同时,NLRP3、ASC、Caspase-1在mRNA和蛋白水平表达升高。此外模型组细胞培养液中IL-1β水平升高,结果提示高糖培养的HRMECS细胞存在miR-223降低和NLRP3/IL-1β通路激活。为观察miR-223与NLRP3/IL-1β通路激活的相关性。本研究分别转染mimcs -miR-223-和inhibitor -miR-223。结果显示,转染miR-22-3mimcs的高糖培养HRMECS细胞NLRP3、ASC、Caspase-1在mRNA和蛋白相对表达水平降低,细胞培养液中IL-1β和IL-18水平降低,从而抑制NLRP3/IL-1β通路激活,而转染inhibitor-miR-223则可促进NLRP3/IL-1β通路激活。本研究结果提示,与动脉粥样硬化、炎症性肠病和脑膜炎等研究中类似,miR-223可调控高糖培养HRMECS细胞NLR3/IL-1β细胞通路,可能在DR的发生发展中发挥保护作用。
综上所述,高糖处理HAMECS后,可引起miR-223降低,上调miR-223表达可通过抑制NLRP3/IL-1β通路激活减轻细胞的炎症反应,本研究结果初步阐述了miR-223在DR发展中的作用,丰富了DR发病的分子机制,为DR治疗提供了新的线索。
