不同生长调节剂对小麦成熟胚愈伤组织诱导效果研究
2023-07-21沈跃鹏
沈跃鹏
(开封市农林科学研究院 河南 开封 475004)
利用小麦成熟胚作为外植体, 进行愈伤组织的诱导与再生分化, 对于建立小麦高效遗传转化体系具有十分重要的意义。 生长调节剂在愈伤组织诱导过程中具有十分重要的作用。 长期以来,人们对培养基中生长调节剂的种类和剂量进行了较多研究,一般认为2,4-D 是小麦组织培养中起主导作用的植物生长调节物质,是影响组织再分化的关键因素,常用剂量为0.2~2.0 mg/L。 目前,在多种植物的胚性愈伤组织诱导中, 不同研究者通过在诱导培养基中加入不同浓度的2,4-D(或配合其他激素),均成功地诱导出了胚性愈伤组织,如枇杷[1]、荔枝[2]、枸杞[3]等。 关于小麦组织培养方面的研究也较多,已筛选出了多种含2,4-D 的培养基和材料[4-5],但关于3,6-二氯-2-甲氧基苯甲酸在植物愈伤组织诱导及再生效果方面的研究较少。 为建立小麦稳定高效再生体系, 探索2,4-D和3,6-二氯-2-甲氧基苯甲酸对小麦成熟胚出愈率和胚性愈伤率的影响,2022 年本文作者以MS 为基本培养基分别添加脯胺酸、 水解酪蛋白和不同剂量的2,4-D 或3,6-二氯-2-甲氧基苯甲酸,形成多种试验培养基,由此开展了本次研究。
1 材料与方法
1.1 小麦成熟胚
试验选用开麦18、开麦20、开麦22 等3 个小麦品种的成熟胚。
1.2 试验培养基
以MS 为基本培养基分别添加脯胺酸、水解酪蛋白和3 个剂量水平的2,4-D 或3, 6-二氯-2-甲氧基苯甲酸,形成S 和M2 类8 种试验培养基(表1)。

表1 不同试验培养基的组成
1.3 试验方法
1.3.1 出愈率的计算 分别取开麦18、 开麦20、开麦22 等3 个品种大小一致的种子用75%的乙醇浸泡3~5 min, 然后用无菌水冲洗3~4 次, 用0.1%的HgCl2(W/W)消毒15~20 min,然后再用无菌水冲洗3~4 次,放入33℃的无菌水中浸泡3~5 h;用灭过菌的解剖刀剥出胚,盾片向上,分别置于8 种试验培养基上,在26℃暗室中培养。 3 个品种分别在每种培养基中重复培养3 次, 各重复均用40 粒成熟胚。 15 d后调查计算愈伤组织诱导率,即出愈率。
1.3.2 胚性愈伤率的计算 把诱导15 d 的愈伤组织切分成两半,接种于继代培养基,采用16 h 光照、8 h黑暗光周期(光照度1 750~2 200 lx)。 在光下出现绿色的愈伤组织视为胚性愈伤组织。 培养20 d 时调查计算胚性愈伤组织诱导率,即胚性愈伤率。
1.4 数据处理
数据处理及统计分析利用Excel 2010 统计软件进行。
2 结果与分析
培养基是植物成熟胚愈伤组织诱导的物质基础,其构成显著影响到愈伤组织的诱导效果(表2)。由表3、表4 可知,出愈率和胚性愈伤率在不同培养基间的差异和品种间的差异均达极显著水平, 而培养基×品种的互作均未达到显著水平。 可见,不同培养基对小麦成熟胚愈伤组织的诱导效应存在极显著差异, 不同品种小麦成熟胚愈伤组织诱导效果也存在极显著的差异, 但培养基和品种对诱导效果的影响相对独立。 为了解析培养基构成对诱导效果的影响,设计一组正交比较(表5)方法,进行单个自由度的方差分析。
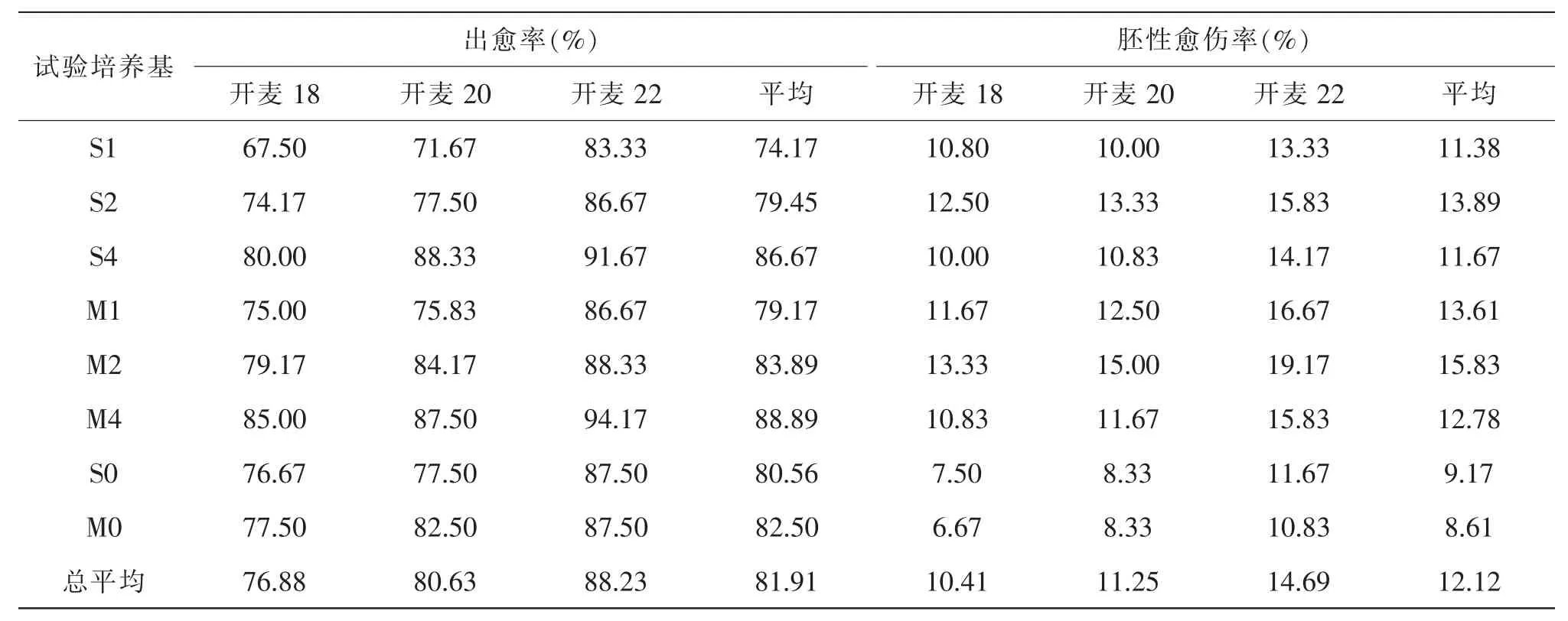
表2 不同试验培养基的平均出愈率和平均胚性愈伤率
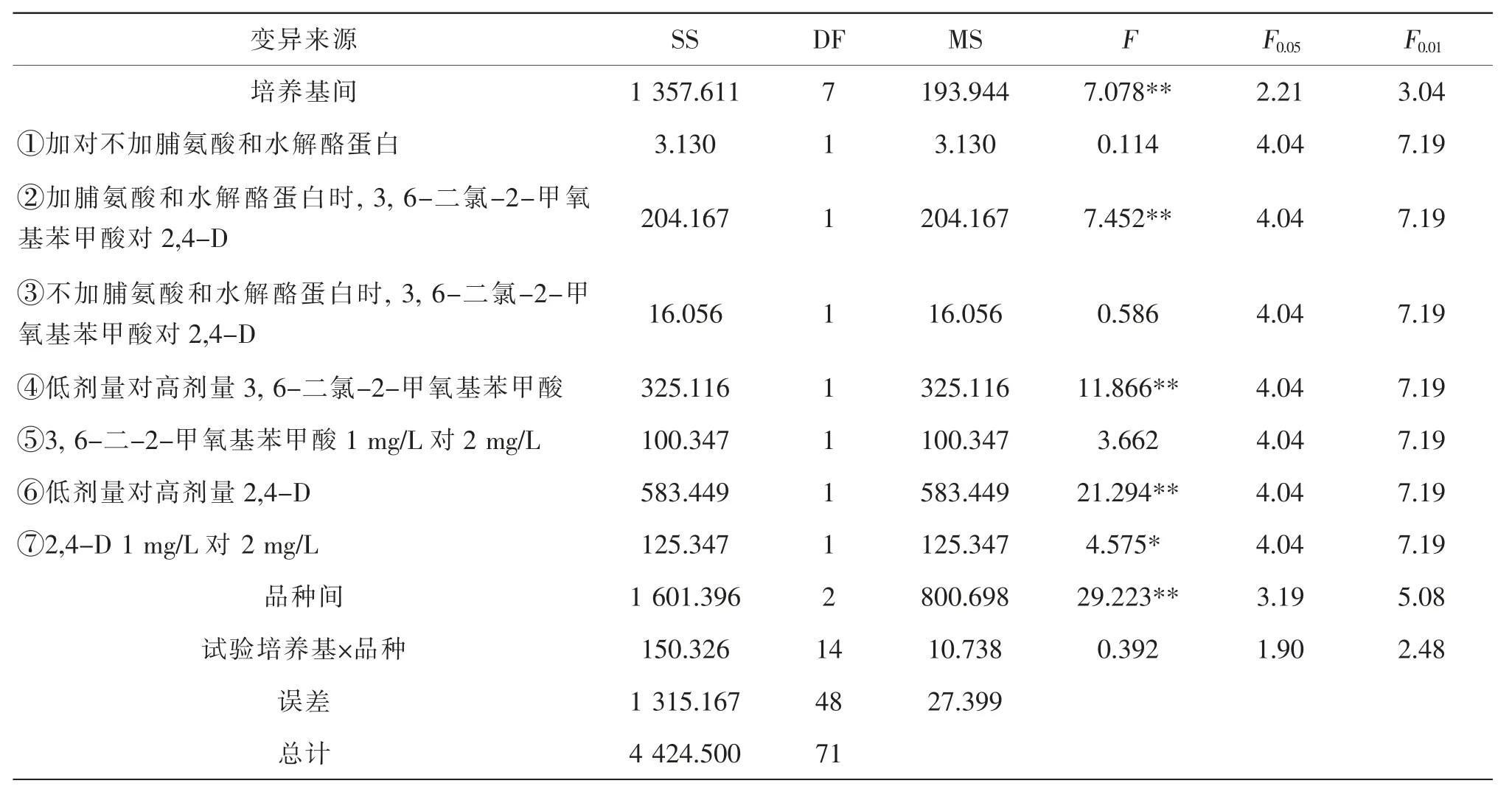
表3 不同试验培养基与各品种出愈率的方差分析
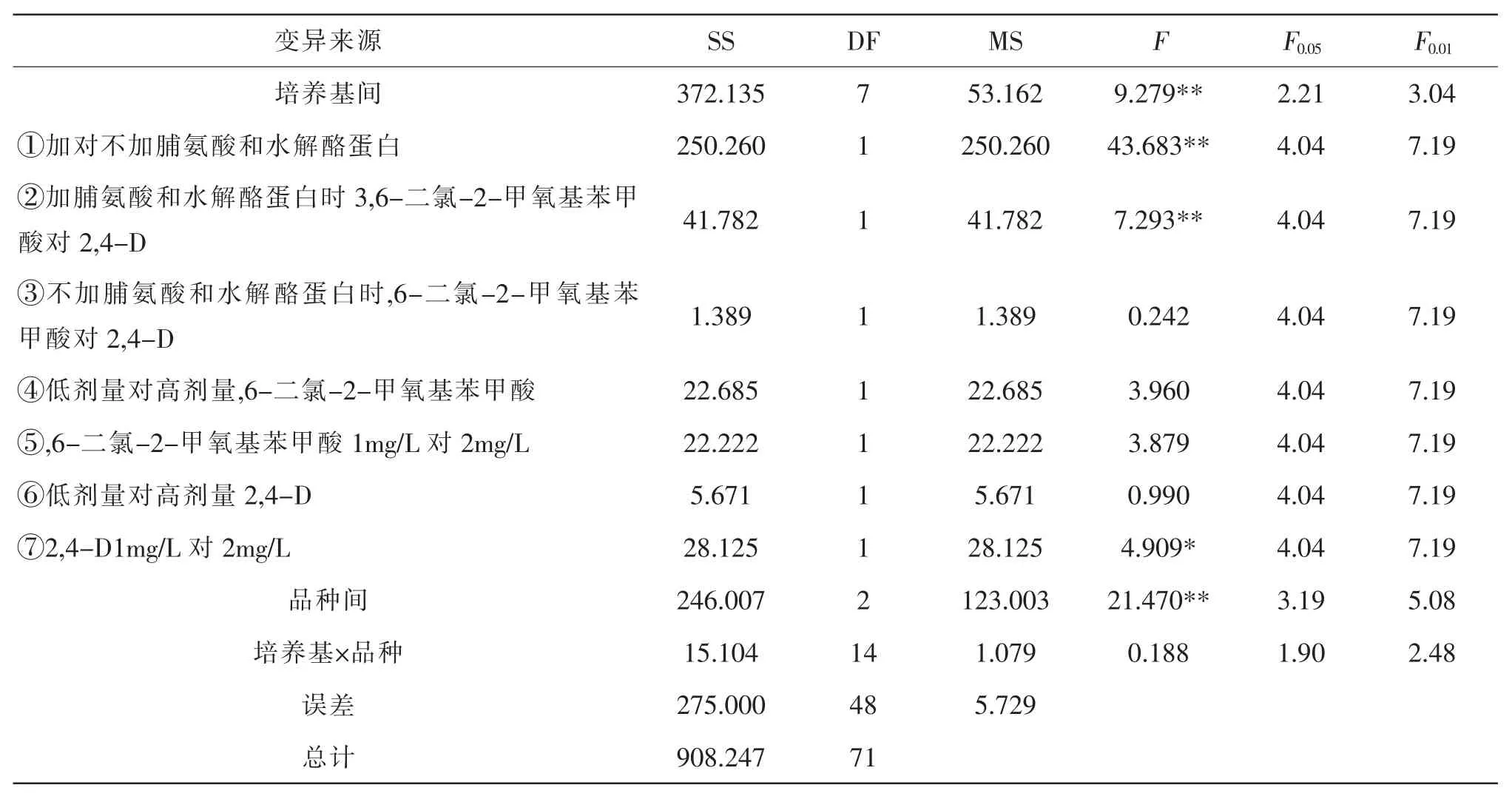
表4 不同培养基与各品种胚性愈伤率的方差分析
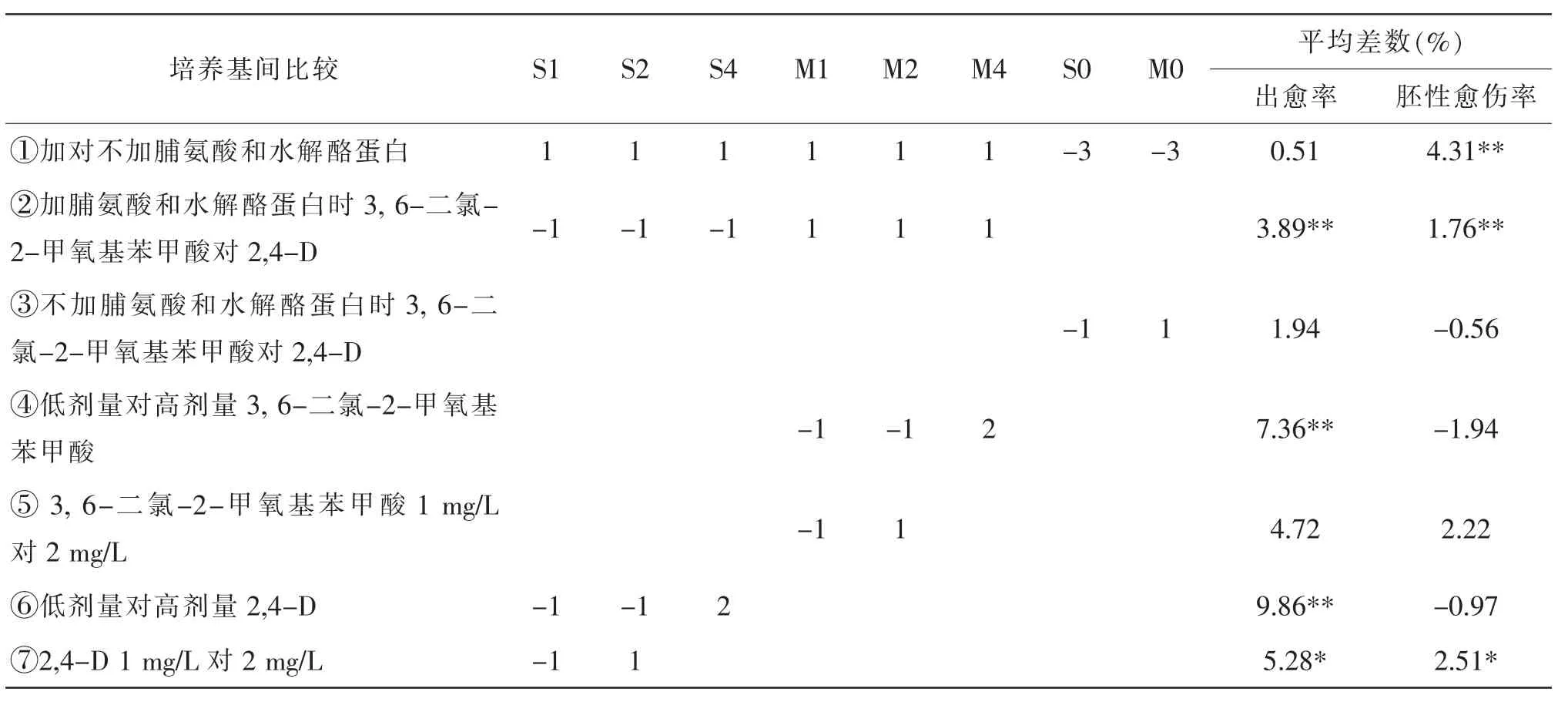
表5 试验培养基分组比较的正交系数和平均差数
2.1 生长调节剂对小麦成熟胚愈伤组织出愈率的影响
由表2、表3 和表5 可知,①添加脯氨酸和水解酪蛋白对出愈率影响不显著;②添加脯氨酸、水解酪蛋白时,含有3,6-二氯-2-甲氧基苯甲酸的M 类培养基比含有2,4-D 的S 类培养基的出愈率高3.89%,达到极显著水平;③不加脯氨酸和水解酪蛋白时,M 类培养基较S 类培养基的出愈率高1.94%, 提高不显著; ④对于M 类培养基,3,6-二氯-2-甲氧基苯甲酸剂量为4 mg/L 的出愈率比2 mg/L 的高7.36%,达极显著水平;2 mg/L 的出愈率比1 mg/L 的出愈率高4.72%,未达显著水平;⑤对于S 类培养基,2,4-D 剂量为4 mg/L 的出愈率比2 mg/L 的出愈率高9.86%,达极显著水平, 2 mg/L 的出愈率比1 mg/L 的出愈率高5.28%, 达显著水平。 由此可见, 添加脯氨酸和水解酪蛋白对小麦成熟胚愈伤组织的出愈率影响不显著, 但添加脯氨酸和水解酪蛋白时使用生长调节剂3,6-二氯-2-甲氧基苯甲酸的出愈率极显著高于使用2,4-D 的,在本试验的剂量范围内,两种生长调节剂对小麦愈伤组织的出愈率的诱导效果均以高剂量为优。
对8 种试验培养基的出愈率进行多重比较(表6)表明,M4 培养基的出愈率最高,为88.89%,但与S4和M2 的出愈率86.67%和83.89%相比差异不显著,而显著高于M0, 极显著地高于S0、S2、M1 和S1;S4培养基的出愈率与M2 和M0 差异不显著,但显著高于S0 和S2,极显著高于M1 和S1;M2、M0、S0、S2 和M1 这5 种培养基的出愈率差异不显著,但前四者均显著或极显著高于S1,而M1 和S1 差异不显著。 由此可见,随着生长调节剂剂量水平的提高,出愈率增高;在生长调节剂的剂量相同时,含有3,6-二氯-2-甲氧基苯甲酸的M 类试验培养基的诱导效果优于含有2,4-D 的S 类试验培养基。
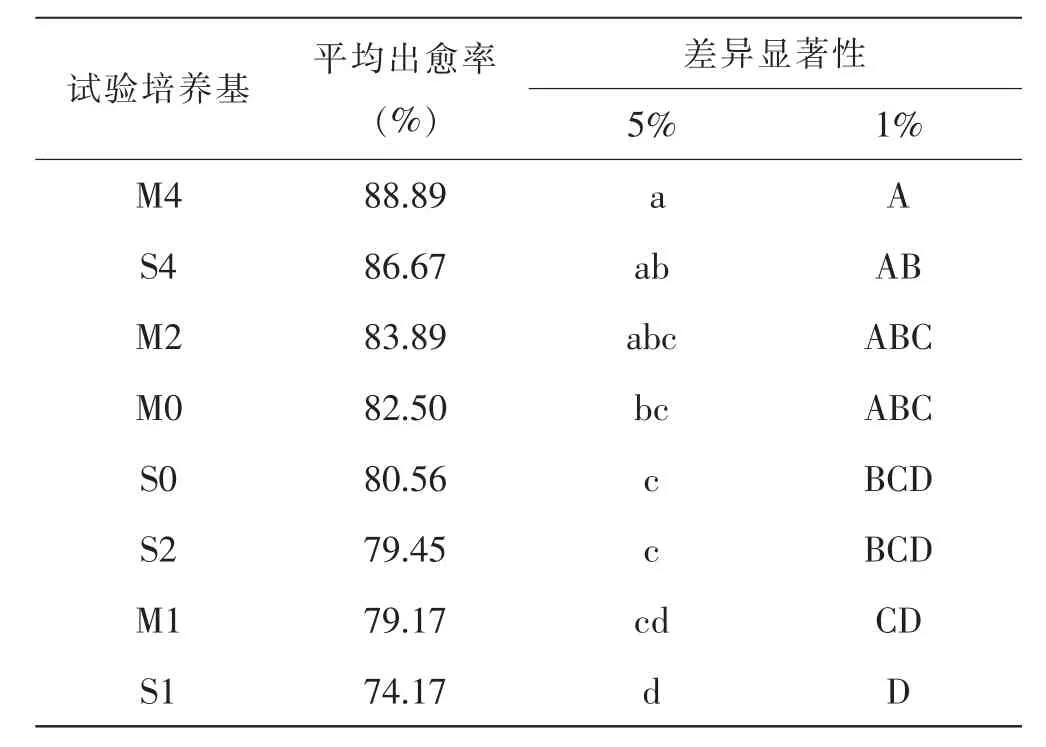
表6 不同试验培养基的出愈率差异显著性比较
2.2 生长调节剂对小麦成熟胚愈伤组织胚性愈伤率的影响
由表2、表4 和表5 可知,①添加脯氨酸和水解酪蛋白的培养基的平均胚性愈伤率为13.19%, 比没有添加脯氨酸和水解酪蛋白的增加了4.31%,达极显著水平;②添加脯氨酸和水解酪蛋白时,含有3,6-二氯-2-甲氧基苯甲酸的M 类培养基的胚性愈伤率比含有2,4-D 的S 类培养基高1.76%, 达极显著水平;③不添加脯氨酸和水解酪蛋白时,含有3,6-二氯-2-甲氧基苯甲酸的M 类培养基与含有2,4-D 的S 类培养基的平均胚性愈伤率分别为8.61%、9.17%,差异未达显著水平;④对于含有3,6-二氯-2-甲氧基苯甲酸的M 类培养基,3,6-二氯-2-甲氧基苯甲酸剂量为4 mg/L 的胚性愈伤率比1 mg/L 或2 mg/L 的低1.94%,接近显著水平,2 mg/L 的胚性愈伤率比1 mg/L 的高2.22%,也接近显著水平;⑤对于含有2,4-D 的S 类基本培养基,2,4-D 剂量为4 mg/L 的胚性愈伤率比1 mg/L 或2 mg/L 的低0.97%,差异不显著,2 mg/L 的胚性愈伤率比1 mg/L 的高2.51%,达显著水平。 综上所述,添加脯氨酸和水解酪蛋白可以极显著提高胚性愈伤率,在此前提下,使用3,6-二氯-2-甲氧基苯甲酸显著优于使用2,4-D。 本试验表明,以MS 为基本培养基,附加脯氨酸和水解酪蛋白各500 mg/L 和2 mg/L的3,6-二氯-2-甲氧基苯甲酸的胚性愈伤率最高。
对胚性愈伤率进行多重比较(表7)表明,培养基M2、S2 和M1 的胚性愈伤率位居前3 位, 分别为15.83%、13.89%和13.61%, 三者间差异不显著;S2、M1、M4、S4、S1 这5 个试验培养基的胚性愈伤率差异不显著, 但前四者显著或极显著地高于S0 和M0;S1、S0 差异不显著,但二者显著高于M0。 由此可见,两种生长调节剂的剂量为2 mg/L 的试验培养基的胚性愈伤率高于其他剂量的试验培养基; 含有3,6-二氯-2-甲氧基苯甲酸的M 类试验培养基优于含有2,4-D 的S 类试验培养基,在培养基中添加脯氨酸和水解酪蛋白可显著提高胚性愈伤率。
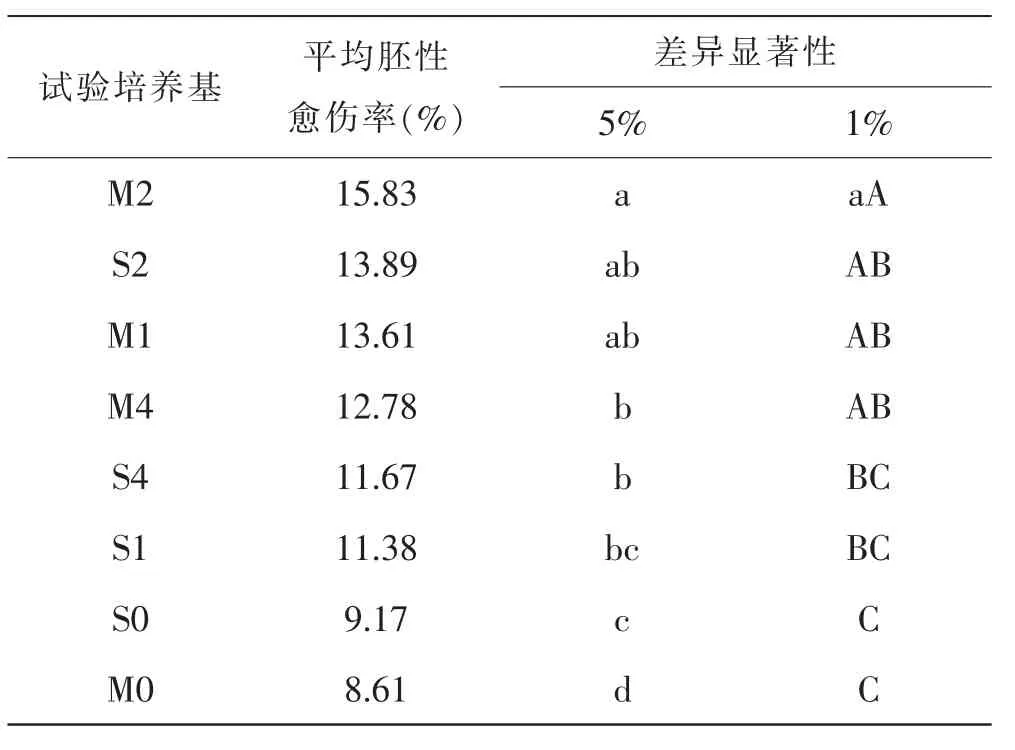
表7 不同培养基的出愈率和胚性愈伤率差异显著性比较
2.3 不同品种间的小麦成熟胚愈伤组织的诱导效果
如上所述, 出愈率和胚性愈伤率的品种间差异均达极显著水平,开麦18、开麦20、开麦22 等3 个品种的愈伤组织出愈率分别为88.23%、80.63%、76.88%, 胚性愈伤率分别达到14.69%、11.25%和10.41%(表2), 可见开麦18 成熟胚的愈伤组织诱导效果最好。
3 讨论与结论
培养基的成分是影响诱导率和愈伤组织质量的主要因素之一,不同培养基的诱导效果有很大差异。出愈率低可以通过增加接种成熟胚量来弥补从而获取大量的愈伤组织, 而愈伤组织质量是决定高效培养体系的关键。 所以应把胚性愈伤率作为衡量培养基好坏的重要指标。
本研究以MS 为基本培养基,通过分别添加脯胺酸、 水解酪蛋白和不同剂量的生长调节剂2,4-D 或3,6-二氯-2-甲氧基苯甲酸,形成8 种试验培养基,研究开麦18 等3 个品种成熟胚的出愈率和胚性愈伤率。 结果表明,出愈率和胚性愈伤率在不同培养基间的差异和品种间的差异均达极显著水平,而培养基×品种的互作差异不显著;在MS 基本培养基上添加脯氨酸和水解酪蛋白可极显著地提高小麦成熟胚愈伤组织的胚性愈伤率,但对出愈率影响不显著;在此基础上, 添加3, 6-二氯-2-甲氧基苯甲酸的出愈率和胚性愈伤率比2,4-D 分别高3.89%和4.31%,均达极显著水平;对于出愈率以高剂量为佳,胚性愈伤率以2 mg/L 为宜。 由此可见,3,6-二氯-2-甲氧基苯甲酸对小麦成熟胚愈伤组织的诱导效果优于2,4-D,且以剂量为2 mg/L 为宜; 脯氨酸和水解酪蛋白可显著提高小麦成熟胚愈伤组织的胚性愈伤率, 对出愈率无显著影响。这与付风玲[6]等适量的L-脯氨酸和水解酪蛋白具有提高胚性愈伤率的作用的研究结果一致。综合出愈率和胚性愈伤率试验结果表明,M2 培养基为小麦愈伤组织诱导的适宜培养基。
