富含亮氨酸的α2糖蛋白1通过RUNX1/OPN信号调节非小细胞肺癌细胞的增殖、迁移和侵袭
2023-07-20曾强张宇陈辉石珂周丽
曾强 张宇 陈辉 石珂 周丽
非小细胞肺癌(non-small cell lung cancer,NSCLC)是主要肺癌类型[1-2]。富含亮氨酸的α-2糖蛋白1(leucine-rich-alpha2-glycoprotein 1,LRG1)能促进胃癌细胞的体内外增殖和血管生成[3],促进黑色素瘤细胞迁移、侵袭和黏附[4],并可增强NSCLC细胞增殖、迁移和侵袭能力[5]。Runt相关转录因子1(runt-related transcription factor 1,RUNX1)具有明显致癌活性[6],可促进大肠癌细胞增殖[7],下调RUNX1可显著诱导NSCLC细胞DNA损伤和凋亡[8],骨桥蛋白(osteopontin,OPN)是RUNX1的下游靶点,RUNX1可直接结合OPN启动子,上调其表达,进而促进头颈部鳞状细胞癌的肿瘤进展和转移[9],作为与多种类型的癌症进展、生长、迁移、侵袭和血管生成相关的关键因子[10],在NSCLC细胞中过度表达,也是其患者的独立预后标志物,而敲除OPN可降低NSCLC细胞的迁移和侵袭力[11],LRG1可通过诱导RUNX1的表达促进大肠癌细胞增殖[12],因而预测LRG1可能通过RUNX1/OPN信号调节非小细胞肺癌细胞的增殖、迁移和侵袭。本文通过体外培养人NSCLC细胞系A549对此进行验证。
材料与方法
一、材料
NCI-H838细胞、NCI-H1650细胞、DMEM高糖(含丙酮酸钠、谷氨酰胺,含双抗)培养基(SNM-002D)购自武汉尚恩生物技术有限公司;人Ⅱ型肺泡上皮细胞(CP-H209)、A549细胞(CL-0016)、Ham’s F-12K培养基(PM150910)、人Ⅱ型肺泡上皮细胞完全培养基(CM-H209)购自武汉普诺赛生命科技有限公司;LRG1 siRNA(序列信息:LRG1 siRNA-1-F:5′-CCGGGCAATTAGAACGGCTACATCTGGATCCAGATGTAGCCGTTCTAATTGCTTTTTG-3′,R:5′-AATTCAAAAAGCAATTAGAACGGCTACATCTGGATCCAGATGTAGCCGTTCTAATTGC-3′;LRG1 siRNA-2-F:5′-CCGGCAGCCGACACCGTGCACCTGGGGATCCCCAGGTGCACGGTGTCGGCTGTTTTTG,R:5′-AATTCAAAAACAGCCGACACCGTGCACCTGGGGATCCCCAGGTGCACGGTGTCGGCTG-3′)、RUNX1过表达质粒(序列信息:F:5′-CCGGAATTCATGCGTATCCCCGTAG-3′,R:5′-CCGCTCGAGGTAGGGCCTCCACACG-3′)、空载质粒购自上海生工生物工程股份有限公司; EdU细胞增殖检测试剂盒、0.1%结晶紫水溶液、ANNEXIN V- FITC/PI 凋亡检测试剂盒、一步法实时荧光定量PCR(real-time quantitative PCR,qRT-PCR)试剂盒购自北京索莱宝科技有限公司;辣根过氧化物酶标记山羊抗兔IgG二抗、兔抗人E-cadherin一抗、兔抗人β-tubulin一抗、兔抗人N-cadherin一抗、兔抗人caspase-3一抗、兔抗人GAPDH一抗、兔抗人Bax一抗、兔抗人Bcl-2一抗购自上海碧云天生物技术有限公司;兔抗人LRG1一抗、兔抗人OPN一抗、兔抗人RUNX1一抗购自美国Abcam公司等。PT-3502C全波长酶标仪购自北京普天新桥技术有限公司;NIB900-FL科研级倒置荧光显微镜、NIB400实验室级倒置生物显微镜购自上海悌可光电科技有限公司;ForeQuant F4/F6qRT-PCR仪购自美国美谷分子公司;CC-SC双垂直电泳槽、VE-186转印电泳槽、DYY-11B电泳仪购自南京普阳科学仪器研究所等。
二、方法
1.各细胞中LRG1、RUNX1与OPN表达检测:qRT-PCR实验使用39.7 ℃水浴快速冻融购买的人Ⅱ型肺泡上皮细胞(人Ⅱ型肺泡上皮细胞完全培养基)与人NSCLC细胞系A549(含10%血清的Ham’s F-12K培养基)、NCI-H838(含10%血清的DMEM高糖培养基)、NCI-H1650(含10%血清的DMEM高糖培养基),复苏培养后收集传代后的各种细胞,以高效RIPA裂解液提出其中总蛋白后测出其浓度,根据测量结果每组取含20 μg总蛋白的样品液,于100 ℃沸水中煮沸变性、跑电泳、湿转,使于胶中分离开的蛋白转移至硝酸纤维素膜,分别截下含有目的蛋白LRG1、RUNX1、OPN、GAPDH,孵育脱脂牛奶封闭后进行抗原抗体反应,接着滴加化学发光试剂显色,摄取各蛋白条带图像,运用Image J软件分析得到各组蛋白相对表达量。实验重复6次。
以Trizol提取收集的上述4种传代细胞总RNA,使用一步法反转录qRT-PCR试剂盒并参照其说明书指导做实时荧光定量PCR扩增,所得数据采用2-ΔΔCt算法做分析,得出LRG1、RUNX1与OPN mRNA相对表达,实验重复6次。GAPDH为内参,各基因引物序列:LRG1上游引物:5′-GTTGGAGACCTTGCCACCT-3′,下游引物:5′-GCTTGTTGCCGTTCAGGA-3′;GAPDH上游引物:5′-ATGGGTGTGAACCACGAGA-3′,下游引物:5′-CAGGGATGATGTTCTGGGCA-3′;RUNX1上游引物:5′-CTGCCCATCGCTTTCAAGGT-3′,下游引物:5′-GCCGAGTAGTTTTCATCATTGCC-3′;OPN上游引物:5′-TTGCAGTGATTTGCTTTTGC-3′,下游引物:5′-GTCAATGGAGTCCTGGCTGT-3′。
2.分组转染细胞及收集标本:取无菌的12孔板,接种传代的A549细胞无菌培养24小时,随机分为对照组、LRG1敲低组、阴性对照组、RUNX1过表达组、LRG1敲低+RUNX1过表达组,使用脂质体2000分组转染质粒,LRG1敲低组转染LRG1 siRNA,阴性对照组转染空载质粒,RUNX1过表达组转染LRG1 siRNA阴性对照和RUNX1过表达质粒,LRG1敲低+RUNX1过表达组转染LRG1 siRNA和RUNX1过表达质粒。具体转染步骤参照脂质体2000说明书指导进行,转染24小时后收集各组细胞作标本备用。实验重复6次。
3.各组细胞LRG1、RUNX1与OPN表达检测:取出1.2.2中收集的各组细胞,采用qRT-PCR和免疫印迹实验分别检测其中LRG1、RUNX1、OPN mRNA与蛋白表达,具体方法步骤按照1.2.1进行。
4.各组细胞增殖、凋亡检测:以EdU染色检测各组细胞增殖:取无菌的12孔板,接种传代的A549细胞无菌培养24小时,遵照1.2.2中方法步骤分组进行细胞转染,24小时后加入适量EdU试剂继续培养,12小时后清洗、固定细胞,参照EdU细胞增殖检测试剂盒说明指导于荧光显微镜下进行染色后观察,每孔任选3个视野摄取图像,细胞计数后计算各组细胞EdU阳性率=EdU阳性细胞数/总细胞数×100%。
5.流式细胞实验检测各组细胞凋亡:取1.2.2中收集的各组细胞,以PBS缓冲液清洗后,加入1 ml PBS缓冲液重悬计数,每组取5×106个细胞,离心后加入PBS缓冲液及ANNEXIN V- FITC/PI 凋亡检测试剂盒中的ANNEXIN V- FITC、PI,避光反应15分钟后采用流式细胞仪检测各组细胞凋亡率。
6.各组细胞迁移侵袭检测:划痕实验检测各组细胞迁移:取无菌的12孔板,接种传代的A549细胞无菌培养24小时,遵照1.2.2中方法步骤分组进行细胞转染,24小时后在每孔中央划一条直线,洗去划痕中细胞后于光学显微镜下观察并拍照,所得图像采用Image Pro Plus软件测量划痕宽度L0,继续培养24小时后再次于光学显微镜下观察、拍照、测量划痕宽度L1,计算各组细胞迁移率=L0-L1/L0×100%。
Transwell实验检测各组细胞侵袭:取1.2.2中收集的各组细胞,以PBS缓冲液清洗后,加入1 ml不含血清的Ham’s F-12K培养基重悬计数,取无菌的Transwell培养板以基底胶包被后于上室中接种1.2.2中5×105个/ml的各组细胞,同时于下室加适量含血清的Ham’s F-12K培养基,无菌培养细胞24小时,以棉签清除上室细胞后清洗、固定下室细胞,加入0.1%结晶紫水溶液没过细胞,染色5分钟后清洗,于光学显微镜下观察拍照,计数所得图像中各组细胞。
7.检测各组细胞凋亡及上皮间质转化标志蛋白表达:取出1.2.2中收集的各组细胞,采用免疫印迹实验分别检测其中Bcl-2、caspase-3、Bax、N-cadherin、E-cadherin蛋白表达,具体方法步骤按照1.2.1中进行。实验重复6次。
三、统计学分析

结果
1.人Ⅱ型肺泡上皮细胞与人NSCLC细胞系A549、NCI-H838、NCI-H1650中LRG1、RUNX1与OPN表达:与人Ⅱ型肺泡上皮细胞相比,人NSCLC细胞系A549、NCI-H838、NCI-H1650中LRG1、RUNX1与OPN mRNA与蛋白表达水平升高(P<0.05)。见图1、表1。
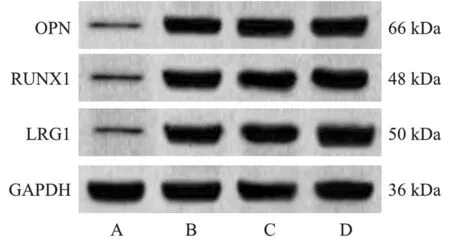
图1 免疫印迹检测各细胞LRG1、RUNX1与OPN蛋白表达
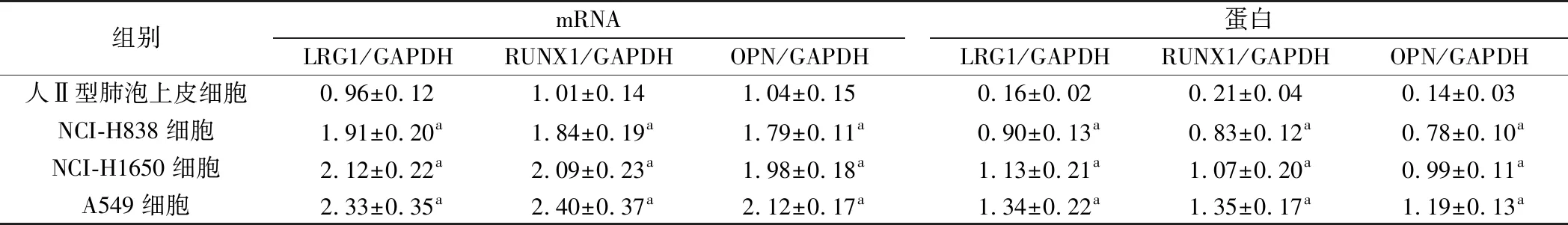
表1 各细胞中LRG1、RUNX1与OPN mRNA相对表达水平(n=6)
2.各组A549细胞中LRG1、RUNX1与OPN表达检测结果:与对照组相比,LRG1敲低组细胞LRG1、RUNX1与OPN mRNA与蛋白表达降低,差异有统计学意义(P<0.05);RUNX1过表达组细胞LRG1 mRNA与蛋白表达差异无统计学意义(P>0.05),RUNX1与OPN mRNA与蛋白表达升高,差异有统计学意义(P<0.05);阴性对照组细胞LRG1、RUNX1与OPN mRNA与蛋白表达差异无统计学意义(P>0.05);与LRG1敲低组相比,LRG1敲低+RUNX1过表达组细胞LRG1 mRNA与蛋白表达差异无统计学意义(P>0.05),RUNX1与OPN mRNA与蛋白表达升高,差异有统计学意义(P<0.05)。见图2、表2。

注:A:对照组;B:LRG1敲低组;C:阴性对照组;D:RUNX1过表达组;E:LRG1敲低+RUNX1过表达组
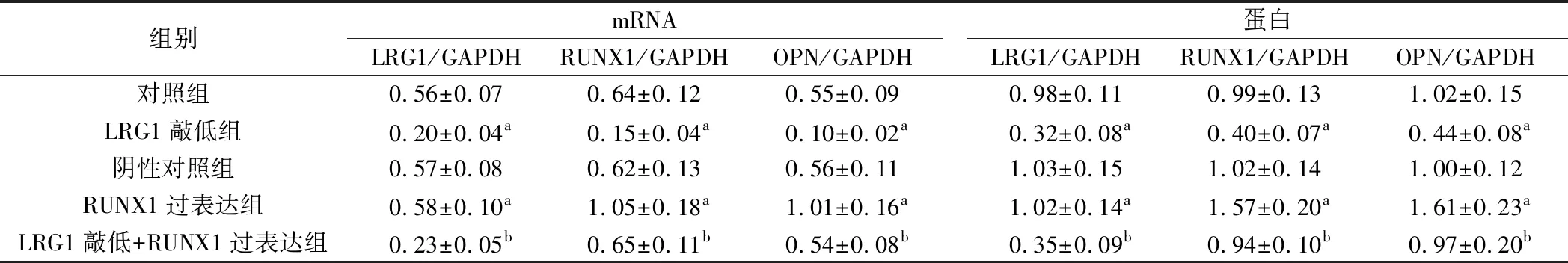
表2 各组A549细胞LRG1、RUNX1与OPN mRNA与蛋白相对表达水平(n=6)
3.各组A549细胞增殖与凋亡情况检测结果比较:与对照组[(41.26±3.89)%、(7.43±0.95)%]相比,LRG1敲低组EdU阳性率[(10.02±1.67)%]降低(P<0.05),细胞凋亡率[(51.82±11.46)%]升高(P<0.05);RUNX1过表达组EdU阳性率[(78.16±8.01)%]升高(P<0.05),细胞凋亡率[(1.13±0.28)%]降低(P<0.05);阴性对照组EdU阳性率[(42.93±4.32)%]与细胞凋亡率[(7.54±0.71)%]均无显著差异(P>0.05)。与LRG1敲低组相比,LRG1敲低+RUNX1过表达组EdU阳性率[(38.14±4.10)%]升高(P<0.05),细胞凋亡率[(9.17±2.20)%]降低(P<0.05)。见图3。
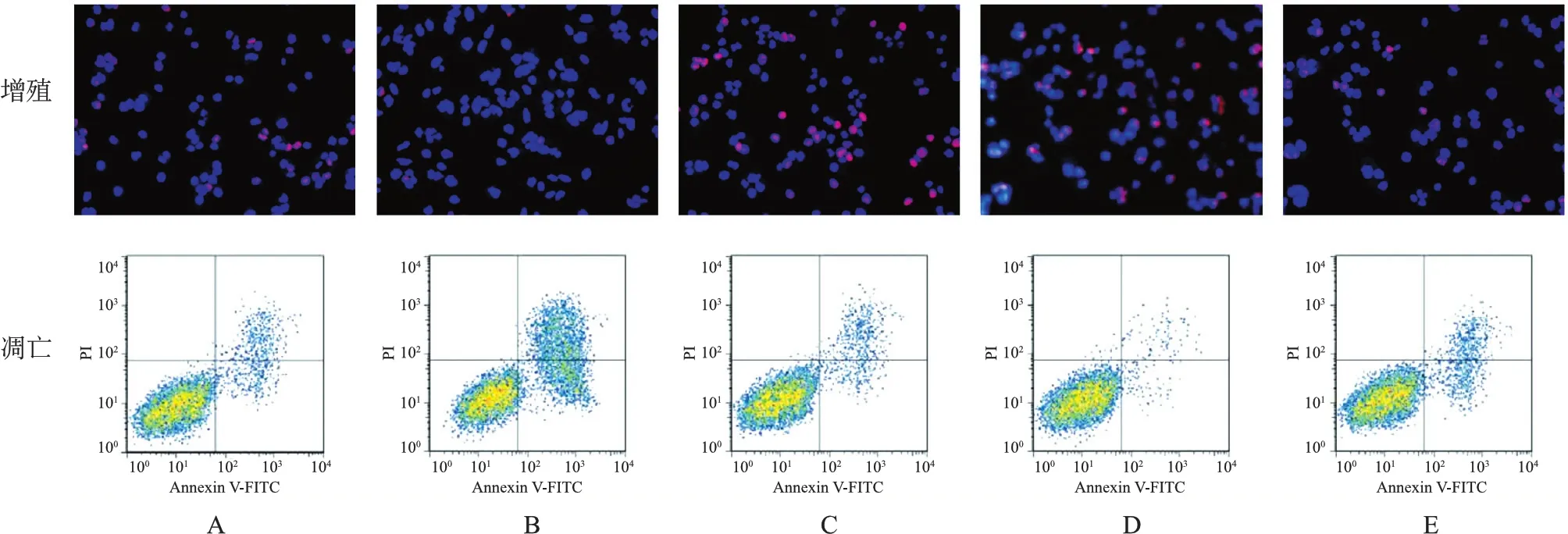
注:A:对照组;B:LRG1敲低组;C:阴性对照组;D:RUNX1过表达组;E:LRG1敲低+RUNX1过表达组
4.各组A549细胞迁移与侵袭情况检测结果:对照组[(75.12±7.03)%、(191.57±32.62)个]相比,LRG1敲低组细胞迁移率[(29.78±4.59)%]与侵袭数[(65.24±8.39)个]均降低(P<0.05),RUNX1过表达组细胞迁移率[(96.67±10.12)%]与侵袭数[(316.35±40.63)个]均升高,差异有统计学意义(P<0.05),阴性对照组细胞迁移率[(76.31±12.45)%]与侵袭数[(197.20±36.12)个]均无明显差异(P>0.05);与LRG1敲低组相比,LRG1敲低+RUNX1过表达组细胞迁移率[(68.25±9.04)%]与侵袭数[(178.95±30.48)个]均升高,差异有统计学意义(P<0.05)。见图4。

注:A:对照组;B:LRG1敲低组;C:阴性对照组;D:RUNX1过表达组;E:LRG1敲低+RUNX1过表达组
5.各组A549细胞凋亡及上皮间质转化标志蛋白表达结果比较:与对照组相比,LRG1敲低组细胞Bcl-2、N-cadherin蛋白表达降低,caspase-3、Bax、E-cadherin蛋白表达升高;RUNX1过表达组细胞Bcl-2、N-cadherin蛋白表达升高,caspase-3、Bax、E-cadherin蛋白表达降低,差异有统计学意义(P<0.05);阴性对照组细胞Bcl-2、caspase-3、Bax、N-cadherin、E-cadherin蛋白表达无明显差异(P>0.05);与LRG1敲低组相比,LRG1敲低+RUNX1过表达组细胞Bcl-2、N-cadherin蛋白表达升高,caspase-3、Bax、E-cadherin蛋白表达降低,差异有统计学意义(P<0.05)。见图5、表3。

注:A:对照组;B:LRG1敲低组;C:阴性对照组;D:RUNX1过表达组;E:LRG1敲低+RUNX1过表达组

表3 各组A549细胞Bcl-2、caspase-3、Bax、N-cadherin、E-cadherin蛋白相对表达水平(n=6)
讨论
NSCLC病人生存期有所延长,但因病情的反复复发及癌细胞的远处转移,每年死于NSCLC的病患数还是越来越多[13-14]。LRG1具有显著致癌作用的癌基因,在包括NSCLC在内的肿瘤中表达显著增加[3,15],敲除LRG1基因可降低胰腺癌细胞活力,抑制其迁移、侵袭和血管生成[16]。有研究显示,LRG1可诱导NSCLC细胞增殖,促进其迁移、侵袭和血管生成,靶向LRG1在NSCLC治疗中具有潜在的应用前景[5],结果显示,相比正常人Ⅱ型肺泡上皮细胞,人NSCLC细胞系A549、NCI-H838、NCI-H1650中LRG1表达升高,转染LRG1 siRNA可降低A549细胞EdU阳性率、迁移率、侵袭数、细胞LRG1、RUNX1与OPN mRNA及蛋白表达、细胞Bcl-2、N-cadherin蛋白表达,升高其凋亡率、细胞caspase-3、Bax、E-cadherin蛋白表达,表明LRG1介导NSCLC细胞增殖、迁移和侵袭过程,敲低LRG1可抑制其增殖、迁移和侵袭,对NSCLC起到显著的抗癌功效。
RUNX1/OPN信号在肿瘤成瘤性、生长、转移及血管生成过程中发挥着重要作用,RUNX1的高表达与胶质瘤病人预后不良密切相关[17],而OPN是调控多种肿瘤间充质-上皮转化的关键因子[18]。本研究结果显示,转染RUNX1过表达质粒可升高A549细胞EdU阳性率、迁移率、侵袭数、细胞LRG1、RUNX1与OPN mRNA及蛋白表达、细胞Bcl-2、N-cadherin蛋白表达,降低其凋亡率、细胞caspase-3、Bax、E-cadherin蛋白表达,表明上调RUNX1表达可促进NSCLC细胞增殖、迁移和侵袭,且LRG1可促进RUNX1表达,进而诱导大肠癌细胞凋亡,因而推测下调RUNX1/OPN通路表达可能是敲低LRG1降低NSCLC细胞增殖、迁移和侵袭能力的分子机制,结果显示,RUNX1与OPN在人NSCLC细胞系A549、NCI-H838、NCI-H1650中高表达,转染LRG1 siRNA敲低LRG1可降低A549细胞RUNX1与OPN mRNA及蛋白表达,表明RUNX1/OPN信号参与介导LRG1对NSCLC细胞的增殖、迁移和侵袭过程,敲低LRG1同时过表达RUNX1,相比只敲低LRG1,可升高A549细胞EdU阳性率、迁移率、侵袭数、细胞RUNX1与OPN mRNA及蛋白表达、细胞Bcl-2、N-cadherin蛋白表达,降低其凋亡率、细胞caspase-3、Bax、E-cadherin蛋白表达,表明过表达RUNX1可减弱敲低LRG1对NSCLC细胞间充质-上皮转化、增殖、迁移和侵袭的抑制作用,逆转其抗癌功效,揭示LRG1是通过RUNX1/OPN轴调节NSCLC细胞增殖、迁移和侵袭的。
综上所述,敲低LRG1可下调RUNX1与OPN的表达,减弱NSCLC细胞增殖及间充质-上皮转化,降低其迁移和侵袭能力,并诱导NSCLC细胞大量凋亡,起到显著的抗癌功能,下调RUNX1/OPN通路是其分子机制之一,本研究有助于全面深入阐释NSCLC发病机制,为其临床治疗提供了新的有应用前景的作用靶点。
