基于指纹图谱及多组分含量测定的黄芩提取物质量控制研究
2023-07-19杨媛媛贾寒冰谢志民陶宏迅陈志永
杨媛媛,贾寒冰,谢志民,曲 彤,陶宏迅,张 鑫,陈志永*,胡 静*
(1.西安市食品药品检验所,陕西 西安 710054;2.陕西省中医药研究院,陕西 西安 710061;3.江苏大学 食品与生物工程学院,江苏 镇江 212013;4.陕西步长制药有限公司,陕西 西安 710075)
黄芩Scutellaria baicalensisGeorgi 具有清热燥湿、泻火解毒、止血安胎的功效[1],其主要药效成分为黄酮类化合物。目前,已从黄芩中分离得到黄芩苷、黄芩素、汉黄芩苷、汉黄芩素、千层纸素等120 余种黄酮类化合物[2-3],现代药理学研究表明此类化合物具有抗菌、抗氧化、抗病原体、抗肿瘤、免疫调节、神经保护等活性[4-8]。
黄芩提取物为黄芩的干燥根茎加工制成的提取物,因其基本保留了黄芩药材的有效成分群,目前已成为双黄连、银黄系列、芩连和茵栀黄系列口服制剂等多种中药制剂的原料药[9]。黄芩提取物质量标准收载于2020 年版《中国药典》(一部),鉴别项为黄芩苷的薄层色谱鉴别,含量测定项以黄芩苷为指标成分,采用HPLC 测定,规定黄芩苷含量按干燥品计算不得低于85.0%[1]。目前黄芩提取质量控制的相关文献多集中在黄芩苷、汉黄芩苷、黄芩素和汉黄芩素等部分黄酮类成分的含量测定[10-11],缺乏系统的指纹图谱研究和除黄芩苷外尽可能多的多成分分析。为完善黄芩提取物质量标准,全面、准确地反映其内在质量,本研究拟建立黄芩提取物HPLC 指纹图谱,并对18 批样品进行相似度评价、聚类分析(CA)、主成分分析(PCA)及正交偏最小二乘-判别分析(OPLS-DA),同时测定野黄芩苷、千层纸素A 苷、汉黄芩苷、汉黄芩素、白杨素、千层纸素A 的含量,旨在为黄芩提取物质量控制和临床应用提供参考。
1 仪器与试药
Agilent 1260 型高效液相色谱仪,Agilent Chem Station for LC Systems 色谱工作站(美国安捷伦科技公司);BS210S 型万分之一电子分析天平(北京赛多利斯天平有限公司);KQ-100 型超声波清洗器(昆山市超声仪器有限公司);PHS-2F 型台式精密pH 计(上海仪电科学仪器股份有限公司)。黄芩苷(批号:110715-201821,纯度:98%)、野黄芩苷(批号:110842-202010,纯度:98%)、黄芩素(批号:111595-201808,纯度:98%)、汉黄芩苷(批号:112002-201702,纯度:98.5%)、汉黄芩素(批号:111514-201706,纯度:98%),均由中国食品药品检定研究院提供(供含量测定用);千层纸素A 苷(批号:Q04602005021,纯度:98.0%)、白杨素(批号:B00111804027,纯度:98.96%)由北京中科质检生物技术有限公司提供(供含量测定用);千层纸素A(批号:6180,纯度:98%)由上海诗丹德标准技术服务有限公司提供(供含量测定用)。盐酸、磷酸、甲醇均为分析纯(国药集团化学试剂有限公司),乙腈为色谱纯(默克两合股份有限公司),水为超纯水。18 批次黄芩提取物S1~S18(批号:YZ20191202、YZ20200205、YZ20200307、YZ20200401、YZ20200402、YZ20200403、YZ20200411、YZ20200412、YZ20200413、YZ20200414、YZ20200421、YZ20210111、202001、202002、202003、20200401、20200402、20200403)由北京华润高科天然药物有限公司(编号:S1 ~S12)和榆林市子洲县天赐中药材有限责任公司(编号:S13 ~ S18)提供。
2 方法和结果
2.1 色谱条件
Shimadzu Shim-pack GISS -C18色谱柱(250 mm×4.6 mm,5 μm),以0.1%磷酸溶液为流动相A、乙腈为流动相B,梯度洗脱(0 ~ 55 min,85%→70%A;55 ~ 80 min,70%→50%A ;80 ~ 90 min,50%→30%A);流速为1.0 mL/min;柱温为30℃;检测波长为274 nm;进样量为10 μL。
2.2 混合对照品溶液制备
精密称取野黄芩苷、汉黄芩苷、千层纸素A、汉黄芩素、白杨素、黄芩素、千层纸素A 苷对照品适量,加70%甲醇分别制成含野黄芩苷75.54 μg/mL、千层纸素A 苷583.69 μg/mL、汉黄芩苷23.81 μg/mL、黄芩素232.38 μg/mL、汉黄芩素56.52 μg/mL、千层纸素A 22.47 μg/mL、白杨素9.88 μg/mL 的混合对照品溶液。
2.3 供试品溶液制备
精密称定本品粉末0.25 g,置50 mL 烧杯中,加水15 mL,用10%NaOH 溶液调节pH 值至6.5 ~7.0,转移至50 mL 容量瓶中,用水冲洗电极和烧杯数次,合并洗液于容量瓶中,至转移完全,加水稀释至刻度,摇匀。精密量取3 mL,置10 mL 容量瓶中,加入70%甲醇稀释至刻度,摇匀,滤过,取续滤液,即得。
2.4 HPLC 指纹图谱方法学考察
2.4.1 精密度试验 精密吸取黄芩提取物(批号:YZ20200403)的供试品溶液,按“2.1”项下色谱条件连续6 次进样测定。以6 号峰千层纸素A 苷为参照峰,13 个共有峰的相对保留时间和相对峰面积的RSD 均小于2%,表明仪器精密度良好。
2.4.2 重复性试验 平行制备同一批黄芩提取物(批号:YZ20200403)的供试品溶液6 份,按“2.1”项下色谱条件进样测定,以6 号峰千层纸素A 苷为参照峰,计算得各共有峰相对保留时间和相对峰面积RSD 均小于2%,表明该方法重复性较好。
2.4.3 稳定性试验 取黄芩提取物(批号:YZ20200403)供试品溶液,按照“2.1”项下色谱条件进样检测,分别在0、1.5、3、6、9、12、15、18、24 h 测定HPLC 色谱图,以6 号峰千层纸素A苷为参照峰,计算得13 个共有峰相对保留时间和相对峰面积的RSD 均小于2%,表明该供试品溶液在24 h 内稳定。
2.4.4 指纹图谱的建立及相似度评价 取18 批黄芩提取物粉末,按“2.3”项下供试品溶液制备方法制备供试品溶液,按“2.1”项下色谱条件测定,记录各样品色谱图,采用“中药色谱指纹图谱相似度评价系统(2012 版)”,参照图谱为S1 色谱图,选择平均数生成方法,时间窗设置0.1 min,进行相似度计算,结果分别为1.000、1.000、1.000、1.000、1.000、1.000、1.000、1.000、1.000、1.000、1.000、1.000、1.000、0.999、0.998、1.000、1.000、1.000。根据匹配结果,确定了13 个共有峰。在共有峰中根据对照品指认出8 个色谱峰,分别是1 号峰(野黄芩苷)、3 号峰(黄芩苷)、6 号峰(千层纸素A 苷)、8 号峰(汉黄芩苷)、10 号峰(黄芩素)、11 号峰(汉黄芩素)、12 号峰(白杨素)、13 号峰(千层纸素A)。黄芩提取物指纹图谱见图1,黄芩提取物样品HPLC 图见图2。
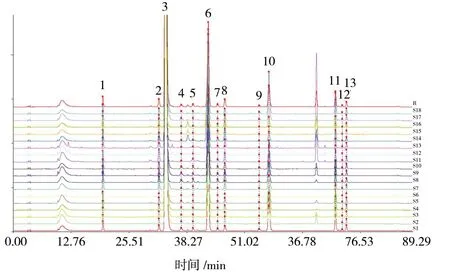
图1 18 批黄芩提取物HPLC 叠加指纹图谱Fig.1 HPLC superimposed fingerprints of 18 batches of Scutellaria baicalensis extract
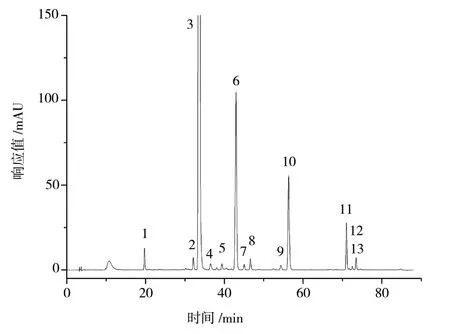
图2 黄芩提取物样品HPLC 图Fig.2 HPLC of Scutellaria baicalensis extract
2.5 化学模式识别
2.5.1 聚类分析(CA)运用SPSS 22.0 软件对18批样品的12 个共有峰(10 号峰黄芩素稳定性较差,已排除)进行聚类分析,以组间联接法聚类,欧氏距离为指标进行CA 作图,聚类结果见图3。
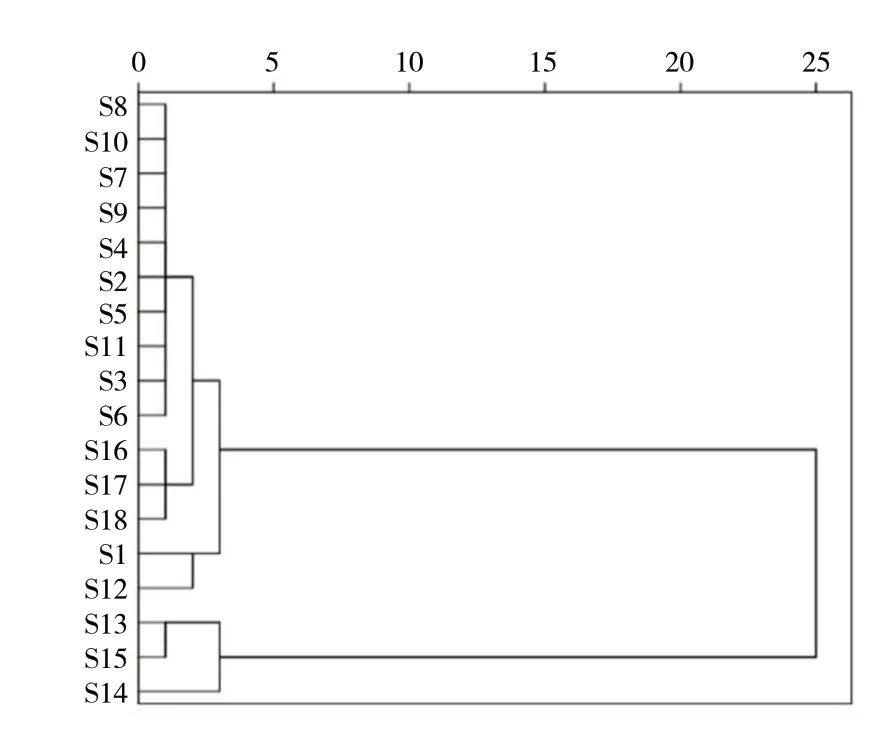
图3 18 批黄芩提取物(S1 ~S18)聚类分析树状图Fig.3 Dendrogram of clustering analysis for 18 batches of Scutellaria baicalensis extract
结果显示,当欧氏距离为20 时,18 批样品聚为两类:S1 ~S12、S16 ~S18 聚为一类;S13 ~S15聚为另一类。当欧氏距离为2.5 时,18 批样品聚为四类:S3 ~S11、S16 ~S18 聚为一类,S1 ~S12 聚为一类,S13 和S15 聚为一类,S14 聚为一类。
2.5.2 主成分分析(PCA)以18 批黄芩提取物指纹图谱中12 个共有峰的峰面积为变量(已剔除不稳定的10 号峰),采用SPSS 19.0 软件进行主成分分析,计算特征值及方差贡献率。以特征值>1 为标准,得到前3 个主成分的累计方差贡献率为95.797%,表明前3 个主成分可代表黄芩提取物的基本特征和大部分信息。结果见表1、表2。峰2、5、6、7、8、9 在主成分1 上具有较高的正载荷,峰3 和峰5 在主成分2上具有较高的正载荷,峰6 和峰7 在主成分3 上具有较高的正载荷。采用MarkerlynxXS 软件绘制主成分分析得分图,其结果与聚类分析结果基本一致,见图4。
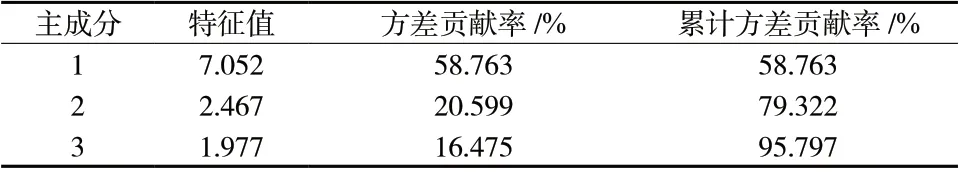
表1 18 批黄芩提取物样品主成分分析特征值及累计方差贡献率Tab.1 Eigenvalue and total variance of PCA for18 batches of Scutellaria baicalensis extract
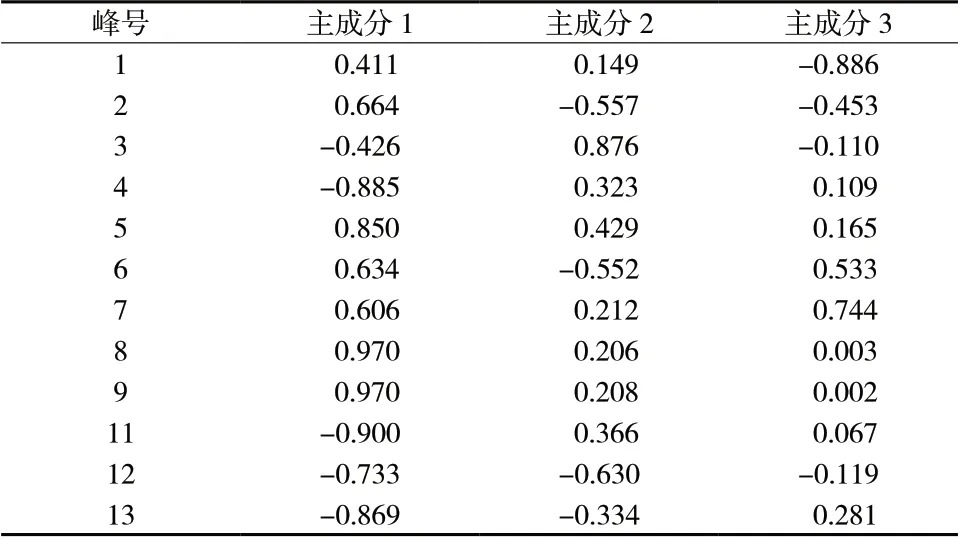
表2 18 批黄芩提取物样品主成分因子载荷矩阵Tab.2 Principal component factor load matrix for 18 batches of Scutellaria baicalensis extract
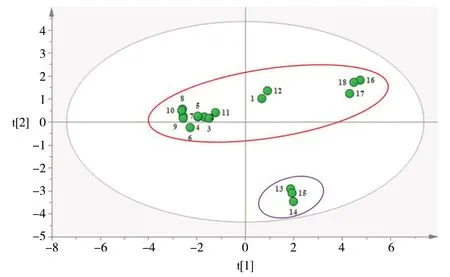
图4 18 批黄芩提取物样品PCA 得分图Fig.4 PCA score plot for 18 batches of Scutellaria baicalensis extract
2.5.3 正交偏最小二乘法判别分析(OPLS-DA)将18 批黄芩提取物指纹图谱中12 个共有峰的峰面积(已剔除不稳定的10 号峰),导入Markerlynx XS 软件,将18 批样品进行OPLS-DA,得到R2X为0.869,R2Y为0.985,Q2为0.933,均大于0.5,表明模型具有较好的预测能力[12]。18 批样品的OPLS-DA 模型得分图见图5,结果显示与CA 及PCA 分类结果一致。为进一步筛选出导致18 批样品产生差异的成分,通过提取OPLS-DA 模型中12 个变量(Var-1 ~9 为峰1 ~9,Var-10 ~12 为峰11 ~13)的重要值(VIP),以VIP>1为标准[13],筛选出3(黄芩苷)、2号色谱峰、6(千层纸素A 苷)、11(汉黄芩素)、4 号色谱峰可能是导致样品之间产生差异的主要标志成分,对分类结果有显著影响,见图6。(备注:原本的10号峰去除,11、12、13 号峰在数据集中依次为10、11、12 号峰。)
2.6 多成分含量测定
2.6.1 混合对照品溶液的制备 同“2.2”项。
2.6.2 供试品溶液的制备 同“2.3”项。
2.6.3 空白对照溶液的制备 量取15 mL 水,置50 mL 烧杯中,用10%NaOH 溶液调节pH 值至6.5 ~7.0,转移至50 mL 容量瓶中,用水冲洗电极和烧杯数次,合并洗液于容量瓶中,至转移完全,加水稀释至刻度,摇匀。精密量取3 mL,置10 mL 容量瓶中,加入70%甲醇稀释至刻度,摇匀,滤过,取续滤液,即得。
2.6.4 系统适应性实验 取上述混合对照品溶液、供试品溶液(编号:S1)、空白对照溶液各适量,按照“2.1”项下色谱条件进样测定,记录色谱图。结果各待测峰与相邻峰间的分离度均大于1.5,见图7。
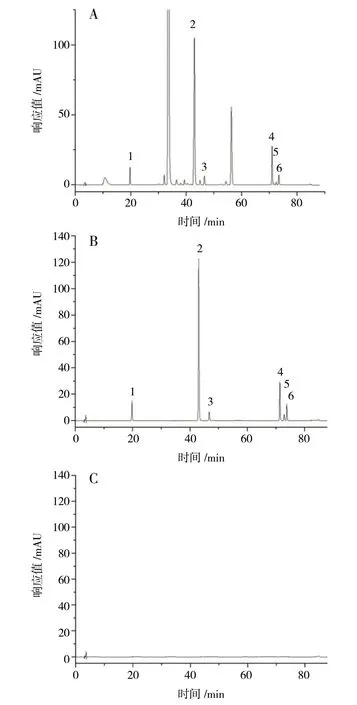
图7 编号S1 供试品(A)、对照品(B)、空白样品(C)高效液相色谱图Fig.7 HPLC chromatograms of S1 sample(A),mixed reference substance(B),blank sample(C)
2.6.5 线性关系考察 分别精密吸取“2.2”项混合对照品储备溶液10、5、2.5、1.25、0.625、0.313 mL置10 mL 容量瓶中,用70%甲醇稀释至刻度,摇匀,进样10 μL。按照“2.1”项下色谱条件测定,以进样量(X,ng)为横坐标,以峰面积平均值(Y)为纵坐标,进行线性回归,得到回归方程,结果见表3,各成分在各自范围内线性关系良好。
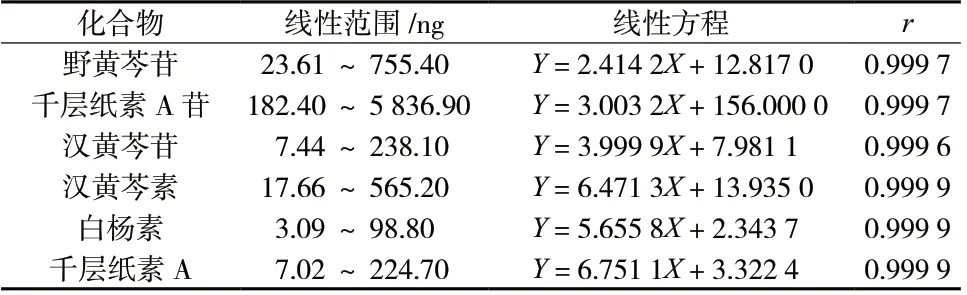
表3 6 个化合物的线性方程Tab.3 Linearity of calibration curve for 6 compounds
2.6.6 精密度试验 取“2.2”项下混合对照品溶液,按“2.1”项下色谱条件连续6 次进样检测,计算野黄芩苷、千层纸素A 苷、汉黄芩苷、汉黄芩素、白杨素、千层纸素A 峰面积、相对峰面积、保留时间和相对保留时间的RSD。结果6 种成分峰面积的RSD 值为0.26% ~ 1.89%、相对峰面积的RSD 值为0.10% ~1.95%、保留时间的RSD 值为0.02% ~ 1.54%、相对保留时间RSD 值为0.02% ~ 1.28%,均小于2.0%,表明该仪器精密度良好。
2.6.7 重复性试验 同一批黄芩提取物(批号:YZ20200403)样品,按“2.3”项下方法平行制备供试品溶液6 份,按“2.1”项下色谱条件测定,结果野黄芩苷、千层纸素A 苷、汉黄芩苷、汉黄芩素、白杨素、千层纸素A 的RSD 依次为0.58%、0.36%、1.29%、0.45%、1.81%、0.59%,表明该方法重复性良好。
2.6.8 稳定性试验 取黄芩提取物(批号:YZ20200403)供试品溶液,按“2.1”项下色谱条件,分别在0、1.5、3、6、9、12、15、18、24 h 测定HPLC 色谱图,结果野黄芩苷、千层纸素A 苷、汉黄芩苷、汉黄芩素、白杨素、千层纸素A 峰面积的 RSD 分别为0.51%、0.19%、1.33%、0.27%、1.98%、0.55%,表明该供试品溶液在24 h 内稳定。
2.6.9 加样回收率试验 取已知浓度黄芩提取物(批号:YZ20200403)样品,按“2.3”项方法制备供试品溶液,精密加入一定量的野黄芩苷、千层纸素A 苷、汉黄芩苷、汉黄芩素、白杨素、千层纸素A 对照品,按“2.1”项下色谱条件进样,计算供试品溶液中6 种化合物的平均加样回收率分别为99.43%、99.48%、99.58%、99.61%、99.81%、100.08%,RSD值分别为0.99%、1.37%、0.98%、1.08%、2.33%、1.85%,具体数据见表4。
2.6.10 样品含量测定 取18 批黄芩提取物粉末,按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件测定,计算18 批供试品中野黄芩苷、千层纸素A 苷、汉黄芩苷、汉黄芩素、白杨素、千层纸素A 的含量,结果见表5。结果表明,6 种成分含量依次为千层纸素A 苷(5.84%)>野黄芩苷(0.56%)>汉黄芩素(0.37%)>汉黄芩苷(0.35%)>千层纸素A(0.12%)>白杨素(0.04%)。产地在北京的样品S2 ~S10 中6 种成分的含量较为接近,产地在陕西子洲的样品S13 ~S15 和S16 ~S18 中6 种成分的含量有明显的差异。同一厂家、不同厂家及不同批次的黄芩提取物样品中6 种成分含量既存在一定差异性又具有相似性。
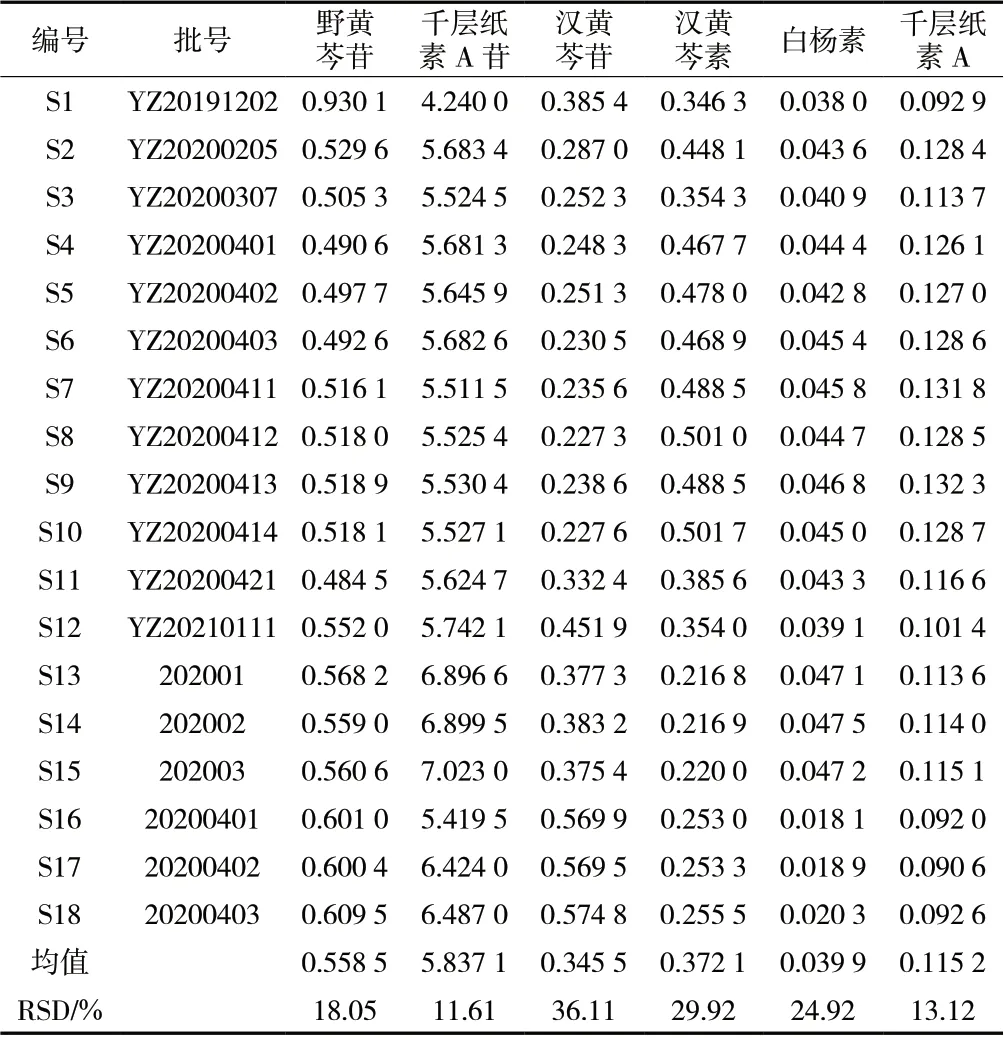
表5 18 批黄芩提取物中6 种成分质量分数(%,n = 3)Tab.5 Content of six compounds in 18 batches of Scutellaria baicalensis extract(%,n = 3)
3 讨论
3.1 色谱条件的选择
研究采用二极管阵列检测器对各化合物对照品进行全波长扫描(190 ~ 800 nm),结果显示黄芩苷最大吸收波长为280.9 nm、333.2 nm,千层纸素A 苷最大吸收波长为271.5 nm、311.1 nm,汉黄芩苷最大吸收波长为272.8 nm,黄芩素最大吸收波长为214.5 nm、276.0 nm、322.9 nm,汉黄芩素最大吸收波长为273.8 nm,白杨素最大吸收波长为211.3 nm、243.0 nm和569.0 nm,千层纸素A 最大吸收波长为214.7 nm、243.2 nm、271.2 nm、316.0 nm。分析发现,在274 nm 波长条件下,提取物指纹图谱出现的峰数量最多,且各化合物有较高的响应值,峰形良好,无杂质干扰,故选择该波长为指纹图谱及含量测定检测波长。
3.2 指纹图谱及模式识别分析
研究采用HPLC 法分析了两个厂家18 批黄芩提取物样品,建立了黄芩提取物的化学指纹图谱,结果表明各批次黄芩提取物的相似度为0.998 ~ 1.000,已知峰面积占总峰面积比为96.90%~98.59%。标定13 个共有峰,指认8 个共有峰。该方法可用于黄芩提取物的鉴定和整体质量控制。本研究对18 批黄芩提取物的质量评价不仅局限于相似度评价,还采用了化学模式识别的分析方法,更客观全面的评价黄芩提取物的质量。CA 中,当欧氏距离为20 时,18 批样品聚为两类:S1 ~S12、S16 ~S18 聚为一类,其中,S1 ~S12 厂家为北京,S16 ~S18 厂家为陕西子洲;S13 ~S15 聚为另一类,厂家为陕西子洲。当欧氏距离为2.5 时,18 批样品聚为四类:S3 ~S11,S16 ~S18 聚为一类,S1 ~S12 聚为一类,S13 和S15 聚为一类,S14 聚为一类,说明同一厂家生产的黄芩提取物质量存在一定的差异性,且不同厂家生产的黄芩提取物质量具有一定的相似性。PCA 和PLSDA 分析得出的结论与CA 基本一致,18 批黄芩提取物总体上聚为两类,并筛选出3(黄芩苷)、2 号色谱峰、6(千层纸素A 苷)、11(汉黄芩素)、4 号色谱峰等5 个引起差异的标志性成分,提示在黄芩提取物的生产过程中应重点关注该5 个成分的变化,以确保药品质量。本研究中黄芩苷VIP 值最大反向证明了2020 年版《中国药典》(一部)黄芩提取物中含量测定项检测黄芩苷含量的价值。此外,本研究对其余4个差异成分中2 个成分进行了定量分析,2 号峰和4号峰后续将采用液-质联用等方法鉴定,以便更好的对黄芩提取物进行质量控制。
3.3 多成分含量测定
通过查阅文献发现黄芩提取物解热抗炎作用是多种黄酮类成分的综合效应,其中,黄芩苷以外的其他成分有助于提高其整体解热抗炎作用[14],如:汉黄芩苷、汉黄芩素为抑菌药效物质[15],野黄芩苷、千层纸素A 的抗肿瘤活性[16]、白杨素的抗炎作用[17]等。本研究对7 个峰面积相对较大的化学成分(除黄芩苷外)进行定量分析,是对2020年版 《中国药典》(一部)黄芩提取物含量测定项的补充,同时能进一步考察不同批次黄芩提取物之间的质量差异。结果显示,各批次中各成分之间的含量差异较大,可能是由于黄芩药材质量受产地、采收季节、生长年份及提取物的工艺差异影响造成。此外,因黄芩素受光照、pH 等因素影响稳定性较差[18],由于提取物供试品溶液在制备过程中需要进行pH 调节,方法建立初期发现其在6 h内峰面积变化较大,因此未对该成分进行质量控制。
4 结论
本研究对18 批黄芩提取物建立了HPLC 指纹图谱,同时测定了野黄芩苷、千层纸素A 苷、汉黄芩苷、汉黄芩素、白杨素、千层纸素A 6 种化学成分的含量。所建立的方法简便、准确,为黄芩提取物的质量控制提供参考。
