生物炭与根际促生菌对盐渍化土壤理化性质及微生物群落组成的影响
2023-07-17远兵强田春丽胡莹莹
远兵强,田春丽,胡莹莹
(河南农业职业学院农业工程学院,河南中牟 451450)
根际促生菌(PGPR)是植物根际重要的微生物组成部分,对植物的生长发育和病害防治具有深远影响[1]。 大量研究表明,PGPR 具有固氮、溶磷、解钾、嗜盐、螯合铁、分泌抗生素及促进激素合成等功能[2],近年来已越来越多地应用于农业生产中,并有望在未来部分替代化肥和农药。 然而,在某些环境中,外源PGPR 进入土壤可能因为环境骤变以及与土著菌竞争等原因而无法存活[3]。因此,优良的载体是保证PGPR 菌株田间施用效果的关键,合格的载体应具备透气性好、能提供基础养分及免受土壤动物取食的特点[4]。
生物炭(BC)是植物残体、城市垃圾及畜禽粪便等生物质材料在限氧或无氧条件下,经中低温热裂解得到的一类富碳产物[4,5]。 BC 具有良好的孔隙排列结构、较大的比表面积、优良的阳离子交换性能及较高的pH 值,已被证明可有效改善土壤理化性质[6]。 此外,BC 在调节土壤微生物学特性方面亦发挥着重要作用。 前人研究表明,外源施用生物炭可导致土壤微生物群落发生显著而快速的变化,影响土壤微生物的组成和相关种类的丰度[7]。 这表明生物炭有利于土壤中微生物的增殖,这些变化可能会驱动养分循环,随后直接或间接影响植物生长,然而目前关于生物炭与微生物组配施用的效果仍处于起步阶段。
番茄(Solanum lycopersicumL.)是全球广泛种植的蔬菜类型,是保障民生的重要食材。 一般而言,为提高番茄的水肥利用效率,通常将肥料采用水溶性灌根施入,且灌溉水源多为咸水,加上大棚中较高的温度及二氧化碳浓度,易使棚中土壤盐渍化[8]。 土壤盐渍化产生的盐胁迫可在细胞、组织和分子水平上影响番茄植株的代谢与发育,造成番茄大幅度减产,已成为危及番茄种植效益的重要限制因素[9]。 盐渍土的有效改良已成为农业可持续化发展亟待解决的问题。 目前盐渍化土壤改良方法主要为施用有机肥,且主要关注土壤Na+含量和理化性质,较少关注土壤微生物的变化[10]。 基于此,本试验研究生物炭、根际促生菌对番茄氮素利用效率、盐渍化土壤改良效果及土壤微生物群落组成的影响,以期为生物炭和根际促生菌的可持续化生产应用提供理论依据。
1 材料与方法
1.1 供试材料
试验于2021 年4—6 月在河南农业职业学院蔬菜试验大棚中进行。 供试番茄品种为郑番1733,来自河南农业科学院蔬菜研究所。 将种子45℃水浴15 min 进行表面灭菌,蒸馏水浸泡2 h,之后采用蔬菜育苗盘培养至四叶期。
供试生物炭来自河南省生物炭工程技术研究中心。 采用玉米和小麦秸秆(W/W,1 ∶2)在低氧、440℃条件下连续炭化65 min 制得。 其基本性质:全碳含量49.82%、总氮2.13%、比表面积15.66 m2/g、容重0.26 g/cm3、pH 值8.36,主要官能团为羟基、烷烃和酰胺基。 PGPR 菌株为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)和巨大芽孢杆菌(Bacillus megaterium),已证实该复合菌株可有效促进番茄植株生长[11],施用菌落数量约为2×108CFU/mL。 供试氮磷钾肥分别为尿素(N 46%)、过磷酸钙(P2O546%)和氯化钾(K2O 60%),三者均为分析纯,皆购自默克化学试剂公司。
供试土壤类型为黄褐土,耕层土壤理化性质:有机质含量20.09 g/kg,全氮1.11 g/kg,碱解氮70.23 mg/kg,有效磷18.85 mg/kg,速效钾127.36 mg/kg,盐分1.38%,pH 值8.01。
1.2 试验设计
试验采用随机区组设计,共设置5 个处理,分别为不施肥处理(C0)、常规施肥处理(CK)、常规施肥+接种根际促生菌处理(PG)、常规施肥+生物炭处理(BC)、常规施肥+生物炭+接种根际促生菌处理(PGB),重复3 次。 小区面积20 m2(长5 m、宽4 m),小区间采用40 cm 宽浅沟分隔。
常规施肥处理中,番茄移栽前条施尿素、过磷酸钙和氯化钾(N 225 kg/hm2,N ∶P2O5∶K2O =5 ∶4 ∶4);生物炭用量为3 000 kg/hm2,采用小型旋转耕茬机以20 cm 深度翻耕施入并起垄。 番茄苗移栽为一穴两株,穴距40 cm。 移栽后根际促生菌采用灌根施入,用量为50 mL/穴。 试验过程中番茄按照常规灌溉、除草及病虫害防治方法进行管理,培育75 d。
1.3 样品采集
培养结束后,剪去番茄植株地上部,去除0~1 cm 表层土壤,采用小铁铲将根系完整挖出,去除距离根系较远的外围土壤,小心抖动根系表面土壤,无法抖落的土壤采用干净刷子轻轻刷落[12]。将各处理土壤混合后分为三部分:一部分保存于-20℃用于土壤Illumina Hiseq 分析;一部分保存于-4℃用于土壤酶活分析;最后一部分采用自然风干研磨过筛用于土壤理化性质分析。
1.4 测定项目及方法
1.4.1 土壤理化性质测定 参照鲍士旦[13]的方法测定土壤各项指标。 采用pH 计测定土壤pH值(水∶土=2.5 ∶1),土壤总盐度(TS)采用电导法测定,土壤容重(BD)采用环刀法测定,土壤有机质含量(OM)采用K2Cr2O7氧化还原滴定法测定,总氮(TN)采用半微量凯氏定氮法测定,有效氮(AN)采用碱解扩散法测定,全磷(TP)、全钾(TK)用NaOH 熔融后分别采用火焰光度法、钼锑抗比色法测定,有效磷(AP) 采用0.5 mol/L NaHCO3浸提分光光度法测定,速效钾(AK)采用NH4OAc浸提火焰光度法测定。
1.4.2 土壤酶活性测定 包括亚硝酸还原酶(NiR)、脲酶(UrE)、纤维素酶(CeL)及木质素过氧化物酶(LiP)活性,分别采用杭州锐创生物技术有限公司生产的试剂盒G0310F、G0301F、G0308F 及G0331F 测定。
1.4.3 土壤微生物群落分析 (1)土壤基因组DNA 的提取:采用DNA 提取试剂盒(Omega Biotek, Norcross, GA, US)对土壤进行基因组DNA的提取。 通过在0.7%琼脂糖凝胶上电泳并使用Nanodrop 2000 分光光度计(Thermo Fisher Scientific, Wilmington, DE)评估DNA 浓度和质量。 细菌扩增引物采用细菌16S rRNA V3—V4 区间:338F ( ACTCCTACGGGAGGCAGCAG ), 806R(GGACTACHVGGGTWTCTAAT)。 以土壤基因组DNA 为模板,通过两轮PCR 扩增,具体反应条件及反应步骤参考Li 等[14]的方法。 两轮扩增结束后采用2%琼脂糖凝胶电泳检测PCR 扩增数量与质量,采用QIAquick Gel Extraction 试剂盒(QIAGEN, Crawley, UK)纯化。
(2)DNA 纯化及Illumina-Mi Seq 测序:对于PCR 产物文库和正常扩增片段在400 bp 以上PCR 产物,选用60%磁珠(VAHTSTMDNA Clean Beads)处理。 使用TruSeq®DNA PCR-Free Sample Preparation Kit (Illumina, USA)生成测序文库,采用Illumina NovaSeq PE3000 对基因文库进行高通量测序。
(3)Illumina-Mi Seq 测序数据的处理:采用FASTP 软件对产生的测序数据进行双端筛选,以去除错误碱基及低质量序列(Phred >20),并以FASTQ 文件格式储存,采用FLASH 对有效数据进行拼接。 借助SSUrRNA 数据库(http:/ /www.arb-silva.de/)基于Mothur 算法对相关代表性序列进行分类信息注释,使用MUSCLE 对相似度为97%的操作分类单位(OTU)信息进行归一化,利用RDP 对细菌Silva 数据库(SSU132)比对进行物种分类注释,以获取每条序列从phylum 到genus 的分类信息[15]。 利用Mothur 软件统计每个生物样本的Chao1 和Shannon 多样性指数。 借助R 语言计算并绘制未加权unifrac 距离的非度量多维缩放(NMDS)的多元统计。 利用高通量测序数据与土壤理化因子进行冗余分析(RDA)。 以上分析委托杭州锐创生物技术有限公司完成。
1.5 数据处理与分析
采用Microsoft Excel 2016 进行数据整理,采用SPSS 19.0 软件进行单因素方差分析(ANOVA),采用邓肯氏多重比较法进行差异显著性检验(α =0.05),采用R 语言、Origin 2020 软件进行绘图。
2 结果与分析
2.1 生物炭与根际促生菌对盐渍化土壤理化性质的影响
由表1 可知,生物炭、根际促生菌处理(PG、BC、PGB)与常规施肥处理(CK)、不施肥处理(C0)在土壤总盐度(TS)含量、pH 值、土壤容重(BD)、有机质(OM)、全氮(TN)、速效钾(AK)含量等共10 个土壤指标中均存在一定差异。 与C0相比,CK 处理提高OM、全量养分(TN、TP、TK)和速效养分(AN、AP、AK)含量,而BD、TS 和pH 值略微下降。 与CK 相比,生物炭与根际促生菌处理可增加土壤全量养分、速效养分、OM 含量,而降低TS、pH 及BD。 整体而言,各指标中多以PGB 处理存在极值。 以上结果表明,生物炭与根际促生菌配施对土壤理化性质有显著影响,是改善盐渍化土壤性状的有效措施。
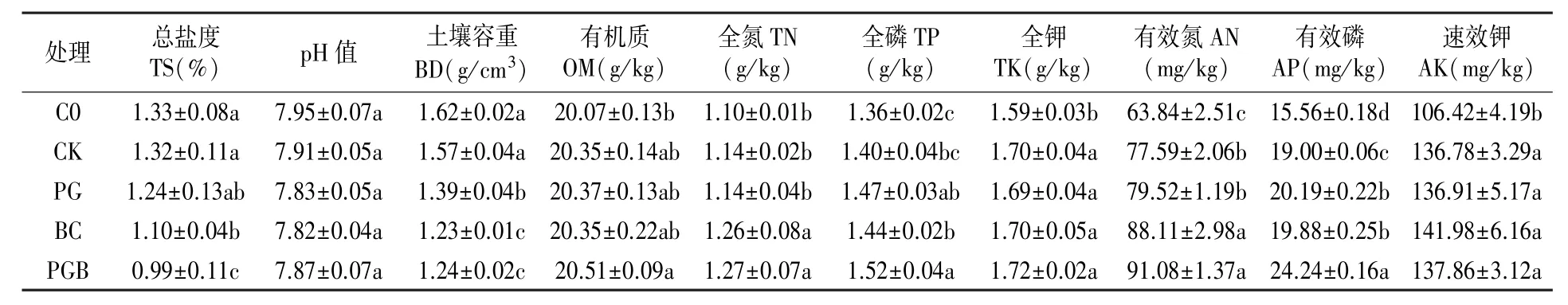
表1 生物炭与根际促生菌对盐渍化土壤理化性质的影响
2.2 生物炭与根际促生菌对盐渍化土壤酶活性的影响
由图1A 可知,土壤亚硝酸还原酶(NiR)活性各处理间均存在显著差异,与C0 相比,各施肥处理显著提高2.04~3.56 倍,且以PGB 处理NiR 活性最高,PG、BC 较PGB 分别显著低16.92%、9.62%。各处理土壤脲酶(UrE)活性表现为C0 <CK<BC<PG<PGB,与PGB 处理相比,C0、CK、PG、BC 分别显著降低71.54%、57.45%、32.39%、38.83%(图1B)。 土壤纤维素酶(CeL)活性以C0最低,与CK 无显著差异,两者皆显著低于生物炭与根际促生菌各处理,且以PGB 处理最大,较其他处理显著降低20.88%~52.15%(图1C)。 各处理土壤木质素过氧化物酶(LiP)活性表现为C0<CK<PG<BC<PGB,其中C0 与CK 无显著差异,但均显著低于生物炭与根际促生菌各处理;整体而言,以PGB 处理LiP 活性最高(图1D)。
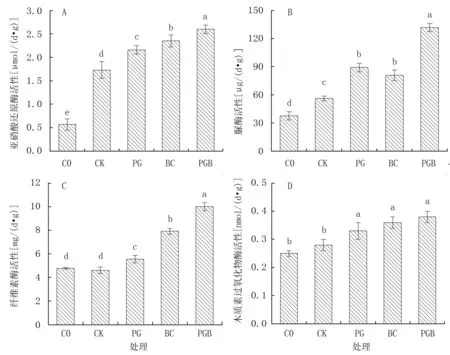
图1 生物炭与根际促生菌对盐渍化土壤酶活性的影响
2.3 生物炭与根际促生菌对盐渍化土壤微生物群落多样性与丰富度的影响
Chao1 指数和Shannon 指数是微生物群落多样性和丰富度的重要表征。 由图2A 可知,各处理Chao1 指数表现为C0<CK<BC<PG<PGB;C0与CK 间无显著差异,但皆显著小于生物炭与根际促生菌各处理。 而从Shannon 指数看,各处理表现为C0<CK<PG<BC<PGB,但处理间无显著差异(图2B)。 这表明在盐碱土中施用根际促生菌、生物炭均可对土壤微生物多样性及丰富度具有积极作用,尤以两者配施效果最好。
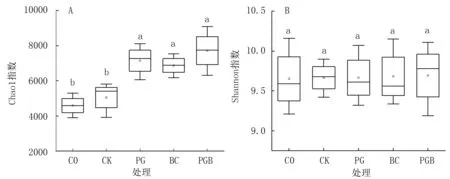
图2 生物炭与根际促生菌对盐渍化土壤微生物群落多样性与丰富度的影响
2.4 生物炭与根际促生菌对盐渍化土壤微生物群落分类与组成的影响
细菌基因序列测序共获取31 门575 属。 图3A 显示了土壤样品中丰度较高的前10 个优势门,可以看出以变形菌门(Proteobacteria)相对丰度最高,为33.32%~36.95%,之后依次是浮霉菌门(Planctomycetes)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、芽单胞菌门(Gematimonadetes)、拟杆菌门(Bacteroidetes)、 绿弯菌门(Chloroflexi)、疣微菌门(Verrucomicrobia)、硝化螺旋菌门(Patescibacteria)、厚壁菌门(Firmicutes),分别占总丰度的15.77%~19.97%、13.44%~14.12%、9.06%~11.13%、4.83% ~7.34%、4.02% ~5.56%、3.49%~4.51%、1.59%~3.69%、1.04%~1.63%、0.56%~1.64%;5 种处理间浮霉菌门、酸杆菌门和放线菌门的相对丰度存在明显差异,即与C0、CK 处理相比,PG、BC 和PGB 处理明显增加了三者的相对丰度,降低了芽单胞菌门、拟杆菌门、疣微菌门、厚壁菌门的相对丰度。
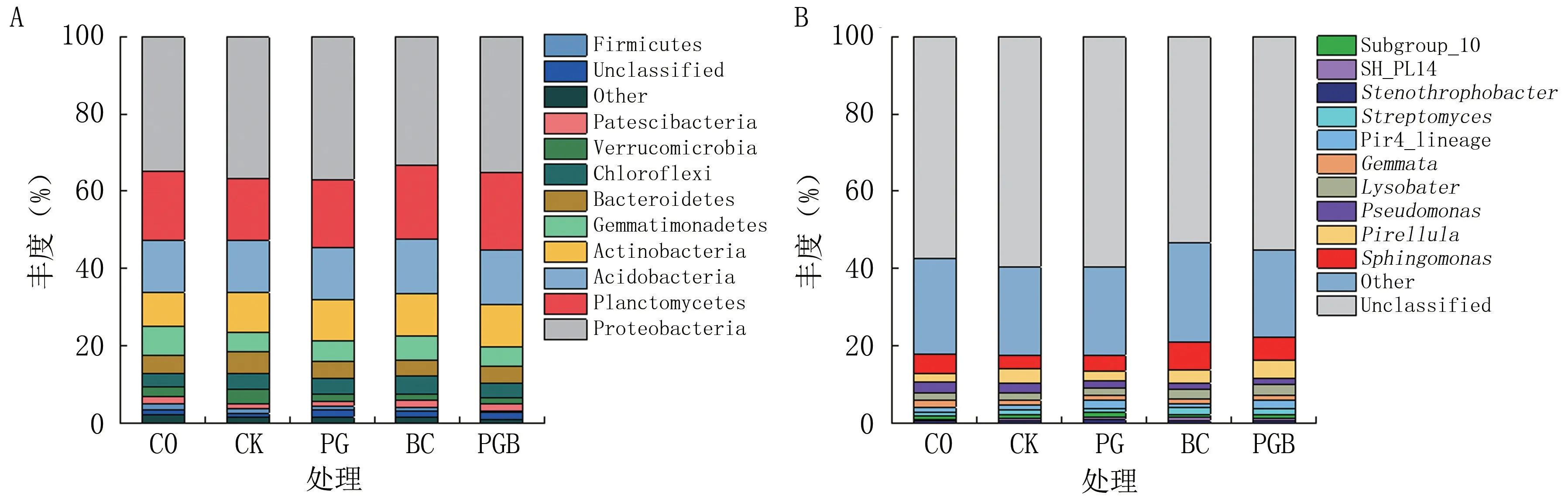
图3 生物炭与根际促生菌对盐渍化土壤微生物群落门水平(A)和属水平(B)组成的影响
由图3B 可知,在属水平上,所有土壤样品中排名前10 位的依次为鞘氨醇单胞菌属(Sphingomonas)、小梨形菌属(Pirellula)、假单胞菌属(Pseudomonas)、溶杆菌属(Lysobacter)、Pir4_lineage、出芽菌属(Gemmata)、链霉菌属(Streptomyces)、寡养单胞菌属(Stenotrophobacter)、Subgroup_10、SH-PL14,不同处理中该10 属丰度总和为17.86%~22.23%。 与C0 相比,所有施肥处理均增加了小梨形菌属(Pirellula)、SH-PL14、寡养单胞菌属(Stenotrophobacter)的相对丰度,而降低了假单胞菌属(Pseudomonas)的相对丰度,但不同处理间上述属总丰度均无明显差异。
2.5 生物炭与根际促生菌对盐渍化土壤微生物群落组成差异的影响
由图4 可知,在代表门水平方面,厚壁菌门(Firmicutes)是各处理丰度最高的门,且在PGB根际土壤微生物群落中丰度最高,分别是C0、CK处理的2.51、1.37 倍。 各处理代表性序列的发育树分支分析表明,厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)是各处理中最具代表性的门。 厚壁菌门(Firmicutes)中,C0、CK、PG、BC、PGB 处理的芽孢杆菌属(Bacillus)相对丰度分别为0.045%、0.077%、0.181%、0.275%、0.382%,且PG、BC、PGB 处理均显著大于C0、CK 处理。 变形菌门(Proteobacteria)中,C0、CK、PG、BC、PGB 处理的嗜盐单胞菌属(Halomonas)相对丰度分别为0.021%、0.075%、0.164%、0.168%、0.195%,且PG、BC、PGB 处理均明显大于C0、CK。 以上结果表明,根际促生菌、生物炭对细菌群落组成和丰度的影响存在一定差异,其中生物炭对细菌群落的影响大于根际促生菌,两者组合施用对微生物群落组成的影响最大。
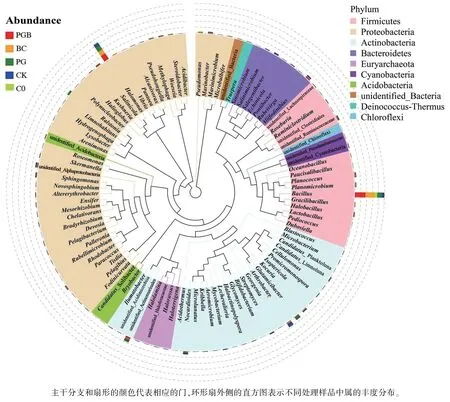
图4 微生物群落门、属水平代表性序列构建的系统发育树
2.6 非度量多维尺度和冗余分析
基于unifrac 距离的非度量多维尺度分析(NMDS)结果(图5A)表明,C0、CK 分布于上半轴,PG 分布于右下轴,BC、PGB 分布于左下轴;C0、CK、PG、BC、PGB 处理间均无明显交集、各自独立,表明各处理间的土壤微生物群落结构变异较大。
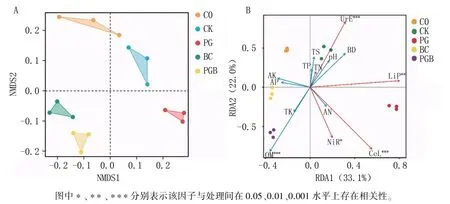
图5 不同处理土壤微生物群落间的非度量多维尺度分析(A)和环境因子与群落结构的冗余分析(B)
冗余分析(RDA)可用于分析环境因子与相关微生物群落间的相关性,箭头所处的象限表示环境因子与排序轴间的正负相关性,箭头与原点的连线长度代表着该环境因子与群落分布间相关程度的大小,连线越长,说明相关性越大,反之越小。 箭头连线和排序轴的夹角代表着某个环境因子与排序轴相关性的大小,夹角越小,相关性越高,反之越低。 由图5B 可知,RDA 的前两个轴分别解释了总变异的33.1%和22.0%。 C0、CK、PG、BC、PGB 处理各自分离,就C0、BC 处理而言,各土壤因子对其群落组成的影响较小。 就CK 而言,土壤脲酶(UrE)、木质素过氧化物酶(LiP)是影响其群落组成的主要因子,其中UrE 效应最为显著。 就PG 处理而言,土壤纤维素酶(CeL)、亚硝酸还原酶(NiR)是影响其群落组成的主要因子,尤其表现在CeL 因子。 就PGB 处理而言,土壤有机质(OM)是显著(P=0.00092)影响其群落组成的环境因子。
3 讨论与结论
物理、生物技术措施是改良盐渍土的重要手段。 现有的研究表明生物炭、根际促生菌(PGPR)均可影响土壤中盐分的分布,改善土壤理化性质、优化土地利用和促进植物生长[7,11]。
土壤理化性质如速效养分、有机质(OM)含量以及pH 值等是反映土壤底物可用性及其相关健康状况的重要表征[16]。 生物炭具有多孔结构、较大的比表面积、优良的阳离子交换性能及较高的pH 值,可降低土壤盐分含量、提高土壤养分含量及持水能力[6,7]。 本研究中,生物炭处理后土壤盐度显著降低,全量养分(TN、TK、TP)、速效养分(AN、AK、AP)和有机质(OM)含量明显提高。这与前人的研究结论趋于一致,即生物炭可加速土壤养分周转过程、增强微生物活性,从而降低土壤盐分和提高土壤肥力[17]。 本研究结果还表明,根际促生菌处理亦可改善土壤理化性质,这可能是因为PGPR 可以激活土壤功能,加速土壤养分溶解,减少土壤水分蒸发,保证土壤膨压转换,从而改善土壤理化性质[18]。 前人研究表明,土壤盐分增加会抑制土壤磷酸酶、脲酶及氧化酶等的活性[19]。 本研究结果表明,C0、CK 处理下的土壤亚硝酸还原酶(NiR)、纤维素酶(CeL)、脲酶(UrE)及木质素过氧化物酶(LiP)活性均较低,而在施用生物炭、PGPR 后这4 种酶活性显著提高,尤其表现在二者组合施用处理(PGB)。 特别地,UrE是将亚硝酸盐降解为NO 或NH3的重要催化酶,PGB 处理显著提高氮循环中的关键酶(UrE)活性,这意味着土壤中的亚硝酸盐代谢加快,从而可降低亚硝酸盐积累对生物体的毒性作用[15]。
生物炭可通过自身的物理化学功能调节养分循环,并影响土壤特性、植物生长和生态系统可持续性[20]。 PGPR 介导的微生物相互作用,从而对土壤肥力、健康状况和植物生长发育产生积极影响[21]。 本研究结果表明,与不施肥(C0)或常规施肥处理(CK)相比,PG、BC 和PGB 处理均影响群落Alpha 指数,其中多样性指数显著提高。 基于unifrac 距离的非度量多维尺度分析(NMDS)显示,5 个处理各自独立且完全分离。 这表明处理间的土壤微生物群落组成结构不同。 前人研究表明,在生物炭与外源微生物配施中,生物炭扮演着载体的辅助角色,以保护PGPR 免受土壤噬菌体或动物的取食[4,22]。 然而本研究中,NMDS 分析表明PG、BC 完全分离,PG 与PGB 处理距离也较远,这意味着生物炭发挥独立作用,且生物炭和PGPR 对土壤微生物群落的影响机制不同。
在群落结构中,变形菌门(Proteobacteria)是各处理占比丰度最高的优势门,其相对丰度占比33.32%~36.95%,该门包括一些固氮类细菌(如根瘤菌)[23]。 在属水平上,鞘氨醇单胞菌属(Sphingomonas)是相对丰度最高的优势属,该属包含许多功能丰富的新型微生物资源,是目前研究中被广泛认可的可改善逆境环境的指示性菌群。 此外,Sphingomonas能在营养有限的环境中生存,表现出反硝化和非共生固氮的特点,因此可能参与氮循环[24]。 此外,Sphingomonas还可用于芳香族化合物的生物降解,在环境污染中发挥着重要作用[25],这可能是该菌能成为盐渍土壤中优势菌的主要原因。 本研究发现BC 和PGB 处理显著增加Sphingomonas的丰度,这可能是因为生物炭可以富集土壤中的固氮菌,进一步改善土壤营养和质量,因此BC 和PGB 处理中TN 和AN 含量更高。
此外,微生物群落组成系统发育分析表明,嗜盐单胞菌属(Halomonas)、芽孢杆菌属(Bacillus)中,均以生物炭和根际促生菌处理(PG、BC、PGB)显著大于CK、C0 处理。 嗜盐单胞菌属(Halomonas)和芽孢杆菌属(Bacillus)是土壤中重要的有益菌群,可分泌多种抗生素、催化酶和生物活性物质,对改善土壤养分周转活力及降低土壤养分累积具有重要作用[14]。 以往的研究表明,pH 值、SOC、AP 和酶活性等环境因素决定生态系统中的土壤微生物群落[12,26]。 本研究RDA 分析表明,土壤酶活性对微生物群落组成具有重要影响,其中就PGB 处理而言,土壤有机质(OM)是影响其群落组成的重要环境因子。 这给予我们启示:施入一定量的有机肥可能对生物炭与根际促生菌效应具有进一步的提升作用。
