藤梨根乙醇提取物通过AKT/PUMA通路诱导结直肠癌细胞凋亡
2023-07-17王晓戎黄禹舒陈仁杰陈欣德张田革NISHIMWEAnge程峰吴志浩
王晓戎,黄禹舒,陈仁杰,陈欣德,张田革,NISHIMWE Ange,程峰,吴志浩
(1.安徽中医药高等专科学校中医学系,安徽 芜湖 241000;2.皖南医学院肿瘤微环境研究室,安徽 芜湖 241002)
结直肠癌是常见的消化系统恶性肿瘤[1],已成为癌症相关死亡的第四大原因[2]。尽管手术切除仍然是唯一能够治愈结直肠癌的方法,但辅助治疗在预防复发和转移方面发挥着重要作用[3]。近年来,中医药在结直肠癌的临床治疗中起到重要作用,逐渐成为癌症综合治疗中不可分割的环节[4]。
1 材料与方法
1.1 药物
将购自亳州市京皖中药饮片厂的藤梨根(产地:四川乐山)2 kg阴干,采用超速破碎仪粉碎,然后用400目滤网过筛备用。取400 g藤梨根粉末加入1 600 mL 95%乙醇,加热、回流、过滤,重复操作2次。将2次得到的澄清液合并,悬蒸至膏状,去离子水50 mL溶解后真空低温干燥4 d,得23.18 g固体粉末(藤梨根生药含量>99%)。取20 mg加入1 mL二甲基亚砜(DMSO)溶解成20 mg·mL-1的储存液以备用。
1.2 细胞株、主要试剂和仪器
结直肠癌细胞系HCT-15、LoVo(中科院细胞库),Hoechst-33258凋亡试剂(Beyotime,C0003),Annexin V-FITC/PI试剂盒(BD,556547),Cell Stain染色液(Beyotime,20294),PUMA siRNA(通用生物公司,RX053889),GSK-3β抑制剂1(MEC,HY-126144),AKT cDNA(Addgene,#78778),AKT抗体(CST,#9272)、p-AKT抗体(CST,#4060)、GSK-3β抗体(CST,#9325)、p-GSK-3β抗体(CST,#9323)、Caspase-3抗体(CST,#9662)、PUMA抗体(CST,#4976)、p65抗体(CST,#8242)、PARP抗体(CST,#9532)、β-actin抗体(CST,#3700),PUMA启动子(Addgene,#16591)、NF-κB启动子(Addgene,#61293)。
垂直电泳仪(BioRad,043BR61501),凝胶成像仪(GE,AI600),酶标仪(BioTek, GluMAX96),硝酸纤维素膜(GE Healthcare,66485),微孔板发光检测仪(Promega, E6521)。
1.3 方法
1.3.1 MTT实验 将HCT-15、LoVo细胞铺48孔培养板中,分为DMSO溶媒对照组、加药组(10、20、30、40、50 μg·mL-1)。各加药组用TLG处理24、36、48 h。加入0.5 g·L-1的MTT溶液处理4 h,后每孔用300 μL DMSO溶解,摇15 min,用酶标仪检测570 nm处的吸光度。
1.3.2 细胞平板克隆实验 每孔吸取500~600个HCT-15、LoVo细胞均匀铺到6孔板中,待细胞贴壁后,饥饿过夜,分为DMSO溶媒对照组、药物低浓度组(12.5 μg·mL-1)、药物中浓度组(25 μg·mL-1)、药物高浓度组(50 μg·mL-1)。TLG处理培养4 h,培养1周,隔日换液,结束后采用甲醇固定细胞,PBS洗3次,5%Cell Stain染色后拍照。利用Image Pro7.6对图片染色程度量化分析。
1.3.3 Annexin V-FITC/PI双染流式细胞术 将HCT-15、LoVo细胞接种到6孔培养板中,分为空白对照组、单染FITC对照组、单染PI对照组、DMSO溶媒对照组、加药组(25、50 μg·mL-1)。TLG处理4 h,0.25%胰酶(不含EDTA)消化6 min,2 000 r·min-1离心4 min,预冷PBS重悬清洗细胞,再次1 500 r·min-1离心3 min后去上清液。加入500 μL Binding buffer,混匀后依次加入5 μL FITC及5 μL PI,室温避光静置30 min。用Flowjo7.6软件分析。
1.3.4 Hoechst-33258染色法 将HCT-15细胞接种于6孔板中,分为DMSO溶媒对照组、加药组(25、50 μg·mL-1),其中加药组加药处理4 h。PBS清洗2次,用甲醇固定15 min,再用PBS洗2次,Hoechst 33258染色液于弱光处染色30 min。置于酶标仪下,观察,拍照。利用Image J对图片染色程度量化分析。
1.3.5 Western blot实验 将HCT-15细胞均匀铺于6孔板,分为DMSO溶媒对照组、加药组(10、20、30、40、50 μg·mL-1)。TLG处理4 h,采用于100 ℃加热5 min的1×Laemmli sample buffer,每孔加80 μL充分裂解后收集蛋白样本到1.5 mL离心管中,金属浴加热8 min,再上样,80 V电泳分离蛋白,将ACR胶上的蛋白泳道转移至硝酸纤维素膜上;之后再用丽春红显色,封闭1 h,4 ℃孵一抗12 h,TBST清洗5 min,室温孵二抗1 h,TBST清洗条带5 min,曝光,保存条带,Image J分析灰度值。重复以上实验步骤,独立实验3次。
1.3.6 双荧光素酶报告基因实验 将HCT-15细胞均匀铺在6孔板中,密度达60%左右时转染NF-κB启动子、PUMA启动子。质粒环中启动子下游为编码萤火虫荧光素酶蛋白的序列,若启动子被激活,则萤火虫荧光素酶含量上升,然后向细胞裂解液中加入底物后,在Promega微孔板发光检测仪检测荧光值。为使各样本间细胞含量具有可比性,需同时转染编码海肾荧光素酶的CMV超级启动子,作为内参。细胞分为DMSO溶媒对照组,加药组(10、20、30、40、50 μg·mL-1)。TLG处理4 h,裂解细胞并收集于EP管中,取上清液上机检测荧光值。重复以上实验步骤,独立实验3次。
企业财务会计风险管理工作的顺利开展,必须有一个完善的、专业的风险防范体系来作为基本保障。因为国内对财务会计风险管理方面的研究尚处于起步阶段,不少专业人员乐观认为财务会计工作中不会有风险产生,同时很多企业高层的会计风险意识相对不足,不愿花费较大经理来构建会计风险防范体系。而有些企业尽管建立了自身的会计风险防范管理体系,但该体系十分不完善,甚至对企业财务会计风险防范管理工作毫无使用价值。除此之外,很多企业没有立足自身实际来建立财务会计风险相关管理制度,从而造成风险防范管理体系无法正常运转。
1.3.7 质粒cDNA转染和siRNA转染 取对数生长期HCT-15细胞,均匀铺在6孔板中,密度达60%左右时,更换为不含双抗的DMEM培养基孵育30 min,转染AKT cDNA,6~8 h后换液,培养36 h后,饥饿过夜。细胞分为DMSO溶媒对照组、加药组(50 μg·mL-1TLG)、转染加药组(50 μg·mL-1TLG+AKT cDNA),处理4 h后收样。PUMA siRNA的正义链序列为5′-GAGCGGCGGAGACAAGAAGAGUUdTdT-3′,反义链序列为5′-AACUCUUCUUGUCUCCGCCGCUCdTdT-3′。
1.3.8 GSK-3β抑制剂实验 取对数生长期细胞均匀铺在6孔板中,密度达80%左右时,饥饿过夜。细胞分为DMSO溶媒对照组、加药组( 50 μg·mL-1TLG)、加药同时加抑制剂组(50 μg·mL-1TLG+GSK-3β抑制剂)处理4 h后收样。其中GSK-3β抑制剂的初始储存液浓度为1 mmol·mL-1(4.50 mL DMSO+1 mg粉末配置),取2 μL加入每孔1 mL的细胞培养板中,终浓度为2 μmol·mL-1,处理细胞4 h。
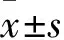
2 结果
2.1 TLG对结直肠癌细胞增殖的影响
MTT结果如图1A所示,与溶媒对照组相比,各浓度处理组结直肠癌细胞HCT-15、LoVo随药物浓度增加及处理时间延长,细胞活力下降,差异均有统计学意义(P<0.05,P<0.01,P<0.001,P<0.000 1)。在图1B中,与溶媒对照组相比,各浓度药物处理组单细胞克隆集落数下降,差异均有统计学意义(P<0.01,P<0.001,P<0.000 1)。其中,TLG在HCT-15中的增殖抑制效果明显优于LoVo。

注:A.MTT实验检测不同浓度TLG分别处理HCT-15、LoVo细胞24、36、48 h的细胞活力情况;B.平板克隆实验检测不同浓度TLG处理HCT-15、LoVo细胞4 h,培养1周后细胞克隆集落数量;与溶媒对照组比较,图1 TLG对结直肠癌细胞增殖能力的影响Fig.1 The effect of TLG on the proliferation ability of colorectal cancer cells
2.2 TLG对结直肠癌细胞凋亡的影响
图2A中利用Annexin V-FITC/PI双染细胞流式术检测细胞凋亡水平,结果显示:TLG(25、50 μg·mL-1)作用于HCT-15、LoVo细胞4 h后,与溶媒对照组相比,药物组随浓度的增加,凋亡细胞数增多,差异存在统计学意义(P<0.01,P<0.001)。同浓度药量处理下,HCT-15细胞的凋亡水平明显高于LoVo细胞。图2B选取HCT-15细胞进行Hoechst-33258染色实验,结果显示:TLG(25、50 μg·mL-1)作用于HCT-15细胞4 h后,与溶媒对照相比,加药组中细胞核固缩、白染的细胞数增多,差异存在统计学意义(P<0.001)。
注:A.Annexin V-FITC/PI双染细胞流式术检测TLG对HCT-15、LoVo细胞诱导凋亡的情况;B.Hoechst-33258染色,观察HCT-15细胞中核固缩、白染的细胞数量;与溶媒对照组比较,图2 TLG对结直肠癌细胞凋亡的影响Fig.2 TLG promoted apoptosis of colorectal cancer cell line HCT-15
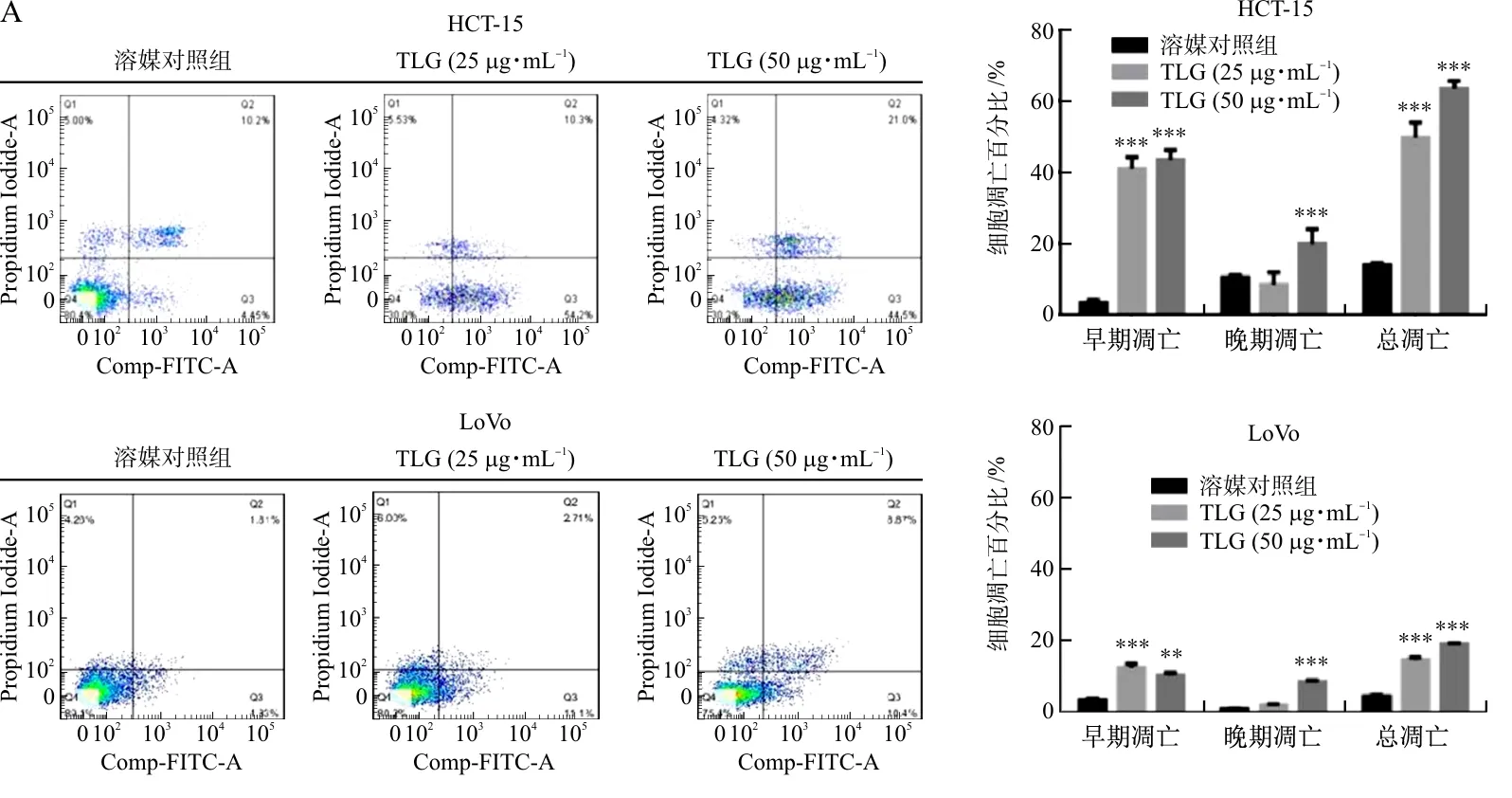
2.3 TLG对HCT-15细胞凋亡相关蛋白的影响
本研究发现TLG在HCT-15细胞系中的抑制效果更强,因此,之后的实验选择HCT-15进行进一步研究。Western blot结果显示,TLG(10、20、30、40、50 μg·mL-1)作用于HCT-15细胞4 h后,与溶媒对照组相比,Cleaved-Caspase-3/Caspase-3、Cleaved-PARP/PARP蛋白表达水平均有明显上升(P<0.01,P<0.001)(图3)。
注:与溶媒对照组(0 μg·mL-1)比较,
2.4 TLG诱导结直肠癌细胞HCT-15细胞系凋亡可能与NF-κB/PUMA通路有关
与溶媒对照组相比,p65、PUMA的蛋白表达量上升(P<0.05,P<0.01,P<0.001)(图4A)。双荧光素酶报告基因检测结果如图4B~C所示,与溶媒对照组相比,NF-κB、PUMA的启动子活性上升(P<0.05,P<0.01,P<0.001)。为进一步确认TLG是通过NF-κB/PUMA通路诱导凋亡,HCT-15转染PUMA siRNA后,TLG对PUMA、Cleaved-Caspase-3/Caspase-3、Cleaved-PARP/PARP蛋白表达的促进作用受到了抑制(P<0.001)(图4D),并且经MTT细胞活力检测发现,转染PUMA siRNA后,TLG对HCT-15细胞的抑制作用有所降低(P<0.001,P<0.000 1)(图4E)。

注:A.Western blot实验检测不同浓度TLG对HCT-15细胞中p65、PUMA蛋白表达水平调控的情况;B~C.双荧光素酶报告基因实验检测不同浓度TLG对HCT-15细胞中NF-κB、PUMA启动子的影响;D.Western blot实验检测HCT-15细胞在利用PUMA siRNA敲低PUMA蛋白表达后,对下游Cleaved-Caspase-3/Caspase-3、Cleaved-PARP/PARP的表达影响;E.MTT实验检测HCT-15细胞在利用PUMA siRNA敲低PUMA蛋白表达后,TLG对HCT-15细胞的抑制效果改变情况。与溶媒对照组比较,*P<0.05,**P<0.01,***P<0.001,****P<0.000 1;与50 μg·mL-1 TLG组比较,图4 TLG诱导结直肠癌细胞HCT-15细胞系凋亡与NF-κB/PUMA通路有关Fig.4 TLG induced apoptosis in human colorectal cancer cell line HCT-15 by NF-κB/PUMA pathway
2.5 TLG可能通过AKT/GSK-3β信号通路影响NF-κB/PUMA通路
为探究TLG是通过何种机制调控NF-κB/PUMA通路,本研究采用Western blot实验检测NF-κB/PUMA通路关联蛋白,发现随药物浓度升高,p-AKT/AKT、p-GSK-3β/GSK-3β水平降低(P<0.001)(图5A)。为进一步验证这一发现,本研究分别在加药的同时转染AKT cDNA或加入GSK-3β抑制剂作为恢复实验组,利用双荧光素酶报告基因检测启动子活性,与单加药相比,恢复实验组中NF-κB、PUMA的启动子活性得以恢复(P<0.01,P<0.001)(图5B~C);另外,利用Western blot实验检测下游蛋白表达水平,与单加药相比,恢复实验组中随p-AKT/AKT及p-GSK-3β/GSK-3β水平上升后,下游蛋白p65、PUMA、Cleaved-Caspase-3/Caspase-3、Cleaved-PARP/PARP重新下降(P<0.01,P<0.001)(图5D~E)。
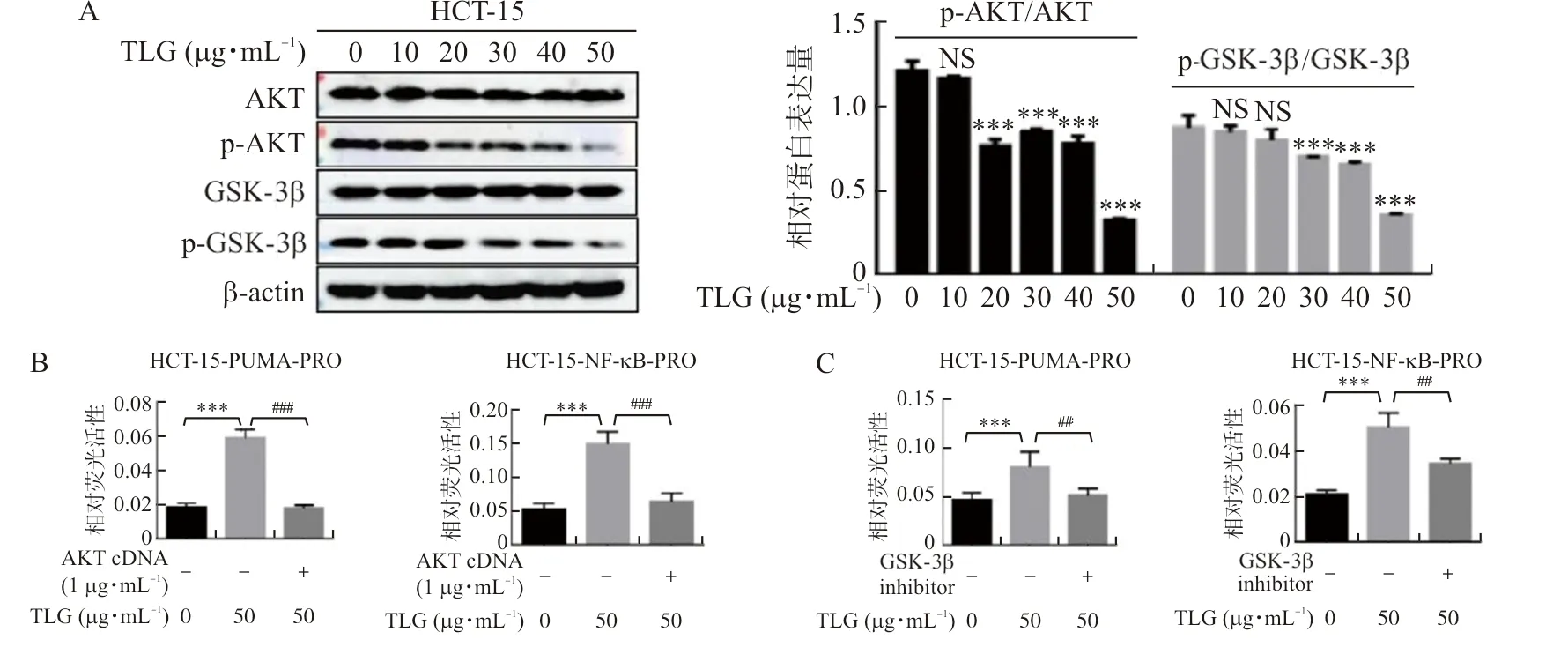
注:A.Western blot实验检测不同浓度TLG对HCT-15细胞中p-AKT/AKT、p-GSK-3β/GSK-3β蛋白表达水平调控的情况;B~C.双荧光素酶报告基因实验检测HCT-15细胞过表达AKT蛋白(GSK-3β抑制剂)同时TLG加药处理对NF-κB、PUMA启动子的影响;D~E.Western blot实验检测HCT-15细胞过表达AKT蛋白(GSK-3β抑制剂)同时TLG加药处理对下游蛋白的表达影响;与溶媒对照组比较,**P<0.01,***P<0.001;与50 μg·mL-1 TLG组比较,图5 TLG可能通过AKT/GSK-3β信号通路影响NF-κB/PUMA通路Fig.5 TLG may affect NF-κB/PUMA pathway by AKT/GSK-3β signaling pathway
2.6 GSK-3β抑制剂和AKT cDNA有效削弱TLG对HCT-15的抑制作用
至此,本研究在蛋白水平证明TLG能够通过AKT/GSK-3β信号通路激活NF-κB/PUMA通路,因此猜想TLG可能通过AKT/GSK-3β/NF-κB/PUMA通路诱导HCT-15细胞凋亡。为验证这一猜想,同样在加药的同时转染AKT cDNA或加入GSK-3β抑制剂作为恢复实验组,利用MTT检测细胞活力。与单加药组相比,恢复实验组中细胞活力重新上升(P<0.001)(图6A~B)。然后,以同样的方式构建恢复实验组,再利用平板克隆实验检测细胞增殖能力,与单加药组相比,恢复实验组中增殖能力重新恢复(P<0.01,P<0.001)(图6C)。另外,利用Hoechst-33258染色实验检测细胞凋亡水平,与单加药组相比,恢复实验组中凋亡水平重新下降(P<0.01,P<0.001)(图6D)。
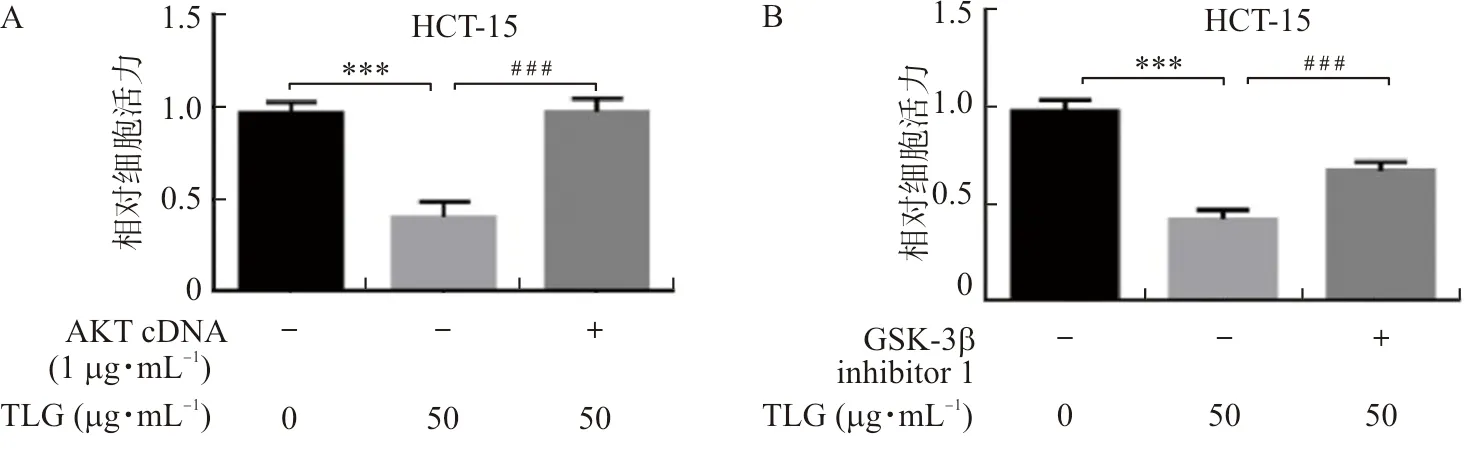
注:A~B.MTT实验检测HCT-15细胞在利用AKT cDNA过表达及GSK-3β抑制剂处理后,TLG对HCT-15细胞活力的抑制效果改变情况;C.平板克隆实验检测HCT-15细胞在利用AKT cDNA过表达及GSK-3β抑制剂处理后,TLG对HCT-15细胞克隆集落数量的抑制效果改变情况;D.Hoechst-33258染色实验检测HCT-15细胞在利用AKT cDNA过表达及GSK-3β抑制剂处理后,TLG对HCT-15细胞凋亡的诱导效果改变情况;与溶媒对照组比较,**P<0.01,***P<0.001;与50 μg·mL-1 TLG组比较,##P<0.01,###P<0.001。图6 GSK-3β抑制剂和AKT-cDNA能够有效遏制TLG对HCT-15的杀伤效果Fig.6 Utilization of GSK-3β inhibitor and overexpression of AKT cDNA to effectivelysuppress the killing effect of TLG on HCT-15
3 讨论
结直肠癌属于中医“肠蕈”“肠积”“下利”“积聚”等范畴,其发病原因为正气不足、饮食内伤、情志失调、外邪侵袭等导致气滞、血瘀、痰湿、热毒等互结于大肠,日久而成。前期调查研究显示,大肠湿热证、脾胃气虚证、肝肾阴虚证、气血两虚证、瘀毒阻滞证等在大肠癌证候类型中发生频率较高,为大肠癌的常见证候类型[14]。中药藤梨根味甘可补虚,性寒可清热,其清热解毒、祛风除湿、利尿止血等功效与结直肠癌湿、热、毒、瘀、虚等病理相契合。
本文前期细胞增殖及细胞凋亡检测结果发现,TLG对于结直肠癌细胞HCT-15、LoVo均有抑制效果,其中对HCT-15更为明显。之后,本实验选取了HCT-15细胞系进行机制探究实验。通过Western blot实验发现随TLG浓度增高其凋亡标志蛋白Cleaved-Caspase-3/Caspase-3、Cleaved-PARP/PARP蛋白水平明显上升。目前报道最经典的细胞凋亡通路是p53/PUMA通路[15],PUMA是Bcl-2家族蛋白,它通过诱导线粒体外膜透化释放大量凋亡因子介导凋亡,其中p53能够直接结合PUMA启动子来调控细胞凋亡,但多数癌细胞中p53基因是突变基因,HCT-15细胞即是典型的p53突变细胞株[16]。有文献报道,在某些p53突变细胞株中,NF-κB可以绕开p53直接促进PUMA表达,从而诱导细胞凋亡[17]。因此,本研究检测了NF-κB、PUMA的蛋白水平及启动子活力,发现TLG可以在转录水平上激活NF-κB/PUMA通路。另外,有研究报道AKT/GSK-3β通路可以直接调控NF-κB/PUMA通路[18]。本实验首先利用Western blot实验检测了AKT/GSK-3β通路蛋白,发现TLG降低了p-AKT/AKT、p-GSK-3β/GSK-3β的表达。由于本实验采用的p-AKT抗体为473号位上丝氨酸磷酸化的抗体,表示AKT的激活形式[19],而p-GSK-3β抗体为9号位上丝氨酸磷酸化的抗体,表示GSK-3β抑制形式[20]。因此可以得出TLG可能是通过抑制AKT的活性从而间接提高GSK-3β活性发挥下游调控机制的。之后采用AKT cDNA过表达以及加入GSK-3β抑制剂来构建恢复实验组,并利用双荧光素酶报告基因实验和Western blot实验分别从转录水平及蛋白水平证实TLG可以通过抑制AKT的活性间接升高GSK-3β活性并发挥下游调控机制。
有研究表明β-谷甾醇能够介导p53/NF-κB/BCRP信号轴,调节结直肠癌对化疗的反应,并发现其与奥沙利铂的联合应用可能是改善结直肠癌的潜在方法[21]。另外芦荟大黄素可诱导内质网应激依赖性细胞凋亡,从而发挥治疗结直肠癌的作用[22]。通过中药系统药理学平台得知β-谷甾醇、芦荟大黄素是藤梨根乙醇提取的复杂物质成分[23]。因此本文对藤梨根乙醇提取物的深入研究可以为结直肠癌的临床治疗提供潜在方案。
综上实验结果表明,藤梨根乙醇提取物能够显著诱导结直肠癌细胞凋亡,发挥有效抗肿瘤作用,其机制可能与AKT/PUMA信号通路有关。我国是藤梨根的主产区,药材价廉易得。接下来仍需深入对体内实验加以验证,并初步设立开展相关临床研究,希冀藤梨根能够逐步成为一种高效抗癌候选药物,使其发挥中医药防治恶性肿瘤的优势。
