养阴活血方干预ApoE-/-动脉粥样硬化小鼠DNA甲基化酶的研究
2023-07-17缪蓉周李煜白丹丹杨云君陈艳冉姜林宏袁冬平龙军吉娟
缪蓉,周李煜,白丹丹,杨云君,陈艳冉,姜林宏,袁冬平,龙军,吉娟
(1.南京中医药大学药学院,江苏 南京 210023;2.中国医学科学院皮肤病医院/中国医学科学院皮肤病研究所,江苏 南京 210042)
动脉粥样硬化(Atherosclerosis,AS)是脂质沉积驱动的慢性炎症性疾病,机体亢进的免疫应答与脂质负载共同参与AS病变[1]。DNA甲基化是由DNA甲基转移酶家族催化,将甲基添加到CpG位点5′位置的胞嘧啶碳上的表观遗传修饰过程[2]。异常的DNA甲基化通过参与炎症形成、平滑肌增殖、脂代谢调控和血管损伤等过程在AS病程中发挥重要作用[3]。近年来研究发现中药复方可以对DNA甲基化进行调控从而干预疾病的进程,包括AS、肿瘤等[4-5]。中医理论认为,AS的病机是肝肾阴虚,痰浊瘀阻,瘀热蕴毒损脉[6]。养阴活血方是江苏省名老中医唐蜀华教授依据多年治疗AS的临床经验,以补益肝肾阴血、活血清热解毒并治为原则创立的复方。课题组前期在高脂饮食(High fat diet,HFD)联合HSP65免疫和HFD联合LPS注射诱导的2种ApoE-/-小鼠AS模型中发现养阴活血方对AS具有积极的治疗作用[7],这些作用与其调节免疫和炎症有密切关系。然而养阴活血方能否通过调节感染性炎症条件下DNA甲基化的酶水平来减轻AS尚不清楚。本研究在构建HFD联合LPS注射形成AS疾病模型[8]的基础上,研究养阴活血方对感染性炎症诱发的ApoE-/-AS小鼠DNA甲基化酶水平的影响。
1 材料
1.1 动物
ApoE-/-小鼠(6~7周,18~22 g,雄性,SPF级),由南京大学-南京生物医药研究所提供,许可证号:SCXK(苏)2015-0001,饲养于南京中医药大学实验动物中心SPF级屏障环境。动物实验由南京中医药大学实验动物伦理委员会批准通过,伦理批号:201804A011。
1.2 药物与试剂
养阴活血方由制何首乌20 g,酒黄精10 g,虎杖30 g,漏芦30 g,姜黄10 g,红花10 g组成(江阴天江药业有限公司),批号:1511048、1512161、1510034、1506035、1507084、1512165。养阴单元由制何首乌、酒黄精组成,清热单元由虎杖、漏芦组成,活血单元由姜黄、红花组成。按前期报道方法制备养阴活血方及各功效单元[7],药物剂量(生药量)为:全方,18 g·kg-1;养阴,5 g·kg-1;清热,10 g·kg-1;活血,3.3 g·kg-1。辛伐他汀(河南天方药业有限公司,批号:160409174)。高脂饲料(含1.25%胆固醇以及20%猪油,南京市青龙山实验动物养殖场)。
总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)与高密度脂蛋白胆固醇(HDL-C)生化试剂盒(南京建成生物技术研究所,批号:20210401、20210401、20210331、20210331);油红O粉末(北京索莱宝科技有限公司,批号:20210426);5×All-In-One逆转录试剂盒、EvaGreen 2×qPCR MasterMix-Low ROX试剂盒(上海爱必梦生物科技有限公司,批号:Q20C22A、1051855127001);Anti-Dnmt1抗体(英国Abcam公司,批号:GR193233-1);Dnmt3b(E4I4O)Rabbit mAb(Mouse Specific)、Dnmt3a (D23G1) Rabbit mAb(美国CST公司,批号:1、5);Goat anti-rabbit IgG(H+L)(武汉三鹰生物技术有限公司,批号:20000199);Mouse IL-2 ELISA检测试剂盒(联科生物,批号:A20220755)、Mouse IL-6 ELISA检测试剂盒(联科生物,批号:A20630415)、Mouse TGF-β1 ELISA检测试剂盒(联科生物,批号:A98130432)。
1.3 主要仪器
5417R高速冷冻离心机(德国Eppendorf公司);7500实时荧光定量PCR仪(美国Applied Biosystems公司);EPS300双稳定时电泳仪(上海天能公司);GelDoc XR+全自动凝胶成像仪(美国Bio-Rad公司);Heraeus Multifuge X1R离心机(美国Thermo Fisher公司);Infinite M200PRO多功能酶标仪(瑞士TECAN公司);JB-L6生物组织包埋机(武汉俊杰公司);KZ-Ⅱ高速组织研磨仪(武汉赛维尔生物科技有限公司);Micro17R高速冷冻离心机(美国Thermo Fisher公司);Pannoramic MIDI组织切片扫描仪(匈牙利3DHISTECH公司);PowerPac HV电泳仪(美国Bio-Rad公司);RM2235病理切片机(上海徕卡公司);SynergyH1全功能微孔板检测仪(美国Biotek公司);Veriti 96-Well Thermal Cycler梯度逆转录PCR仪(美国Applied Biosystems公司)。
2 方法
2.1 分组、造模与给药
ApoE-/-小鼠分为对照组、模型组、辛伐他汀组、养阴活血方组、养阴组、清热组及活血组,每组10只。正常组饲喂普通饲料,其余各组给予高脂饲料(含1.25%胆固醇,20%猪油)喂养,持续20周。分别于第10、12、14、16、18周,对照组以外的各组动物腹腔注射10 μg LPS,对照组小鼠腹腔注射等体积无菌PBS。灌胃给药与高脂饮食同期进行,均采用临床等效量给药(辛伐他汀,3.3 mg·kg-1;养阴活血方,18 g·kg-1;养阴,5 g·kg-1;清热,10 g·kg-1;活血,3.3 g·kg-1),每日灌胃给药1次。
2.2 血脂检测
TC、TG、LDL-C和HDL-C生化试剂盒检测血脂,酶标仪读取OD值,再按公式计算得到血清中血脂含量。非高密度脂蛋白胆固醇(Non-HDL-C)的含量以TC扣除HDL-C计算得到。
2.3 qPCR检测小鼠脾脏和主动脉Tets和Dnmts mRNA表达
低温条件下称取约50 mg组织(脾脏/主动脉),剪碎后放入EP管,每份组织中加入1 mL TRIzol提取总RNA。逆转录成模板DNA前,RNA通过微量紫外分光光度计将脾脏/主动脉RNA定量为10 μg·mL-1后,将RNA逆转录为模板DNA。qPCR操作及反应条件按试剂盒说明书进行,引物委托上海生工合成(见表1)。数据按2-ΔΔCt法(内参β-actin)分析。

表1 qPCR引物序列Table 1 Primer sequences used in qPCR
2.4 Western blot检测小鼠脾脏/主动脉蛋白表达
低温条件下称取约50 mg组织(脾脏/主动脉),剪碎后放入EP管,管内加入2枚钢珠。采用蛋白裂解液提取组织中Dnmt1、Dnmt3a和Dnmt3b。通过BCA法测定蛋白质量浓度后,加入上样缓冲液在100 ℃金属浴中变性10 min。样品以30 μg的上样量进行电泳(先60 V,30 min;后90 V,60 min)。再转膜,封闭,加入兔抗鼠抗体Dnmt1(1∶1 000)、Dnmt3a(1∶1 000)、Dnmt3b(1∶1 000)、GAPDH(1∶1 000),4 ℃过夜,次日洗膜后加入辣根过氧化酶标记的二抗(1∶10 000)摇床孵育2 h,洗膜后,全自动凝胶成像仪获取条带图像,Image Lab 4.0.1软件分析。
2.5 主动脉斑块面积测定及冠脉病理分析
将主动脉从主动脉弓至左右髂总动脉分支分离,多余组织在解剖镜下进一步精密剖离,并在4%多聚甲醛中固定12 h。生理盐水洗涤后滴加油红O染色。Image J软件测量主动脉斑块面积,计算斑块与血管总面积的比值。心脏取下后于4%多聚甲醛中固定,进行HE冠脉染色。滴加中性树胶,封片后制成玻片标本,显微镜下拍摄(放大倍数:×400,标尺:50 μm)并分析病变程度。
2.6 ELISA法检测小鼠血清细胞因子表达
眼眶后静脉丛采血收集小鼠外周血,静置2 h,室温下3 000 r·min-1离心10 min获取血清,-80 ℃超低温冰箱分装保存备用。使用提供的IL-2、IL-6、TGF-β1 ELISA试剂盒进行检测,ELISA酶标板每孔血清上样量为20 μL,实验操作严格按照说明书要求进行,加入显色剂后,使用酶标仪读取规定波长下的OD值,通过标准曲线以及说明书中的公式计算各细胞因子含量。标准曲线R2>0.995。
2.7 统计学方法
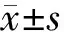
3 结果
3.1 养阴活血方及其功效单元对ApoE-/-小鼠AS斑块的影响
油红O染色结果如图1A所示。与对照组相比,模型组小鼠主动脉斑块显著增多,且主动脉弓处尤为明显(P<0.01)。与模型组相比,给药各组斑块面积均有所减少,其中养阴活血方组与清热组抑制斑块面积的效果更佳(P<0.01)。冠脉HE染色显示(图1B),与对照组相比,模型组小鼠出现明显管腔狭窄,管腔面积变小(P<0.05)。与模型组比较,辛伐他汀组、养阴活血方组及清热组管腔狭窄情况和管腔面积有明显改善(P<0.01)。以上结果表明,20周高脂饮食联合5次LPS注射造成了ApoE-/-小鼠严重的AS病变,表现为主动脉斑块增加与冠脉血管腔狭窄。养阴活血方及其功效单元对主动脉斑块形成和冠脉壁管腔变窄均有抑制作用。

注:A.油红O染色;B.HE染色;a.对照组;b.模型组;c.辛伐他汀组;d.养阴活血方组;e.养阴组;f.清热组;g.活血组;与对照组比较,#P<0.05,##P<0.01;与模型组比较,图1 各组主动脉斑块油红O染色(n=3)和冠脉HE染色(n=5)Fig.1 Aortic plaque oil red O staining (n=3) and coronary artery HE staining(n=5)
3.2 养阴活血方及其功效单元对ApoE-/-小鼠体质量和血脂的影响
各组小鼠体质量在20周内整体稳步上升。但在第12周,除对照组外,其他组体质量有所下降,第14周又恢复正常水平(图2A)。

注:与对照组比较,#P<0.05,##P<0.01,###P<0.001;与模型组比较,图2 养阴活血方及其功效单元对ApoE-/-小鼠体质量及血脂水平的影响Fig.2 Effects of Yangyin Huoxue Prescription and its efficacy units on weight and serum lipid levels of ApoE-/- mice
实验初期(第0周)各组小鼠血脂水平基本保持一致(图2B)。在实验中期(第10周,图2C),与对照组相比,模型组小鼠TC、non-HDL-C、LDL-C水平显著升高(P<0.01,P<0.001),而TG与HDL-C无变化。与模型组比较,各给药组non-HDL-C水平均明显升高(P<0.05)。在实验末期(第20周,图2D),与对照组相比,模型组小鼠TC、TG、non-HDL-C和LDL-C水平显著升高(P<0.05,P<0.01),HDL-C水平显著降低(P<0.001)。与模型组比较,养阴活血方组TG、LDL-C水平显著降低(P<0.01),而HDL-C水平显著升高(P<0.05),TC与non-HDL-C无变化;养阴组TC、non-HDL-C、LDL-C水平显著降低(P<0.05,P<0.01),而HDL-C升高(P<0.05);清热组TC(P<0.01)和TG(P<0.001)水平显著降低;活血组LDL-C、non-HDL-C、TG水平显著降低(P<0.05,P<0.01)。以上结果表明,养阴活血方及其功效单元对高脂饮食联合LPS刺激引起的AS ApoE-/-小鼠的血脂水平具有不同程度的调节作用,但对体质量无影响。
3.3 养阴活血方及其功效单元对ApoE-/-小鼠DNA甲基化相关mRNA表达的影响
qPCR结果如图3显示,与对照组比较,模型组小鼠脾脏及主动脉Tets mRNA含量均没有显著变化。与模型组比较,各给药组小鼠脾脏及主动脉Tets mRNA水平均没有显著变化。以上结果表明,高脂饮食联合LPS刺激不影响Tets mRNA的表达,养阴活血方及其功效单元对Tets mRNA的表达也无显著影响。
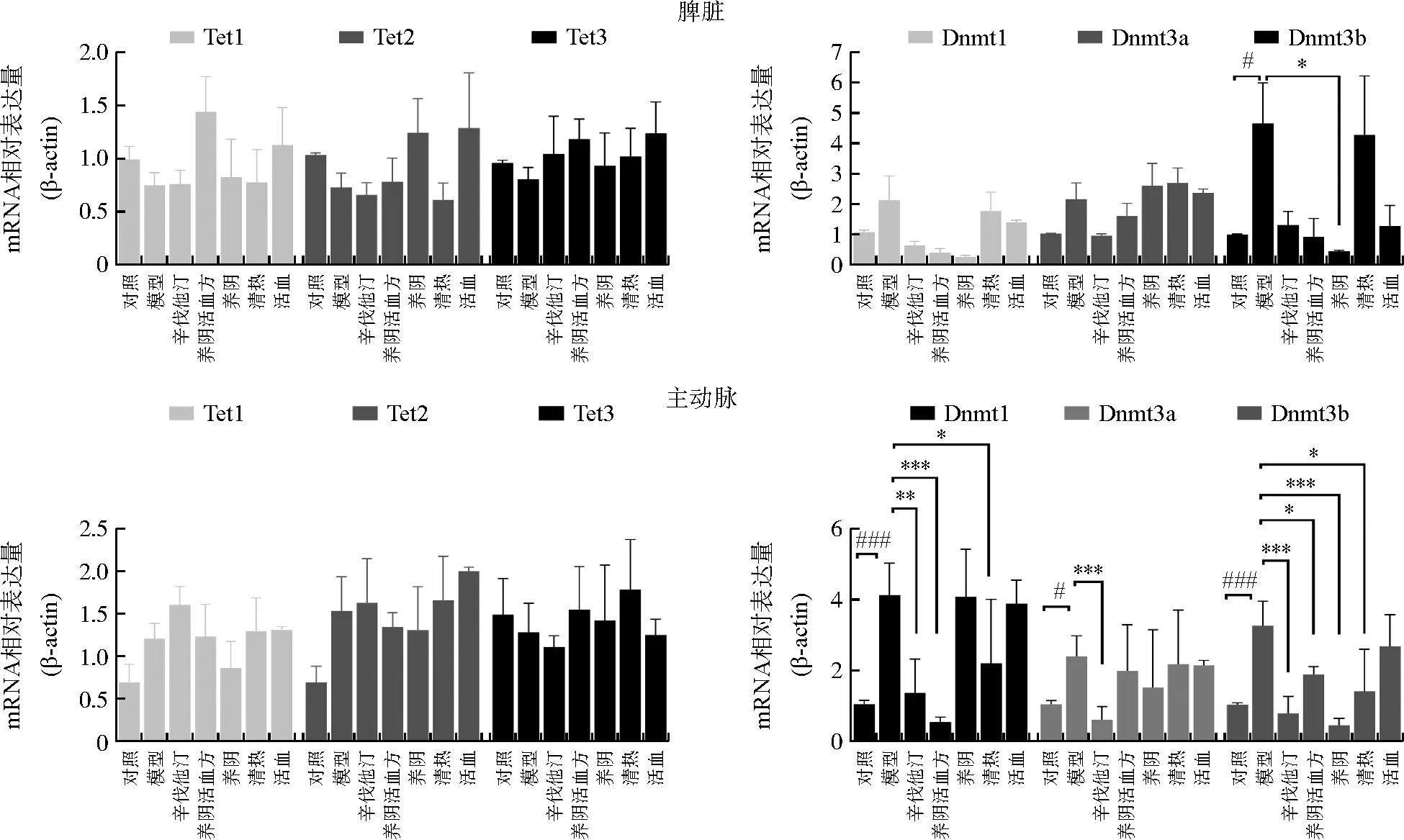
注:与对照组比较,#P<0.05,###P<0.001;与模型组比较,图3 养阴活血方及其功效单元对ApoE-/-小鼠脾脏和主动脉Tets、Dnmts mRNA表达的影响Fig.3 Effects of Yangyin Huoxue Prescription and its efficacy units on mRNA expression of Tets and Dnmts in spleen and aorta of ApoE-/-mice
与对照组比较,模型组小鼠脾脏Dnmt3b mRNA含量增加(P<0.05),主动脉Dnmt1、Dnmt3a、Dnmt3b mRNA含量显著增加(P<0.05,P<0.001)。与模型组比较,养阴活血方组降低主动脉Dnmt1(P<0.001)和Dnmt3b(P<0.05)的mRNA含量;养阴组降低脾脏和主动脉Dnmt3b mRNA表达量(P<0.05,P<0.001);清热组降低主动脉Dnmt1和Dnmt3b mRNA含量(P<0.05);活血组对脾脏和主动脉Dnmt1、Dnmt3a、Dnmt3b mRNA含量均无显著影响。以上结果表明,高脂复合LPS形成的感染型AS小鼠脾脏Dnmt3b及主动脉Dnmt1、Dnmt3a、Dnmt3b mRNA表达均增加,而养阴活血方及其功效单元降低主动脉Dnmt1和Dnmt3b mRNA表达的作用比较突出。
3.4 养阴活血方及其功效单元对ApoE-/-小鼠Dnmts相关蛋白表达的影响
Western blot结果显示,与对照组比较,模型组小鼠脾脏和主动脉Dnmt1(P<0.05)、Dnmt3a(P<0.05,P<0.01)、Dnmt3b(P<0.01)蛋白的表达增加(图4)。与模型组比较,养阴活血方降低脾脏Dnmt1和Dnmt3a的表达(P<0.05),降低主动脉Dnmt1和Dnmt3b的表达(P<0.05);养阴组降低主动脉Dnmt3a的表达(P<0.05);清热组降低脾脏Dnmt1的表达(P<0.05),降低主动脉Dnmt1、Dnmt3a和Dnmt3b的表达(P<0.05);活血组降低主动脉Dnmt3a和Dnmt3b的表达(P<0.05)。以上结果表明,高脂复合LPS形成的感染型AS小鼠脾脏和主动脉Dnmts蛋白表达均异常升高,而养阴活血方及其功效单元可以不同程度地降低脾脏和主动脉Dnmts蛋白的表达,其中,清热组对主动脉Dnmt1、Dnmt3a和Dnmt3b蛋白表达的调控作用最为明显。

注:与对照组比较,#P<0.05,##P<0.01;与模型组比较,
3.5 养阴活血方及其功效单元对ApoE-/-小鼠细胞因子的影响
ELISA结果显示(图5),与对照组比较,模型组小鼠血清IL-6和IL-2水平增加(P<0.05,P<0.01),TGF-β1水平明显下降(P<0.05)。与模型组比较,养阴活血方组降低IL-6水平(P<0.05),升高IL-2、TGF-β1水平(P<0.05);养阴组升高TGF-β1水平(P<0.05);清热组降低IL-6水平(P<0.05),增加TGF-β1水平(P<0.05);活血组降低IL-6水平(P<0.05),升高IL-2水平(P<0.05)。以上结果表明,高脂复合LPS形成的感染型AS小鼠血清中促炎因子IL-6和调节性因子IL-2水平升高,抑炎因子TGF-β1水平下降,而养阴活血方及其功效单元可以不同程度地降低促炎因子表达并提高抑炎因子表达。
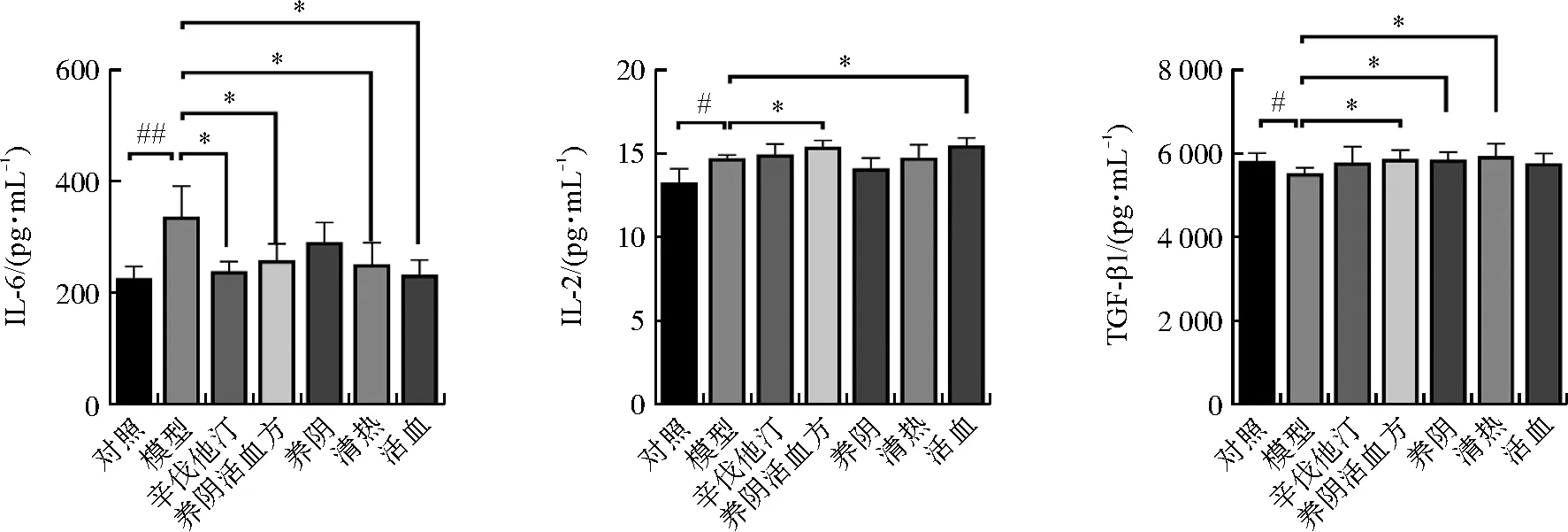
注:与对照组比较,#P<0.05,##P<0.01;与模型组比较,图5 养阴活血方及其功效单元对ApoE-/-小鼠细胞因子的影响Fig.5 Effects of Yangyin Huoxue Prescription and its efficacy units on cytokines of ApoE-/- mice
4 讨论
AS是一种复杂的慢性疾病,脂质紊乱伴随慢性炎症是其主要特征,增加了AS发生的概率[9]。除高水平脂质引起低强度全身性炎症反应外,细菌感染亦是AS形成的原因之一[10]。当机体感染革兰氏阴性菌时,其细胞壁外膜的构成成分之一脂多糖(Lipopolysaccharide,LPS)可以通过Toll样受体(Toll-Like receptor,TLR)介导的信号诱导免疫细胞活化,促进炎症因子分泌,引起全身炎症[11]。拮抗TLR4可以干扰LPS的促炎作用,从而延缓AS的发展[12]。本研究利用对ApoE-/-小鼠进行高脂饲养并腹腔注射LPS的方法,模拟高脂伴随感染的AS炎症特征,并在此基础上开展复方作用研究。
养阴活血方以制何首乌、黄精为君药,滋阴,化浊降脂;以姜黄、红花为臣药,通利血脉,化瘀行气;漏芦与虎杖共为佐使,清热解毒,活血化瘀。养阴活血方可分为3个功效单元,为养阴单元(制何首乌、酒黄精)、清热单元(虎杖、漏芦)、活血单元(红花、姜黄),3个功效单元在AS治疗中各有侧重。脂质代谢紊乱和慢性炎症是AS形成的关键病机[13]。本研究发现,养阴活血方在长期(第20周)使用时调控血脂的作用较短期(第10周)更为明显。养阴组降低TC(P<0.05)和LDL-C(P<0.01)、增加HDL-C水平(P<0.05)的作用比较突出,清热组降低TC、TG(P<0.01,P<0.001)作用也较为突出,活血组降低TG、LDL-C(P<0.05,P<0.01)的作用比较明显,养阴活血方组的调脂作用主要表现在降低TG(P<0.01)和LDL-C(P<0.01)、增加HDL(P<0.05)。高血脂是促进AS斑块形成的重要因素[14]。因此,降低血脂对减少AS斑块的形成是有利的。养阴活血方及其功效单元都能降低冠脉厚度,改善冠脉血管狭窄和面积并且减少主动脉斑块面积,其中养阴活血方组及清热组尤为明显(P<0.01)。可见,养阴活血方及其功效单元对AS斑块形成的改善作用与其长期应用有较好的调脂作用有密切关系。
研究发现,AS斑块中多种基因存在甲基化异常的现象,表明甲基化参与了AS疾病进展[15]。甲基化通过与基因组中CpG二核苷酸胞嘧啶5′碳位共价键结合一个甲基基团而发生可逆DNA甲基化修饰,通常能使基因表达沉默[2]。DNA高甲基化通常会导致长期且稳定的基因抑制,相反DNA低甲基化会促进基因表达[16]。Tets和Dnmts是调控基因甲基化的关键酶。Tets家族(包括Tet1、Tet2、Tet3)介导DNA去甲基化,而Dnmts家族(包括Dnmt1、Dnmt3a、Dnmt3b)介导DNA甲基化[15]。Tet2过表达可以通过调节Beclin1依赖性的自噬来减缓ApoE-/-小鼠AS发展,而Tet2缺失则加速AS发展[17]。造血细胞Tet2可以通过抑制促炎细胞因子和趋化因子的上调以及炎症小体的激活来预防AS[18]。AS的炎症状态与DNA的高甲基化有关[19]。Dnmts介导的甲基化可以通过调节NF-κB信号引发炎症,炎症也可以改变DNA甲基化[20]。Dnmt1和Dnmt3a介导了AS过程中DNA的甲基化[21]。Dnmt1是细胞内的主要Dnmts,负责维持甲基化水平。Dnmt1可以促进ABCA1甲基化,从而影响巨噬细胞胆固醇外流和泡沫细胞的形成[22]。因此,DNA甲基化酶参与了AS斑块部位细胞脂质代谢的调节。许多与AS发病相关的基因都受DNA甲基化的调节[16]。有研究表明,人颈AS斑块中Dnmt1的表达减少,Dnmt3a检测不到,Dnmt3b没有改变,Tet1增加[23]。给予高脂饮食的ApoE-/-小鼠AS斑块中Tet2表达水平下调,而过表达Tet2有效逆转AS病变[24]。在感染型炎症性疾病发展过程中也存在DNA甲基化修饰的现象。研究发现[25]在LPS诱导的脓毒症炎症小鼠的肺组织中,Dnmt1上调,而下调Dnmt1则可以抑制LPS对肺泡Ⅱ型上皮细胞的损伤作用。本研究发现,在高脂饮食联合LPS刺激引起的AS ApoE-/-小鼠脾脏及主动脉中,Tets mRNA的表达未发生显著变化,但是脾脏中Dnmt1 mRNA(P<0.05)和主动脉中Dnmt1、Dnmt3a、Dnmt3b mRNA(P<0.05,P<0.001)的表达增加,脾脏和主动脉中Dnmt1(P<0.05)、Dnmt3a(P<0.05,P<0.01)、Dnmt3b(P<0.01)蛋白的表达都增加。本实验结果可以推测,高脂饮食联合LPS注射造成ApoE-/-小鼠体内呈现炎症状态,进而出现高DNA甲基化水平,促使AS迅速发展。干预基因的甲基化可以对AS的发展产生影响[26]。本研究发现,养阴活血方及其功效单元对AS ApoE-/-小鼠脾脏及主动脉中Tets mRNA水平无显著影响。然而,在转录及翻译水平对主动脉Dnmt1、Dnmt3a和Dnmt3b的表达具有不同程度的下调作用。养阴活血方可以减轻AS炎症水平[9]。实验结果表明,养阴活血方及清热、活血单元降低促炎因子IL-6表达(P<0.05),而养阴活血方及养阴、清热单元提高抑炎因子TGF-β1表达(P<0.05)。以上实验结果提示养阴活血方及其功效单元可能下调了主动脉斑块的甲基化水平,并进一步减轻了炎症水平,这可能是养阴活血方减少AS斑块形成的内在原因。
综上所述,养阴活血方能够显著调节AS小鼠脂质水平,下调DNA甲基化水平,有效减少炎症因子的分泌,因而减少AS斑块面积。养阴组调节AS的效果主要来源于对血脂和抗炎因子的调节,清热组和活血组调节AS的效果则体现在对血脂、甲基化酶Dnmts、促炎和抗炎因子的调节方面。本实验发现养阴活血方中清热组和活血组可以下调Dnmts的表达,这可能与清热单元中虎杖主要成分白藜芦醇和活血单元中姜黄素的Dnmts抑制作用有密切关系[27-28]。养阴活血方全方对于AS的改善作用体现在将各功效单元的作用进行整合,对血脂、甲基化水平和炎症水平进行综合调节,揭示了中药复方在治疗AS这类复杂疾病时的整体作用的优势,但其具体分子机制还有待进一步的阐明。
