探究不同剂量硫辛酸注射液热原反应的影响
2023-07-11曾令伟刘昱廷赵亚绘
曾令伟,刘昱廷,赵亚绘
中南大学湘雅医院药学部,湖南长沙 410008
硫辛酸注射液是内分泌科常用药,其对蛋白质的糖基化抑制作用可有效降低葡萄糖转化率,同时体外实验中对神经组织脂质氧化的抑制作用突出,因此被广泛应用于糖尿病周围神经病变引起的感觉异常,在控制血糖和并发症方面具有突出效果[1-2]。硫辛酸的强效抗氧化作用不受基质性质影响,可在脂溶性和水溶性介质中发挥同样作用,且硫辛酸还原剂和其本身的抗氧化效果相近,还能促进维生素族再生,提升细胞谷胱甘肽水平,对机体代谢产生积极影响,因此也被应用于护肤美容行业和肿瘤治疗[3-5]。临床研究和动物试验均证实了硫辛酸的解毒作用,可用于减轻金属中毒对肝肾的毒性作用,有效保护机体重要脏器[6]。目前对于硫辛酸的研究越来越多,虽然硫辛酸注射液在临床应用剂量范围内处于用药安全水平,但其亦可引起诸多不良反应,比如过敏性紫癜、皮疹、静脉炎、头痛、抽搐、复视等[7-8]。近年来的研究发现,硫辛酸所致热原反应现象频出,相比于其他注射剂药品,硫辛酸注射液热原反应尤为严重,甚至危及生命[9]。基于上述观点,本研究于2022年3—6 月在中南大学医院药学研究所选取新西兰兔11 只作为药物实验动物进行观察,对硫辛酸热原反应的原因加以分析,为药物生产和临床用药安全提供参考。现报道如下。
1 材料与方法
1.1 材料
①仪器:体温测量设备为上海黄海药检仪器生产的热原测温仪,型号WRY-C,硫辛酸注射液加热设备为上海博迅生产的现代电热恒温水浴锅,型号SSW-600-2S,内毒素试验检查设备为湛江安度斯生物生产的恒温仪,试管型号选用TAL-40D 型,离心设备为安徽中科中佳生产的低速离心机,型号SC-3012,溶血试验所使用的吸光度计算设备为梅特勒-托利多国际生产的UV7 紫外可见分光光度计,以及由上海精科分析仪器公司生产的紫外分光光度计,型号754N。
②药品与试剂:热原反应试验药品分两种,即硫辛酸注射液实验样品和对照样品,均产自山西亚宝药业,前者给药剂量30 mg/kg,后者10 mg/kg。内毒素标本样品出自中国食品药品检定研究院,生产批号为150601-201783,内毒素试验中鲎试剂产自湛江博康生物,生产批号为1708230,溶血试验中血浆游离血红蛋白(hemoglobin, Hb)测定使用产自北京百奥莱博科技的游离Hb 检测试剂盒,生产批号为171205。所有药品和试剂均符合实验室标准。
③实验动物及环境:实验动物选择由济南西岭角养殖繁育中心供给的11 只新西兰兔,生产许可证为SCXK(鲁20150001),雌雄兔子比例为6∶5,实验兔子体质量2.3~2.6 kg,平均(2.47±1.05)kg,属普通级。于中南大学医院药学研究所开展研究,实验环境中白天和晚上交替时间12 h/12 h,动物饲养温度控制在22~26℃,最高温与最低温差值不超过5℃,空气湿度保持在50%~70%。研究已获本院动物伦理委员会批准。
1.2 方法
①热原试验:热原试验原理依据热原检查法,参考《中国药典》2020年版[9]。随机选出实验动物中的6 只新西兰兔进行观察,设计硫辛酸药物毒理试验,同时将实验动物分为两组,即硫辛酸注射液实验样品(观察组3 只)和硫辛酸注射液对照样品(对照组3 只)[10],观察组体质量(2.57±0.11)kg,雌兔2 只,雄兔1 只,对照组体质量(2.42±0.09)kg,雌兔2只,雄兔1 只,两组指标比较,差异无统计学意义(P>0.05),具有可比性。具体试验操作为先使用测温仪测量并记录兔子正常体温,于10 min 后使用注射器抽取加热到37.5℃左右的硫辛酸药物,随即由耳静脉缓慢注射入兔子体内,剂量控制在30 mg/kg(对照组为10 mg/kg)、1 mL/kg;紧接着是测温环节,测温间隔时间为0.5 h,3 h 内共测量6 次,对比于正常体温值,计算升高温度,用℃表示,计算方法为用最高一次的体温值减去正常值;热原反应阳性判断依据为,初检的3 只新西兰兔子体温升高温度总计≥1.3℃,或任意1 只兔子体温升高温度≥0.6℃,可判断初检阳性,随之进入复检环节,另外取5 只兔子进行复检,操作与初检方法一致。
②内毒素检查:内毒素检查方法依据《中国药典》2015年版进行。内毒素实验要求标准[9]:对照组标本样品为≤0.4 EU/mg,观察组标本样品为≤0.25 EU/mg(即内毒素限值)。具体操作如下,先以最大稀释倍数(CL/λ)将供试品稀释得到2 支供试品管和2 支阳性对照(将内毒素标准品使用该浓度的供试品稀释液制成2λ 浓度),内毒素阴性对照管和阳性对照管的制备需另外各取2 支,前者加入细菌内毒素检查用水,后者加入2λ 内毒素标准液,将制备完成的试管放入提前设定好的恒温仪处理,1 h 后取出,记录结果变化,判断阳性和阴性情况。
③体外溶血试验:体外溶血试验在动物红细胞悬液基础上进行,制备浓度为2%,具体操依据《中国药典》2015年版进行,加入供试液、新西兰兔红细胞悬液和0.9%氯化钠注射液,硫辛酸注射液为30 mg/mL 的浓度,阳性对照使用灭菌纯净水,阴性对照使用0.9%氯化钠注射液[9]。参照药典计算溶血率,a 是供试品各管的上清液吸收度,b 是灭菌纯净水上清液吸收度,c 是0.9%氯化钠注射液对照管上清液吸收度,具体计算方法为先调零处理,使用0.9%氯化钠注射液在分光光度计作用下操作,波长在545 nm 时使用分光光度计测定吸收度,溶血率=(a-c)/(b-c)×100%。
④体内溶血试验:体内溶血试验通过静脉给药,首先给药前2 h 采集耳中动脉血2 mL 置于抗凝管,紧接着对6只试验兔子以1 mL/kg容积、30 mg/mL浓度以及30 mg/kg 的剂量进行耳静脉注射给药,仅注射1 次,随后于2 h 同样采集耳中动脉血。使用低速离心机分别测定给药前后血浆中游离Hb 水平,对比前后变化,判断体内溶血试验阳性情况。
1.3 观察指标
观察两组兔子体内温度值,统计较正常体温升高的水平,判断两组热原反应阳性结果,观察细菌内毒素检查结果,判断致热原是否为内毒素,观察分光光度计吸收度数值,计算体外溶血率,判断体外溶血反应是否导致热原反应,观察兔子体内血浆游离Hb 水平。
1.4 统计方法
采用SPSS 22.0 统计学软件分析数据,计量资料以(±s)表示,LSD 检验用于方差齐的数据,t检验用于方差不齐的数据,通过单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 热原检查结果
观察组初检和复检结果中,每只兔子体温升高均>0.6℃,温度升高总和分别为2.3℃、3.7℃,热原反应结果均为阳性,硫辛酸注射液剂量为30 mg/kg,而对照组每只兔子体温升高均<0.6℃,温度升高总和为0.9℃,热原反应结果为阴性。见表1、表2。

表1 初检硫辛酸注射液热原检查情况(℃)

表2 复检硫辛酸注射液热原检查情况(℃)
2.2 内毒素检查结果
内毒素检测结果中两组均显示阴性,与热原反应无必要联系,内毒素含量在规定范围内,符合标准,见表3。

表3 硫辛酸注射液内毒素检查结果
2.3 体外溶血试验结果
体外溶血试验中观察组溶血率超过5%,硫辛酸注射液浓度<30 mg/mL,加样0.3 mL 后即出现了明显溶血反应,观察组为阳性结果,对照组溶血率显然不足5%,为阴性结果。见表4。
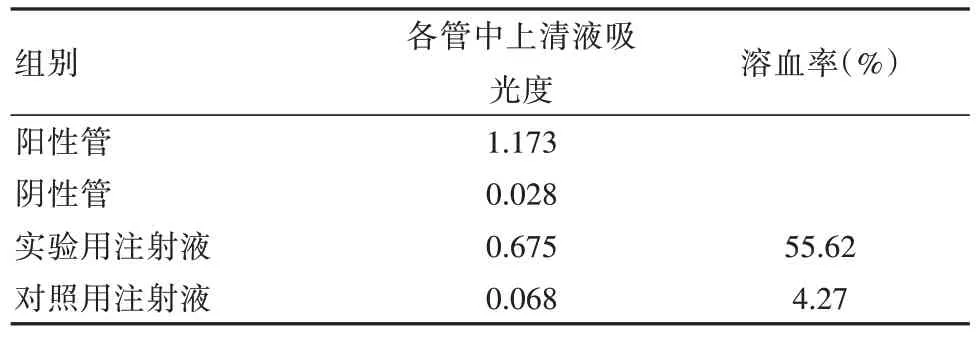
表4 硫辛酸注射液体外溶血试验结果
2.4 体内溶血试验结果
体内溶血试验中观察组兔子注射硫辛酸后血浆游离Hb 水平较对照组明显升高,差异有统计学意义(P<0.001),且观察组较注射前Hb 水平提升明显,差异有统计学意义(P<0.001),而对照组注射后Hb 水平较注射前升高不明显,差异物统计学意义(P=0.179)。见表5。
表5 硫辛酸注射液体内溶血试验结果(±s)

表5 硫辛酸注射液体内溶血试验结果(±s)
组别观察组(n=3)对照组(n=3)t 值P 值注射剂量(mg/kg)3030注射前(g/L)46.15±9.1747.21±4.69-0.1780.867注射后(g/L)128.54±11.7651.36±8.239.3130.001 t 值55.0982.031 P 值<0.0010.179
3 讨论
致热原是引起临床用药出现热原反应的主要原因,热原反应也是常见不良反应,持续高热可能诱发休克,危及患者生命,因此用药说明应严格进行,降低热原反应发生率[10]。常见致热原分为内源性和外源性两种,细菌内毒素属外源性,在临床最多见,而内源性机制复杂,但与机体中枢的调节和溶血反应具有一定联系,但具体结果尚待研究。有关研究采用4 种中药制剂以检查家兔热原反应试验结果提示,细菌内毒素检查法可为热原检查提供一定依据[11]。有关研究指出,鲎试剂热原检查法易出现假阳性结果,且灵敏度受多因素影响,建议兔法与内毒素法联合检测,以降低干扰因素,提高准确性[12]。兔试验和鲎试剂法常被作为热原检查的通用方法,在热原反应的药品质量检查中具有重要意义[13-14]。而上述试验中使用鲎试剂检查内毒素是否为热原反应的主要因素,结果提示阴性,而兔试验结果显示硫辛酸注射液热原反应阳性,两项研究结论不同的原因可能在于注射制剂的差异,具体原因有待进一步探讨。本研究结论表明致热原与外源性细菌内毒素联系不大,后续可进行深入研究,分析具体原因。溶血试验的设计逻辑源于红细胞破裂可致免疫因子这类内源性致热原释放,最终引起体温变化,依据此种思路设计溶血试验[15]。田恩圣等[8]通过对体外溶血试验的实践,证明了硫辛酸注射液浓度30 mg/mL 情况下可引起溶血反应,而体内溶血试验结果提示注射30 mg/mL 硫辛酸后2 h 新西兰兔血浆中游离Hb 为(125.9±31.5)g/L,较注射前(45.2±11.8)g/L 提升明显(P<0.01),证明了体内溶血反应阳性。在上述研究中,体外溶血试验阳性,判断一定浓度的硫辛酸可致溶血,而体内溶血试验结果显示观察组兔子血浆游离Hb 水平为(128.54±11.76)g/L,较对照组(51.36±8.23)g/L 明显升高(P<0.05),且较给药前提升明显(P<0.05),而对照组Hb 水平较给药前相比变化不大(P>0.05),进一步表明体内溶血反应的发生可诱导新西兰兔体内细胞因子、激素、免疫介质等内源性致热原入血,红细胞的破坏和相关炎性因子干扰了体温调节中枢,从而引起体温升高现象[16-17]。
综上所述,硫辛酸注射液热原反应与细菌内毒素关系不大,而实验样品在30 mg/kg 注射剂量条件下可致热原反应呈现阳性结果,过程中实验兔子体内外发生了溶血反应,可能与热原反应存在内在联系,需引起高度重视。
