东北林蛙LEPR基因的克隆及其在感染中的表达分析
2023-07-08许冬梅刘婷婷刘依铭刘玉芬赵文阁
许冬梅,刘婷婷,刘依铭,刘玉芬,刘 鹏,赵文阁
(哈尔滨师范大学 生命科学与技术学院,黑龙江 哈尔滨 150025)
瘦素(Leptin,LEP)是一种由脂肪组织分泌的16 ku蛋白激素,属于Ⅰ类α螺旋细胞因子,目前已在哺乳类、鱼类和鸟类等多种脊椎动物中广泛开展研究[1-3]。LEP与瘦素受体(Leptin receptor,LEPR)结合后,发挥脂质代谢和能量平衡[4]、生殖[5]、造血[6]、骨形成[7]和参与免疫反应[8]。近年来研究[9-10]显示,在动物体LEP和LEPR可作为一种新发现的炎症介质,起到调节炎症和免疫应答作用。LEPR基因最早在小鼠脉络膜丛克隆出来,归入Ⅰ类细胞因子受体超家族[11],具有一次跨膜结构域的细胞膜蛋白。LEPR基因具有多态性,在哺乳动物中主要分为长型、短型、分泌型3类6种亚型,即LEPR-a、LEPR-b、 LEPR-c、LEPR-d、LEPR-e、LEPR-f 6种,其中长型LEPR-b具有完整功能结构域,是具有完整细胞内信号传导功能的受体。LEPR-e没有跨膜结构域,所以是一种分泌型受体,其他短型受体可能在血脑屏障的转运中发挥作用[12]。人类的长型LEPR-b在胞内具有完备的功能结构域,包括Box1、Box2和3个保守的酪氨酸残基,这些特征已经在多种脊椎动物中被鉴定[13-15]。研究发现[16],LEPR能够激活Janus 激酶-信号转导与转录激活子(Janus kinase-signal transducer and activator of transcription,JAK-STAT)和丝裂原活化蛋白质激酶(Mitogen-activated protein kinase,MAPK)2个信号通路,发挥多种生物学功能。研究也证明,LEPR在多种免疫细胞上广泛表达,如巨噬细胞、淋巴细胞和单核细胞等,表明LEPR与免疫应答具有相关性[17-18]。目前已知非洲爪蟾的LEPR与人类LEPR的胞内结构相对应,推测生物学功能相似[19];峨眉树蛙LEPR基因与繁殖功能的相关性也进行了确认研究[20];也有研究证实,温度对蟾蜍体内LEP信号通路和LEPR基因表达也存在影响[21],而LEPR基因与两栖类免疫应答的相关性研究鲜有报道。
东北林蛙具有抵抗寒冷环境和适应能力强的特性,其输卵管干制品可入药,具有药用价值[22-23]。近年来因东北林蛙经济价值大,被大肆捕捞,加上森林的砍伐、污水的排放、农药的施用和病原体的侵染,使野生东北林蛙数量锐减。嗜水气单胞菌(Aeromonashydrophila,Ah)是东北林蛙患红腿病的元凶,该病传染能力强、致死率高,是野生和人工养殖蛙群数量减少的原因之一[24-25]。本研究通过RT-PCR技术克隆东北林蛙LEPR基因,以Ah作为感染菌种,构建东北林蛙人工感染模型,利用qRT-PCR技术检测LEPR基因在不同组织的转录水平的变化;再利用免疫组化染色验证LEPR蛋白表达量变化,本试验旨在为进一步探究LEPR基因在炎症反应中的免疫功能提供理论基础。
1 材料和方法
1.1 试验材料
1.1.1 试验样品采集 东北林蛙成体(25±5)g,嗜水气单胞菌株DW1701-1909(Ah)由哈尔滨师范大学生物化学与分子生物学实验室分离鉴定[26]。对照组和试验组严格遵照相关试验动物福利规定(批准号HNUARTA202102),安乐死后分别在8,16,24,36,48,72 h采集东北林蛙心脏、肝脏、脾脏、肾脏、皮肤、肌肉和胃等部分组织样品。用任氏液清洗干净后用灭菌剪刀剪小块,先放入液氮速冻后再放入EP管内,放置-80 ℃冰箱储存备用;另取肝脏、肾脏、皮肤和肌肉作为固定样品,用于制作石蜡切片。
1.1.2 试验试剂 TRIzol 试剂盒、dNTP Mix、10×Taq Buffer、TaqDNA Polymerase、DNA Marker(DL2000)、HiScript Ⅱ 1st Strand cDNA Synthesis Kit、HiScript Ⅱ Q RT Super Mix for qPCR(+gDNA wiper)、ChamQ SYBR qPCR Master Mix,均购于南京诺唯赞(Vazyme)生物科技有限公司;胶回收试剂盒购于上海生工生物工程股份有限公司;pMDTM18-T Vector购自宝生物工程(大连)有限公司;感受态细胞 DH5α购于上海唯地生物技术有限公司; LEPR兔源多克隆抗体、HRP标记山羊抗兔抗体 IgG(H+L)、10%封闭山羊血清、中性树胶封片剂均购于博奥森(北京)生物技术有限公司;DAB显色试剂盒(20×)购于北京中杉金桥生物技术有限公司;福尔马林溶液、苏木精染色液等均为常规国产化学试剂。
1.2 试验方法
1.2.1 活化菌种及感染东北林蛙 依据参考文献[26]活化菌种并确定感染浓度为1.5×107cfu/mL。东北林蛙随机分为对照组和试验组,每组21只,对照组每只注射1 mL的液体LB培养基,试验组每只腹腔注射1 mL 嗜水气单胞菌液,取样后放置-80 ℃冰箱储存,为后续试验准备。
1.2.2 引物设计 根据NCBI公布的欧洲林蛙预测LEPRmRNA序列(登录号:XM_040360759.1),利用Primer Premier 5.0软件进行引物设计,共设计4对引物(LEPR-A、LEPR-B、LEPR-C、LEPR-D),测序后进行拼接得到完整ORF区。再依据该序列设计荧光定量引物(LEPR-q),内参引物选用β-actin[27],以上引物均由上海生工生物工程股份有限公司合成,引物详细信息见表1。

表1 本研究所用引物Tab.1 Primers used in this study
1.2.3 东北林蛙的组织RNA提取及cDNA的合成 将8种组织各0.1 g加入液氮充分研磨后置于EP管内,利用TRIzol 法提取组织中总RNA,1%的琼脂糖凝胶电泳验证RNA完整度,有清晰的3条带。依据逆转录试剂盒说明书,通过逆转录反应合成cDNA,置于-20 ℃冰箱冻存,为后续试验准备。
1.2.4 东北林蛙LEPR基因的克隆与测序 取东北林蛙脾脏cDNA作为模板进行RT-PCR 反应,反应体系配置依照Taq plus DNA 聚合酶说明书,1%的琼脂糖凝胶电泳检测PCR产物是否与预期相符,利用胶回收试剂盒进行DNA的回收与纯化,将得到DNA片段与pMD18-T在16 ℃ 低温恒温槽中连接6 h,随后将连接产物转化到大肠杆菌感受态DH5α中,37 ℃恒温培养箱过夜培养,挑取单一菌落接入LB 液体培养基(有AMP+)中培养12 h,进行菌液PCR反应,经1%琼脂糖凝胶电泳检测后,将得到阳性菌株送至哈尔滨睿博科兴公司进行测序。
1.2.5 东北林蛙LEPR生物信息学分析 利用DNAMAN、MEGA7 和 SMART(http://smart.embl.de)、TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)、I-TASSER(http://zhanggroup.org /I-TASSER/)、 SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/secpredsopma.pl)等软件进行东北林蛙LEPR核苷酸和氨基酸序列分析;采用PROSITE(https://www.expasy.org/resources/prosite)、 ProtParam(https://web.expasy.org/protparam/)以及ProtScale(https://web.expasy.org/protscale/)、NetPhos3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)NetNGlyc-1.0(http://www.cbs.dtu.dk/services/NetNGlyc/)等程序预测蛋白质的结构域及理化性质,用Clustal Omega软件对LEPR氨基酸序列进行同源性比对。
1.2.6 苏木精-伊红染色分析(Hematoxylin-eosin staining,HE染色) 取东北林蛙对照组和试验组肝脏和皮肤组织,经10%福尔马林溶液固定后用石蜡包埋,制作病理组织切片。HE染色方法参考文献[26],常规脱蜡复水后苏木精染色,1%的盐酸乙醇溶液进行分化,1%的氨水返蓝,蒸馏水冲洗,后进行0.5%伊红染液染色。染色完成后进行不同浓度酒精脱水和二甲苯透明,最后用中性树胶封片。
1.2.7 东北林蛙LEPR组织表达分析 依据获得的序列结果,设计LEPR的特异性引物,采用qRT-PCR技术检测LEPR基因在对照组与试验组感染后的不同时间点心脏、肝脏、脾脏、肺脏、肾脏、皮肤、肌肉和胃等组织中的表达量。qRT-PCR的反应体系为20 μL,具体为2×ChamQ SYBR qPCR Master Mix 10 μL,Primer 1(10 μmol/L)0.4 μL,Primer 2(10 μmol/L)0.4 μL,ddH2O 8.2 μL,cDNA 模板1 μL。反应程序设置:94 ℃ 10 min;94 ℃ 30 s,60 ℃ 30 s,72℃ 30 s,40个循环;72 ℃ 10 min。以β-actin作为内参基因,每组试验处理3次重复。
1.2.8 东北林蛙LEPR蛋白的免疫组织化学检测 取对照组和试验组感染后8,16,24,36,48,72 h肾脏、皮肤和肌肉组织,用10%福尔马林溶液进行固定,在乙醇中脱水,用于常规石蜡包埋。连续切片厚度5 μm;二甲苯脱蜡后 3% H2O2阻断过氧化物酶;10%山羊血清37 ℃封闭 30 min,滴加1∶250倍稀释兔抗LEPR多克隆抗体,4 ℃过夜孵育;复温45 min,加1∶2 000辣根过氧化物酶标记的羊抗兔IgG二抗后37 ℃孵育30 min;DAB避光染色8 min,苏木精复染15 min后脱水透明并中性树胶封片。拍照保存图像,利用 Image J 软件将彩色图像转变为单色通道灰度图像,将阳性染色和背景色进行分离,调节参数至所有阳性染色区域均被选中,将测量得到的阳性染色区域的光密度值与阳性面积之比,计算平均光密度值,对免疫组化阳性染色进行定量分析。
1.2.9 数据统计及分析 利用 2-ΔΔCt法对LEPR基因在东北林蛙对照组和试验组的表达量进行分析,利用SPSS 20软件单因素方差分析法进行差异显著性分析,用 GraphPad Prism 8 软件进行作图,Image J软件用来统计免疫组化光密度值。
2 结果与分析
2.1 东北林蛙LEPR基因克隆
采用分段克隆的方式,测序后获得LEPR-A、LEPR-B、LEPR-C、LEPR-D4段序列,将这4段基因序列进行拼接,获得LEPR基因序列长度共3 604 bp,完整ORF区长度为3 405 bp,共编码1 134个氨基酸(图1),将编码区序列提交至GenBank 获得登录号为:ON652850.1。

M.DL2000 DNA Marker。
2.2 东北林蛙LEPR基因生物信息学分析
2.2.1 氨基酸同源性分析 使用DNAMAN进行序列比对,东北林蛙LEPR的氨基酸序列与欧洲林蛙(XP_040216693.1)序列相似性达到95.35%,其次是高山倭蛙氨基酸相似性为75.19%,与大蟾蜍、非洲爪蟾、热带爪蟾相似性分别为51.97%,44.27%和45.40%,与人和大鼠的相似性分别为35.27%和34.62%,表明LEPR蛋白在不同物种保守程度相对较低。
2.2.2 东北林蛙 LEPR 蛋白理化性质 LEPR蛋白由1 134个氨基酸组成,其蛋白质分子式为C5742H8861N1519O1733S58,分子量为128 ku,理论等电点为5.95,带正电荷的氨基酸残基(Arg+Lys)数为110个,带负电荷的氨基酸残基(Asp+Glu)数为123,推测LEPR蛋白可能带负电荷。SignalIP 4.1预测信号肽显示,东北林蛙LEPR属于非分泌蛋白,不具有信号肽,利用TMHMM Server v.2.0 软件对蛋白进行跨膜结构预测,发现LEPR是具有一次跨膜结构域的细胞膜蛋白质(图2-A)。NetPhos 3.1 Server在线软件预测,东北林蛙LEPR共有140个潜在磷酸化位点,其中丝氨酸79个,苏氨酸38个,酪氨酸23个(图2-B)。NetNGlyc 1.0 Server进行 N-糖基化位点预测显示,LEPR存在多个糖基化位点,由于LEPR是一种跨膜蛋白,跨膜蛋白只有细胞外结构域可以发生N-糖基化,因而推测东北林蛙 LEPR蛋白在胞外共有12个糖基化位点。不稳定指数计算为47.09,亲水性总平均值为-0.330,同时利用Hphob./Kyte&Doolittle算法预测蛋白质的亲疏水性,得出LEPR蛋白是亲水不稳定蛋白(图2-C)。使用 NCBI 数据库 Conserved Domain Search Service结果显示,东北林蛙LEPR蛋白在123—215和417—519存在2个ObR_Ig 超家族结构域;在315—399存在Lep_receptor_Ig超家族结构域(图2-D)。

A.LEPR蛋白的跨膜结构域;B.LEPR蛋白磷酸化位点预测;C.LEPR蛋白亲水性/疏水性分析;D.LEPR蛋白功能结构域预测。A.The transmembrane domain of LEPR protein;B.Prediction of LEPR protein phosphorylation sites;C.Hydrophilic/hydrophobic analysis of LEPR protein;D.Prediction of LEPR protein functional domain.
2.2.3 东北林蛙LEPR蛋白的结构预测及互作网络 使用SOPMA 软件预测东北林蛙LEPR二级结构,发现由α 螺旋(占15.26%,173个氨基酸)、延伸链(占25.57%,290个氨基酸)、β 转角(占2.12%,24个氨基酸)和无规卷曲(占57.05%,647个氨基酸)等几种结构组成(图3)。利用I-TASSER在线预测软件获得东北林蛙LEPR蛋白质三级结构(图3),三级结构与二级结构分析相符合。利用 STRING 软件分析东北林蛙LEPR与其他蛋白质互作网络图,分析显示LEPR蛋白可能与LEP(瘦素)、JAK2(JANUS激酶2)、STAT3(信号传导转录激活因子3)、SOCS3(细胞因子信号转导抑制因子3)、PTPN1(非受体型蛋白酪氨酸磷酸酶1)等蛋白发生相互作用。

A.LEPR蛋白质二级结构;B.LEPR蛋白质三级结构;C.LEPR蛋白质蛋白互作网络。A.LEPR protein secondary structure;B.LEPR protein tertiary structure;C.LEPR protein interaction network.
2.2.4LEPR基因同源性分析及氨基酸进化树的构建 经MegAlign分析软件比对分析,东北林蛙LEPR与欧洲林蛙的核苷酸同源性最高为96.5%,与高山倭蛙、大蟾蜍、非洲爪蟾、热带爪蟾和加蓬蚓螈分别为84.4%,66.4%,57.1%,57.2%和52.6%(图4)。使用Mega 7.0软件中NJ 法构建的氨基酸序列系统进化树,发现东北林蛙与两栖动物中的蛙、蟾蜍属于同一分支,与两栖类中的加蓬蚓螈在不同分支,与哺乳类、禽类等遗传距离较远,与鱼类遗传距离更远,这也进一步验证LEPR基因的保守程度不高这一结论。

A.LEPR基因同源性;B.LEPR系统进化树。A.LEPR gene homology;B.LEPR phylogenetic tree.
2.2.5 嗜水气单胞菌感染东北林蛙病理组织学鉴定 取东北林蛙试验组与对照组肝脏和皮肤组织,制备组织切片,进行HE染色。肝脏组织病理学观察所见(图5-A1—A3),与对照组相比,随着感染时间增加,肝脏细胞间隙逐渐变大,黑色素沉积增加,肝细胞边界模糊并且淋巴细胞浸润,最后呈明显炎症感染状态;在皮肤组织可见(图5-B1—B3),与对照组相比,感染36 h皮肤组织的表皮层与真皮层发生分离,炎症后期表皮层发生崩解,真皮层胶原纤维发生溶解,大量色素细胞增加,以上结果都表明,嗜水气单胞菌感染东北林蛙的炎症模型成功建立。

HE染色观察嗜水气单胞菌感染的东北林蛙的不同组织。A.肝脏;B.皮肤;1,2,3.0,36,72 h。Observation by HE staining in different tissues of Rana dybowskii infected by Ah.A.Liver;B.Skin;1,2,3.0,36,72 h.
2.2.6 东北林蛙LEPR基因的组织表达 应用qRT-qPCR技术检测LEPR基因在东北林蛙的组织分布,以β-actin为内参基因,选择心脏表达量作为对照。结果表明(图6),LEPR基因广泛表达在东北林蛙的心脏、肝脏、脾脏、肺脏、肾脏、皮肤、肌肉和胃,其中LEPR基因在皮肤的表达量最高(P<0.05),在肝脏和胃组织中表达量也具有较高水平,二者之间差异不显著,脾脏与肾脏表达量差异不显著,肺脏和肌肉表达量差异不显著,心脏的表达量最低。
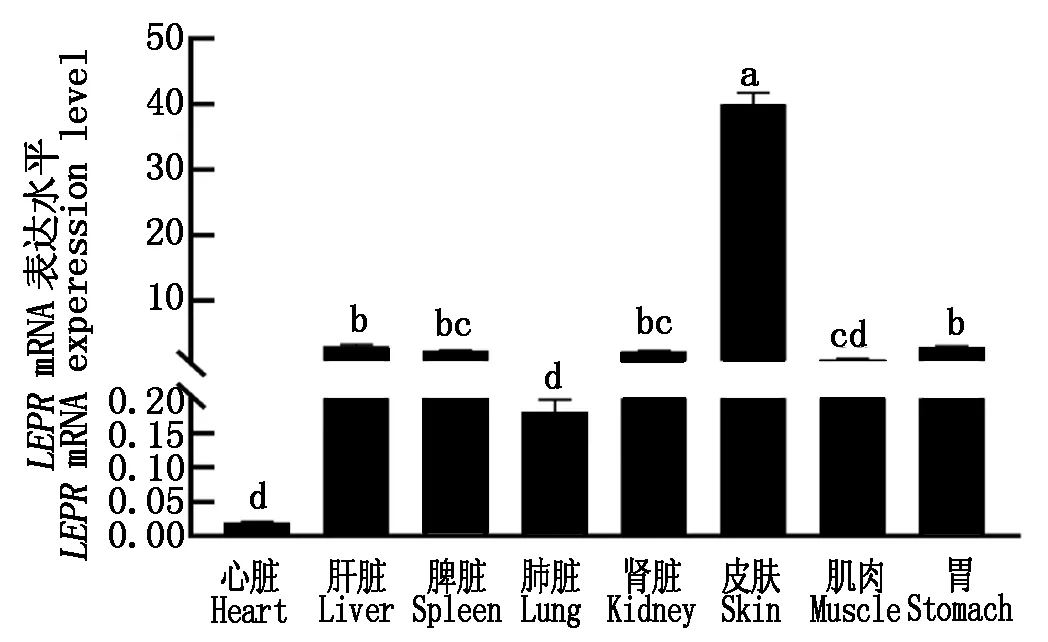
不同小写字母表示在不同组织中的相对表达量差异性显著(P<0.05)。 Different lowercase letters indicate significant differences in relative expression among tissues(P<0.05).
2.2.7 嗜水气单胞菌感染后东北林蛙LEPR基因的时序表达 利用qRT-PCR检测东北林蛙在嗜水气单胞菌感染后不同器官和组织中LEPR基因表达达量变化趋势。结果表明,嗜水气单胞菌感染后东北林蛙的各器官和组织中LEPRmRNA表达量出现明显变化。心脏中LEPRmRNA表达量在感染初期8~16 h发生下调,在24 h表达量达到峰值,与对照组相同,随后表达量呈波动变化(图7-A);肝脏LEPRmRNA表达量在感染初期8 h达到峰值为对照组2.96倍,16~72 h表达量变化趋势为先下调后上调(图7-B);脾脏中LEPRmRNA表达量在8~36 h变化趋势为先与对照组持平后下调,表达量在48 h重新上调,在72 h达到表达量峰值,为对照组的2.61倍(图7-C);肺脏LEPRmRNA表达量在感染16 h达到峰值,为对照组8.51倍,随后表达水平出现下调,72 h表达量又重新上调至本底水平的6.8倍(图7-D);肾脏在感染初期8 h时LEPRmRNA表达量开始急剧上调,16 h达到峰值为对照组的2.57倍,24~72 h表达量变化趋势为先下调后上调(图7-E);皮肤中LEPRmRNA表达量在8~48 h均低于对照组,感染72 h表达量上调达到峰值,为对照组的2.07倍(图7-F);肌肉组织中LEPRmRNA表达量在感染16 h达到峰值,为对照组的4.44倍,感染36 h与48 h表达量之间差异不显著,在72 h表达量下调至最低(图7-G);胃组织中LEPRmRNA表达量在感染16 h表达量达到峰值为对照组的3.12倍,随后表达量下调低于对照组,72 h表达量再次上调为对照组2倍左右(图7-H)。

A.心脏;B.肝脏;C.脾脏;D.肺脏;E.肾脏;F.皮肤;G.肌肉;H.胃。不同小写字母表示 5%水平差异显著(P<0.05)。A.Heart;B.Liver;C.Spleen;D.Lung;E.Kidney;F.Skin;G.Muscle;H.Stomach.Different lowercase letters indicate significantly different at 5% level(P<0.05).
综上所述,在嗜水气单胞菌感染下,东北林蛙的肺脏、肾脏、肌肉和胃LEPRmRNA表达量在感染前期16 h达到峰值,而脾脏和皮肤在72 h达到峰值,心脏和肝脏分别在24,8 h达到峰值,表明LEPR基因对细菌感染引发的应答存在时间和水平差异。
2.2.8 嗜水气单胞菌感染后LEPR蛋白在不同组织的表达 对东北林蛙嗜水气单胞菌感染后不同时间点的肾脏、皮肤和肌肉组织进行免疫组织化学染色(图8—10),在对照组与试验组均有LEPR蛋白的阳性染色,观察到不同时间点蛋白表达水平有差异,再利用软件Image J计算各组织染色图像进行平均光密度值分析(图11)。结果显示,肾脏中LEPR蛋白在感染初期16 h达到表达量峰值,为对照组1.46倍,24~72 h LEPR表达量呈现波动变化;皮肤组织中,感染8~48 h LEPR蛋白表达量均低于对照组,表达量在72 h上调达到峰值,为对照组的1.53倍;肌肉组织中,LEPR表达量在16 h达到峰值,为对照组1.65倍(P<0.01),24 h表达量开始下调,36~48 h表达量重新上调与对照组持平,随后表达量又重新下调。以上结果与qRT-PCR检测LEPRmRNA水平变化趋势基本一致,进一步验证LEPR蛋白表达量在嗜水气单胞菌感染后发生显著上调,推测LEPR在两栖动物中能够参与细菌感染引起的免疫应答。

A—G分别表示对照组、感染后8,16,24,36,48,72 h肾脏组织。A—G respectively represent the kidney tissue in the control group,8,16,24,36,48,72 h after infection.

A—G分别表示对照组、感染后8,16,24,36,48,72 h皮肤组织。A—G respectively represent the skin tissue in the control group,8,16,24,36,48,72 h after infection.

A—G分别表示对照组、感染后8,16,24,36,48,72 h肌肉组织。A—G respectively represent the muscle tissue in the control group,8,16,24,36,48,72 h after infection.

不同大写字母表示1%水平差异显著(P<0.01)。Different capital letters are significantly at 1% level(P<0.01).
3 结论与讨论
LEPR作为一种跨膜受体,属于Ⅰ类细胞因子受体家族成员,其基因具有多态性,由于蛋白酶水解或mRNA可变剪切可导致产生多种亚型。在哺乳动物中,LEPR具有6种亚型,其中只有长型受体具有完整功能结构域;在斑马鱼[28]、点带石斑鱼[29]等多数鱼类中只有长型受体这种亚型,但在大西洋鲑鱼[30]、罗非鱼[31]、虹鳟鱼[32]中存在多种受体。本研究中东北林蛙LEPR的克隆是以欧洲林蛙LEPR转录突变X1基因序列设计引物,经比对后发现得到的东北林蛙LEPR为长型受体,东北林蛙中是否还存在其他亚型还需进一步研究。根据东北林蛙与其他物种LEPR氨基酸序列比对,东北林蛙与欧洲林蛙的同源性较高,与其他两栖类LEPR同源性有所降低,与禽类、哺乳动物氨基酸序列相似性更低,这表明东北林蛙LEPR与其他物种LEPR保守性较低,同时系统进化树也表明,哺乳动物、禽类、蚓螈类LEPR聚为一支,鲤形目中斑马鱼与其他物种类别亲缘较远,聚为另一大分支,东北林蛙与两栖纲无尾目的LEPR聚为一支,表明亲缘关系最近。
在哺乳动物中,LEP作为一种重要的脂肪组织分泌的蛋白,与LEPR结合后,可发挥脂质代谢、能量平衡、神经内分泌、繁殖、造血和免疫等多种生理作用[4-8],所以LEPR在哺乳动物体内分布广泛,以脂肪组织表达为主,在下丘脑、垂体、肝脏、肺脏、肾脏等组织也均有表达[33];与哺乳动物类似,在鸟类中,垂体、脾脏和脂肪组织中也检测到LEPR基因的高表达[13];同样在鱼类中,黄颡鱼、黄鳝LEPR基因表达水平在在下丘脑和垂体中最高,更说明了通过瘦素与LEPR的结合激发神经系统通路,增强脂质代谢[34-35],然而大西洋鲑鱼[30]、石斑鱼[36]、欧洲鲈鱼[37]在卵巢中表达丰富,也验证其与繁殖功能具有相关性;在两栖类中,非洲爪蟾中LEPR基因在脑垂体和脑的表达量最高,在皮肤、肌肉和睾丸组织也有高水平表达,在心脏、肺脏、卵巢和血液中较低但可检测到表达水平;本研究显示,在东北林蛙心脏和肺脏表达水平较低,在皮肤组织中观察到了高表达水平,这可能是由于两栖动物皮肤直接接触外部生活环境,在受到病原体感染后,皮肤首先做出对抗原提呈的反应。这些相关研究也证明LEPR基因在不同物种间的表达存在种属差异性。
本研究中嗜水气单胞菌感染东北林蛙后,LEPR基因的表达水平发生明显变化,在肝脏、肺脏、肾脏、肌肉和胃组织中均在8~16 h表达量达到最高,表明LEPR基因在感染前期表达量急剧升高,随后表达量开始不同程度下调,脾脏和皮肤组织均在72 h表达量达到高水平,心脏在8~72 h表达量变化程度不大,这表明该基因在东北林蛙不同组织可能发挥不同功能。研究[38]发现,草鱼在感染嗜水气单胞菌后肠道通过NF-κB信号通路参与炎症反应,吴彤等[26]也发现东北林蛙中LepROT通过启动NF-κB 信号通路发挥抗感染作用,据此推测出LEPR也可能通过这一信号通路进行免疫应答。在以往研究中[39],LEPR基因出现突变(Q223R)或多态性(rs1137101),导致LEPR-STAT3信号通路受损,可能导致在感染传播中易感性增加,比如LEPR基因突变会导致阿米巴结肠炎[40]、肝脓肿和细菌性腹膜炎[41]的易感性。Madan等[42]也证实在人类和小鼠中,LEPR-STAT3信号通路在艰难梭菌感染的炎症反应中具有调节作用,这与本研究中蛋白互作网络预测结果相同,但具体作用机制还需要进一步研究。在动物机体中如果免疫、代谢和神经内分泌等方面失调,可能导致LEP-LEPR信号通路发生障碍,这也是导致免疫缺陷的原因之一。研究发现[43],肺部巨噬细胞能够特异性表达LEPR,在LEPR信号作用下巨噬细胞减轻肺部炎症,能够抑制急性肺损伤,这也进一步证明LEPR在感染中具有的免疫调节功能。研究发现[44],在小鼠急性感染犬新孢子虫后,在脂肪组织中长型和短型LEPR表达水平下降,在肝脏中2种受体表达量升高,这与嗜水气单胞菌感染后东北林蛙肝脏中LEPR基因表达量上调变化相同。在小鼠慢性脑灌注不足(CCH)炎症模型研究[45]中验证了LEPR缺乏会抑制促炎反应和其他抗炎因子的表达。嗜水气单胞菌感染东北林蛙炎症模型中,8种组织中LEPR基因均出现显著变化趋势,且达到表达量峰值的时间不同,表明不同组织中LEPR功能不同,结合免疫组织化学染色观察和Image J软件分析LEPR蛋白质表达水平的变化,推测 LEPR在Ah感染过程中发挥免疫功能。
本研究成功克隆了东北林蛙LEPR基因的完整开放阅读框,共编码1 134个氨基酸。通过氨基酸序列比对发现LEPR与其他物种之间保守度不高,是一种亲水不稳定跨膜蛋白。LEPR基因广泛存在东北林蛙的多种组织,并且在Ah感染后不同组织LEPR基因开始应答的时间不同,但均在感染过程中发生表达量上调现象。综上可以推测,东北林蛙LEPR基因在炎症反应中具有参与抗感染的功能。
