荷斯坦奶牛FABP4基因结构与功能分析
2023-07-08王川川李德生李蕾蕾顾亚玲
王川川,母 童,李德生,张 迪,李蕾蕾,张 娟,顾亚玲
(宁夏大学 农学院,宁夏 银川 750021)
脂肪酸结合蛋白(Fatty acid binding proteins,FABPs)是胞内脂质结合蛋白超家族成员。 FABPs蛋白可结合长链脂肪酸和其他具有生物活性的配体以促进其在细胞内的定位[1],也可以影响细胞内的脂质通量、代谢和信号传导[2]。在奶牛乳腺组织中,FABP3、FABP4和FABP5均高表达,并且在哺乳期间显著上调[3]。FABPs作为进化上保守的蛋白质,其独特的家族成员,如FABP1、FABP3、FABP4等具有调节脂肪酸代谢相关基因转录的能力[4]。其中FABP4常被作为脂肪细胞分化成熟的标志基因,通过与激素敏感性脂肪酶(Hormone-sensitivetriglayceridelipase,HSL)和过氧化物酶体增殖物激活受体(Peroxisome proliferator-activated receptor γ,PPARγ)的相互作用在维持脂肪细胞稳态、调节脂肪分解和生成方面发挥作用[5]。最早对牛脂肪酸结合蛋白4(Fatty acid binding protein 4,FABP4)的研究表明[6],牛背最长肌中FABPs的活性随着安格斯牛和日本和牛的大理石花纹分数的增加而增加。目前,已经鉴定出FABP4是影响山东黑牛和鲁西黄牛脂肪沉积的重要候选标记基因,这为改善肉质和产生新品种牛提供了新的思路[7]。FABP4在牛中被定位在14号染色体(46 833 665~46 838 053),该位置富含产奶性状的数量性状基因座(Quantitative trait loci,QTL),这表明它可能是产奶的候选基因或标记。Marchitelli等[8]发现,FABP4还是影响乳脂成分的重要基因,主要影响牛奶中的中链和长链脂肪酸水平。因此,了解FABP4基因的表达调控规律有助于改善家畜的肉质及牛奶中乳脂的成分。
目前,有关FABP4基因在荷斯坦奶牛乳脂中的相关研究较少。基于前期对荷斯坦奶牛高、低乳脂率组的转录组测序数据分析,确定FABP4作为影响奶牛乳脂代谢的关键功能候选基因[9],但目前FABP4在奶牛乳脂合成中的作用机制还不确定,故对其进行乳脂合成方面的深入研究是非常有必要的。本研究旨在通过克隆荷斯坦奶牛FABP4基因的CDS区,通过生物信息学分析FABP4基因的分子结构、功能、蛋白特性及启动子等,并运用qRT-PCR检测FABP4基因在泌乳中期荷斯坦奶牛各组织中的表达,为进一步研究FABP4基因在荷斯坦奶牛乳脂调控中的作用提供理论基础。
1 材料和方法
1.1 试验材料
本试验所用荷斯坦奶牛均来自宁夏农垦贺兰山奶业茂盛牧场,奶牛的小肠、肝脏、乳腺、心脏、子宫、肾脏及卵巢组织样品均为宁夏回族自治区反刍动物分子细胞育种重点实验室前期采集(3头泌乳中期、无乳房疾病的荷斯坦奶牛),剪碎组织后装入1.5 mL冻存管,迅速放入液氮中带回实验室-80 ℃保存备用。本试验所用的原代BMECs来自本实验室前期通过胶原酶Ⅰ消化法分离获得,且采集乳腺组织的奶牛也处于泌乳中期。
1.2 主要试剂
TRIzol试剂盒(TaKaRa,大连);DNA胶回收试剂盒(生工,上海);反转录试剂盒购自诺唯赞生物科技股份有限公司;DL2000 DNA Marker购自北京百泰克生物技术有限公司;2×Taq DNA Master Mix购自诺唯赞公司;pMD18-T Vector Cloning Kit(宝生生物,大连);2×SYBR Green PCR Master Mix(艾科瑞,长沙);DH5α感受态细胞购自北京博迈德基因技术有限公司;氨苄青霉素、胰蛋白胨、酵母提取物、琼脂粉和琼脂糖均购自上海生工生物有限公司;胎牛血清(FBS)购自Cell Max公司;DMEM/F12培养基购自Hyclone公司;双抗(青霉素、链霉素)、PBS均购自金克隆公司、0.25%胰蛋白酶购自北京索莱宝科技有限公司;Cytoplasmic &Nuclear RNA Purification Kit 购自英国NORGREN公司。
1.3 引物设计
根据NCBI中牛FABP4及U6、β-actin和GAPDH的基因序列,利用Primer 5.0设计PCR和qRT-PCR特异性引物(表1),委托陕西中科羽瞳生物公司合成。

表1 基因引物序列Tab.1 Primer sequences of gene
1.4 RNA的提取与cDNA的合成
按照TRIzol法提取奶牛不同组织总RNA。利用试剂盒提取BMECs的细胞核RNA和细胞质RNA。使用紫外可见光分光光度计(Eppendorf BioSpectrometer basic)进行浓度和纯度检测,利用1%琼脂糖凝胶电泳进行总RNA完整性检测。挑取完整性及纯度较好的不同组织的RNA利用诺唯赞生物公司反转录试剂盒将其反转录为cDNAs,反转完成后置于-20 ℃冰箱保存备用。
1.5 FABP4基因CDS区扩增与测序
通过PCR扩增出FABP4基因CDS区全长。FABP4基因扩增体系为25 μL(统一为250 ng/μL):cDNA样品1 μL,上、下游引物各1 μL(10 μmol/L),TaqPCR Master Mix 12.5 μL,ddH2O 9.5 μL。PCR扩增程序为:95 ℃预变性3 min;95 ℃变性30 s,退火30 s,72 ℃延伸2 min,共30个循环;72 ℃终延伸6 min,4 ℃保存。对产物进行1%琼脂糖凝胶电泳检测后,用胶回收试剂盒进行回收目的片段,随后将目的片段与pMD18-T Vector Cloning Kit克隆载体在4 ℃条件下过夜连接。将产物转化到DH5α感受态细胞中,置于冰上30 min,42 ℃水浴90 s,再次置于冰上3 min,加入无抗液体LB培养基,37 ℃振荡培养45 min,涂布于含氨苄抗性的LB平板培养基上,37 ℃倒置培养过夜,挑取单菌落放入含氨苄抗性的LB液体培养基,37 ℃摇床振荡培养8 h,进行菌液PCR扩增。同时,收集菌液送至上海生工进行测序。
1.6 生物信息学分析
利用生物信息学软件对牛FABP4基因进行分析,主要包括蛋白跨膜结构域、信号肽、亚细胞定位、蛋白质二、三级结构定位等,具体软件使用的网址及预测的功能见表2。

表2 生物信息学分析软件及功能Tab.2 Bioinformatics analysis software and functions
1.7 统计与分析
以GAPDH为内参基因,通过2-ΔΔCt法计算FABP4基因在奶牛各组织中的相对表达量。核质定位采用细胞核RNA中基因占比(%)=2^-胞核CT值/(2^-胞浆CT值+2^-胞核CT值),细胞质RNA中基因占比(%)=1-细胞核RNA中基因占比(%),原始数据结果通过Microsoft office 2019整理后利用SAS 9.2(SAS Institute,Cary,NC,美国)的线性混合模型(Linear mixedmodel)进行单因素方差分析,P<0.05认为具有统计学意义。
2 结果与分析
2.1 牛FABP4基因CDS序列扩增结果
以荷斯坦奶牛乳腺组织cDNA为模板,扩增FABP4基因CDS序列,通过1%琼脂糖凝胶电泳检测PCR产物,结果如图1所示,扩增出468 bp的清晰条带,与预期条带相符,可进行下一步研究。

图1 荷斯坦奶牛FABP4基因CDS序列PCR扩增电泳结果Fig.1 Results of PCR amplification electrophoresis of CDS sequence of FABP4 gene in Holstein cows
2.2 牛FABP4基因片段克隆及测序结果分析
经菌液PCR鉴定成功获得468 bp的目的片段(图2-A)。将菌液测序结果与NCBI发布的牛FABP4基因序列进行比对,得到单峰全长为399 bp的CDS区序列(图2-B),比对结果显示(图2-C)荷斯坦奶牛基因CDS序列第149位核苷酸存在错义突变(T→G),使丝氨酸突变为丙氨酸。

A.PCR扩增产物鉴定;B.测序峰图;C.测序序列比对。A.PCR amplification product identification;B.Sequencing peak map; C.Sequencing sequence comparison.
2.3 荷斯坦奶牛FABP4蛋白生物信息学分析
2.3.1 荷斯坦奶牛FABP4蛋白的功能分析 通过ProtParam在线网站分析FABP4蛋白的氨基酸组成成分,结果显示,荷斯坦牛FABP4基因共编码133个氨基酸残基,蛋白分子式为C646H1043N171O201S8,分子质量为14.677 89 ku,其中含量最高的氨基酸为缬氨酸(占11.4 %),含量最低的氨基酸为半胱氨酸(1.5%)、脯氨酸(1.5%)、色氨酸(1.5%)、酪氨酸(1.5 %)。FABP4蛋白理论等电点(PI)为5.52,蛋白不稳定指数为15.92,是稳定蛋白。用ProtScale程序对牛FABP4蛋白进行疏水性分析,结果如图3-A所示,FABP4蛋白第46位天冬酰胺疏水性最强为1.789,第76位脯氨酸亲水性最弱为-2.244,亲水性的总体平均值为-0.183,预测该蛋白为亲水性蛋白。利用TMHMM 2.0在线软件预测荷斯坦牛FABP4蛋白的跨膜结构,结果表明,利用SignalP 6.0程序预测FABP4蛋白的信号肽(图3-B),发现该蛋白可能不存在信号肽序列,有较大可能为非分泌型蛋白。该蛋白不含跨膜区,且蛋白全部在膜外(图3-C)。运用NetPhos 3.1Server程序对FABP4蛋白磷酸化位点进行预测,结果发现(图3-D),荷斯坦牛FABP4氨基酸序列共有21个磷酸化位点,包括8个丝氨酸、11个苏氨酸及2个酪氨酸,其中苏氨酸在氨基酸序列中均广泛分布。
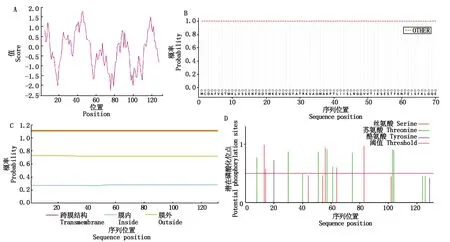
图3 牛FABP4亲疏水性(A)、蛋白信号肽(B)、跨膜结构域(C)、磷酸化位点(D)预测结果Fig.3 Predicted results of bovine FABP4 hydrophobicity(A),protein signal peptide(B),transmembrane structural domain(C),and phosphorylation site(D)
2.3.2 荷斯坦奶牛FABP4蛋白空间结构预测 蛋白质二级结构主要指多肽链主链骨架中局部的构象,对其进行预测分析有助于认识蛋白的空间结构。本研究使用SOPMA软件预测牛FABP4的二级结构,结果表明(图4-A),由4种结构组成,其中包括无规卷曲(占25.00%)、α-螺旋(占28.03%)、β-折叠(占36.36%)、β-转角(占10.61%)。通过SWISS对FABP4的三级结构进行预测分析,结果显示,其组成部分与二级结构预测相符(图4-B)。

蓝色线条.α-螺旋;红色线条.β-折叠;紫色线条.无规则卷曲;绿色线条.β-转角。 Blue line. α-helix; Red line. β-sheet; Purple line. Random curl; Green line. β-turn.
2.3.3 FABP4的亚细胞定位 细胞可以分成多个细胞器或者细胞区域,如细胞膜、细胞质、细胞核、线粒体和高尔基体等,这些细胞器被称为“亚细胞”。把确定某种蛋白质或表达产物在亚细胞位置的过程称为蛋白质亚细胞定位。对于蛋白质功能研究而言,亚细胞定位是非常重要的分析内容,蛋白质在细胞中是流动的,所以一个蛋白可以具有一个到多个亚细胞定位信息。本研究通过Euk-mPLOC 2.0、YLoc和MultiLoc2等在线软件预测了FABP4蛋白的亚细胞定位。如表3所示,预测结构表明,FABP4基因主要在细胞质中发挥重要功能。

表3 FABP4的亚细胞定位预测Tab.3 Predicted subcellular localization of FABP4 %
为了进一步验证预测结果的真实性,分别提取了奶牛乳腺上皮细胞的细胞核RNA和细胞质RNA,通过qRT-PCR检测(图5),发现U6在细胞核中的含量接近60%,内参基因GAPDH和β-actin、FABP4在细胞质中的含量均为80%以上,上述结果表明,细胞核RNA和细胞质RNA分离成功。此外,结果显示,FABP4在细胞质中的含量达80%以上,说明FABP4基因主要分布在细胞质,推测FABP4在细胞质中可能发挥重要功能。

图5 FABP4在BMECs中的亚细胞定位Fig.5 Subcellular localization of FABP4 in BMECs
2.3.4 荷斯坦奶牛FABP4核心启动子预测 启动子是位于结构基因5′端上游的一段核苷酸序列,是RNA聚合酶识别并与模板DNA特异性结合的部位,保证转录起始的精准性。因此,深入细致地研究启动子,对于了解包括FABP4基因在内的各种基因的结构及其表达调控等具有重要意义。
本试验选取基因转录起始位点ATG上游2 000 bp作为FABP4基因的启动子,利用BDGP(http://www.fruitfly.org/seq_tools/promoter.html)在线软件进行启动子预测(图6),结果显示,共预测到FABP4基因有4个核心启动子区,分别位于FABP4基因上游732~782 bp,1 148~1 198 bp,1 246~1 296 bp,1 710~1 760 bp。

图6 FABP4核心启动子区域预测结果Fig.6 FABP4 core promoter region prediction results
2.3.5 FABP4蛋白的同源比对及系统进化树构建 利用MegAlign对多个物种FABP4氨基酸序列进行同源比对分析,结果显示(图7),牛FABP4与绵羊、山羊、小鼠、人、大鼠、猪、马、鸡和斑马鱼的相似性分别为93.2%,92.4%,85.6%,84.1%,83.3%,81.8%,78.8%,72.0%和47.7%,其中与斑马鱼的相似性最低仅有47.7%,与其他几个物种有较高的相似性。使用MEGA 11构建FABP4氨基酸序列在不同物种中的遗传进化树,结果表明(图8),牛与绵羊和山羊之间的亲缘关系最近,与鸡和斑马鱼的亲缘关系较远。以上研究说明,FABP4基因编码区在物种间比较保守。

图7 牛与不同物种FABP4氨基酸序列同源性比对Fig.7 Comparison of amino acid sequence homology between bovine and different species of FABP4

图8 FABP4氨基酸序列的系统进化树Fig.8 Phylogenetic tree of FABP4 amino acid sequences
2.3.6 牛FABP4蛋白互作预测分析及共转录因子预测 通过STRING数据库分析FABP4蛋白与其他蛋白之间的关系,结果如图9-A所示,蛋白互作网络图中各有10个节点,置信度为0.7(高等),线的粗细表示了数据支撑的强度。从图9-A可以看出, FABP4蛋白与多个脂代谢相关蛋白(FABP1、LEP、FABP6、LIPE、LPL、PPARG、GOT2、FABP3、ADIPOQ、FABP7)存在较强的互作关系,推测可能在调控乳脂代谢方面扮演着重要的角色。利用CHEA3数据库对以上11个基因进行共转录因子预测,结果如图9-B所示,展示了对FABP4蛋白互作网络中的基因预测的共转录因子之间相互调控的结果,根据ENCODE ChIP-seq展示了排名前十的转录因子(图9-C)。

图9 FABP4蛋白互作、共转录因子预测结果Fig.9 FABP4 protein interactions,co-transcription factor prediction results
2.4 FABP4在泌乳中期荷斯坦奶牛不同组织间的表达分析
qRT-PCR结果显示(图10),FABP4在7个组织中均有表达,以小肠组织作为对照,FABP4在乳腺组织中表达水平最高,与其他组织差异显著,其他组织之间的表达量差异不显著,提示FABP4在乳腺组织中发挥重要作用。
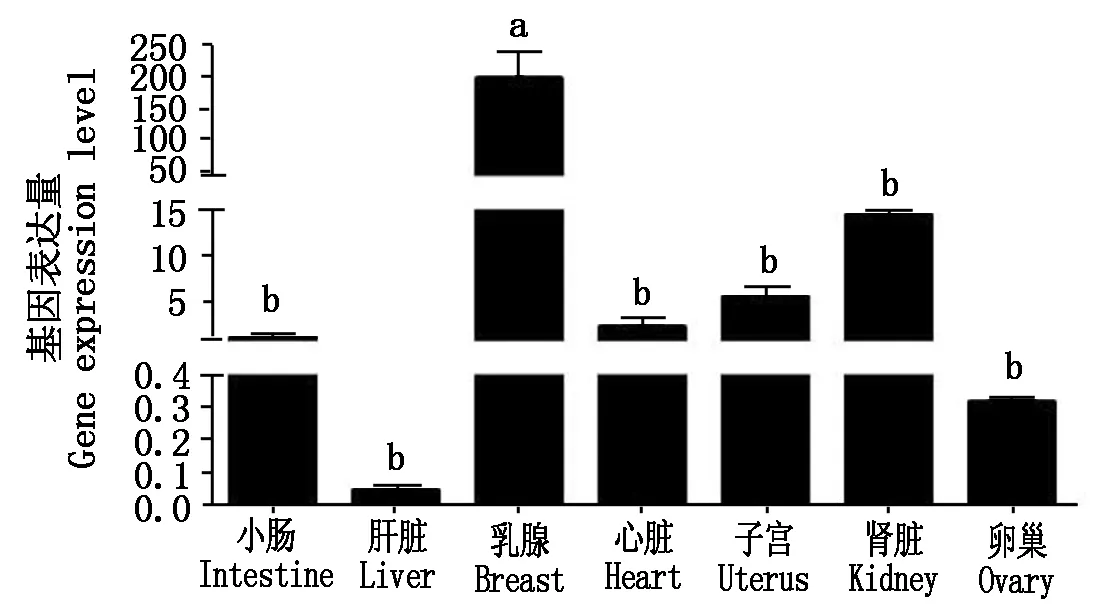
不同小写字母表示差异显著(P<0.05)。The difference lowercase letters indicate significant differences(P<0.05).
3 结论与讨论
作为脂质伴侣的FABPs,其功能大多的研究集中在3个主要的方面,一是在大多数细胞中其含量与FA代谢率呈正比[10],它可以主动促进脂质运输到细胞的特定区域。其次,FABPs参与蛋白质-蛋白质的相互作用,包括膜和细胞内蛋白的相互作用[11]。第三,FABPs通过将脂质运输到核受体,例如过氧化物酶体增殖物激活受体(Peroxisome proliferator-ac-tivated receptor,PPAR)来介导某些转录因子的活性,从而参与组织和细胞中脂质传感和反应机制的调节[12]。牛的FABP4由133个氨基酸组成,在6—32个氨基酸,包含一个结构域脂质运载蛋白,它能运输小的疏水性分子,如脂质、类维生素A、类固醇激素和胆汁素等[13-14]。FABP4蛋白主要存在于脂肪细胞和巨噬细胞中,负责脂肪组织对脂肪酸的吸收和储存,通过调节负责脂质代谢基因的表达,对维持正常代谢和机体的能力平衡发挥重要作用[15]。
本研究以荷斯坦奶牛FABP4为研究目标,克隆了荷斯坦奶牛FABP4基因的CDS序列,与NCBI已公布的序列比对后,发现FABP4基因序列存在一个突变位点,使得氨基酸序列、蛋白二、三级结构发生改变。改变后二级结构中无规卷曲和α-螺旋结构占比增加、β-折叠和β-转角占比减少。无规则卷曲结构是蛋白肽链中构成配体、受体结合的组成部分,会受侧链的影响改变其空间结构[16],进一步改变了FABP4蛋白的功能。对荷斯坦奶牛蛋白跨膜结构及信号肽进行预测分析,结果显示,FABP4蛋白无跨膜结构域和信号肽剪切位点,表明其可能不是分泌蛋白。分析FABP4氨基酸序列及遗传进化树分析发现,牛与绵羊和山羊之间的氨基酸序列相似性均90%以上,亲缘关系也最近,而与鸡和斑马鱼的亲缘关系较远,FABP4发育树与生物进化的物种树基本一致,表明FABP4基因编码区在物种间比较保守。这与石鹏飞等[17]的分析结果一致。FABP4亚细胞定位结果与在线软件预测结果一致,表明FABP4基因可能主要在细胞质中发挥重要功能。而Yonekura等[18]对2种基因型的FABP4进行了核定位,研究结果存在差异,他们认为FABP4的核定位存在基因型依赖性差异,即FABP4V/V和I/I的核定位不同,造成这一原因是因为细胞内转录因子配体与FABP4的脂肪酸结合袋的结合会导致含核转运信号区域发生轻微改变,从而使FABP4进入细胞核内,故FABP4的亚细胞定位还需要用更多的试验研究去证实。利用STRING预测发现,FABP4蛋白与FABP1、LEP、FABP6和PPARG等10种蛋白存在较强的互作关系,其中FABP1能够激活PPARα,启动靶基因的转录,活化后的PPARα可正反馈调节FABP1,使FABP1表达量增加[19-20]。FABP3已被证明是与家畜肌内脂肪(Intramuscular fat,IMF)含量相关的候选基因[20-21]。Wei等[22]的研究表明,FABP4通过调节脂质代谢相关基因(如ADIPOQ、LEP和LEPR)在脂肪沉积和代谢综合征中起作用。Bao等[23]通过综合转录组的研究发现,受lncRNA调控的LIPE、ADIPOQ等可能通过AMPK信号通路使藏羊肌内脂肪沉积含量降低。以上研究均表明,与FABP4互作的蛋白是与脂质代谢密切相关的蛋白,进一步推测FABP4在奶牛乳脂代谢中也发挥着关键的作用。共转录因子预测到SREBP1转录因子参与到FABP4基因的表达,与Li等[24]的研究结果一致,SREBP1可能是调控牛FABP4基因表达的重要转录因子。qRT-PCR结果表明,FABP4基因在泌乳中期的荷斯坦奶牛各个组织中均有不同程度的表达,FABP4在乳腺组织中高表达,显著高于其他组织(小肠、肝脏、心脏、子宫、肾脏、卵巢),其他组织之间差异不显著。在肝脏组织中的表达量最低,几乎可以忽略,这与Attal等[25]的研究结果一致,FABP4通常不在肝脏中表达。Marchitelli等[8]的研究发现,FABP4对长链脂肪酸有正调控,对中链脂肪酸有负调控,并表明FABP4是影响乳脂组成最重要的基因。Zhou等[26]的研究表明,FABP4影响奶牛的产奶量和乳蛋白的含量。这暗示了FABP4在奶牛泌乳过程中发挥着重要的调控作用。
本研究利用荷斯坦奶牛乳腺组织,克隆了FABP4基因的CDS区。对FABP4基因及编码蛋白进行了生物信息学分析,并通过对泌乳中期荷斯坦奶牛不同组织表达谱的分析,表明FABP4基因在乳腺组织中高表达。本研究为后续深入研究荷斯坦奶牛FABP4的生物学功能及乳脂调控机制提供了理论基础。
