进展期白癜风患者肠道微生物菌落构成及功能特征
2023-07-08栾梅赵怡馨李盼牟宽厚
栾梅,赵怡馨,李盼,牟宽厚
白癜风是一种色素脱失性自身免疫性疾病,全球发病率约0.5%~2.0%,发病机制尚未完全明确,包括有遗传学说、自身免疫学说、精神与神经化学学说、微量元素缺乏和自由基损伤学说等[1]。近来肠道微生物在白癜风发病中的作用受到关注。白癜风患者合并幽门螺旋菌感染及炎症性肠病的几率高于健康人群[2-3]。白癜风小鼠模型的研究表明,口服抗生素(氨苄青霉素)改变小鼠肠道菌群组成可显著加速白癜风病理进程,提示肠道菌群的改变与疾病活动相关[4]。目前白癜风患者肠道菌群如何参与白癜风病理进程尚不清楚。为进一步探究肠道菌群在白癜风发病中的作用,笔者通过宏基因组学技术分析非节段型进展期白癜风患者肠道微生物组成及基因功能与潜在的代谢通路,为探索疾病的发病机制及临床诊疗提供依据。
1 对象与方法
1.1研究对象 纳入2022年6月—2022年9月就诊于西安交通大学第一附属医院皮肤科的进展期非节段型白癜风患者25例,纳入标准符合2021版《白癜风诊疗共识》[5],排除标准为既往有自身免疫性疾病、感染性疾病、肿瘤、其他脏器疾病(甲状腺、心脏、消化道等)及其他皮肤病,或在前3个月内曾系统使用抗生素或其他免疫抑制剂,纳入男18例,女7例,平均年龄(30.47±9.03)岁,身高体重指数(body mass index,BMI)为22.81±4.05。对照组纳入25例性别、年龄和BMI相匹配的健康志愿者。本研究经西安交通大学第一附属医院伦理委员会批准。所有参与者都签署了知情同意书。
1.2样品收集 粪便样本使用快速提取试剂盒(MGIEasy粪便样本收集试剂盒,上海,中国),患者排便取新鲜粪便10 g,取样后立即储存在-80 ℃的冰箱中。
1.3宏基因组测序 使用MagbeadsDNA®快速提取试剂盒(MP生物医药,上海,中国)提取粪便样本中DNA。用1%琼脂糖凝胶电泳法测定提取的DNA浓度。用超声波碎波仪将DNA修剪至平均约420 bp,构建成对端文库。舍弃低质量、与接头序列重叠的碱基,使用Bowtie2软件(v2.3.5.1)去除宿主基因。按照说明,在BGI平台(MGESEQ-T7,深圳, 中国)上对人类粪便样本进行宏基因组测序。
1.4分类分析 基于MetaPhlAn3版本3.0.5预测不同分类等级的菌群相对丰度。根据Shannon指数估算菌群丰富度和分布(α-多样性)。基于置换多元方差分析(permutational multivariate analysis of variance,PERMANOVA)法进行主坐标分析(principal coordinate analysis,PCoA),测定白癜风患者和对照组间的成分差异(β-多样性)。生物特异性基因分布到KEGG和KEGG Orthologys(KO)。利用通路分类的MetaCyc层次结构,将每个样本的宏基因组基于注释重构为代谢通路,分析肠道微生物代谢功能变化。
1.5统计学处理 所有数据均采用R软件(v4.0.2)进行分析,采用Wilcoxon秩和检验分析组间差异,线性判别分析(linear discriminant analysis effect size,LEfSe)组间差异菌,LDA值>2.0,P<0.05表示差异有统计学意义。
2 结果
2.1白癜风患者肠道微生物多样性 分析α-多样性代表物种的多少、丰富度和均匀度。Shannon指数反应群落的物种数量和均匀度,Shannon指数越大,代表物种多样性越高。本研究分析显示,白癜风患者Shannon指数较健康人降低(图1a),差异有统计学意义(Z=-2.09,P<0.05)。进一步将白癜风患者按病程分组,发现病程小于5年的白癜风患者与健康对照组相比,α-多样性降低(Z=-2.24,P<0.05,图1b)。β-多样性代表群落结构的相似性,基于 Bray-Curtis算法的PCoA分析显示两组差异无统计学意义(PEMANOVA,P=0.4541),见图1c。
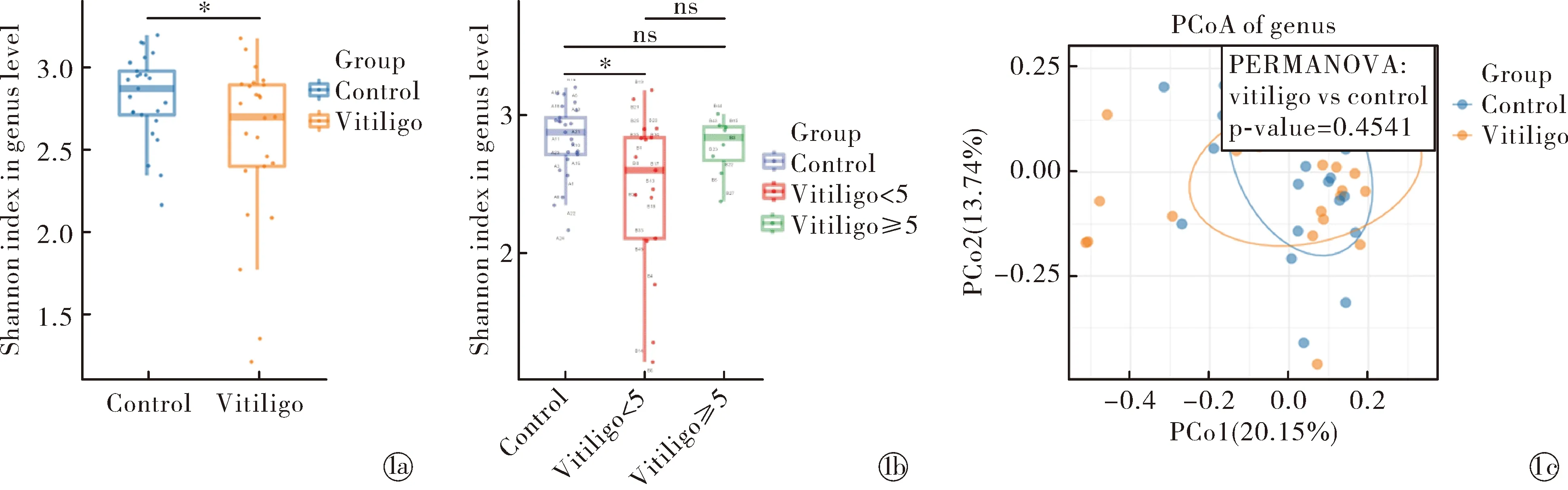
Note:Compared with healthy controls,*P<0.05. α-diversity was decreased in patients with vitiligo; The Shannon index in<5 years goup was lower than healthy controls; PCoA score plot based on Bray-Curtis图1 白癜风患者肠道菌群的多样性分析Fig.1 Analysis of intestinal microbiota diversities patients with vitiligo
2.2白癜风患者的肠道微生物组成 在属水平上,丰富度最高的前20种菌属包括居海事城球杆菌属(Phocaeicola)、拟杆菌属(Bacteroides)、巨单胞菌属(Megamonas)、罗斯拜瑞氏菌属(Roseburia)、梭杆菌属(Faecalibacterium)、布劳特氏菌属(Blautia)、普雷沃氏菌属(Prevotella)、地中海杆菌属(Mediterraneibacter)、双歧杆菌属(Bifidobacterium)、别样杆菌属(Alistipes)、瘤胃球菌属(Ruminococcus)、梭菌属(Clostridium)、厌氧棒状菌属(Anaerostipes)、戴阿利斯特菌属(Dialister)、多尔氏菌属(Dorea)、埃希氏菌属(Escherichia)、副拟杆菌属(Parabacteroides)、梭状链杆菌属(Fusicatenibacter)、毛螺菌属(Lachnospira)(图2)。白癜风患者中拟杆菌属(Bacteroides)、双歧杆菌属(Bifidobacterium)、梭菌属(Clostridium)、多尔氏菌属(Dorea)和布劳特氏菌属(Blautia)(Z=-2.09,P<0.05)相对丰度较健康人群低。
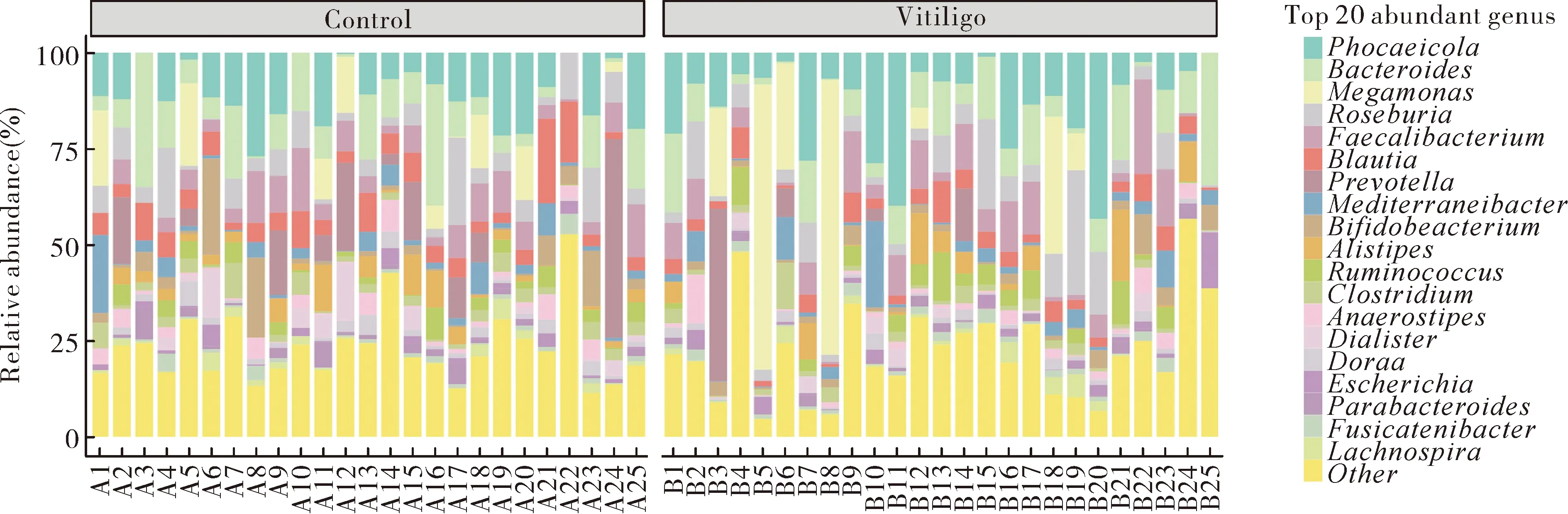
图2 白癜风患者肠道菌群的分类学组成Fig.2 Taxonomy composition of the intestinal flora in patients with vitiligo
2.3白癜风患者和健康对照的差异微生物 与健康对照组相比,11种菌属相对丰度在白癜风组降低(图3a),包括阿里松氏菌属(Allisonella)(Z=-2.91,P<0.01)、伊格尔兹氏菌科(Eggerthellaceae)(Z=-2.88,P<0.01)、霍尔德曼穆尔菌属(Holdemanella)(Z=-2.58,P<0.05)、粗杆菌属(Raoultibacter)(Z=-2.40,P<0.05)、脱硫弧菌属(Desulfovibrio)(Z=-2.17,P<0.05)、栖白蚁菌属(Isoptericola)(Z=-2.08,P<0.05)、特吕佩尔氏菌属(Trueperella)(Z=-2.06,P<0.05)、粪样单胞菌属(Faecalimonas)(Z=2.04,P<0.05)、幼婴粪杆菌属(Coprobacter)(Z=-2.63,P<0.01)、布劳特氏菌属(Blautia)(Z=-2.09,P<0.05)、Neobittarella(Z=-2.24,P<0.05)。其中霍尔德曼穆尔菌属(Holdemanella)和特吕佩尔氏菌属(Trueperella)在白癜风患者中缺如。念珠菌-糖链菌(Candidatus-Saccharibacteria)(Z=2.01,P<0.05)、巴恩斯氏菌属(Barnesiella)(Z=-2.18,P<0.05)、日本医学研究开发署杆菌属(Amedibacillus)(Z=2.25,P<0.05)、座便单胞菌属(Sellimonas)(Z=2.00,P<0.05)相对丰度在白癜风组明显增加(图3a)。
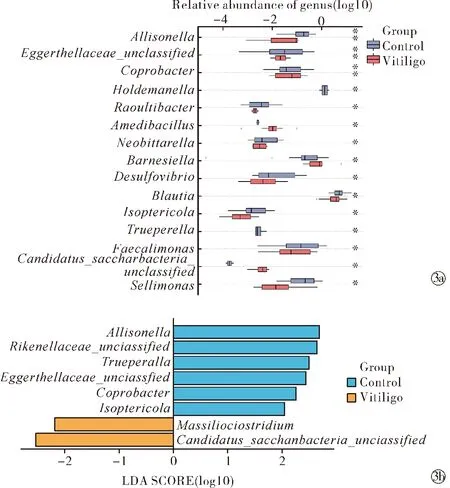
Note:Compared with healthy controls,*P<0.05,**P<0.01. Wilcoxon test; LEfSe图3 白癜风患者与健康对照肠道菌群差异菌分析Fig.3 Differences of the intestinal flora between vitiligo patients and healthy controls
LEfSe分析差异菌结果显示(图3b),念珠菌-糖链菌(Candidatus-Saccharibacteria)(LDA=2.54,P<0.05)在白癜风组富集。阿里松氏菌属(Allisonella)(LDA=2.70,P<0.05)、特吕佩尔氏菌属(Trueperella)(LDA=2.51,P<0.05)、幼婴粪杆菌属(Coprobacter)(LDA=2.26,P<0.05)、伊格尔兹氏菌科(Eggerthellaceae)(LDA=2.45,P<0.05)、栖白蚁菌属(Isoptericola)(LDA=2.05,P<0.05)等在对照组富集。
2.4肠道微生物基因功能和代谢途径 分析KEGG及KO分析提示白癜风患者中显著富集的功能包括(图4):NOD样受体信号通路(Z=3.56,P<0.01)、氨基糖和核苷酸糖代谢(Z=2.80,P<0.01)和嘌呤霉素生物合成(Z=2.34,P<0.05)。而在健康对照组中最丰富的功能是倍半萜和三萜生物合成(Z=-2.78,P<0.05)、吲哚二萜生物碱生物合成(Z=-2.58,P<0.05)、萜类主干生物合成(Z=-2.49,P<0.05)和n-聚糖生物合成(Z=-2.47,P<0.05)。

图4 白癜风患者肠道菌群的基因功能分析Fig.4 Analysis of the intestinal flora gene functions in patients with vitiligo
代谢模块分析腺苷甲硫氨酸合成和谷氨酸降解在两组间差异有统计学意义;较对照组,白癜风组腺苷甲硫氨酸合成(Z=-2.47,P<0.05)和谷氨酸降解(Z=-2.24,P<0.05)通路水平显著降低,差异有统计学意义(图5a~5b)。
3 讨论
肠道微生物在物质代谢、能量吸收及免疫调节方面发挥重要作用[6]。肠道微生物参与了多种皮肤相关疾病的发生,例如斑秃[7]、银屑病[8]、特异性皮炎[9]等。肠道菌群在白癜风中的作用近来受到高度关注,目前已有的研究全部基于16sRNA扩增子测序技术。本研究采用的宏基因组测序技术可直接对DNA分子进行序列测定,获取样本中所有微生物的基因组信息,从而分析微生物的组成、功能特点和代谢特征。
本研究发现与健康对照相比,白癜风患者肠道菌群的α-多样性降低,这与Bzioueche等[10]的研究一致,但与Ni等[11]的研究结果相反。进一步亚组分析,发现病程小于5年的白癜风患者肠道菌群α-多样性显著降低,提示肠道菌群伴随白癜风发病多样性显著降低;病程的延长可能会导致肠道菌群在白癜风和正常对照组的肠道菌群趋于一致。本研究发现β-多样性在两组间的差异无统计学意义,这与Bzioueche等[10]的研究结果一致;但Ni等[11]的研究发现主成分1(principal component analysis 1,PCA1)贡献最大,达到24.53%,提示白癜风患者肠道群落结构有差异。白癜风患者中丰度降低的肠道微生物包括产生短链脂肪酸(short-chain fatty acids, SCFAs)的多种菌属,如拟杆菌属(Bacteroides)、双歧杆菌属(Bifidobacterium)、布劳特氏菌属(Blautia)和梭菌属(Clostridium)等[12]。SCFAs在维持肠道黏膜屏障的完整性和通透性中发挥重要作用。同样丰度降低的菌属譬如霍尔德曼穆尔菌属(Holdemanella)可通过代谢低聚果糖产生长链脂肪酸发挥抗炎作用[13]。阿里松氏菌属(Allisonella)可代谢产生组胺[14],组胺可抑制肠道微生物异位,促进肠黏膜修复。本研究发现上述菌属与肠道屏障功能及具有肠道抗炎功能的肠道微生物相对丰度降低,提示肠道屏障功能破坏可能与白癜风发病相关。补充维持肠道屏障功能的益生菌可能有益于白癜风的辅助治疗。
本研究结果显示白癜风患者中4个菌属肠道微生物相对丰度升高。既往研究提示这些菌属可能与抑郁等精神疾病相关:座便单胞菌属(Sellimonas)在重度抑郁症者肠道中高度富集[15]。巴恩斯氏菌属(Barnesiella)的相对丰度在便秘孤独症组中高于非便秘孤独症组[16]。一项大规模人群的队列研究发现白癜风与抑郁症高度相关[17]。本研究提示肠道菌群可能与白癜风患者的精神症状如抑郁表型高度相关,其具体机制有待研究。LEfSe结果显示,念珠菌-糖链菌(Candidatus-Saccharibacteria)在白癜风组富集。念珠菌-糖链菌是一种寄生菌,属于糖细菌(TM7)分类中的一种, 可通过Ⅳ型菌毛可识别并附着于其细菌宿主[18]。TM7被检测为健康人类口腔、胃、皮肤和肠道微生物群落的共生成员,在炎症环境中相对活跃[19],提示炎症也可能是白癜风的病理因素之一。
不同于16sRNA测序技术,宏基因组学技术可以分析肠道细菌基因功能。KEGG分析显示白癜风患者中NOD样受体信号通路丰富。核定位富亮氨酸重复序列蛋白1 (nuclear localization leucine-rich-repeat protein 1,NLRP1)是NOD样受体家族的成员。编码NLRP1的核定位NLRP1基因的多态性与白癜风高度相关[20]。核定位富含亮氨酸重复序列蛋白3(nuclear localization leucine-rich-repeat protein 3,NLRP3)炎症小体的NOD样受体家族表达于角质形成细胞。氧化应激诱导角质形成细胞中NLRP3炎症小体激活可促进皮肤T细胞免疫反应,参与白癜风的发生[21]。由于NOD样蛋白家族成员数量众多,作为先天免疫调节因子的NOD样受体成员可能成为研究白癜风发病机制的潜在靶点。
代谢模块分析显示白癜风患者肠道菌群甲硫氨酸合成和谷氨酸代谢通路水平降低。Liu等[22]发现甲硫氨酸可通过降低细胞内活性氧(reactive oxygen species,ROS)水平从而发挥抗炎作用。Marzabani等[23]对白癜风患者血清氨基酸代谢研究发现白癜风患者血清谷氨酸水平升高,认为谷氨酸是疾病进展的潜在生物标志物。谷氨酸通过线粒体膜运输还原剂,通过苹果酸/天冬氨酸穿梭调节糖酵解和细胞氧化还原状态[24]。氧化应激是白癜风发病的重要诱因之一,由此笔者推测肠道菌群代谢物可能通过影响全身氧化应激状态促进白癜风的病理进程。
综上所述,本研究发现白癜风患者肠道微生物多样性降低,微生物的相对丰度及菌群基因功能和代谢功能均发生改变。本研究为白癜风的发病机制研究及潜在治疗策略提供重要的理论依据。
