针灸调节miR-221-3p/CCR5轴对缺血性脑卒中大鼠神经炎症的影响
2023-07-07张京兰
卢 菁,王 非,张京兰
缺血性脑卒中早期起病隐匿,发病时病情进展迅速,多数病人遗留偏瘫、认知障碍等,影响病人身心健康[1-2]。神经炎症认为是缺血性脑卒中发生及病情进展过程中的关键病理因素,调控过度活跃的神经炎症是改善缺血性脑卒中神经损伤的有效手段[3-4]。有研究表明,针灸可降低促炎细胞因子表达,抑制炎症细胞激活和浸润,减轻脑缺血/再灌注后的炎症,促使受损神经系统修复[5]。针刺脑卒中大鼠阳陵泉+配穴、关元、照海+申脉穴位,均可抑制炎症及凋亡信号激活,减少神经元凋亡数量[6]。针灸在缺血性脑卒中的临床治疗中亦具有明显疗效[7],但其分子机制尚未明确。有研究显示,缺血性脑卒中病人血清miRNA-221-3p水平降低[8],上调miRNA-221-3p可抑制氧化应激和神经元凋亡,减轻帕金森病小鼠神经元损伤[9]。C-C趋化因子受体5(C-C chemokine receptor 5,CCR5)是一种关键的神经炎症调控因子,其表达上调导致并维持持续的神经炎症,促使各种炎症相关神经系统疾病进展。通过TargetScanHuman 7.2数据库可见miR-221-3p与CCR5之间有结合位点,因此miR-221-3p/CCR5可作为缺血性脑卒中的潜在治疗靶点[10]。本研究通过构建缺血性脑卒中大鼠模型,观察针灸调节miR-221-3p/CCR5轴对缺血性脑卒中大鼠神经炎症的影响。
1 材料与方法
1.1 实验动物 SD雄性大鼠,约6周龄,购自厦门万泰沧海生物技术有限公司[许可证号:SCXK(闽)2018-0002],无特定病原体(SPF)级,体质量为(195±15)g,均喂养在本院动物房的饲养笼中,动物房条件:12 h/12 h(明/暗)交替、温度(24.5±1.5)℃、湿度(55±5)%、噪声≤80 dB,大鼠适应饲养1周后用于实验,并遵照3R原则给予人道关怀。
1.2 实验试剂及仪器 miR-221-3p antagomir、miR-221-3p antagomir阴性对照、野生型CCR5 3′-UTR报告质粒、miR-221-3p mimic、miR-221-3p mimic阴性对照、突变型CCR5 3′-UTR报告质粒、miR-221-3p及U6、CCR5、GAPDH引物均购自上海吉玛制药技术有限公司;三苯基氯化四氮唑(triphenyltetrazolium chloride,TTC,货号T8170)、总RNA提取试剂盒(货号R1200)、LipofectamineTM2000(货号11668)、一步法实时荧光定量聚合酶链式反应(RT-PCR)试剂盒(货号T2210)、双荧光素酶报告基因检测试剂盒(货号D0010)购自北京索莱宝科技有限公司;苏木精-伊红(HE)染色试剂盒(货号ab245880)、大鼠白细胞介素(interleukin,IL)-10酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒(货号ab214566)、大鼠IL-17 ELISA试剂盒(货号ab214028)、大鼠IL-18 ELISA试剂盒(货号ab213909)均购自美国Abcam公司;大鼠海马神经元细胞(货号CP-R107)、大鼠海马神经元细胞完全培养基(货号CM-R107)购自武汉普诺赛生命科技有限公司。
6805-D型电针仪购自四川科仪诚科技有限公司;XR-XY1032型大鼠Y迷宫购自上海欣软信息科技有限公司;HB-800S型大鼠跳台箱及记录仪购自淮北软隆生物科技公司;CM1950型冰冻切片机购自德国Leica公司;BD-SW50型生物光学显微镜购自深圳市博视达光学仪器有限公司;ND1000型酶标仪购自美国NanoDrop公司;CFX96 Touch Deep Well型荧光定量PCR仪购自美国Bio-Rad公司等。
1.3 方法
1.3.1 制备缺血性脑卒中大鼠模型及分组给药 参照相关文献[11]分离颈外动脉和颈总动脉后通过改良线栓法制备缺血性脑卒中大鼠模型,24 h后以Zea Longa分级法[12]对造模大鼠做神经功能缺损评分,剔除评分为0分和4分的大鼠,将评分为1~3分的大鼠随机分为模型组、针灸组、miR-221-3p antagomir组、miR-221-3p antagomir阴性对照组、针灸+miR-221-3p antagomir组,每组12只;另取12只SD大鼠只分离颈动脉,不结扎、不插线,作为假手术组。
miR-221-3p antagomir组、miR-221-3p antagomir阴性对照组、针灸+miR-221-3p antagomir组大鼠尾静脉注射miR-221-3p antagomir及其阴性对照(剂量参照说明书设定),每周1次,共注射2次;假手术组、模型组和针灸组大鼠尾静脉注射等剂量生理盐水,每周1次,共注射2次;针灸组、针灸+miR-221-3p antagomir组大鼠参考《实验针灸学》定位关元穴,设定电针仪电压为2~4 V,脉冲宽度0.5 ms,频率2/100 Hz,舒波4 Hz,行针以大鼠出现轻微颤抖为宜,留针30 min,每日针灸1次,连续针灸14 d[6]。
1.3.2 大鼠神经功能损伤 各组大鼠在最后1次针灸治疗后24 h进行神经功能缺损评分。
1.3.3 大鼠学习记忆能力 各组大鼠在神经功能损伤后,以Y迷宫实验和跳台实验测定大鼠学习记忆能力。Y迷宫实验:将Y迷宫的新异臂以隔板遮挡,将大鼠自起始臂放入,训练其在Y迷宫中自由探索活动10 min,之后间隔4 h取下新异臂的隔板,将大鼠自起始臂放入Y迷宫,让其在各个臂中自由探索活动,将大鼠5 min内在各个臂中停留的时间及进入次数。跳台实验:跳台装置接通电源,将大鼠置于反应箱中适应训练5 min,间隔4 h后再次将大鼠放入接通电源的跳台装置反应箱中,将首次错误跳台的时间作为其潜伏期,之后记录大鼠5 min内犯错次数。
1.3.4 大鼠脑梗死情况及标本采集 各组大鼠在学习记忆能力测定结束后进行乙醚麻醉,断头处死,解剖取出大脑,每组随机选出6只大鼠的大脑进行冠状面切片,切为大约等厚的5片,以TTC染液孵育后,拍照并采用Image J软件对图片分析得到脑梗死面积。每组剩余6只大鼠的大脑剪下约0.6 g存在液氮中备用;再次剪下约0.4 g加入生理盐水研磨匀浆后离心,吸出上清后采用二喹啉甲酸法(BCA)试剂盒并参照说明书测定总蛋白浓度,分组标记好后保存于-80 ℃备用;剩余脑组织漂洗后以液氮冷冻,将冻好的组织块置于冰冻切片机中进行常规病理切片备用。
1.3.5 大鼠海马神经元形态 取出脑组织切片,每只大鼠选出有典型海马结构的3张复温、固定后,以HE试剂盒并参照其说明书进行染色,采用光学显微镜观察海马神经元形态并随机采集每张切片上3个视野。
1.3.6 大鼠脑组织IL-17、IL-18、IL-10水平 取出脑组织样品液置于4 ℃冰箱中,提前缓慢解冻,采用大鼠ELISA试剂盒并参照说明书检测IL-17、IL-18、IL-10水平。
1.3.7 大鼠脑组织miR-221-3p、CCR5 mRNA表达 取出保存于液氮中的脑组织,置于研钵中,加入总RNA提取试剂盒中的提取试剂,研磨后参照试剂盒说明书提取出各组大鼠脑组织中总RNA,之后使用一步法RT-PCR试剂盒并参照说明书进行扩增,miR-221-3p的内参选用U6,CCR5的内参选用GADPH,实验所得的数据经2-ΔΔCt法分析计算后得到miR-221-3p及CCR5 mRNA相对表达量,引物序列见表1。
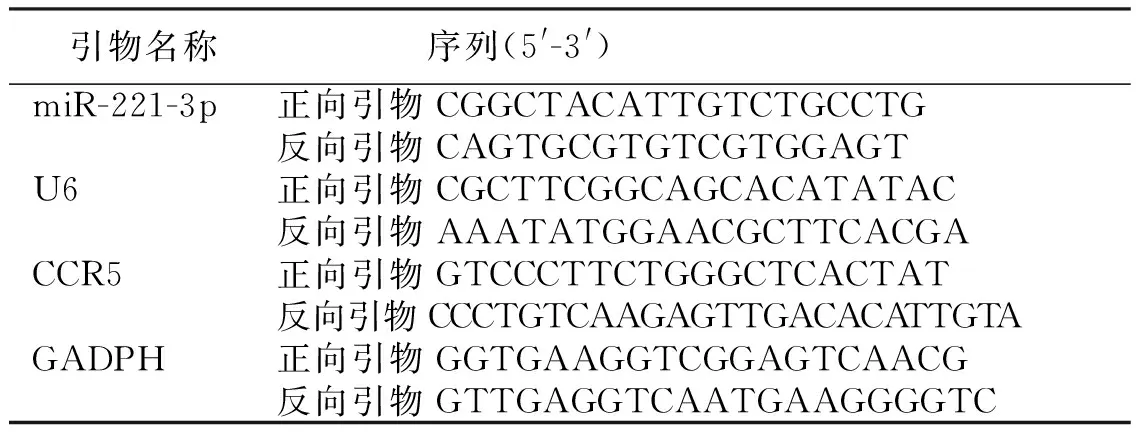
表1 引物序列
1.3.8 大鼠海马神经元细胞中miR-221-3p对CCR5的靶向调控 解冻复苏大鼠海马神经元细胞,随机分为野生型CCR5+miR-221-3p mimic组、野生型CCR5+miR-221-3p mimic阴性对照组、突变型CCR5+miR-221-3p mimic组、突变型CCR5+miR-221-3p mimic阴性对照组,采用LipofectamineTM2000并按照说明书步骤,以野生型CCR5 3′-UTR报告质粒、突变型CCR5 3′-UTR报告质粒、miR-221-3p mimic、miR-221-3p mimic阴性对照分组转染细胞,各组细胞转染后24 h,将其消化后分组收集,以双荧光素酶报告基因检测试剂盒且参照说明书检测各组细胞的双荧光素酶相对活性[9]。
2 结 果
2.1 针灸对缺血性脑卒中大鼠学习记忆能力的影响 与假手术组比较,模型组大鼠新异臂进入次数减少,新异臂停留时间比及跳台实验潜伏期缩短(P<0.05),跳台实验犯错次数增加(P<0.05)。与模型组比较,针灸组大鼠新异臂进入次数、新异臂停留时间比及跳台实验潜伏期延长(P<0.05),跳台实验犯错次数减少(P<0.05);miR-221-3p antagomir组大鼠新异臂进入次数、新异臂停留时间比及跳台实验潜伏期减少(P<0.05),跳台实验犯错次数增加(P<0.05)。与针灸组比较,针灸+miR-221-3p antagomir组大鼠新异臂进入次数、新异臂停留时间比及跳台实验潜伏期减少(P<0.05),跳台实验犯错次数增多(P<0.05);与miR-221-3p antagomir组比较,针灸+miR-221-3p antagomir组大鼠新异臂进入次数、新异臂停留时间比及跳台实验潜伏期增多(P<0.05),跳台实验犯错次数减少(P<0.05)。详见表2。
表2 各组大鼠Y迷宫实验及跳台实验结果比较(±s)
2.2 针灸对缺血性脑卒中大鼠脑梗死的影响 与假手术组比较,模型组大鼠脑梗死面积增加(P<0.05)。与模型组比较,针灸组大鼠脑梗死面积减小(P<0.05);miR-221-3p antagomir组大鼠脑梗死面积增加(P<0.05)。与针灸组比较,针灸+miR-221-3p antagomir组大鼠脑梗死面积增加(P<0.05)。与miR-221-3p antagomir组比较,针灸+miR-221-3p antagomir组大鼠脑梗死面积减小(P<0.05)。详见图1、表3。
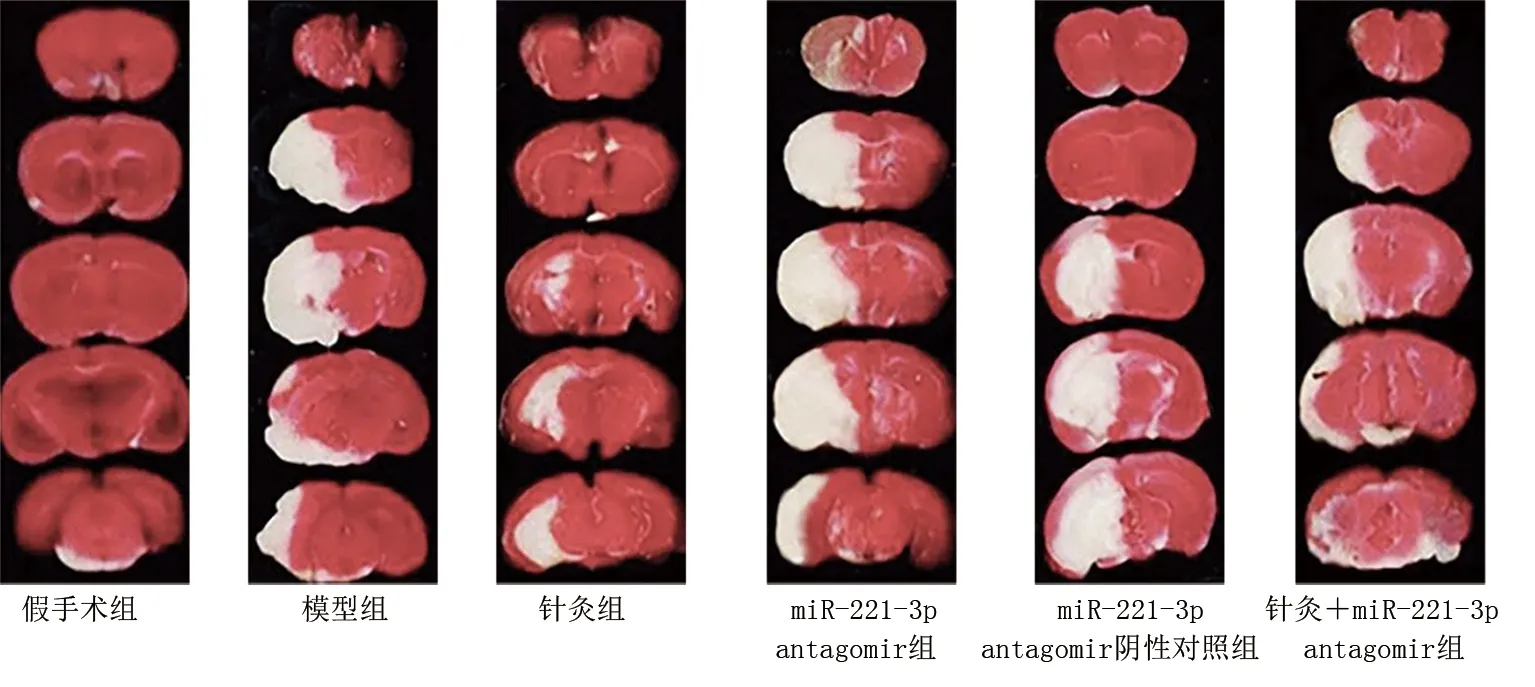
图1 各组大鼠脑梗死情况(TTC)
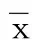
表3 各组大鼠脑梗死面积比较(±s) 单位:%
2.3 针灸对缺血性脑卒中大鼠神经损伤的影响 假手术组大鼠海马神经元形态完好圆润,排列规则,神经功能缺损评分为0分。与假手术组比较,模型组大鼠海马神经元发生明显病理损伤,细胞结构破碎,形态萎缩,排列紊乱,数量减少,神经功能缺损评分升高(P<0.05)。与模型组比较,针灸组大鼠海马神经元病理损伤减轻,神经功能缺损评分降低(P<0.05);miR-221-3p antagomir组大鼠海马神经元病理损伤加重,神经功能缺损评分升高(P<0.05);与针灸组比较,针灸+miR-221-3p antagomir组大鼠海马神经元病理损伤加重,神经功能缺损评分升高(P<0.05)。与miR-221-3p antagomir组比较,针灸+miR-221-3p antagomir组大鼠海马神经元病理损伤减轻,神经功能缺损评分降低(P<0.05)。详见图2、表4。
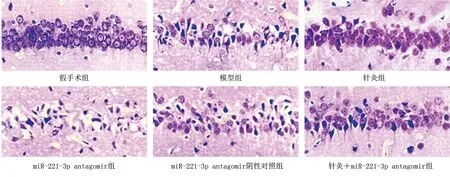
图2 各组大鼠海马神经元形态变化(HE,×200)
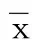
表4 各组大鼠神经功能缺损评分比较(±s) 单位:分
2.4 针灸对缺血性脑卒中大鼠神经炎症的影响 与假手术组比较,模型组大鼠脑组织抑炎因子IL-10水平降低(P<0.05),促炎因子IL-17、IL-18水平升高(P<0.05)。与模型组比较,针灸组大鼠脑组织抑炎因子IL-10水平升高(P<0.05),促炎因子IL-17、IL-18水平降低(P<0.05);miR-221-3p antagomir组大鼠脑组织抑炎因子IL-10水平降低(P<0.05),促炎因子IL-17、IL-18水平升高(P<0.05)。与针灸组比较,针灸+miR-221-3p antagomir组大鼠脑组织抑炎因子IL-10水平降低(P<0.05),促炎因子IL-17、IL-18水平升高(P<0.05)。与miR-221-3p antagomir组比较,针灸+miR-221-3p antagomir组大鼠脑组织抑炎因子IL-10水平升高(P<0.05),促炎因子IL-17、IL-18水平降低(P<0.05)。详见表5。
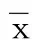
表5 各组大鼠脑组织促炎因子IL-17、IL-18及抑炎因子IL-10水平比较(±s) 单位:pg/g prot
2.5 针灸对缺血性脑卒中大鼠脑组织miR-221-3p/CCR5轴表达的影响 与假手术组比较,模型组大鼠脑组织miR-221-3p mRNA表达水平降低(P<0.05),CCR5 mRNA表达水平升高(P<0.05)。与模型组比较,针灸组大鼠脑组织miR-221-3p mRNA表达水平升高(P<0.05),CCR5mRNA表达水平降低(P<0.05);miR-221-3p antagomir组大鼠脑组织miR-221-3p mRNA表达水平降低(P<0.05),CCR5 mRNA表达水平升高(P<0.05)。与针灸组比较,针灸+miR-221-3p antagomir组大鼠脑组织miR-221-3p mRNA表达水平降低(P<0.05),CCR5 mRNA表达水平升高(P<0.05)。与miR-221-3p antagomir组比较,针灸+miR-221-3p antagomir组大鼠脑组织miR-221-3p mRNA表达水平升高(P<0.05),CCR5 mRNA表达水平降低(P<0.05)。详见表6。
表6 各组大鼠脑组织miR-221-3p、CCR5 mRNA表达水平比较(±s)
2.6 大鼠海马神经元细胞中miR-221-3p对CCR5的靶向调节情况 通过TargetScanHuman 7.2数据库查询到miR-221-3p与CCR5之间有结合位点,详见图3。与野生型CCR5+miR-221-3p mimic阴性对照组比较,野生型CCR5+miR-221-3p mimic组相对荧光素酶活性降低(P<0.05);突变型CCR5+miR-221-3p mimic阴性对照组与突变型CCR5+miR-221-3p mimic组相对荧光素酶活性比较,差异无统计学意义(P>0.05)。详见表7。
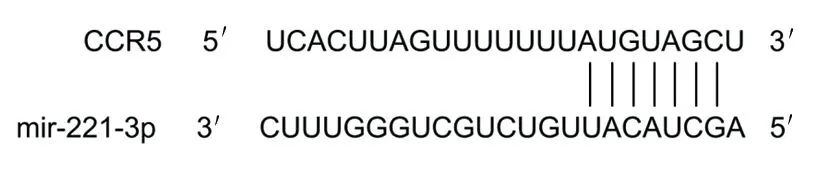
图3 miR-221-3p与CCR5的结合位点图
表7 各转染组细胞相对荧光素酶活性比较(±s)
3 讨 论
本研究采用改良线栓法构建缺血性脑卒中大鼠模型,结果显示,造模大鼠脑部大面积梗死,脑组织抑炎因子IL-10水平降低,促炎因子IL-17、IL-18水平升高,引发严重的神经炎症,造成大鼠海马神经元细胞结构破碎,形态萎缩,排列紊乱,数量减少,发生病理损伤,大鼠神经功能缺损评分、跳台实验犯错次数增加,新异臂进入次数、新异臂停留时间比及跳台实验潜伏期减少,表明大鼠学习记忆能力降低,神经功能发生严重损伤。大脑缺血时,炎性因子、活性氧等致炎因子大量释放,触发神经炎症反应,最终损伤神经功能,控制并减弱脑内神经炎症,可减轻缺血性脑卒中小鼠脑损伤[13-14]。中医学将脑卒中归属于“中风”范畴,气血运行不顺、阴阳失调是主要病机,针灸作为一种施加于特定穴位的非特异性刺激,可调动机体调节机制,改变组织器官病理状态,减轻机体氧化应激和炎症反应,使其恢复稳态,缓解缺血性脑卒中引发的神经损伤,治疗缺血性脑卒中时显示出较好的临床疗效[5,15-16]。督脉针刺与常规治疗结合可提高对急性缺血性脑卒中病人的疗效,改善神经功能受损症状[17]。本研究以针灸干预治疗缺血性脑卒中大鼠,可减小大鼠脑部梗死面积,降低脑组织促炎因子IL-17、IL-18水平,升高抑炎因子IL-10水平,减轻神经炎症,恢复大鼠海马神经元形态,缓解病理损伤,降低大鼠神经功能缺损评分及跳台实验犯错次数,增加新异臂进入次数、新异臂停留时间比,延长跳台实验潜伏期,提高大鼠学习记忆能力,改善神经功能损伤,表明针灸治疗通过抑制神经炎症减轻缺血性脑卒中大鼠脑损伤,保护神经功能。
相关研究显示,miRNA-221-3p可调控细胞凋亡及炎症等病理过程,过表达miR-221-3p可抑制香烟烟雾提取物引发的肺组织炎症反应,减轻支气管上皮细胞凋亡水平,改善慢性阻塞性肺病症状[18]。miRNA-221-3p作为诊断缺血性脑卒中的潜在生物标志物,在缺血性脑卒中病人体内低表达[8],促进其表达可抑制神经元凋亡[9]。CCR5与神经炎症的发生及进展密切相关,鞘内注射CCR5拮抗剂可抑制坐骨神经损伤大鼠神经炎症,减轻神经病理性疼痛[19]。CCR5通过介导炎症,参与各种神经系统疾病的病理过程,抑制CCR5可减弱促炎信号触发的神经元热下垂,减轻神经元死亡和神经功能缺损[20]。本研究结果显示,针灸可上调miR-221-3p表达,下调CCR5表达,以miR-221-3p antagomir干预处理缺血性脑卒中大鼠,加重海马神经元病理损伤,减小大鼠新异臂进入次数、新异臂停留时间比、跳台实验潜伏期、脑组织抑炎因子IL-10水平表达,增加大鼠跳台实验犯错次数、神经功能缺损评分、脑梗死面积、脑组织IL-17、IL-18水平及CCR5 mRNA表达,表明下调miR-221-3p mRNA可促使神经炎症进展,进一步降低大鼠学习记忆能力,加重神经损伤,减弱针灸干预对神经炎症的抑制,拮抗其对大鼠学习记忆能力的提升作用,最终逆转针灸对大鼠的神经保护作用。双荧光素酶实验结果显示,大鼠海马神经元中miR-221-3p可靶向下调CCR5表达,表明针灸治疗减轻缺血性脑卒中大鼠神经炎症及脑损伤是通过上调miR-221-3p表达、下调CCR5表达实现的。
综上所述,针灸通过促进miR-221-3p表达,进而降低CCR5表达,减小缺血性脑卒中大鼠脑梗死面积,调控抗炎因子与促炎因子平衡,抑制炎性级联反应,减轻大鼠脑内神经炎症损伤,增强学习记忆功能,缓解神经功能障碍。本研究为深入阐释针灸治疗缺血性脑卒中的分子机制提供实验依据,有利于临床推广及改进发展。
