实时直接分析质谱法在中药质量研究中的应用进展
2023-07-06胡双飞王永刚苏薇薇
胡双飞,张 奥,王永刚,苏薇薇
实时直接分析质谱法在中药质量研究中的应用进展
胡双飞,张 奥,王永刚,苏薇薇*
中山大学生命科学学院,广东省中药上市后质量与药效再评价工程技术研究中心/广东省热带亚热带植物资源重点实验室,广东 广州 510275
中药化学成分组成是其物质基础,针对中药中有效成分、特征成分及有害物质的定性、定量分析,是阐明中药药效成分和鉴定其品质的主要方式。实时直接分析质谱(direct analysis in real time-mass spectrometry,DART-MS)技术无需或仅需简单的样品处理,具有快速、直接、现场检测等特点,将其引入到中药质量研究,有助于评价中药质量的稳定性和安全性。通过对DART-MS离子源结构、原理及在中药质量研究中的应用进行综述,为该技术在中药领域的应用提供参考。
实时直接分析质谱;有效成分;成分分析;中药质量;快速分析
中药质量是保证其药效的根本,对药材种类和品质的鉴定是确保中药质量的关键环节[1]。发展快速、有效的质量检测/鉴定手段,建立高效、精准的质量评价体系,对于保证中药的质量安全至关重要,也是中药产业发展的重要保障。
中药化学成分复杂,鉴定其化学成分物质基础与质量控制困难复杂。目前主要依靠质谱技术对中药中的成分进行研究[2]。但传统的色谱-质谱联用技术,如高效液相色谱-质谱[3]和气相色谱-质谱[4]等,存在基质效应、电离效率、繁琐的样品预处理等问题,且难以实时管控中药的质量,限制了其广泛应用。
实时直接分析质谱(direct analysis in real time-mass spectrometry,DART-MS)是一种非表面接触分析/离子化质谱分析离子源技术,不仅能最大限度减少样品量与样品制备、降低检测限和分析时间,而且具有较高的灵敏度、多成分同时测定、同时分析不同极性(极性、中等极性和非极性)成分等特点[5]。DART离子源快速实时分析化学成分的特点与中药多成分同时分析的研究需求相匹配,能够快速分析中药成分的变化。然而,当前的DART-MS技术缺少与之匹配的数据库,分析未知化合物解谱耗时较长。因此建立针对该技术的化合物数据库,是适用于真伪鉴别、农药残留等检测的有利方法,并能为研究中药质量提供新的理论和方法。本文拟对DART-MS离子源结构、原理及在中药质量研究中的应用进展进行综述,为促进其在中药中的应用提供参考。
1 DART离子源结构及原理
DART离子源是一种大气压气体吸附电离源,外接He、Ar或N2等气体进入DART内部时,通过高压放电针产生辉光放电形成分析物离子体(离子、电子、亚稳态分子、原子等),然后气体通过电极进入陶瓷加热管获得高能与动能,再经过栅网电极除去亚稳态物质与异电荷,最后产生的样品离子进入质谱[6-7],见图1。
应用DART离子源时,解析气体温度、栅网电极电压、进样速度、解析气体类型等对离子源检测灵敏度具有重要作用,其中解析气体温度对DART的离子化性能影响最大[8]。在DART离子源中,解析气温度是影响其分析的首要因素[10],其温度高低可影响解析气原子动能,导致DART的离子转化率受到影响[8],正负离子模式的选择确定其是否检出。
2 DART在中药质量检测中的应用
中药质量受药材来源、产地和采摘时间等多重因素的影响[9],当前已有大量研究使用DART-MS技术实现对药材的鉴别。通过对文献调研发现,DART- MS在中药质量研究中符合本研究的论文共纳入94篇,其中中文22篇、英文72篇。按照中药成分可分为生物碱类、黄酮类、苷类、挥发油类、有机酸类、糖类等,主要集中于生物碱类、黄酮苷元及有机酸等的研究,将发文量较少的酚类、有毒物质等的研究合并到其他类别中,见图2。表明利用DART-MS技术用于中药中其他化学成分研究相对较少,建议后续扩大该技术在中药质量研究中的应用。
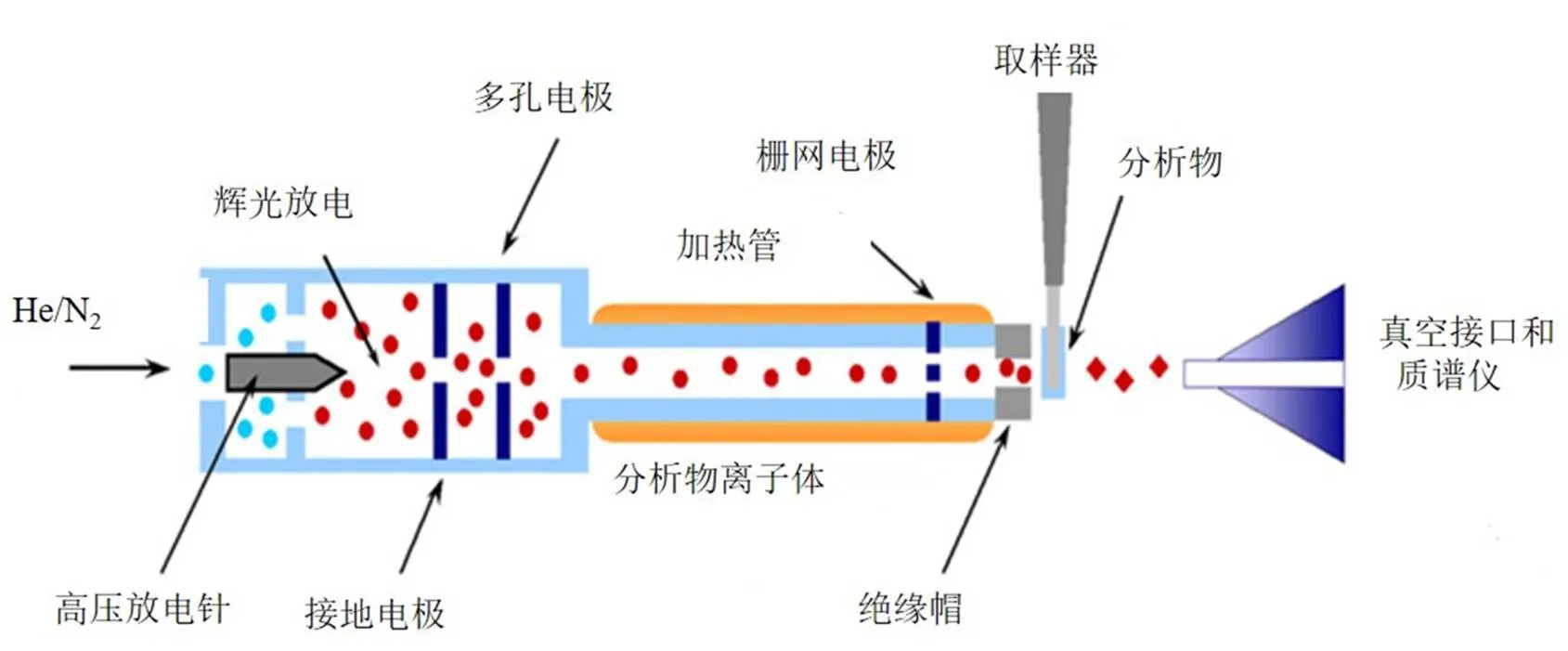
图1 DART离子源原理
2.1 生物碱类
Singh等[10]在样品未预处理情况下,使用DART-MS研究牧豆树根、茎、花、叶和豆荚中的生物碱分布,并指认出不同类别生物碱,如哌啶生物碱和普罗索平生物碱,通过分布部位的含量比较,这些生物碱类成分在牧豆树不同部位的分布存在差异,其中叶和豆荚中生物碱含量最高,且均含有12种不同的生物碱,而花中仅有4种生物碱。Singh等[11]应用DART-MS技术直接测定叶柄小檗中果实、叶、根和茎的化学成分,采用主成分分析(principal component analysis,PCA)处理DART-TOF-MS获得的数据,可实现对其部位进行有效区分。王洋等[12]采用DART-Orbitrap-MS确证了延胡索中延胡索甲素和延胡索乙素,并考察其定量方法的精密度与稳定性,实验表明DART与质谱联用能够快速对延胡索素定量研究,且定性分析时无需样品前处理。孙磊等[13]在未经前处理和色谱分离的情况下应用DART-MS检测吐根生物碱,通过建立吐根茎和叶的特征图谱,并采用外标法对吐根生物碱定量分析,结果发现吐根茎和叶的图谱中均有明显的吐根碱和吐根酚碱的质子离子峰。Zhu等[14]应用DART-MS技术鉴别附子炮制是否合格并筛选出其质量标志物,采用DART-MS技术获取样品中化合物数据信息,将16个附子样品中发现的化合物(=133)丰度归一化处理并设为变量,利用指纹数据阵列进行奇异值分解实现PCA分析,该数据阵列由16×133个数据矩阵组成。结果显示,该方法不仅能区分不同炮制程度的附子,而且便于筛选附子的质量标志物,主要为单酯型、双酯型乌头碱类,总之DART-MS技术结合多元数据分析为中药的质量评价提供了一种灵活可靠的方法,主要流程见图3。目前,将DART-MS技术与多元统计分析方法相结合,已成功应用于区分多种不同来源的中药,如曼陀罗[15]、萝芙木[16]、槟榔、川贝[17]等,并确定其中的质量标志物。

图2 不同类别中药成分在总发文章中的占比
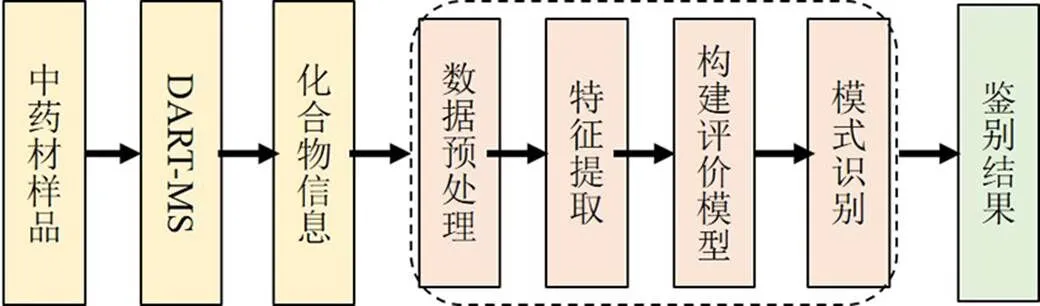
图3 DART-MS与多元统计分析方法鉴别中药流程
通过DART-MS技术对中药中生物碱类成分进行研究,可用于中药质量稳定性、鉴别与溯源的评价。表明DART技术在中药质量分析中具有重要作用,其中生物碱类成分检测的最佳温度大多集中在300 ℃,这可能与生物碱类成分性质较稳定相关,温度过低离子源中解析不充分,响应度低,过高则可能导致成分分解和转化[18];DART离子源具有独立的软件控制系统,离子源分为正、负2种离子模式,检测离子模式均为正离子模式时,可能是生物碱类成分含碱性氮原子,携带一个单位的正电荷或易携带正电荷,易产生质量数为自身相对分子质量的离子峰[M]+或[M+H]+,由于其易结合质子,在正离子模式下响应较好,因此通常设置为正离子模式,DART-MS技术在生物碱类中药中的应用见表1。

表1 DART-MS技术在含生物碱类成分中药中的应用
2.2 黄酮苷元类
黄酮类成分生物活性多样,是多种中药的有效成分,如桑属植物中存在大量的黄酮类成分,且具有抗菌、抗炎、降血压等多种药理作用[19]。近年来,DART技术已被用于含黄酮类成分中药的检测。李乐乐等[20]采用DART-Orbitrap MS技术设定解析气温度300 ℃,从黄芩中检出黄芩素、汉黄芩素、韧黄芩素II等成分,并通过黄芩素和汉黄芩素离子流图积分计算峰面积确定其含量。Chernetsova等[21]采用DART-Orbitrap MS对蜂胶中黄酮类成分和其他酚类成分进行分析,研究发现,在250 ℃这2类成分在负离子模式下基质效应少,而在正离子模式下可鉴定出多种化学成分,此外,应用DART-MS分析一个蜂胶样品约30 s,具有快速分析的特点。Wang等[17]应用DART-MS技术定性分析黄芩中黄酮类成分,通过黄芩中主要活性成分黄芩素与汉黄芩素的峰优化气体温度,并根据碎裂过程对其电离机制进行讨论,发现黄酮类成分在正离子模式下(200 ℃)响应较好。Huang等[22]利用演化气体分析(evolved gas agalysis,EGA)-质谱联用仪与DART-MS联用对蜂胶进行分析,结果显示在300~550 ℃,部分黄酮苷类、酚甘油酯和蜂蜡响应度较好。以上表明,DART-MS技术在中药黄酮类成分定性定量时,最佳温度在200~300 ℃。因黄酮类成分研究结果较少,未能充分反映最佳检测黄酮类成分的范围,故在确定温度时,需根据化合物的性质确定温度,防止因温度低导致的解析不充分,同时防止因温度过高导致样品分解与碳化的问题[20]。黄酮类成分母核均含有3个环,其中C环为杂氧环,同时含有一个醚键和一个羟基键,易发生断裂,故在正/负离子模式下均有较高的响应,其中多甲氧基黄酮在黄酮母核的基础上被不同数量的羟基或甲氧基取代,在电离过程中,倾向于丢失甲基、水等中性小分子,如[M+H-H2O]+,故在正离子模式下有较好的响应强度。
2.3 苷类
苷类成分具有止咳祛痰、抗炎平喘等功效[23]。Liu等[24]通过对人参中人参皂苷甲基衍生化处理,采用DART-MS分析人参皂苷Rb1、Rd、Re、Rf和Rg1的甲基化产物,样品在甲基化后无需进一步纯化即可检测,进一步利用固相甲基化方法制备氘代甲基化人参皂苷,并将其作为内标进行定量分析,以上表明DART-MS技术通过联合甲基化和氘代内标技术能够对人参皂苷快速定量分析。Huang等[22]利用EGA-质谱联用仪与DART-MS联用分析蜂胶,结果显示300~550 ℃部分黄酮苷类成分的响应度较好,在蜂胶样品中,黄酮苷元及其糖苷占总黄酮的52.6%~66.7%,结果也表明EGA-质谱联用仪与DART-MS联用能够有效分析蜂胶中的主要成分。应用DART-MS技术鉴定化合物时,除了合适的温度,还需要选择适合的正/负离子模式。金欣等[25]使用高效液相色谱-电喷雾质谱探讨加和离子的形成机制,发现苷类成分在正离子模式下响应更强,因苷类成分以质子化分子离子[M+H]+或阳离子加合物[M+NH4]+、[M+Na]+和[M+K]+的形式被检测,而在负离子模式下仅检测到[M-H]−的形式,表明苷类成分的检测模式选择与苷元的分子结构相关。
2.4 挥发油类
中药挥发油具有抗炎、抗过敏、驱虫等作用[26]。DART-MS技术在含有挥发油类中药质量检测中的应用见表2,Maleknia等[27]应用DART-MS对桉树中挥发性成分进行研究,在较低温度(50~100 ℃)下,丙酮、乙醇、甲醇和低沸点萜烯类响应度较高,而在较高温度(100~200 ℃)下,检测沸点较高的萜烯和含量较少的化合物。陈志永等[28]以东莨菪素等为鉴别指标性成分,采用DART结合离子阱质谱建立了一种大果飞蛾藤药材的快速鉴别方法。Huang等[22]利用EGA-质谱联用仪与DART-MS联用对蜂胶进行分析,发现在120~160 ℃,萜类成分响应较高;且通过萜类成分的含量能够对不同产区的蜂胶进行有效区分。Bajpai等[29]利用DART-MS分析数据与PCA分析相结合的方式可有效区分不同品种的蒌叶。该方法同样用于芫荽、罗勒和绿薄荷中挥发性成分的鉴定[30],区分荜澄茄果、当归、川芎[31-32]等的不同品种与产地等。综上,DART-MS可应用于中药挥发性成分的定性分析。挥发性成分根据沸点的不同,在较低温度下低沸点的挥发性成分100 ℃响应度较高,高沸点的挥发油类响应度较高时,对应的最佳温度为300 ℃。

表2 DART-MS技术在挥发油类中药材中的应用
2.5 有机酸类
有机酸是中药的药效成分之一,如绿原酸等,具有抗菌、消炎、治疗心脑血管等作用[33]。DART-MS技术已应用于中药有机酸的研究。孙磊等[34]应用DART-MS技术在未经前处理和色谱分离的情况下快速鉴别乳香中乳香酸类成分,发现DART-MS法能够迅速准确鉴别乳香中的特征成分,且无需对照,但对比色谱分离的样品,未经处理的样品难以区分相同化学式的同分异构体。陈志永等[28]发现DART-MS可用于大果飞蛾藤药材的定性鉴别。该方法同样已实现鉴定厚叶岩白菜的有机酸类[35]、丁公藤中的绿原酸[29]及蜂胶中的酚酸[22]等。Huang等[22]利用EGA-质谱联用仪与DART-MS联用对蜂胶进行分析,结果显示在160~300 ℃,酚酸类成分的响应度较好。检测有机酸时,若化合物的挥发性较差,则其在较高温度下才能解析,需选择相对较高的温度[34]。在正/负离子模式选择上,因有机酸类含有一个-COOH基团,易脱H,故在负离子模式时离子响应度更高。断裂过程中,通常先脱去H2O、CO、COOH、HCOOH、CH3、CH3O等,并产生相应的碎片离子。若有机酸中除含有羧基外,亦包含其他基团,如氨基等,需要根据基团的影响强弱和不同离子模式背景下的复杂度和噪声高低来决定。李无双等[36]采用DART-MS技术对桑叶中γ-氨基丁酸进行定性定量分析,研究表明最佳响应温度为500 ℃,检测模式为正离子模式化学成分响应较好,且基质效应少[37],由于该技术进样前无样品前处理过程,极大地缩短了分析时间。另外,γ-氨基丁酸采用DART-MS检测时氨基比羧基可更快的离子化。综上,DART-MS技术用于大批量桑叶样品中γ-氨基丁酸含量测定,可以实现实验室高通量分析。
2.6 多糖类
多糖类是中药中一个重要的化学基团,具有抗癌、细胞识别、抗病毒等特性[38]。糖类成分自身极性大、亲水作用力强、黏性大,且糖类成分分子中多含有羟基,在裂解过程中单糖容易丢失CO、H2O、C3H6O3、C4H8O4等,而低聚糖中的单糖结构易整体丢失,同时伴随CO、C3H6O3等小分子的脱落,故低聚糖和多糖在负离子模式下响应更好。但单糖和双糖因其易与氨形成加合物[M+NH4]+,在正离子模式也能获得较好的响应度。Liu等[24]采用DART-MS技术研究不同类型的糖类,如单糖、双糖和三糖在不同温度下以正离子模式进行检测。通过气体温度的升高,易观察到单糖、双糖标准的糖簇和氨加合物[M+NH4]+。然而,三糖和人参低聚糖提取物在DART-MS检测时,难以在未衍生化的情况下形成氨加合物[M+NH4]+,故在检测三糖等成分时,应先进行衍生化处理。蒋青等[39]采用DART-MS和机械力化学提取法相结合测定黄芪、银耳、百合、茯苓、鼓槌石斛、金钗石斛、铁皮石斛和党参8种中药多糖,结果表明机械力化学提取法与DART-MS相结合可简单、快速、高通量的从复杂多糖大分子中获取特征指纹图谱,为其他天然药物多糖类成分的鉴别提供了新思路。
2.7 其他
Chernetsova等[35]采用简化的DART离子源结合高分辨率质谱以负离子模式鉴定了青海岩白菜生叶中的酚类成分;DART技术同样应用于白芷[40]、肉桂[41]、朝鲜当归[32,42]等中药中香豆素类成分的鉴别与定量等分析,及五味子中木脂素[43]、五味子素[44]等的测定,以上表明,DART技术是一种研究中药快速鉴别及定量方法,能够为中药安全评价提供理论依据。
中药的质量安全取决于所含的药效成分和有害的杂质部分[45],在质量控制领域,DART-MS技术已应用于中药中有害物质与农药残留等快速检测与分析。Vaclavik等[46]和Busman等[47]采用DART和高分辨质谱联用检测了小麦、玉米中的多种真菌毒素,并对其进行快速定量分析,结果表明,DART-MS可用于检测中药中的毒素。此外,该方法已用于检测玉米中的黄曲霉毒素B1[48]、蜂蜜中的5-羟甲基糠醛[49]与氯霉素等[50]。Wang等[51]采用DART与气相色谱-质谱联用的方式检测出稻壳中的次氯酸钠氧化产物。Shen等[18]采用DART-MS鉴定出八角茴香中的莽草毒素。Schurek等[52]指认了小麦中的杀菌剂嘧菌酯和吡唑醚菌酯等。Danhelova等[53]采用DART-TOF-MS方法对不同咖啡样品中的咖啡因进行了定量研究。黄鑫等[45]采用DART对中药中的农药残留进行分析,针对100多种农药残留成分展开了快速检测,发现多种农药残留在DART电离过程中形成加合离子,并能够产生碎片离子。综上,通过DART与其他检测技术联合,在中药质量安全控制中具有重要作用,并已具备实现定量分析基础,为中药的质量安全保障提供了一种新的方法,表明该技术在中药质量研究领域具有广阔的发展空间与应用前景。
3 结语与展望
随着中药的市场需求增大,亟需建立高效、精准的质量评价体系,DART-MS因其样品前处理简单、分析时间短等优势已成为一种科学分析中药化学成分的新方法,在多种中药的化学成分分析中已积累了应用经验。采用DART-MS研究中药时,解析气体的温度与正负离子模式是影响其实验结果的主要因素。其中,解析气体温度设定取决于化合物的理化性质,若化合物属于热稳定类,气体温度高有利于化学成分解析并获得更高的离子响应度;若化合物为热不稳定类,解析气体温度过高可能导致信号降低甚至消失等。若化合物易结合质子,则正离子模式下相应较好,若倾向脱H,则在负离子模式下响应较好。综上,DART-MS技术主要具备以下4点优势。
(1)无需制样具备直接检测中药材物质基础优势,如孙磊等[34]使用DART-MS技术检测乳香中的乳香酸类成分,无需前期制样能够获得乳香的特征图谱,具有明显的指纹特征,且与文献报道的电喷雾离子源结果一致。Yao等[54]通过DART-MS技术定量分析金银花提取物中的绿原酸,所得结果与高效液相色谱结果一致。(2)具备同时分析水溶性与脂溶性成分的特点。Huang等[22]使用DART-MS结合分析热技术分析中国粗蜂胶的成分,同时分析出多种水溶性和脂溶性成分,获得了萜类成分、碳氢化合物、类黄酮类和酚酸类等成分的特征图谱,为全面快速揭示中药成分提供了新的方向。(3)程序升温分析中药物质组成基础,获取更丰富的化合物信息。Maleknia等[27]使用DART-MS通过调整温度梯度为100、200、300 ℃研究挥发性有机化合物。在100 ℃的条件下获得的成分是一系列反应性烃;在200 ℃的条件下主要获取相对较高沸点的植物特异性萜类;当温度大于300 ℃时主要是植物纤维进行热解析后产生的成分。该研究表明DART-MS具有在不同温度鉴别分析出不同类别的化合物的特点,从而实现快速分析中药化学成分的目的。(4)与多元统计方法联合实现中药质量快速鉴别。通过DART-MS技术在几秒内获取化合物信息,打破了传统药物分析周期长的局限,将化合物数据导入多元统计方法模型中,能够快速实现中药质量的鉴别,故开发内置多元统计方法的工具能够实现快速鉴别中药目标,将成为现场鉴别中药质量的重要工具之一。农药残留是影响中药安全问题之一,DART-MS技术已应用于中药中有害物质与农药残留等检测中,以保证中药的安全,将DART-MS技术与多元统计方法联合设置中药的有害物质与农药残留的含量等级标准,并为开发便携式鉴别中药质量的设备提供了思路。
DART-MS技术用于研究中药的质量具有诸多优势,目前仍存在一些局限性[8],如DART在检测时检测环境对其干扰较大,中药有效成分容易疏漏,难以实现同一个条件下检出所有有效成分;对化学成分进行定量分析的手段需要优化等;此外,DART-MS缺少匹配数据库,后续分析未知化合物耗时较多。针对以上问题,建议开发更精确的进样装置,或特异性结合的解析电离方法,建立其对应的数据库,进一步拓展其在中药材领域的应用。
随着DART离子源技术革新,并与新技术联合使用的开发,DART离子源在中药质量控制与鉴别领域将会有广阔的应用前景。通过DART离子源对目标中药进行全成分分析与特征图谱的建立,与便携式质谱仪结合有望对中药现场鉴定与质量提供保证。中药的质量与药效密切相关,不同产地的中药药效存在差异,从中药的特征性成分确定中药质量,快速鉴别中药的质量,已成为研究热点。中药由于其复杂性,使得样品预处理在常规分析中发挥着不可或缺的作用。DART-MS为中药研究提供了一个新契机,只需很少甚至无需样品预处理和液相色谱分离,极大缩短了总分析时间和消耗量。随着DART技术的发展,DART的更广泛和深入的应用,如高通量分析、快速定量、中药代谢物成像和快速非法添加剂筛选,将在未来的高效中药研究中得到有趣的尝试。
利益冲突 所有作者均声明不存在利益冲突
[1] 马双成, 王莹, 魏锋. 中药质量控制未来发展方向的思考 [J]. 中国药学杂志, 2021, 56(16): 1273-1281.
[2] 马聪玉, 生宁, 李元元, 等. 中药成分质谱分析新技术和新策略进展[J]. 质谱学报, 2021, 42(5): 709-717.
[3] 刘星, 王玲, 姚帅, 等. 高效薄层色谱、薄层质谱和HPLC指纹图谱联用技术鉴定杜仲不同部位的化学成分差异[J/OL]. 中草药, [2022-05-16]. http://kns.cnki. net/kcms/detail/12.1108.R.20220513.1319.004.html.
[4] 杨彩静, 曹人郦, 赵颖, 等. 气相色谱法同时测定扎冲十三药材中6种挥发性成分的含量 [J]. 中国药房, 2019, 30(12): 1650-1654.
[5] Smoluch M, Mielczarek P, Silberring J. Plasma-based ambient ionization mass spectrometry in bioanalytical sciences [J]., 2016, 35(1): 22-34.
[6] 徐斌. DART-MS法快速测定桑叶中的DNJ含量及对环状多羟基化合物的电离行为研究 [D]. 镇江: 江苏科技大学, 2015.
[7] Hajslova J, Cajka T, Vaclavik L. Challenging applications offered by direct analysis in real time (DART) in food-quality and safety analysis [J]., 2011, 30(2): 204-218.
[8] 张佳玲, 霍飞凤, 周志贵, 等. 实时直接分析质谱的原理及应用 [J]. 化学进展, 2012, 24(1): 101-109.
[9] 李元政, 胡文忠, 萨仁高娃, 等. 天然植物提取物的抑菌机理及其在果蔬保鲜中的应用 [J]. 食品与发酵工业, 2019, 45(14): 239-244.
[10] Singh S, Verma S K. Study of the distribution profile of piperidine alkaloids in various parts ofby the application of direct analysis in real time mass spectrometry (DART-MS) [J]., 2012, 2(5): 206-209.
[11] Singh A, Bajpai V, Srivastava M,. Rapid screening and distribution of bioactive compounds in different parts ofusing direct analysis in real time mass spectrometry [J]., 2015, 5(5): 332-335.
[12] 王洋, 李乐乐, 李波, 等. DART-Orbitrap质谱法快速定性定量分析延胡索 [J]. 中成药, 2015, 37(6): 1279-1283.
[13] 孙磊, 胡晓茹, 刘丽娜, 等. 实时直接分析-串联质谱法(DART-MS/MS) 快速检测吐根中生物碱 [J]. 中国中药杂志, 2012, 37(10): 1426-1430.
[14] Zhu H B, Wang C Y, Qi Y,. Rapid quality assessment ofusing direct analysis in real time mass spectrometry [J]., 2012, 752: 69-77.
[15] Lesiak A D, Cody R B, Dane A J,. Plant seed species identification from chemical fingerprints: A high- throughput application of direct analysis in real time mass spectrometry [J]., 2015, 87(17): 8748-8757.
[16] Kumar S, Bajpai V, Singh A,. Rapid fingerprinting ofspecies using direct analysis in real time mass spectrometry combined with principal component analysis for their discrimination [J]., 2015, 7(14): 6021-6026.
[17] Wang Y, Li C M, Huang L,. Rapid identification of traditional Chinese herbal medicine by direct analysis in real time (DART) mass spectrometry [J]., 2014, 845: 70-76.
[18] Shen Y, van Beek T A, Claassen F W,. Rapid control of Chinese star anise fruits and teas for neurotoxic anisatin by direct analysis in real time high resolution mass spectrometry [J]., 2012, 1259: 179-186.
[19] 姜玥, 刘洋洋, 田海涛, 等. 桑属植物中异戊烯基黄酮类化合物及其药理活性研究进展[J]. 中草药, 2022, 53(21): 6948-6958.
[20] 李乐乐, 郭云龙, 刘文龙, 等. DART-Orbitrap质谱法对黄芩药材的快速分析 [J]. 分析测试学报, 2016, 35(7): 859-863.
[21] Chernetsova E S, Bromirski M, Scheibner O,. DART- Orbitrap MS: A novel mass spectrometric approach for the identification of phenolic compounds in propolis [J]., 2012, 403(10): 2859-2867.
[22] Huang Y L, Huang Z P, Watanabe C C,. Combined direct analysis in real-time mass spectrometry (DART- MS) with analytical pyrolysis for characterization of Chinese crude propolis [J]., 2019, 137: 227-236.
[23] 任嘉佳, 杨兴, 吴石丽,等. 荔枝核的化学成分及生物活性研究[J]. 中草药, 2022, 53(24): 7664-7671.
[24] Liu W L, He Y F, Li L L,. Fast quantitative analysis of ginsenosides in Asian ginseng (C. A. Mayer) by using solid-phase methylation coupled to direct analysis in real time [J]., 2016, 30(Suppl 1): 111-115.
[25] 金欣, 张淑芬, 杨锦宗. 烷基多苷高效液相色谱-电喷雾质谱行为的研究 [J]. 质谱学报, 2007, 28(3): 179-184.
[26] 林波. 挥发油及其活性成分组合与富马酸钠共同添加对体外瘤胃发酵和湖羊养分消化的影响 [D]. 杭州: 浙江大学, 2011.
[27] Maleknia S D, Vail T M, Cody R B,. Temperature- dependent release of volatile organic compounds of eucalypts by direct analysis in real time (DART) mass spectrometry [J]., 2009, 23(15): 2241-2246.
[28] 陈志永, 杨媛媛, 崔小敏, 等. 实时直接分析质谱法快速鉴别大果飞蛾藤药材 [J]. 西部中医药, 2021, 34(2): 32-34.
[29] Bajpai V, Sharma D, Kumar B,. Profiling ofLinn. cultivars by direct analysis in real time mass spectrometric technique [J]., 2010, 24(12): 1283-1286.
[30] Musah R A, Domin M A, Walling M A,. Rapid identification of synthetic cannabinoids in herbal samples via direct analysis in real time mass spectrometry [J]., 2012, 26(9): 1109-1114.
[31] Kim H J, Baek W S, Jang Y P. Identification of ambiguous cubeb fruit by DART-MS-based fingerprinting combined with principal component analysis [J]., 2011, 129(3): 1305-1310.
[32] Lee S M, Kim H J, Jang Y P. Chemometric classification of morphologically similar Umbelliferae medicinal herbs by DART-TOF-MS fingerprint [J]., 2012, 23(5): 508-512.
[33] 汤喜兰, 刘建勋, 李磊. 中药有机酸类成分的药理作用及在心血管疾病的应用 [J]. 中国实验方剂学杂志, 2012, 18(5): 243-246.
[34] 孙磊, 胡晓茹, 金红宇, 等. 实时直接分析-串联质谱法快速分析乳香中多种乳香酸 [J]. 中草药, 2012, 43(7): 1320-1323.
[35] Chernetsova E S, Crawford E A, Shikov A N,. ID-CUBE direct analysis in real time high-resolution mass spectrometry and its capabilities in the identification of phenolic components from the green leaves ofL [J]., 2012, 26(11): 1329-1337.
[36] 李无双, 郎文成, 马琳, 等. 用实时直接分析质谱法(DART-MS) 快速测定桑叶中的γ-氨基丁酸含量 [J]. 蚕业科学, 2018, 44(4): 567-572.
[37] 屠钰, 李无双, 朗文成, 等. 串联质谱法实时直接测定茶叶中γ-氨基丁酸含量 [J]. 分析化学, 2020, 48(9): 1252-1259.
[38] 陈慧颖, 韦体, 贾翼玮, 等. 多糖类物质的提取分离、结构鉴定及其生物活性研究进展 [J]. 生物化工, 2021, 7(4): 171-174.
[39] 蒋青, 李红丽. 实时直接分析质谱分析中草药多糖 [J]. 分析测试学报, 2021, 40(2): 288-294.
[40] 李永生, 杨媛媛, 陈志永. 实时直接分析质谱法快速鉴别白芷药材 [J]. 辽宁中医杂志, 2018, 45(3): 587-589.
[41] Avula B, Smillie T J, Wang Y H,. Authentication of true cinnamon () utilising direct analysis in real time (DART)-QToF-MS [J]., 2015, 32(1): 1-8.
[42] Kim H J, Seo Y T, Park S I,. DART-TOF-MS based metabolomics study for the discrimination analysis of geographical origin ofroots collected from Korea and China [J]., 2015, 11(1): 64-70.
[43] Guo Y L, Chi H Y, Liu X K,. Rapid characterization ofspecies by using direct analysis in real time mass spectrometry [J]., 2021, 192: 113648.
[44] Kim H J, Jee E H, Ahn K S,. Identification of marker compounds in herbal drugs on TLC with DART-MS [J]., 2010, 33(9): 1355-1359.
[45] 黄鑫, 刘文龙, 张勇, 等. 敞开式离子化质谱技术在中草药研究中的应用 [J]. 质谱学报, 2017, 38(1): 1-10.
[46] Vaclavik L, Zachariasova M, Hrbek V,. Analysis of multiple mycotoxins in cereals under ambient conditions using direct analysis in real time (DART) ionization coupled to high resolution mass spectrometry [J]., 2010, 82(5): 1950-1957.
[47] Busman M, Maragos C M. Determination of T-2 and HT-2 toxins from maize by direct analysis in real time mass spectrometry [J]., 2015, 8(4): 489-497.
[48] Busman M, Liu J H, Zhong H J,. Determination of the aflatoxin AFB1 from corn by direct analysis in real time-mass spectrometry (DART-MS) [J]., 2014, 31(5): 932-939.
[49] Elena S C, Gertrud E M. Assessing the capabilities of direct analysis in real time mass spectrometry for 5- hydroxymethylfurfural quantitation in honey [J]., 2012, 314: 22-32.
[50] Li X Q, Li H M, Xu S,. Rapid quantification of trace chloramphenicol in honey under ambient conditions using direct analysis via real-time QTRAP mass spectrometry [J]., 2019, 276: 50-56.
[51] Wang S Z, Fan X, Zheng A L,. Evaluation of the oxidation of rice husks with sodium hypochlorite using gas chromatography-mass spectrometry and direct analysis in real time-mass spectrometry [J]., 2014, 47(1): 77-90.
[52] Schurek J, Vaclavik L, Hooijerink H D,. Control of strobilurin fungicides in wheat using direct analysis in real time accurate time-of-flight and desorption electrospray ionization linear ion trap mass spectrometry [J]., 2008, 80(24): 9567-9575.
[53] Danhelova H, Hradecky J, Prinosilova S,. Rapid analysis of caffeine in various coffee samples employing direct analysis in real-time ionization-high-resolution mass spectrometry [J]., 2012, 403(10): 2883-2889.
[54] Yao X H, Xu J Y, Hao J Y,. Microwave assisted extraction for the determination of chlorogenic acid inby direct analysis in real time mass spectrometry (DART-MS) [J]., 2018, 1092: 82-87.
Application progress on direct analysis in real time-mass spectrometry in quality study of traditional Chinese medicine
HU Shuang-fei, ZHANG Ao, WANG Yong-gang, SU Wei-wei
School of Life Science, Guangdong Engineering and Technology Research Center for Quality and Efficacy Re-Evaluation of Post-Marketed TCM/Guangdong Key Laboratory of Plant Resources, Sun Yat-Sen University, Guangzhou 510275, China
The properties of traditional Chinese medicine are determined by its chemical composition. Qualitative and quantitative analysis based on effective, characteristic and harmful components has been commonly used for accessing medicinal ingredients and evaluating the quality of traditional Chinese medicine. Direct analysis in real time-mass spectrometry (DART-MS) technique allows rapid, direct and on-site detection with minimal-to-no sample preparation. Thus, the introduction of which is conductive to evaluation of the stability and security for the quality of traditional Chinese medicine. The technique needs no or only simple sample treatment, and has the characteristics of fast, direct and on-site detection. The application of DART-MS technology in the quality research of traditional Chinese medicine was reviewed to provide reference for the application of this technology in the field of traditional Chinese medicine.
direct analysis in real time-mass spectrometry; active ingredient; component analysis; quality of traditional Chinese medicine; rapid analysis
R284
A
0253 - 2670(2023)13 - 4377 - 08
10.7501/j.issn.0253-2670.2023.13.031
2022-12-07
“十四五”广东省农业科技创新十大主攻方向“揭榜挂帅”项目(2022SDZG07)
胡双飞(1992—),女,博士研究生,研究方向为天然产物研究。E-mail: hushf8@mail2.sysu.edu.cn
通信作者:苏薇薇,博士生导师,教授,从事创新药物研制、中药上市后再评价及中药国际化研究。E-mail: lsssww@126.com
[责任编辑 赵慧亮]
