基于细胞亲和的抗瘢痕纳米经皮给药制剂研究进展
2023-07-06庄泽槟刘冬榕姚碧金覃楚悦
庄泽槟,刘冬榕,姚碧金,覃楚悦,时 军, 2*
基于细胞亲和的抗瘢痕纳米经皮给药制剂研究进展
庄泽槟1,刘冬榕1,姚碧金1,覃楚悦1,时 军1, 2*
1. 广东药科大学中药学院,广东 广州 510006 2. 广东省局部精准递药制剂工程技术研究中心,广东 广州 510006
瘢痕是各种创伤所引起的正常皮肤组织外观形态和组织病理变化的总称,严重影响患者的容貌,且易引起肢体功能障碍和不适等。细胞亲和性是药物制剂能否在疾病部位稳定释放并充分发挥疗效的主要影响因素。伤口愈合过程的复杂性导致瘢痕的形成受到多种因素的影响,基于细胞亲和性能设计瘢痕治疗的纳米靶向经皮给药制剂,可有效提高治愈率。通过对细胞亲和性设计的防治瘢痕纳米靶向经皮制剂进行综述,为更多瘢痕防治策略的开发与临床应用提供参考。
纳米靶向制剂;细胞亲和;经皮给药;瘢痕;脂质体;纳米粒;微乳;外泌体
瘢痕是人体皮肤在遭受创伤后所引起的一系列外观形态及组织病理变化的统称,包括生理性和病理性瘢痕。病理性瘢痕是皮肤不正常愈合引起的纤维增生异性疾病,主要分为增生性瘢痕和瘢痕疙瘩,常发生在烧伤、创伤、手术甚至是蚊虫叮咬之后,据报道烧伤后增生性瘢痕发生率高达70%[1-2],瘢痕疙瘩的发病率为4.5%~16%[3]。瘢痕的存在严重影响患者容貌和形象,尤其是伴有瘙痒疼痛等症状的病理性瘢痕,极大降低了患者的生活质量,给患者带来心理和经济负担,因此瘢痕防治及其医学研究具有重要的社会和经济价值,设计具有高效防治病理性瘢痕、诱导伤口正常愈合的治疗策略尤为重要。
1 瘢痕的防治手段
现阶段临床上对于病理性瘢痕的治疗主要有手术、物理和药物治疗等手段[4]。手术治疗适用于瘢痕增生面积较大、症状明显的患者,对成纤维化结缔组织进行切除,然而其复发率高达45%以上,手术也可能造成二次创伤,临床上常根据患者情况联合其他手段治疗[5]。物理治疗包括压力、激光、冷冻及放射治疗等。压力治疗通过加压抑制瘢痕发展,但顺应性低,压力难以恒定[6];激光治疗可改善瘢痕质地及柔软度,缓解瘙痒症状,但存在复发率高的缺点[7];冷冻治疗通过利用冷冻剂破坏细胞和微血管,造成组织缺氧坏死而脱落,只适用于小面积瘢痕组织[8];放射治疗通过电离辐射对成纤维细胞和瘢痕组织中的血管内皮产生破坏作用,使得胶原产生减少,存在小概率致癌作用[9]。
而中药治疗瘢痕具有悠久历史及丰富经验,是目前瘢痕治疗的主要手段。临床上用于瘢痕防治的药物包括:细胞外基质靶向药物(糖皮质激素、甲苯吡啶酮、胶原酶等)、细胞靶向药物[5-氟尿嘧啶(5-fluorouracil,5-FU)、博来霉素、维甲酸、秋水仙碱等)及生化微环境靶向药物(生长因子调节药物、他克莫司、干扰素、积雪苷等)][5]。在瘢痕治疗的给药方式上,主要包括口服、注射和经皮3种途径:口服药物首关效应明显,不良反应较大,常需与其他疗法联合使用以提升疗效;注射治疗可准确局部给药,但进行注射时需有专业人员和设备,在家庭使用上较为不便,顺应性低;而药物经皮制剂具有可避免首关效应、延长药物作用时间及操作方便等优势,是防治瘢痕的优选手段,可通过靶向递药的经皮制剂高效调控瘢痕形成。
2 瘢痕的形成机制
广义上讲,瘢痕是深度创伤、烧烫伤修复的必然产物。瘢痕形成是一个复杂的动态过程,涉及成纤维细胞、肥大细胞等主要细胞的增殖、分化、迁移与凋亡,信号传导和蛋白质表达等过程,经历炎症、增殖、重塑3个阶段对伤口进行修复而形成。
2.1 炎症阶段
炎症阶段发生于机体受到创伤后,一般持续2~3 d。皮肤受到创伤刺激后,伤口部位组织屏障功能受到破坏,毛细血管损伤,处于缺氧缺血环境。伤口会形成止血栓塞,主要是由纤维蛋白和纤维连接蛋白组成的纤维蛋白凝块,作为防御外源性病原体的屏障;同时血小板脱颗粒大量聚集,转化生长因子-α(transforming growth factor-α,TGF-α)、TGF-β、表皮生长因子、血小板衍生因子(platelet derived growth factor,PDGF)等被释放,通过趋化作用招募中性粒细胞、肥大细胞、巨噬细胞等炎症细胞诱导细胞迁移到伤口处发挥作用,进而引发炎症反应[10]。炎症反应在几天内开始减退,同时巨噬细胞在吞噬病原体和细胞碎片后凋亡,少数转化为M2巨噬细胞,推动伤口愈合进入下一阶段。
2.2 增殖阶段
增殖阶段发生于炎症阶段之后,可持续3~6周。伤口修复进入增殖阶段后,M2巨噬细胞释放PDGF、TGF-β和血管内皮生长因子等因子促进角质形成细胞、成纤维细胞及内皮细胞进行增殖和迁移,同时加速血管生成、再上皮化和胶原蛋白的产生。其中,成纤维细胞可分泌III型胶原蛋白和细胞外基质(extracellular matrix,ECM)为细胞提供黏附结构和分化框架,且在增殖阶段后期分化为肌成纤维细胞[10];肌成纤维细胞含有肌动蛋白纤维,具收缩特性,能够诱导胶原蛋白聚拢,加速伤口收缩。与正常伤口的愈合过程相比,病理性瘢痕组织在增殖阶段中的成纤维细胞过度增殖、分化,III型胶原、纤连蛋白、层黏连蛋白、骨膜及黏蛋白的转录和翻译水平更高。
2.3 重塑阶段
在细胞增殖和ECM合成后,伤口愈合进入重塑阶段,一般持续数月至1年。重塑阶段的特征是细胞增殖减少,大多数内皮细胞、巨噬细胞和肌成纤维细胞凋亡,在胶原酶和基质金属蛋白酶(matrix metalloproteinases,MMPs)的作用下I型胶原取代III型胶原[11]。此阶段中创伤愈合的肉芽组织中肌纤维细胞发生凋亡,当其增殖与凋亡达到平衡,即表现为形成成熟的瘢痕;相反地,当增殖与凋亡失去平衡时,将向病理性瘢痕发展。瘢痕增生作用机制见图1。
3 基于细胞亲和的抗瘢痕纳米经皮递药系统
药物制剂经皮治疗是防治瘢痕的优选手段,而制剂材料的亲和性是影响药物能否在疾病部位持续释放并充分发挥疗效的主要因素。制剂材料的细胞亲和性是指制剂材料对细胞的黏附及影响细胞生长的能力。对细胞的黏附是制剂材料细胞亲和性的基础,其黏附过程由细胞与材料间的物理、化学作用(范德华力、离子力等)引起,与材料的表面亲水性、疏水性、表面电荷及化学组成等因素有关。细胞具有丰富而复杂的表面化学成分如蛋白质、脂类及糖类等,允许细胞对生物材料做出响应,为设计瘢痕防治的高细胞亲和性经皮制剂提供了思路与生物基础。
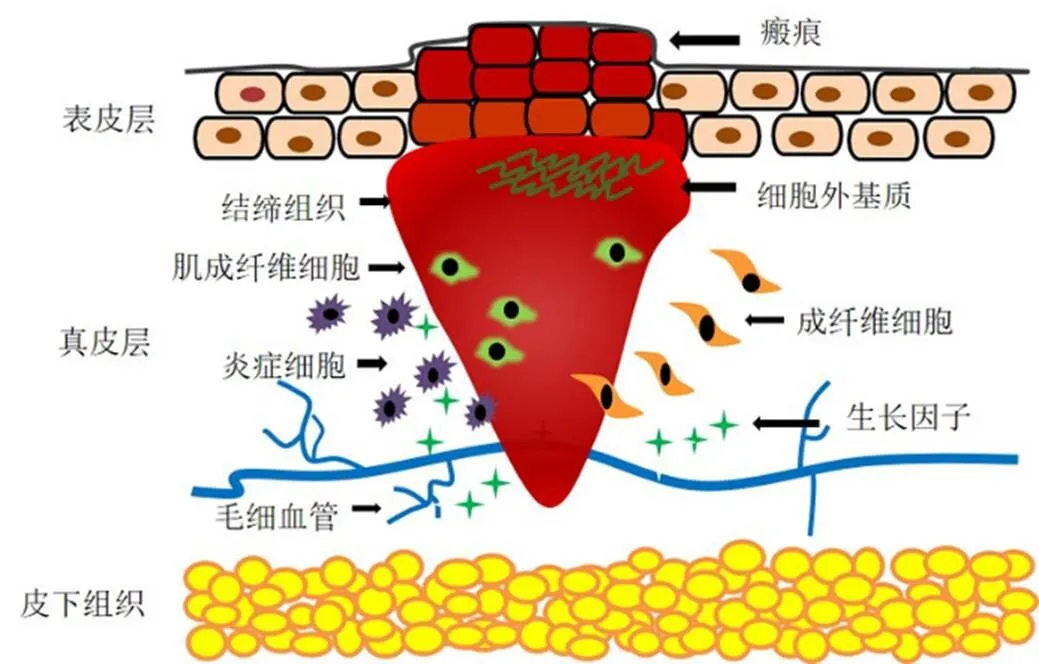
图1 瘢痕增生的作用机制
随着纳米技术的发展,从疾病发生机制出发、基于细胞表面成分高亲和性的靶向纳米制剂被广泛应用于癌症治疗、伤口愈合等临床治疗。目前纳米制剂的研究主要集中于脂质体、纳米粒、微乳及外泌体。基于细胞亲和设计治疗疾病的纳米靶向给药制剂,可促进制剂与病变细胞的桥接与融合,提高药物在病变组织中浓度和疗效,同时减少用药剂量、降低药物对正常组织的副作用。从瘢痕形成机制出发,研发出高细胞亲和性的靶向纳米经皮制剂是提高瘢痕防治效率的有效策略,具有广泛的应用前景。
3.1 脂质体
脂质体是将药物包封于脂质双分子层内而形成的微小囊泡,被称为“人工生物膜”,其结构与皮肤细胞膜类似,具有良好的生物相容性和细胞亲和性,可增加药物溶解度、促进药物渗透、水化保湿及延长药物释放时间,载体的保护作用还可以避免药物被破坏[12],在瘢痕的局部治疗方面具有应用潜力。
脂质体与皮肤细胞融合而产生透皮作用的机制有3种[13]:(1)通过表皮渗透或附属器途径进入体内参与血液循环;(2)脂质体磷脂与角质层脂质融合,使皮肤屏障的作用发生逆转,通过脂质颗粒的间隙进入机体;(3)脂质体通过增强皮肤的水合作用,使角质细胞的间隙增大,药物通过扩散和毛细吸力作用进入机体。用于经皮吸收的脂质体一般包括传递体、醇质体、醇传递体、类脂囊泡、前体脂质体、萜质体等。Zhang等[14]制备由磷脂酰胆碱、5-FU、乙醇和磷酸盐缓冲液组成的5-FU-醇质体,进行体外增生性瘢痕和皮肤渗透研究。经研究测量,24 h后5-FU在瘢痕和皮肤中的积累量由多到少的依次为醇质体-瘢痕、乙醇对照液-瘢痕、醇质体-皮肤、乙醇对照液-皮肤,表明与正常皮肤相比,醇质体可更有效地渗透增生性瘢痕,并且在增生性瘢痕中醇质体比对照溶液更能渗透组织。
传统脂质体仍存在主动靶向性不明显、体内循环时间不足等缺点,需要对材料进行选择或通过表面修饰进行改善,如加入表面活性剂或其他可改变脂质体性能的物质,在膜表面嵌插靶向配体物质,或将配体与膜材偶联共同组成脂质体结构。Shi等[15]将贝伐单抗作为亲细胞配体用于连接脂质体制备具有靶向性的丹皮酚靶向脂质体,当药物经皮给药时,免疫脂质体与成纤维细胞表面受体牢牢结合在一起,与此同时脂质体释放被包裹的丹皮酚,共同作用于瘢痕部位,从而达到稳定的治疗效果,如图2所示。Manosroi等[16]将含木瓜蛋白酶的类脂囊泡负载在凝胶中,并作用于兔耳增生性瘢痕模型。研究发现在治疗28 d后,脂质体组胶原纤维排列较对照组更规则,胶原纤维数量和瘢痕高度显著降低,与正常皮肤相似。类脂囊泡表面带有负电荷,与木瓜蛋白酶结合后整体ζ电位增加,更好地与疾病部位黏附,同时类脂囊泡的高皮肤渗透性导致增生性瘢痕中大量的木瓜蛋白酶积累而降解胶原蛋白。
张小灵[17]用卵磷脂、胆固醇、十八胺制备脂质体搭载双丹方活性成分(丹参素、丹参酮IIA、丹皮酚),并包裹于卡波姆940中形成脂质体凝胶剂,考察其对兔耳增生性瘢痕的防治效果。脂质体系统中的十八胺能够改变脂质体的电性,使脂质体整体带正电,增强与靶细胞的黏附;凝胶系统可降低脂质分子的流动性,防止药物渗出。经抗瘢痕实验研究发现,与空白凝胶组、双丹凝胶组相比,双丹脂质体凝胶组白细胞介素-1β(interlenkin-1β,IL-1β)表达水平均显著降低;与空白凝胶组相比,双丹脂质体凝胶组、双丹凝胶组的TGF-β1表达水平均有显著差异(<0.05),瘢痕增生指数、成纤维细胞数密度指数显著下降。综上表明双丹脂质体凝胶制剂经皮给药可有效防治增生性瘢痕,相较于凝胶制剂,脂质体凝胶防治效果更好。

A-脂质体结构 B-脂质体靶向作用
穿膜肽TAT介导的脂质体载体对脂质体本身的理化性质没有影响,但是可增强脂质体的靶向性,避开细胞膜上外排蛋白的作用,增强制剂的细胞亲和性和药物的跨膜递送,提高皮肤渗透能力和真皮滞留量,提高治疗效果。吴艳婷等[18]利用2种不同相对分子质量的磷脂材料磷脂酰乙醇胺-聚乙二醇(1,2-distearoyl-sn-glycero-3-phosphatidyl ethanolamine-polyethylene glycol,DSPE-PEG)制备脂质体,同时通过迈克尔加成反应合成DSPE-PEG1000-TAT,开发了一种TAT修饰的丹酚酸B脂质体传递系统(salvianolic acid B-TAT- liposome,SAB-TAT-LIP),用于靶向治疗增生性瘢痕,如图3所示。体外释药实验显示SAB-TAT-LIP在1 h内释放率小于40%且无突释效应,24 h该脂质体释放率为62.49%,释放速率低于丹酚酸B脂质体组,具有明显的缓释与控释作用;在透皮吸收实验中,SAB-TAT-LIP在32 h内的累积透过量、真皮层滞留量均高于丹酚酸B组和丹酚酸B脂质体组,具有良好的角质层穿透能力和显著的皮肤滞留效果,可将药物集中于皮肤病灶,以贮库的形式持续释放。
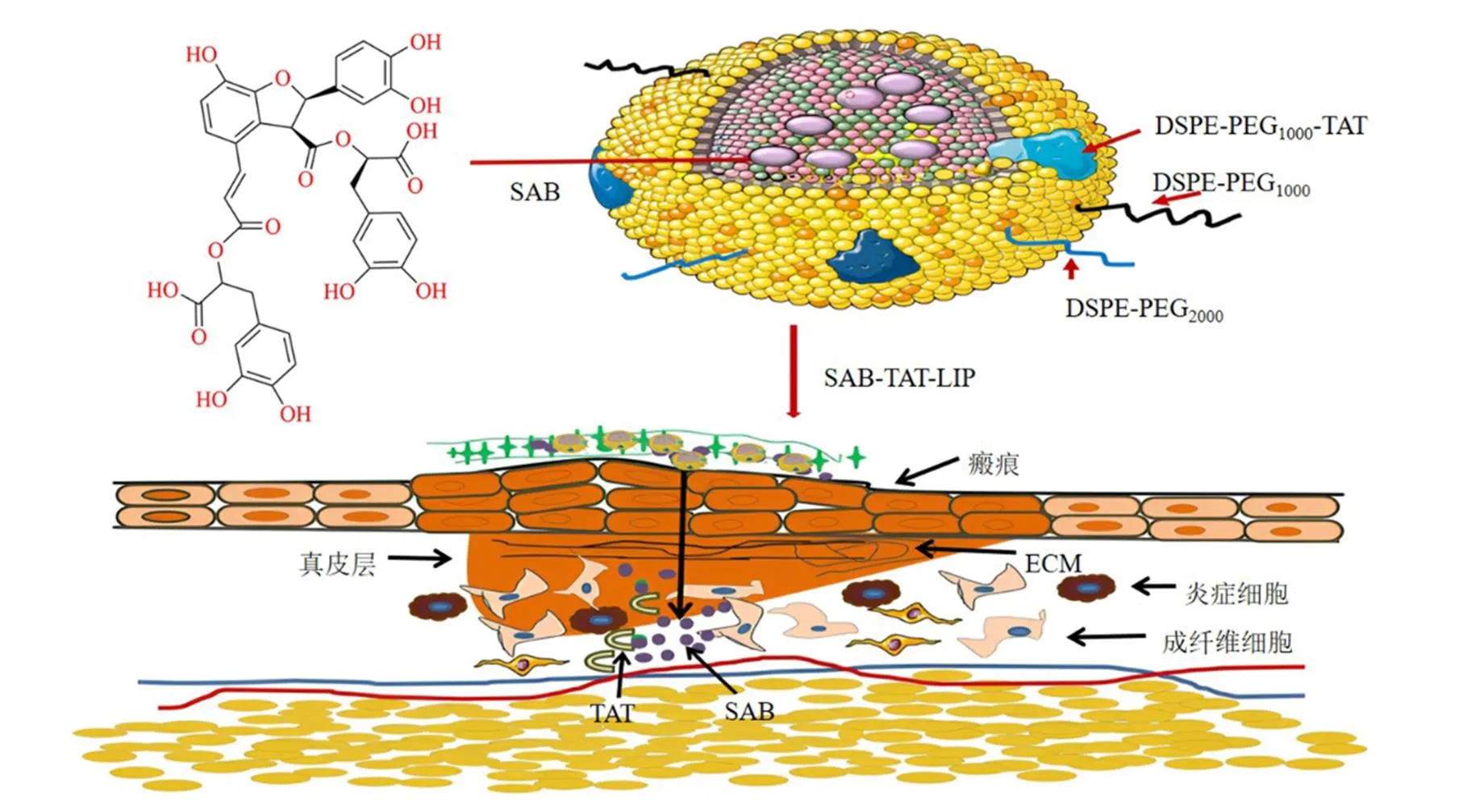
图3 SAB-TAT-LIP防治增生性瘢痕
3.2 纳米粒
纳米粒是将适宜的高分子材料制成粒径在1~1000 nm的固态胶体分散系统,可在皮肤中形成药物储库,使药物缓慢释放,主要分为脂质、聚合物、无机和天然载体纳米粒[19]。纳米粒载体制剂可增强药物溶解度与稳定性、延长药物在体内驻留与循环时间,控制药物释放,提高药物靶向性。
脂质纳米颗粒具有良好的皮肤黏附性,促进药物与角质层的接触,形成单层脂质膜,脂质纳米颗粒在毛细管力下融合变形,在皮肤表面形成疏水膜,增加皮肤的水合作用,减少角质形成细胞的堆积,并扩大角质形成细胞间的间隙,从而增强药物的皮肤渗透[20]。聚合物纳米粒作用于皮肤后,不能被动通过角质层直接扩散到皮肤深处,而是在皮肤角质层表面、沟纹及毛囊口聚集,之后作为药物储库,药物从纳米粒中逐渐释放,使其所包载的药物在某一部位达到较高的局部浓度,药物在浓度梯度下扩散至皮肤的活性层[21]。
由于真皮中成纤维细胞过度增生导致皮肤组织增厚的病理性瘢痕,局部给药的药物不能有效通过这种病理组织渗透到皮肤深处,而纳米粒具有良好的皮肤黏附性,容易对皮肤表面产生密封作用,减少皮肤表面的水分流失,促进药物的透皮吸收,同时可改善靶向性,减少不良反应。Qin等[22]以聚乳酸-乙醇酸为载体材料制备具有良好生物相容性和生物降解性的曲安奈德脂质纳米粒(triamcinolone acetonide-lipid nanoparticles,TAA-LNPs),在系统研究其理化性质的基础上,建立兔耳增生性瘢痕模型,评价TAA-LNPs在体外瘢痕组织中的渗透性,并评价其疗效和皮肤刺激作用。体外瘢痕组织渗透性实验表明,TAA-LNPs对瘢痕组织的渗透率分别是普通脂质体和曲安奈德悬浮液的2倍和40倍,吸收药物的浓度可有效抑制成纤维细胞增殖,对增生性瘢痕有治疗作用,且不刺激完整或受损的皮肤。
纳米粒制剂进入机体后会被当成“外来物”而清除,导致与纳米微粒靶细胞结合亲和力弱,靶组织中沉积量少,一般在纳米粒表面偶联特异性的靶向配体或物理促渗,引导与细胞表面特异性受体结合,配体材料按靶向修饰类型可分为被动、主动及物理靶向:被动靶向配体材料主要有非离子表面活性剂、聚乙二醇等;主动靶向修饰材料包括聚山梨酯在内的表面活性剂、糖类、核酸等;物理靶向材料有超声波、电磁波等响应材料。吴海斌[23]将天然阳离子材料壳聚糖制备成纳米载体,利用电荷作为亲细胞配体增强制剂的细胞亲和性,增强与带负电细胞膜的黏附;将结缔组织生长因子的小干扰RNA(connective tissue growth factor-small interfering RNA,CTGFsiRNA)载入壳聚糖纳米粒中并作用于瘢痕模型,结果显示,载CTGFsiRNA壳聚糖纳米粒在体外对成纤维细胞有着具有较高的转染率且可显著下调mRNA和蛋白表达,抑制增生性瘢痕形成。陈珂等[24]运用可增加细胞膜通透性、实现纳米粒微泡药物缓释、靶向释药的低频超声结合微泡靶向技术,将装载碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)纳米粒微泡与低频超声结合,评价对裸鼠瘢痕疙瘩的作用。结果显示各bFGF处理组瘢痕疙瘩体积和质量、组织形态、细胞凋亡、肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、TGF-β、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、I型胶原蛋白、PTEN/磷脂酰肌醇3-激酶/蛋白激酶B(protein kinase B,Akt)通路蛋白表达均表现出抗瘢痕疙瘩发展的趋势。与对照组、超声空化组相比,各bFGF处理组对裸鼠瘢痕疙瘩均具有明显的治疗作用;与bFGF水溶液组、bFGF纳米微泡组相比,超声+bFGF水溶液组、超声+bFGF纳米微泡组均有统计学差异(<0.05)。表明bFGF纳米微泡能够抑制裸鼠瘢痕疙瘩的生长,通过结合超声物理靶向技术,抗瘢痕疙瘩效果更明显。
3.3 微乳
微乳是由表面活性剂、助表面活性剂、水相和油相按适当比例在溶媒中自发形成的透明或半透明、胶状、各向同性的热力学稳定的液-液分散体系。从结构上,微乳可分为水包油(O/W)型、W/O型和双连续相结构型[25]。作为极具潜力的新型药物载体,微乳具有热力学稳定、可滤过、易于制备和保存,可同时增加不溶性或难溶性药物的溶解度等优点,O/W型微乳可保护易水解的药物,W/O型微乳可使水溶性药物持续释放。
微乳的透皮机制主要有2种:(1)微乳通过角质层实现药物透皮吸收,微乳进入角质层后,疏水部分与角质层相互作用,脂质层双分子结构被破坏,亲脂性药物通过角质层脂质区进入机体;亲水部分与角质层发生水合作用,当微乳水相进入极性区时,角质双分子层的膜内体积增加,界面结构被破坏,角质层对药物的渗透性提高,实现药物渗透吸收。(2)微乳可通过皮肤附属器途径的毛囊、皮脂腺和汗腺实现药物经皮递送。
传统微乳表面没有靶向物质,凭借趋化特性作用于组织,被视为被动靶向微乳;主动靶向微乳是指表面结合有抗体或配体的微乳,包括配体靶向微乳和免疫微乳,在细胞亲和性与靶向性上明显优于被动靶向微乳,配体主要包括各种糖脂或糖蛋白、植物凝集素、肤类激素和其他蛋白质等。透明质酸是一种天然多糖类高分子,可将其分子链中的自由羧基与不同化合物的醇羟基通过酯化反应制成细胞亲和性材料,高媛媛[27]通过对透明质酸进行修饰,成功合成了双亲性透明质酸单甘脂衍生物,并制备了载10,11-亚甲二氧基喜树碱(methylenedioxy- camptothecin,MD-CPT)的纳米微乳。研究发现吞噬载MD-CPT纳米微乳的瘢痕成纤维细胞数量随时间逐渐增多,纳米微乳由胞外扩散到胞内再到细胞核内,直到平衡,表明该纳米制剂作为药物载体在细胞吞噬方面具有良好性能,在载药微乳的靶向作用下,可显著抑制瘢痕疙瘩的产生。吕建华等[28]制备苦参碱微乳用于预防兔耳瘢痕增生,观察兔耳增生性痕病理改变情况。术后28 d瘢痕组织真皮层显著增厚,为周边正常真皮层厚度的3~4倍,胶原纤维多而致密粗大,排列紊乱,可见漩涡状结构和胶原结节,其间有少量炎性细胞。与对照组相比,苦参碱微乳组瘢痕厚度小且炎性细胞较少,说明苦参碱微乳对增生性瘢痕的生长具有一定的抑制作用。Li等[29]制备了积雪草苷微乳并考察其对皮肤瘢痕的治疗效果。体外透皮实验结果表明与普通积雪草苷凝胶、积雪草苷微乳凝胶相比,积雪草苷微乳渗透速度更快,能够长期稳定释放、保持皮下组织药物浓度恒定,具有较高的生物利用度;小鼠皮肤药动学研究显示皮肤局部涂抹给药后,微乳剂和微乳凝胶剂中的积雪草苷在皮肤均能迅速达到峰值,并可长时间保持在相对稳定的水平;通过苏木精-伊红染色和激光扫描共聚焦显微镜观察瘢痕组织,研究积雪草苷微乳的经皮机制,显示该药物主要通过破坏角质层的微结构和皮肤附属器途径发挥对瘢痕的防治作用。
3.4 外泌体
外泌体是由细胞分泌的具有磷脂双分子层结构的颗粒物,直径30~150 nm,携带多种重要的生物物质如核酸、蛋白质和脂质[30],是一种天然的纳米级细胞生物信息传递工具。外泌体具有高稳定性、低免疫原性、强载药能力、高度的组织相容性及细胞亲和性等优势,目前已被应用于癌症治疗、心血管疾病、皮肤疾病、骨科疾病及代谢疾病等。
相比于其他药物载体,外泌体在瘢痕防治上已具有显著的生物功能优势。(1)调控炎症反应,适度的炎症反应有利于创口愈合,外泌体能够调控血管生成,趋使炎症细胞表型极化,降低炎性因子生成,如骨髓间充质干细胞来源的外泌体可诱导M1型巨噬细胞向M2型极化,调控炎症和抗炎因子比例,减轻局部炎症,促使创面快速进入增殖期[31-32],促进伤口愈合,减少瘢痕形成。(2)调控细胞外基质与成纤维细胞。外泌体可抑制瘢痕成纤维细胞的增殖、迁移及向肌成纤维细胞细胞的分化,减少胶原合成和减轻创面收缩。如脂肪干细胞来源外泌体(adipose stem cell-exosomes,ADSC-Exos)使瘢痕组织α-SMA的表达水平显著降低,TGF-β1与TGF-β3的比例下降,减少成纤维细胞的分化和伤口中肌成纤维细胞的数量[33];人脐带来源的外泌体能够抑制TGF-β/Smad信号通路的激活,降低纤维化动物模型中I型和III型胶原蛋白的表达水平[34]。
然而,天然外泌体作为瘢痕防治的药物载体,仍存在半衰期短、缺乏特异性靶向能力和细胞内传递效率低等不足。为克服天然外泌体存在的不足,工程化外泌体应运而生。工程化外泌体是指天然外泌体经过细胞工程和外泌体工程技术处理后,形成具有高载药效率和靶向性等特点的一类外泌体[35]。外泌体的细胞工程是对外泌体的亲细胞进行干预而间接改造外泌体;而外泌体工程则是直接对外泌体进行修饰、改造。Liu等[36]通过细胞工程技术对外泌体亲细胞进行干预,用褪黑激素预处理间充质干细胞(mesenchymal stem cells,MSC),研究发现其衍生的外泌体可成功靶向调节PTEN/Akt信号通路,促进M1型巨噬细胞向M2表型极化,降低IL-1β、TNF-α等促炎因子表达,显著提高IL-10等抗炎因子表达;同时与未处理的MSC衍生的外泌体相比,用褪黑激素预处理的MSC衍生外泌体可改善大鼠皮肤伤口的血管生成,促进伤口愈合。Li等[37]运用外泌体工程对外泌体进行修饰,在体外将氧化铁纳米颗粒接入MSC来源外泌体,考察其在伤口愈合中的作用,研究显示负载氧化铁纳米颗粒的外泌体与静磁场相结合后,其靶向性和细胞亲和性显著提高,在损伤部位积累增多,能够通过调节成纤维细胞加速伤口愈合。
综上,外泌体既可作为瘢痕防治的生物物质,也可作为瘢痕治疗的药物递送载体,但作为新兴的生物传递工具,其治疗瘢痕等皮肤疾病的制剂尚处于开发阶段,目前主要以凝胶剂形式辅佐给药。Shafei等[38]将ADSC-Exos用海藻酸盐水凝胶搭载,研究其对大鼠全层伤口愈合的影响。研究发现在钙离子存在的情况下,藻酸盐水凝胶能够形成稳定的交联生物活性支架,较好黏附于伤口处,实现ADSC-Exos在伤口的稳定持续递送;与空白水凝胶相比,经外泌体水凝胶处理的伤口可更好的闭合。Nooshabadi等[39]将人子宫内膜干细胞来源的外泌体(human endometrial stem cells-exosomes,HESC-Exos)封装在壳聚糖水凝胶中,评估其对小鼠模型皮肤组织再生的影响。研究发现将HESC-Exos封装在水凝胶支架中,HESC-Exos的生物相容性性能得到了改善;与对照样品相比,外泌体水凝胶在体外能够调控血管生成和成纤维细胞的迁移、增殖来改善组织恢复。
4 结语
随着纳米技术的进步,经皮给药制剂得到进一步发展,纳米靶向经皮制剂已成为现代化制剂的研究热点,为瘢痕的防治提供了新策略。传统经皮制剂存在许多局限性:(1)对药物属性依赖较大,只能选择低相对分子质量、亲脂性药物,在应用促渗增强技术后使亲水性药物具透皮功能,但仍无法有效解决大分子经皮给药技术问题;(2)靶向性低,给药后部分药物无法到达病灶,导致治疗量不足而无法充分发挥疗效;(3)稳定性差,制剂内药物可能出现因环境变化而质量降低等情况。而应用细胞亲和性设计的纳米靶向经皮制剂具有促进大分子药物经皮渗透、提高药物化学稳定性、控制药物释放、促进制剂与病变细胞的融合、黏附及靶向给药等优点,在防治病理性瘢痕上具有广阔的应用前景。然而目前纳米技术研究仍处于基础阶段,许多问题仍需进一步研究,如纳米制剂的成型、释药过程及生物毒性、制剂中药物药效学的不确定性、制剂经皮渗透行为的分子机制等。纳米化制剂是现代化制剂发展的必然趋势,需要加强学科交叉等研究,解决纳米制剂存在的问题,提高制剂在病变部位的亲和性、靶向性及安全性,弥补传统制剂的缺陷,高效防治瘢痕及其他难治性疾病。
利益冲突 所有作者均声明不存在利益冲突
[1] Zhang T, Wang X F, Wang Z C,. Current potential therapeutic strategies targeting the TGF-β/Smad signaling pathway to attenuate keloid and hypertrophic scar formation [J]., 2020, 129: 110287.
[2] 张浩, 林川, 周建敏, 等. 莪术二酮对增生性瘢痕成纤维细胞的作用及机制探讨 [J]. 中草药, 2018, 49(8): 1854-1859.
[3] Chen L X, Su Y J, Yin B,. LARP6 regulates keloid fibroblast proliferation, invasion, and ability to synthesize collagen [J]., 2022, 142(9): 2395-2405.
[4] Waibel J S, Rudnick A. Comprehensive treatment of scars and other abnormalities of wound healing [J]., 2018, 1(1): 151-162.
[5] 徐子琪. 病理性瘢痕发病机制及治疗研究进展 [J]. 新乡医学院学报, 2022, 39(7): 688-693.
[6] 许佳, 樊佳俊, 韩冬, 等. 增生性瘢痕压力治疗的研究进展 [J]. 组织工程与重建外科, 2022, 18(2): 176-178.
[7] 刘振楠, 赵倩楠, 韩花花, 等. 瘢痕疙瘩的激光治疗进展 [J]. 中国美容整形外科杂志, 2022, 33(11): 677-680.
[8] El-Deen D S, Youssef N F A. The effect of cryotherapy application before versus after subcutaneous anticoagulant injection on pain intensity and hematoma formation: A quasi-experimental design [J]., 2018, 5(3): 223-229.
[9] Moon S J, Byun I H, Chang J S,. A prospective comparative study of radiotherapy effect upon scar quality [J]., 2021, 74(8): 1801-1806.
[10] Moretti L, Stalfort J, Barker T H,. The interplay of fibroblasts, the extracellular matrix, and inflammation in scar formation [J]., 2022, 298(2): 101530.
[11] 李晓康, 王舒, 于杨, 等. 皮肤创伤修复研究进展 [J]. 中国中西医结合皮肤性病学杂志, 2016, 15(1): 62-65.
[12] Dymek M, Sikora E. Liposomes as biocompatible and smart delivery systems-the current state [J]., 2022, 309: 102757.
[13] 代旭栋, 李云, 李双双, 等. 皮肤外用脂质体的研究进展 [J]. 国际药学研究杂志, 2020, 47(11): 914-921.
[14] Zhang Z, Wo Y, Zhang Y X,.study of ethosome penetration in human skin and hypertrophic scar tissue [J]., 2012, 8(6): 1026-1033.
[15] Shi J, Wu Y T, Guo S Y,. The efficacy of anti-VEGF antibody-modified liposomes loaded with paeonol in the prevention and treatment of hypertrophic scars [J]., 2019, 45(3): 439-455.
[16] Manosroi A, Chankhampan C, Manosroi W,. Transdermal absorption enhancement of papain loaded in elastic niosomes incorporated in gel for scar treatment [J]., 2013, 48(3): 474-483.
[17] 张小灵. 双丹脂质体凝胶剂的制备及抗增生性瘢痕研究 [D]. 广州: 广东药科大学, 2017.
[18] 吴艳婷, 郭思旖, 时军, 等. 穿膜肽TAT修饰载丹酚酸B脂质体的制备及其抑制人皮肤成纤维细胞增殖与迁移初步研究 [J]. 中草药, 2019, 50(1): 59-68.
[19] Zhou X L, Hao Y, Yuan L P,. Nano-formulations for transdermal drug delivery: A review [J]., 2018, 29(12): 1713-1724.
[20] 孔明, 程晓杰, 陈西广. 经皮给药中纳米制剂与皮肤的质构效关系 [J]. 生物化学与生物物理进展, 2013, 40(10): 1023-1030.
[21] 谌林清, 陈爱政, 王士斌. 聚合物纳米粒应用于透皮给药及促渗机制研究进展 [J]. 高分子通报, 2014(9): 38-45.
[22] Qin Z M, Chen F, Chen D M,. Transdermal permeability of triamcinolone acetonide lipid nanoparticles [J]., 2019, 14: 2485-2495.
[23] 吴海斌. 载siCTGF壳聚糖纳米粒在兔耳增生性瘢痕中的应用研究 [D]. 上海: 第二军医大学, 2017.
[24] 陈珂, 陈翠兰, 周雪萍, 等. 超声激励bFGF纳米微泡靶向治疗对裸鼠瘢痕疙瘩及PTEN/PI3K/Akt通路的影响 [J]. 实用医学杂志, 2022, 38(17): 2158-2164.
[25] Szumała P, Macierzanka A. Topical delivery of pharmaceutical and cosmetic macromolecules using microemulsion systems [J]., 2022, 615: 121488.
[26] 潘慧婕, 魏莉. 微乳在经皮给药系统中的研究进展 [J]. 湖南中医杂志, 2016, 32(11): 208-210.
[27] 高媛媛. 喜树碱衍生物通过透明质酸纳米微乳经皮给药作用于瘢痕修复的研究 [D]. 青岛: 中国海洋大学, 2014.
[28] 吕建华, 魏红, 张振, 等. 苦参碱微乳经皮给药在小鼠体内分布及对兔耳增生性瘢痕预防作用的研究 [J]. 时珍国医国药, 2011, 22(3): 572-575.
[29] Li H M, Peng Q, Guo Y S,. Preparation andandstudy of asiaticoside-loaded nanoemulsions and nanoemulsions-based gels for transdermal delivery [J]., 2020, 15: 3123-3136.
[30] Chavda V P, Pandya A, Kumar L,. Exosome nanovesicles: A potential carrier for therapeutic delivery [J]., 2023, 49: 101771.
[31] Shi Y X, Kang X, Wang Y J,. Exosomes derived from bone marrow stromal cells (BMSCs) enhance tendon-bone healing by regulating macrophage polarization [J]., 2020, 26: e923328.
[32] Gurusamy N, Alsayari A, Rajasingh S,. Adult stem cells for regenerative therapy [J], 2018, 160: 1-22.
[33] Wang L, Hu L, Zhou X,. Exosomes secreted by human adipose mesenchymal stem cells promote scarless cutaneous repair by regulating extracellular matrix remodelling [J]., 2017, 7(1): 13321.
[34] Eirin A, Zhu X Y, Puranik A S,. Mesenchymal stem cell-derived extracellular vesicles attenuate kidney inflammation [J]., 2017, 92(1): 114-124.
[35] 张琪, 于湄, 刘磊, 等. 工程化外泌体研究现状与临床转化的挑战 [J]. 中国组织工程研究, 2023, 27(19): 3052-3060.
[36] Liu W, Yu M Y, Xie D,. Melatonin-stimulated MSC-derived exosomes improve diabetic wound healing through regulating macrophage M1and M2polarization by targeting the PTEN/Akt pathway [J]., 2020, 11(1): 259.
[37] Li X Y, Wang Y, Shi L Y,. Magnetic targeting enhances the cutaneous wound healing effects of human mesenchymal stem cell-derived iron oxide exosomes [J]., 2020, 18(1): 113.
[38] Shafei S L, Khanmohammadi M, Heidari R,. Exosome loaded alginate hydrogel promotes tissue regeneration in full-thickness skin wounds: Anstudy [J]., 2020, 108(3): 545-556.
[39] Nooshabadi V T, Khanmohamadi M, Valipour E,. Impact of exosome-loaded chitosan hydrogel in wound repair and layered dermal reconstitution in mice animal model [J]., 2020, 108(11): 2138-2149.
Research progress on anti-scar nano-transdermal drug delivery based on cell affinity
ZHUANG Ze-bin1, LIU Dong-rong1, YAO Bi-jin1, QIN Chu-yue1, SHI Jun1, 2
1. School of Traditional Chinese Medicine, Guangdong Pharmaceutical University, Guangzhou 510006, China 2. Guangdong Engineering & Technology Research Center of Precise Drug Delivery System, Guangzhou 510006, China
Scar is a general term for the appearance, morphology, and histopathological changes of normal skin tissue caused by various types of trauma, which seriously affects the appearance of patients and can easily cause limb dysfunction and discomfort. Cell affinity is the main influencing factor for the stable release and full efficacy of drug formulations at disease sites. The complexity of wound healing process leads to the formation of scars being influenced by various factors. The design of nano targeted percutaneous drug delivery formulations for scar treatment based on cell affinity performance can effectively improve the healing rate. This review provides a reference for the development and clinical application of scar prevention and treatment strategies through the review of cell affinity designed nano-transdermal formulations for scar prevention and treatment.
nanometer targeted preparation; cell affinity; transdermal administration; scar; liposomes; nanoparticles; microemulsion; exosomes
R283
A
0253 - 2670(2023)13 - 4359 - 08
10.7501/j.issn.0253-2670.2023.13.029
2023-02-06
国家自然科学基金资助项目(82173982);广东省自然科学基金资助项目(2022A1515011382)
庄泽槟(1998—),男,硕士研究生,研究方向为中药制剂研究与开发。E-mail: 1051037404@qq.com
通信作者:时 军(1980—),男,博士,教授,从事中药新剂型及制剂新技术研究。Tel: (020)39352169 E-mail: shijun8008@163.com
[责任编辑 赵慧亮]
