白芍总苷中4个活性成分在正常和四氯化碳诱导的急性肝损伤大鼠体内药动学比较研究
2023-07-06陶西雨程晓羽魏真真周菁杨张小平郑永霞詹淑玉
陶西雨,程晓羽,魏真真,周菁杨,敖 雷,张小平,韩 丰,郑永霞*,詹淑玉*
白芍总苷中4个活性成分在正常和四氯化碳诱导的急性肝损伤大鼠体内药动学比较研究
陶西雨1,程晓羽1,魏真真1,周菁杨1,敖 雷1,张小平2,韩 丰2,郑永霞1*,詹淑玉1*
1. 嘉兴学院医学院,浙江 嘉兴 314001 2. 嘉兴学院附属医院,浙江 嘉兴 314001
研究白芍总苷中4个活性成分(芍药苷、芍药内酯苷、没食子酰芍药苷和苯甲酰芍药苷)在正常和四氯化碳(carbon tetrachloride,CCl4)诱导急性肝损伤大鼠体内的药动学过程,并比较其差异。参照临床给药剂量给SD大鼠ig白芍总苷后,采集不同时间点大鼠血清,建立LC-MS方法测定血药浓度,采用WinNonlin5.3药动学软件计算各成分药动学参数,并进行统计学分析。没食子酰芍药苷和苯甲酰芍药苷的入血浓度较低,可能大部分迅速代谢为中间产物芍药苷。肝损伤使主要成分芍药苷、芍药内酯苷在大鼠体内的半衰期(1/2)和平均滞留时间(MRT)显著延长(<0.05、0.01),药时曲线下面积(AUC)显著增加(<0.05、0.01),清除率(CL/F)显著降低(<0.05、0.01);没食子酰芍药苷在2组大鼠体内的药动学参数无显著性差异,但其在肝损伤大鼠体内的药-时曲线出现双峰现象;苯甲酰芍药苷在2组大鼠体内的1/2和MRT0~∞无显著变化,但肝损伤使其AUC显著增加(<0.01)。为进一步探究白芍总苷多成分协同的保肝作用机制提供实验基础,同时为该中药的临床合理用药提供指导参考。
白芍总苷;肝损伤;药动学;芍药苷;芍药内酯苷;没食子酰芍药苷;苯甲酰芍药苷
白芍总苷(total glucosides of peony,TGP)为白芍的有效部位,主要含芍药苷、芍药内酯苷、苯甲酰芍药苷、羟基芍药苷等单萜糖苷类化合物,为白芍的药效物质基础[1-3]。现代药理学研究证明,TGP具有抗炎、抗氧化、调节免疫、保肝等多种药理活性[4],其中成药制剂TGP胶囊(商品名帕夫林)在临床上已广泛用于类风湿性关节炎等的辅助治疗,疗效确切[5]。但是目前对TGP多成分、多靶点、整合作用的机制及体内过程研究还较薄弱。
中药多成分药动学研究主要揭示中药多种有效成分的体内过程,对帮助阐释中药整合调节作用机制及指导临床合理用药等都具有重要作用。目前,以含量较高的活性成分芍药苷、芍药内酯苷为药动学标志物的TGP体内药动学过程已有较多研究[6-8],但对部分含量较低的单萜糖苷类活性成分如苯甲酰芍药苷、没食子酰芍药苷等的体内药动学特征还少见报道。机体疾病状态可能影响药物在体内的吸收、分布、代谢和排泄等药动学过程,阐明药物在正常生理和病理状况下的药动学差异,对于帮助临床合理制定给药方案具有重要意义。对各种类型肝损伤的保护作用是TGP的主要临床疗效之一[9-11],因此探讨肝损伤对TGP多种活性成分药动学特征的影响,可以帮助较全面揭示TGP保肝作用的药理机制及体内过程。本研究前期发现,TGP入血成分除了主要的芍药苷和芍药内酯苷外,还可监测到少量的没食子酰芍药苷和苯甲酰芍药苷,且其药时变化过程具备规律性。因此,本研究以TGP中4个活性成分芍药苷、芍药内酯苷、没食子酰芍药苷和苯甲酰芍药苷为药动学标志物,基于LC-MS技术对比分析TGP在正常和四氯化碳(carbon tetrachloride,CCl4)诱导急性肝损伤大鼠体内的药动学差异,以期帮助全面阐明TGP多成分的体内过程特征,为TGP保肝作用的机制研究及临床用药的合理指导提供参考依据。
1 材料
1.1 动物
SPF级雄性SD大鼠,体质量260~280 g,由浙江维通利华实验动物技术有限公司提供,动物许可证号SCXK(浙)2019-0001。大鼠饲养于嘉兴学院实验动物中心,饲养环境12 h光照黑暗循环,正常饮食饮水,适应性饲养7 d,实验前禁食12 h。动物实验经嘉兴学院实验动物伦理委员会审核(批准号JUMC2022-055),实验过程符合各项伦理要求。
1.2 药品与试剂
对照品芍药苷(批号M28GB143089)、芍药内酯苷(批号O31GB166251)、没食子酰芍药苷(批号M20H182502)购自上海源叶生物科技有限公司,质量分数均≥98%;对照品苯甲酰芍药苷(批号170526,质量分数>98%)、龙胆苦苷(批号200908,质量分数>98%)购自上海融禾医药科技有限公司;TGP胶囊(批号210813)由宁波立华制药有限公司生产,经含量测定分别含芍药苷360.2 mg/g、芍药内酯苷108.6 mg/g、没食子酰芍药苷7.9 mg/g和苯甲酰芍药苷6.0 mg/g;质谱级乙腈、甲醇均购自上海泰坦科技股份有限公司;质谱级甲酸购自上海麦克林生化科技股份有限公司;色谱级醋酸乙酯购自杭州青辰化学试剂厂;色谱级CCl4购自江苏强盛功能化学股份有限公司;注射用生理盐水购自杭州民生药业股份有限公司;丙氨酸氨基转移酶(alanine aminotransferase,ALT)试剂盒(批号20210819)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)试剂盒(批号20210818)、总胆汁酸(total bile acid,TBA)试剂盒(批号20210819)均购自南京建成生物工程研究所;超纯水为Milli-Q超纯化系统自制。
1.3 仪器
超高效液相-ISQ EC单四级杆质谱联用仪(美国Thermo Fisher Scientific公司);XS105 DualRange型十万分之一电子天平(瑞士METTLER TOLEDO公司);VXR basic Vibrax®型振荡器(德国IKA公司);5301型快速真空浓缩机、5424R型高速离心机(德国Eppendorf公司);Milli-Q超纯水处理装置(美国Millipore公司)。
2 方法与结果
2.1 给药与样品采集
2.1.1 正常大鼠给药与样品采集 随机取正常SD大鼠8只,参照TGP胶囊最高临床给药剂量,折算成大鼠给药量(567 mg/kg)后正常大鼠ig TGP生理盐水溶液,换算成各成分的给药量分别为芍药苷204.2 mg/kg、芍药内酯苷61.6 mg/kg、没食子酰芍药苷4.5 mg/kg和苯甲酰芍药苷3.4 mg/kg。各大鼠分别于给药后5、10、20、30 min及1、1.5、2、3、4、6、8、12 h经眼眶静脉取全血约0.5 mL,全血在室温放置1~1.5 h后,4 ℃、14 000 r/min离心10 min,取上层血清冻存于−20 ℃待测。
2.1.2 肝损伤大鼠模型建立、给药与样品采集 随机取正常SD大鼠8只,采用一次性ip 40% CCl4溶液(2 mL/kg)诱导建立急性肝损伤模型。造模24 h后,检测正常组和模型组血清肝功能指标(ALT、AST、TBA),结果见图1,经双侧检验分析模型组大鼠血清中各项指标均较正常组显著升高(<0.05、0.01),表明造模成功。各模型组大鼠同正常组给药量ig TGP生理盐水溶液后,按“2.1.1”项下方法采集血清样品。
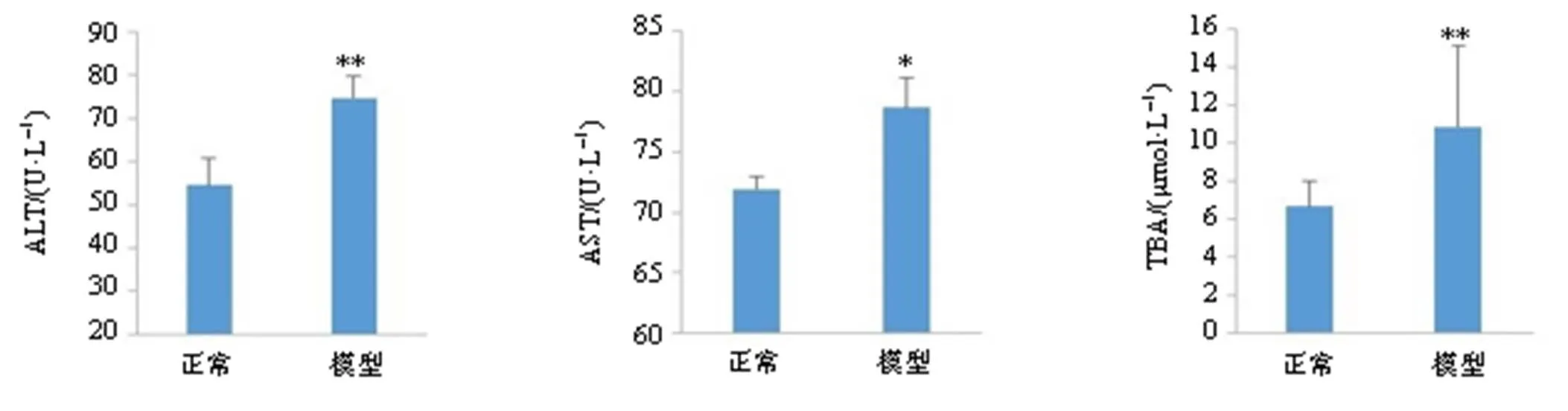
与正常组比较:*P<0.05 **P<0.01
2.2 溶液制备
2.2.1 对照品及内标储备液的制备 各精密称取对照品芍药内酯苷3.6 mg、芍药苷5.2 mg、没食子酰芍药苷5.0 mg、苯甲酰芍药苷0.8 mg和内标龙胆苦苷2.5 mg,分别采用甲醇溶解,并定容至1 mL,得质量浓度分别为3.6、5.2、5.0、0.8、2.5 mg/mL的对照品及内标储备液,4 ℃保存备用。
2.2.2 高、中、低质量浓度质控样品的制备 精密量取各对照品储备液适量混合,用甲醇定容配制成高、中、低3种质量浓度的质控标准溶液,其中芍药内酯苷质量浓度分别为500、125、25 ng/mL,芍药苷质量浓度分别为2000、500、100 ng/mL,没食子酰芍药苷质量浓度分别为10、2.5、0.5 ng/mL,苯甲酰芍药苷质量浓度分别为5、1.25、0.25 ng/mL,标准溶液于4 ℃保存。使用时,分别精密量取各质量浓度质控标准溶液250 μL于2 mL聚丙烯管中,45 ℃离心浓缩蒸干溶剂后,残渣加入空白大鼠血清250 μL,涡旋振荡5 min溶解后作为质控样品。
2.3 血清样品处理
吸取大鼠血清样品250 μL,加入含内标(5 ng/mL)的醋酸乙酯萃取液1 mL,1500 r/min涡旋震荡萃取5 min,10 000 r/min离心5 min,转移上清液850 μL于2 mL聚丙烯管中,在残留沉淀中再加入含内标(5 ng/mL)的醋酸乙酯萃取液1 mL,1500 r/min涡旋震荡萃取5 min,10 000 r/min离心5 min,取上清液950 μL与前面的850 μL上清液合并,于45 ℃离心浓缩蒸干溶剂,残渣加入50 μL 80%甲醇,涡旋振荡5 min溶解,14 000 r/min离心5 min,取上清液进样分析。
2.4 测定条件
2.4.1 色谱条件 XBridge C18色谱柱(75 mm×4.6 mm,2.5 μm);流动相为0.02%甲酸水溶液(A)-乙腈(B),梯度洗脱:0~3.0 min,92% A;3.0~8.0 min,92%~65% A;8.0~10.0 min,65%~58% A;10.0~12.0 min,58%~30% A;12.0~13.0 min,30%~92% A;13.0~18.0 min,92% A。体积流量0.5 mL/min;柱温30 ℃;进样量10 μL。
2.4.2 质谱条件 离子源为电喷雾离子源(ESI);离子传输管温度300 ℃;气化温度282 ℃;喷雾电压−2.0 kV;载气为氮气;鞘气压49.9 psi(1 psi=6.895 kPa);辅助气压5.7 psi;吹扫气压0.5 psi。采用选择负离子扫描模式,待测成分及内标化合物的离子信息分别为芍药内酯苷[M+HCOO]−525.25、芍药苷[M+HCOO]−525.24、没食子酰芍药苷[M-H]−631.27、苯甲酰芍药苷[M+HCOO]−629.28和龙胆苦苷[M+HCOO]−401.11。
2.5 方法学考察
2.5.1 专属性 分别取大鼠空白血清、加入混合对照品溶液的空白血清和大鼠ig TGP后的血清样品,按照“2.3”项下的血清样品方法处理后,按“2.4”项下测定条件进样分析,记录色谱图,见图2。各成分分离度良好,芍药内酯苷、芍药苷、没食子酰芍药苷、苯甲酰芍药苷和内标龙胆苦苷的保留时间分别为9.09、9.41、10.14、12.71、8.79 min,血清内源性物质对待测成分及内标均无干扰。
2.5.2 定量限和线性范围 精密吸取各对照品溶液适量,混匀后采用甲醇定容得一定质量浓度的混合对照品溶液,再用甲醇逐级稀释成一系列不同质量浓度的混合对照品溶液。分别取不同质量浓度的各混合对照品溶液各250 μL,于45 ℃离心浓缩蒸干溶剂,再分别加入250 μL空白血清涡旋振荡5 min混匀,得到一系列不同质量浓度的血清标准溶液,按“2.3”项下的血清样品方法处理后,按“2.4”项下方法测定。以各待测物信噪比为10确定各成分的定量下限。采用内标法,以血清中各待测物的浓度为横坐标(),各待测物与内标的峰面积比值为纵坐标(),求算各待测物的线性回归方程和相关系数。各待测物的回归方程、线性范围、相关系数(2)及定量限见表1。
2.5.3 准确度和精密度 取高、中、低3个质量浓度的质控样品各6份,按“2.3”项下方法处理后,按“2.4”项下方法进样分析,计算各待测物高、中、低质量浓度血清标准样品的日内准确度和精密度。分别在6 d中配制6份高、中、低3个质量浓度的血清质控样品,按“2.3”项下方法处理后,按“2.4”项下方法进样分析,计算各待测物高、中、低质量浓度血清标准样品的日间准确度和精密度。结果见表2,方法的准确度和精密度良好。
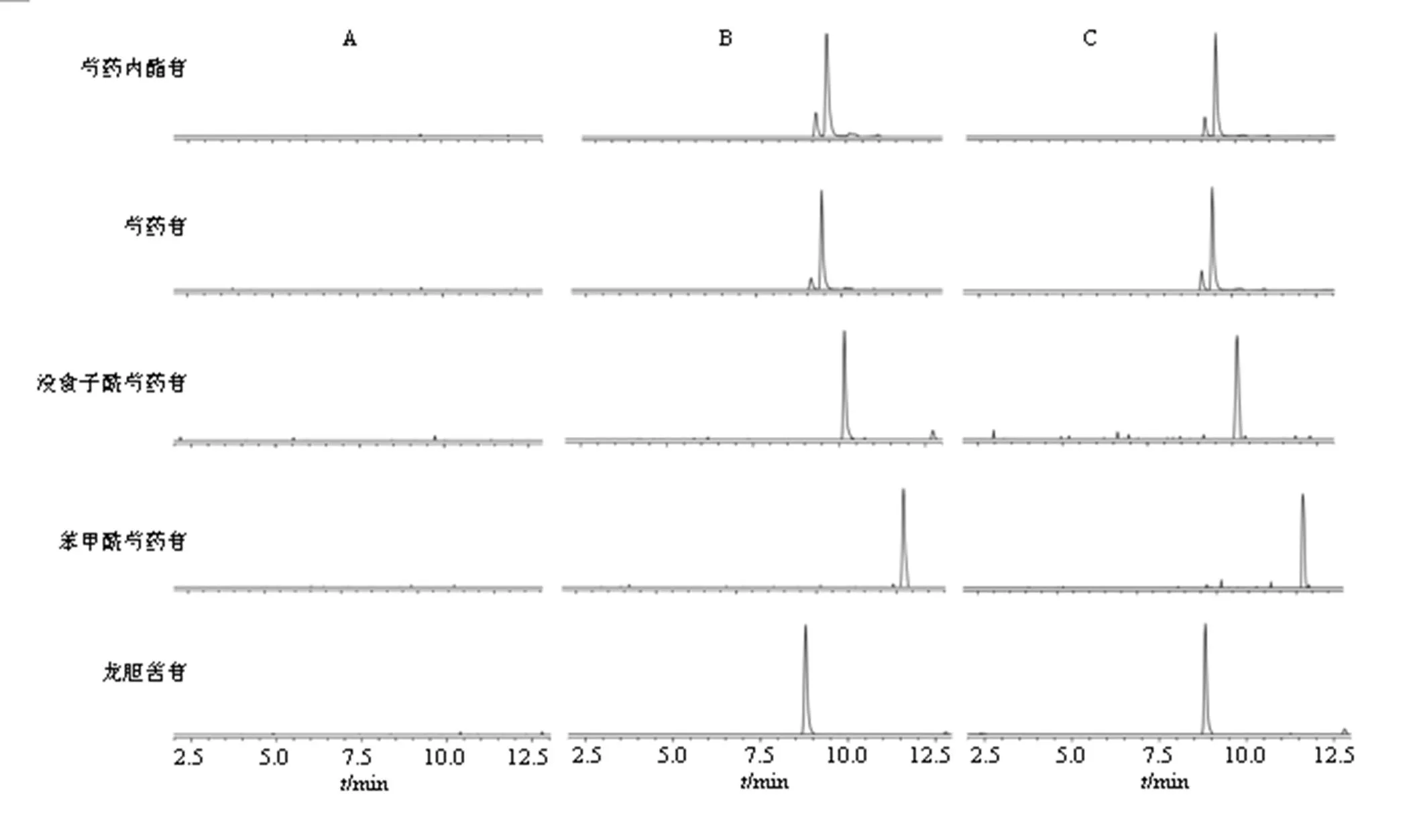
A-空白血清 B-质控样品 C-给药后血清样品

表1 各待测物的线性范围、回归方程、R2及定量限
2.5.4 提取回收率和基质效应 取高、中、低3个质量浓度的质控样品各6份,按“2.3”项下方法处理后,按“2.4”项下方法进样分析,记录各成分峰面积为A;另取250 µL大鼠空白血清,按“2.3”项下方法处理后,残渣分别加入250 μL高、中、低质量浓度的质控混合对照品溶液,涡旋震荡混匀5 min,于45 ℃离心浓缩蒸干溶剂,残渣再加入50 μL 80%甲醇,涡旋震荡5 min溶解,14 000 r/min离心5 min,取上清液进样分析,记录各成分峰面积为B,计算提取回收率(A/B);另取250 μL高、中、低质量浓度的质控混合对照品溶液各6份,按“2.3”项下方法处理后,残渣分别加入50 μL 80%甲醇,涡旋震荡5 min溶解,14 000 r/min离心5 min,取上清液进样分析,记录各成分峰面积记为C,计算基质效应(B/C)。结果见表3,方法的提取回收率和基质效应符合生物样本分析的要求。
2.5.5 稳定性 取高、中、低3个质量浓度的质控样品,分别考察3种情况下的稳定性。①短期稳定性:将质控样品处理后,在室温下放置于进样盘上24 h后进样分析;②冻融稳定性:将质控样品在−20 ℃冰箱中反复冻融3次后再处理分析;③长期稳定性:将质控样品在−20 ℃冰箱冻存7 d后再处理分析。每种稳定性考察情况下,每个质量浓度各平行6份。结果见表4,3种情况下样品稳定性良好,符合生物样本分析的要求。
表2 各待测物的日内、日间准确度和精密度(, n = 6)
表3 各待测物的提取回收率和基质效应(, n = 6)
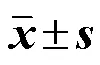
表4 各待测物的稳定性(, n = 6)
2.6 药动学研究
大鼠ig TGP后,按照上述所建立的方法测定各时间点血药浓度,绘制平均血药浓度-时间曲线,见图3。采用WinNonlin 5.3药动学软件以非房室模型分析计算正常组和模型组各成分的药动学参数,主要包括消除半衰期(1/2)、平均滞留时间(MRT0~∞)、血药浓度-时间曲线下面积(AUC)、达峰浓度(max)、达峰时间(max)、表观分布容积(Vd/F)和消除率(CL/F)。采用双侧检验对正常组和模型组各个药动学参数进行显著性差异分析。结果见表5,与正常组比较,芍药苷、芍药内酯苷在肝损伤大鼠体内的1/2和MRT0~∞均显著延长(<0.05、0.01),AUC显著增加(<0.05、0.01),CL/F显著降低(<0.05、0.01);苯甲酰芍药苷在肝损伤大鼠体内的1/2和MRT0~∞无显著变化,AUC显著增加(<0.01),Vd/F和CL/F显著降低(<0.05、0.01);没食子酰芍药苷在正常组和模型组大鼠体内的药动学参数均无显著性差异。说明CCl4诱导的急性肝损伤疾病状态对TGP不同活性成分体内药动学过程的影响存在差异。
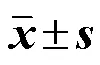
表5 TGP中4个成分在正常和肝损伤大鼠血清中的药动学参数(, n = 8)
与正常组比较:*<0.05**<0.01
*< 0.05**< 0.01normal group
3 讨论
芍药苷和芍药内酯苷为TGP的主要药效成分,其含量高、活性明确,因此多数有关TGP的作用机制、体内过程及临床疗效评价均以这2个成分为代表展开,较少关注其他单萜糖苷类成分。本课题组在前期对TGP物质组成的研究中发现,除了芍药苷、芍药内酯苷外,TGP中还含有少量的没食子酰芍药苷、苯甲酰芍药苷和羟基芍药苷,进一步的入血成分研究发现没食子酰芍药苷和苯甲酰芍药苷均可少量入血且存在规律性的药-时变化关系。没食子酰芍药苷和苯甲酰芍药苷均为芍药苷的活性衍生物,近年来较多研究证明其具有抗炎、抗氧化和免疫调剂等药理活性,对胃炎、骨质疏松症、非小细胞肺癌和败血症等具有潜在的治疗功效[12-16]。因此,有必要同时探讨TGP多种活性成分的体内过程,为其多成分协同作用机制研究提供依据。本研究发现,在TGP的临床给药剂量下,可检测到的主要入血成分仍为芍药苷和芍药内酯苷,没食子酰芍药苷和苯甲酰芍药苷的给药量约为芍药苷的1/50~1/100,但是其达峰浓度仅约为芍药苷的1/1000,分析原因可能是这2个成分入血后大部分被迅速代谢为中间产物芍药苷[17-18],仅剩少量的入血原型药物,因此提示在对TGP多成分协调作用的药效评价时,应充分考虑各成分量的差异。
研究发现在TGP临床给药剂量下,芍药苷和芍药内酯苷在正常大鼠体内的1/2和MRT分别为2~3 h和3~4 h,与多数已有研究相符[6]。CCl4诱导急性肝损伤可显著延长芍药苷和芍药内酯苷在大鼠体内的1/2和MRT,并显著增加AUC,降低CL/F,说明肝损伤疾病状态使TGP主要成分代谢减慢、体内滞留时间和暴露程度增加。刘恩荔等[19]也考察了CCl4诱导急性肝损伤对芍药苷和芍药内酯苷在大鼠体内药动学的影响,同样发现急性肝损伤使这2个成分的max、AUC0~t显著增大,1/2延长;Jiang等[20]比较了正常和急性胆汁淤积型肝炎大鼠ig赤芍提取物后,芍药苷和芍药内酯苷在2组大鼠体内的药动学差异,结果也显示急性肝损伤可显著增加2个成分的max和AUC0~t。综合文献报道及本研究结果说明急性肝损伤在某种程度上可能增强TGP的保肝药效,也提示临床上应注意根据实际情况调整给药方案。肝脏是药物在体内生物转化和代谢的最重要器官,肝损伤可能通过影响肝微粒体CYP450酶的活性从而影响药物体内代谢[21],研究发现CCl4对5种P450酶(CYP1A2、CYP2C9、CYP2C19、CYP2D6和CYP3A4)均有显著的抑制作用[22];此外,肝损伤可能引起胃肠道菌群紊乱、抑制药物肠道转运从而影响体内代谢[23-24],因此,CCl4诱导急性肝损伤究竟通过哪些环节影响TGP体内过程还需要深入探究。本研究发现没食子酰芍药苷在正常组和模型组大鼠体内的药动学参数差异无统计学意义,可能与大鼠组内个体差异大、血药浓度偏低等有关,另外,肝损伤使没食子酰芍药苷在大鼠体内的药-时曲线呈现较明显的双峰现象,说明肝损伤对其体内过程的影响较为复杂,可能涉及肠肝循环、肾小管重吸收等过程。研究结果苯甲酰芍药苷在正常和肝损伤大鼠体内的1/2和MRT0~∞无显著差异,但肝损伤使AUC显著增加、Vd/F和CL/F显著降低,分析原因可能肝损伤部分抑制了苯甲酰芍药苷向芍药苷的代谢转化,使其原型成分的体内暴露量增加,但具体原因还需要进一步深入研究。
本研究首次对TGP中4个活性单萜糖苷类成分芍药苷、芍药内酯苷、没食子酰芍药苷和苯甲酰芍药苷同时开展了药动学研究,并对比分析了4个成分在正常和CCl4诱导急性肝损伤大鼠体内的药动学差异,可为进一步探究TGP多成分协同的保肝作用机制提供实验基础,同时为该中药的临床合理用药提供指导参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 马喆, 宋志敏, 韩雅馨, 等. 白芍总苷对胶原诱导性关节炎大鼠长期给药的组织分布研究 [J]. 中草药, 2023, 54(10): 3167-3178.
[2] Jiang H J, Li J, Wang L,. Total glucosides of paeony: A review of its phytochemistry, role in autoimmune diseases, and mechanisms of action [J]., 2020, 258: 112913.
[3] 李雪岩, 韩星, 杨文宁, 等. 基于大鼠体内序贯代谢的白芍质控成分遴选研究[J]. 药物评价研究, 2021, 44(2): 329-337.
[4] Zhang L L, Wei W. Anti-inflammatory and immunoregulatory effects of paeoniflorin and total glucosides of paeony [J]., 2020, 207: 107452.
[5] Liu B, Meng X, Ma Y F,. Clinical safety of total glucosides of paeony adjuvant therapy for rheumatoid arthritis treatment: A systematic review and meta-analysis [J]., 2021, 21(1): 102.
[6] Fei F, Yang H L, Peng Y,. Sensitive analysis and pharmacokinetic study of the isomers paeoniflorin and albiflorin after oral administration of total glucosides of White Paeony Capsule in rats [J]., 2016, 1022: 30-37.
[7] Xu W Z, Zhao Y, Qin Y,. Enhancement of exposure and reduction of elimination for paeoniflorin or albiflorin via co-administration with total peony glucosides and hypoxic pharmacokinetics comparison [J]., 2016, 21(7): 874.
[8] Zhao M M, Gao M, Tian Y L,. Pharmacokinetic and tissue distribution studies of paeoniflorin and albiflorin in rats after oral administration of total glycosides of paeony by HPLC-MS/MS [J]., 2014, 23(6): 403-411.
[9] Xiang N, Li X M, Zhang M J,. Total glucosides of paeony can reduce the hepatotoxicity caused by methotrexate and leflunomide combination treatment of active rheumatoid arthritis [J]., 2015, 28(1): 802-807.
[10] 贾岚, 王蕾蕾, 孟靓, 等. 白芍总苷对大鼠化学性肝损伤与肝阴虚证结合模型的影响和机制研究 [J]. 中草药, 2020, 51(7): 1885-1892.
[11] 任敏霞, 吴素香, 詹淑玉, 等. 白芍总苷及其所含主要成分芍药苷和芍药内酯苷对四氯化碳致小鼠急性肝损伤的保护作用 [J]. 中华中医药学刊, 2020, 38(5): 244-247.
[12] Zhang Y, Wang M H, Zhang K B,. 6'-O-galloylpaeoniflorin attenuates-associated gastritis via modulating Nrf2 pathway [J]., 2022, 111: 109122.
[13] Liu W J, Xie G, Yuan G X,. 6′--galloylpaeoniflorin attenuates osteoclasto-genesis and relieves ovariectomy-induced osteoporosis by inhibiting reactive oxygen species and MAPKs/c-fos/NFATc1signaling pathway [J]., 2021, 12: 641277.
[14] Gao J Y, Song L, Xia H,. 6′--galloylpaeoniflorin regulates proliferation and metastasis of non-small cell lung cancer through AMPK/miR-299-5p/ATF2 axis [J]., 2020, 21(1): 39.
[15] Kim C, Sim H, Bae J S. Benzoylpaeoniflorin activates anti-inflammatory mechanisms to mitigate sepsis in cell-culture and mouse sepsis models [J]., 2022, 23(21): 13130.
[16] Zhong W C, Li E C, Hao R R,. Anti-anaphylactic potential of benzoylpaeoniflorin through inhibiting HDC and MAPKs from[J]., 2021, 19(11): 825-835.
[17] 章芳珍, 吴德玲, 赵宏苏, 等. 苯甲酰芍药苷灌胃给药的代谢产物芍药苷的药动学研究 [J]. 中药新药与临床药理, 2019, 30(12): 1490-1496.
[18] 周晓雯, 鲍真真. 苯甲酰芍药苷在大鼠体内的药动学研究 [J]. 江苏中医药, 2019, 51(2): 3.
[19] 刘恩荔, 谢敏, 王玉峰, 等. 白芍总苷在急性CCl4肝损伤大鼠与正常大鼠体内的药代动力学比较研究 [J]. 中国药学杂志, 2012, 47(7): 534-538.
[20] Jiang F J, Zhao Y L, Wang J B,. Comparative pharmacokinetic study of paeoniflorin and albiflorin after oral administration ofin normal rats and the acute cholestasis hepatitis rats [J]., 2012, 83(2): 415-421.
[21] Xie Y, Hao H P, Wang H,. Reversing effects of lignans on CCl4-induced hepatic CYP450 down regulation by attenuating oxidative stress [J]., 2014, 155(1): 213-221.
[22] 郑天慧, 刘伟, 李淑萍, 等. 不同急性肝损伤大鼠模型对5种CYP450酶的影响 [J]. 中国药学杂志, 2017, 52(12): 1023-1028.
[23] Li Y T, Wang L, Chen Y,. Effects of gut microflora on hepatic damage after acute liver injury in rats [J]., 2010, 68(1): 76-83.
[24] Fouts D E, Torralba M, Nelson K EBacterial translocation and changes in the intestinal microbiome in mouse models of liver disease[J]., 2012, 56(6): 1283-1292.
A comparative pharmacokinetics study of four active ingredients of total glucosides of paeony in normal rats and carbon tetrachloride-induced acute hepatic injury rats
TAO Xi-yu1, CHENG Xiao-yu1, WEI Zhen-zhen1, ZHOU Jing-yang1, AO Lei1, ZHANG Xiao-ping2, HAN Feng2, ZHENG Yong-xia1, ZHAN Shu-yu1
1. Medical College, Jiaxing University, Jiaxing 314001, China 2. Affiliated Hospital of Jiaxing University, Jiaxing 314001, China
To study the pharmacokinetics of four active ingredients (paeoniflorin, albiflorin, galloylpaeoniflorin and benzoylpaeoniflorin) of total glucosides of paeony (TGP) in normal and carbon tetrachloride (CCl4)-induced acute hepatic injury rats, and then compare their differences in pharmacokinetic parameters.TGP was intragastrically administered to SD rats with the reference of its clinical dosage. After administration, serum of rats was collected in planed interval time points. LC-MS method was established to determine drug concentrations in serum. The pharmacokinetic parameters were calculated using WinNonlin 5.3 pharmacokinetic software, and their difference in normal and hepatic injury rats were statistically analyzed.The concentration of galloylpaeoniflorin and benzoylpaeoniflorin were relatively lower than paeoniflorin in blood because they might mainly be metabolized to the intermediate compound paeoniflorin. For the main ingredients of paeoniflorin and albiflorin, their half-life (1/2) and mean residence times (MRT) were significantly extended (< 0.05, 0.01), area under drug-time curve (AUC) were significantly increased (< 0.05, 0.01), and clearance (CL/F) were significantly reduced in hepatic injury rats when comparing with normal rats (< 0.05, 0.01). For galloylpaeoniflorin, there were no significant differences of pharmacokinetic parameters in two groups of rats, but it presented double peak of drug-time curve in hepatic injury rats. For benzoylpaeoniflorin, there were no significant differences of1/2and MRT0~∞in two groups of rats, but its AUCs were significantly increased in hepatic injury rats than in normal rats (< 0.01).This study would provide an experimental basis for further exploring the liver protective mechanism of the synergistic effect of TGP and provide guidance and reference for its clinical rational use.
total glucosides of paeony; hepatic injury; pharmacokinetics; paeoniflorin; albiflorin; galloylpaeoniflorin; benzoylpaeoniflorin
R285.61
A
0253 - 2670(2023)13 - 4224 - 09
10.7501/j.issn.0253-2670.2023.13.015
2022-12-31
国家自然科学基金资助项目(81503338);浙江省基础公益研究计划项目(LGF22H280004,LGD22H160004);嘉兴市科技计划项目(2020AY10022);嘉兴学院重点SRT资助项目(8517221147)
陶西雨,本科,研究方向为中药药动学。E-mail: 203625310@qq.com
通信作者:詹淑玉,博士,教授,研究方向为中药药理学与中药药动学。E-mail: zhansy2000@163.com
郑永霞,博士,副教授,研究方向为肝癌的发病机制研究。E-mail: zhengyongxia@163.com
[责任编辑 李亚楠]
