银杏二萜内酯葡胺注射液及其银杏二萜内酯成分抗人脐静脉内皮细胞氧糖剥夺损伤的转录组学研究
2023-07-06徐小波武子寅张新庄王振中
徐小波,武子寅,张新庄,曹 亮,王振中,肖 伟,
银杏二萜内酯葡胺注射液及其银杏二萜内酯成分抗人脐静脉内皮细胞氧糖剥夺损伤的转录组学研究
徐小波1,武子寅2, 3*,张新庄2, 3,曹 亮2, 3,王振中2, 3,肖 伟1, 2, 3*
1. 南京中医药大学,江苏 南京 210023 2. 江苏康缘药业股份有限公司,江苏 连云港 222001 3. 中药制药过程新技术国家重点实验室,江苏 连云港 222001
研究银杏二萜内酯葡胺注射液(Diterpene Ginkgolides Meglumine Injection,DGMI)及其银杏二萜内酯成分抗人脐静脉内皮细胞(human umbilical vein endothelial cells-T1,HUVEC-T1)氧糖剥夺(oxygen-glucose deprivation,OGD)损伤的潜在作用通路。采用CCK-8法分别测定不同浓度银杏内酯A(ginkgolide A,GA)、银杏内酯B(ginkgolide B,GB)、银杏内酯K(ginkgolide K,GK)和DGMI对HUVEC-T1细胞的毒性,明确药物处理细胞浓度;采用转录组测序技术对溶剂对照组(二甲基亚砜)、模型组(OGD/R 4 h/24 h)及给药组(造模+不同剂量DGMI、GA、GB、GK处理)的细胞样本分别进行转录组测序;通过生物信息学分析方法,以GEO数据库中缺血性脑卒中患者转录组数据为参考,采用基因集富集分析(gene set enrichment analysis,GSEA)、差异基因富集等分析方法完成对HUVEC-T1 OGD模型及不同浓度药物抗OGD损伤能力的评价,阐明DGMI及其功效成分的潜在作用机制。GSEA分析显示,临床缺血性脑卒中患者血液转录组数据分析获得的疾病富集通路与本实验细胞模型测序结果获得的富集通路相似度为55.6%;DGMI、GA、GB、GK处理组与模型组相比,显著富集的主要信号通路包括FcεRI、NOD样受体、有丝分裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)、血管内皮生长因子(vascular endothelial growth factor,VEGF)等。差异基因分析显示,与对照组相比,模型组共筛选出439个差异基因,差异基因的基因本体(gene ontology,GO)分析主要富集在应激反应过程,京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)分析主要富集在磷脂酶D、FcεRI、NOD样受体和血小板活化等信号通路;与模型组相比,给药组差异基因的GO分析主要富集在造血和代谢过程,KEGG分析主要富集在血小板活化、磷脂酶D等信号通路。HUVEC-T1 OGD模型模拟了部分缺血性脑卒中的病理特征;DGMI、GA、GB、GK均具有抗OGD损伤作用,发挥抗OGD损伤作用的关键基因及信号通路主要集中在抗炎、抗凋亡、调控血小板活化等生物学过程,可能通过下调FcεRI、NOD样受体、MAPK和VEGF信号通路,干预血小板活化、磷脂酶D等信号通路发挥作用。
银杏二萜内酯葡胺注射液;银杏内酯A;银杏内酯B;银杏内酯K;人脐静脉内皮细胞;氧糖剥夺模型;转录组测序
脑卒中是世界范围内导致死亡和残疾的主要原因之一,每年因脑卒中死亡的人数占全球死亡人数的12%,这一比例在发展中国家更高[1]。随着人们生活方式的改变与生活水平的提高,脑卒中的发病率呈现上升趋势[2],其中血管阻塞导致的缺血性脑卒中约占所有脑卒中类型的85%[3],引发脑血管阻塞的机制十分复杂,涉及到动脉粥样硬化、动脉炎症等,因此其病理机制也十分复杂,缺氧缺糖导致的能量衰竭、谷氨酸等代谢物累积导致的兴奋性中毒、炎症爆发以及神经细胞凋亡等均参与其中。目前临床上最有效的治疗方法是在时间窗内进行重组组织型纤溶酶原激活剂静脉溶栓或机械取栓,但这2种救治方法时间窗窄、成本高且面临出血风险[1],无法满足目前的临床需求。因此,开发更可靠的治疗药物和方法至关重要。
银杏叶提取物制剂是临床上使用最广泛的中药提取物制剂之一,具有拮抗血小板活化因子、扩血管和抗炎等药理作用[4-6],被广泛用于心脑血管疾病治疗。银杏二萜内酯葡胺注射液(Diterpene Ginkgolides Meglumine Injection,DGMI)是主要的银杏提取物制剂之一[7-8],其主要活性成分为银杏内酯A(ginkgolide A,GA)、银杏内酯B(ginkgolide B,GB)和银杏内酯K(ginkgolide K,GK)。临床研究显示DGMI对中、老年缺血性脑卒中患者均有显著疗效[9-10]。此外,来自不同实验室的现有研究显示,GA有抗炎和神经保护等作用[11-12];GB有抗炎、抗氧化和血小板拮抗等作用[13-14];GK有抗脑缺血损伤作用[15]。上述研究表明DGMI及其功效成分可能是治疗缺血性脑卒中的潜力药物。为明确DGMI及其功效成分抗脑缺血损伤的潜在作用通路,本研究通过建立人脐静脉内皮细胞(human umbilical vein endothelial cells-T1,HUVEC-T1)氧糖剥夺(oxygen-glucose deprivation,OGD)模型,模拟缺血性脑卒中时细胞缺血缺氧的状态,再利用转录组测序技术对对照组、模型组及给药组的细胞样本进行转录组测序,并结合生信分析方法,鉴定DGMI/GA/ GB/GK抗脑缺血损伤的作用通路及生物学功能,为中药及中药功效成分作用机制的科学阐释提供思路。
1 材料
1.1 细胞
HUVEC-T1细胞购自中国医学科学院基础医学研究所细胞资源中心。
1.2 药品与试剂
DGMI(国药准字Z20120024,批号201201)、GA(批号F15IB207297,质量分数为97.4%)、GB(批号S23HB195722,质量分数≥98%)、GK(批号J12HB184945,质量分数≥98%)由江苏康缘药业股份有限公司提供;CCK-8试剂盒购自美国Bimake公司;DMEM培养基(批号AE29422782)、双抗(批号J190015)、胰酶(批号J1900034)购自美国Hyclone公司;胎牛血清(批号11G292)购自依科赛生物;裂解缓冲液(批号20201211-270-1)、裂解酶(批号20201211-270-1)购自博奥生物集团有限公司。
1.3 仪器
Spectra Max Plus 384酶标仪(美国Molecular Devices公司);T100型PCR仪(美国Bio-Rad公司;4150型TapeStation自动化电泳系统(美国Agilent公司);Invitrogen Qubit4.0核酸定量仪、Countess II型细胞计数器、3111型CO2细胞培养箱、3131型三气培养箱(美国Thermo Fisher Scientific公司);Illumina HiSeq X Ten型测序仪(美国Illumina公司)。
2 方法
2.1 细胞培养
将HUVEC-T1细胞用含10%胎牛血清和1%双抗的完全培养基,于37 ℃、5% CO2的培养箱中培养。实验前用PBS润洗,胰酶消化,显微镜下观察,当80%的细胞呈圆形时,加入完全培养基终止消化,转移至离心管内,800 r/min离心5 min,弃上清,重悬细胞计数,根据实验需求计算稀释体积并稀释。
2.2 CCK-8法测定受试药细胞毒性
HUVEC-T1细胞以8000个/孔接种至96孔板中,于37 ℃恒温培养箱中培养24 h后,将细胞分为对照组(加入含对应溶剂的培养基)和给药组(分别加入含12.5、25、50、100、200 μg/mL DGMI或12.5、25、50、100、200 μmol/L GA、GB、GK的培养基),放入培养箱中继续培养24 h。取出96孔板,每孔加入10 μL CCK-8溶液,将96孔板放入培养箱中避光孵育3 h后,移至酶标仪中检测各组细胞在450 nm处的吸光度()值。
2.3 转录组实验分组与给药
HUVEC-T1细胞以1×104个/孔接种至96孔板中,培养24 h。设置对照组、模型组、给药组,对照组于正常条件下培养;模型组将培养基更换为无糖培养基,置于37 ℃三气培养箱(94% N2、5% CO2、1% O2)中培养4 h,随后将培养基换为完全培养基于CO2培养箱中再培养24 h;给药组相同条件下缺氧培养4 h后分别加入含12.5、25、50、100、200 μg/mL DGMI或12.5、25、50、100、200 μmol/L GA、GB、GK的培养基,于CO2培养箱中培养24 h。加入裂解液,于冰上裂解每个样本孔5 min。裂解完成后,收集裂解液于−80 ℃冰箱保存备用。
2.4 转录组测序
吸取裂解液上清,经反转录、PCR扩增和纯化后,使用双端引物进行建库,质检合格后混样pooling,采用Illumina HiSeq X Ten测序平台进行高通量测序(委托博奥生物集团有限公司完成)。
2.5 转录组数据分析
2.5.1 转录组数据处理 利用Trimmomatic软件[16]对测序数据进行过滤,获取高质量数据信息,再利用HISAT2[17]和StringTie[18]软件对高质量数据进行序列比对和拼接,统计每组样本比对到各个基因上的reads数。
2.5.2 体外模型评价 从基因表达综合数据库(gene expression omnibus,GEO)中下载3组缺血性脑卒中患者与健康人群血液转录组数据(GSE22255、GSE16561、GSE58294)进行基因集富集分析(gene set enrichment analysis,GSEA),获得缺血性脑卒中疾病特征通路集合;将本研究中模型组与对照组的数据对比进行GSEA分析,获得HUVEC-T1细胞OGD模型的特征通路集合,比较缺血性脑卒中疾病特征通路集合与OGD模型特征通路集合的相似程度,用于判断本研究构建的OGD模型是否可以表征临床疾病的特征通路,并用于受试药物评价。
2.5.3 药物处理组逆转通路分析 将上述模型组对照组GSEA分析获得的通路集定义为OGD特征通路集;将每组药物处理后的细胞转录组数据分别以模型组数据为对照进行GSEA分析,获取给药组富集通路,与OGD特征通路集进行比较,并计算药物干预后表达趋势逆转的通路数与OGD特征通路总数的比值(响应值),将该比值作为评价不同受试药物抗OGD损伤能力的指标:若响应值≥50%,表明该受试药物具有强抗OGD损伤能力;若响应值为30%~50%,表明该受试药物有中等抗OGD损伤能力;若响应值<30%,表明该受试药物不具备抗OGD损伤能力。
2.5.4 差异基因筛选 采用DESeq[19]软件包对各组细胞的基因表达量进行差异分析,模型组差异基因以模型组对照组筛选,给药组差异基因以给药组模型组筛选(筛选标准|log2(fold change)|≥1.5且≤0.05)。
2.5.5 GO和KEGG富集分析 对各组差异基因进行基因本体(gene ontology,GO)功能和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,获取富集通路,并用R语言将相关信息可视化。
3 结果
3.1 受试药物的细胞毒性检测
如图1所示,受试药物DGMI在质量浓度不超过200 μg/mL,GA、GB、GK在浓度不超过200 μmol/L时对细胞均无明显毒性,且DGMI表现出一定的促细胞增殖作用。
3.2 转录组测序数据质量分析
在所建立的测序文库中,36组样本碱基质量超过20的比例在91.84%以上,超过30的比例在84.42%以上,与指定参考基因组的序列比对率在93.15%以上,表明测序结果较好。
3.3 体外模型评价
如图2、3所示,与健康人群相比,3组缺血性脑卒中患者数据的富集通路中共有27条通路重合且变化趋势相同。与对照组相比,模型组共富集到66条通路,其中15条与缺血性脑卒中疾病通路集中的通路重合且变化趋势相同,包括细胞凋亡、有丝分裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)、Toll样受体、NOD样受体等与炎症、免疫和凋亡相关的通路。

与对照组比较:*P<0.05 **P<0.01 ***P<0.001

*重合通路,图3同

图3 受试药物干预对OGD损伤后的HUVEC-T1细胞的影响
3.4 药物干预对GSEA通路的影响
如表2所示,16个不同浓度药物处理组中,11组表现出中等及以上抗OGD损伤能力(响应值>30%),其中GB 50 μmol/L(响应值38/66=57.58%)、GK 50 μmol/L(响应值40/66=60.61%)、DGMI 25 μg/mL(响应值35/66=53.03%)均表现出强抗OGD损伤能力,GA 50 μmol/L(响应值32/66=48.48%)表现出中等抗OGD损伤能力。上述4个组别均逆转了FcεRI、血管内皮生长因子(vascular endothelial growth factor,VEGF)、MAPK和NOD样受体信号通路的表达趋势,且16个药物处理组中,FcεRI、VEGF、MAPK和NOD样受体信号通路的表达趋势均被8个以上组别逆转。此外,B细胞受体、T细胞受体、血管平滑肌收缩、自然杀伤细胞介导的细胞毒性等通路均在GA、GB、GK 50 μmol/L通路中被逆转,DGMI 25 μg/mL中未被逆转;而转化生长因子-β(transforming growth factor-β,TGF-β)信号通路则仅在DGMI 25 μg/mL中被逆转,单体中未被逆转(图3)。
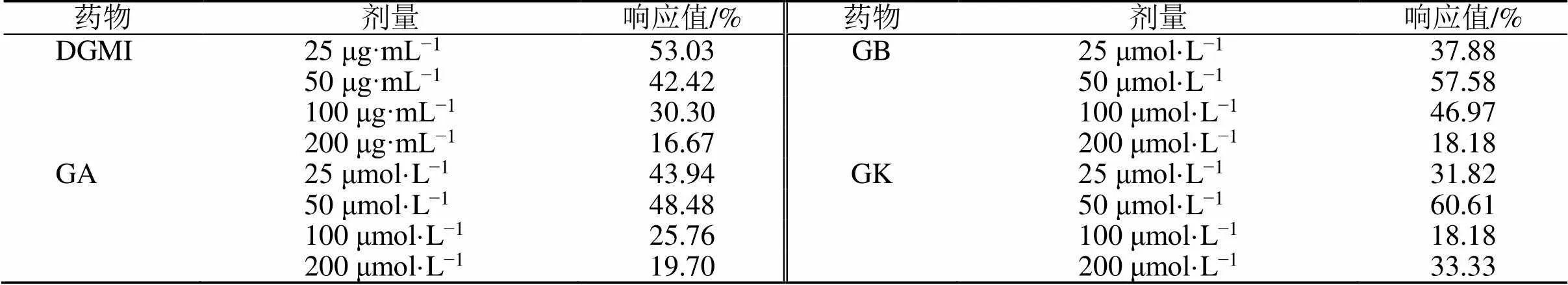
表2 药物干预后各组的响应值
3.5 差异基因分析
如图4所示,与对照组相比,模型组共筛选获得439个差异表达基因,其中127个基因上调,312个基因下调;与模型组相比,药物处理组细胞的差异基因数量见表3,进一步分析发现,部分模型组差异基因在药物干预后表达趋势被逆转(图5、6)。

图4 模型组差异基因火山图

表3 受试药物干预对OGD处理后的HUVEC-T1细胞基因表达的影响
M-模型组
M-model group
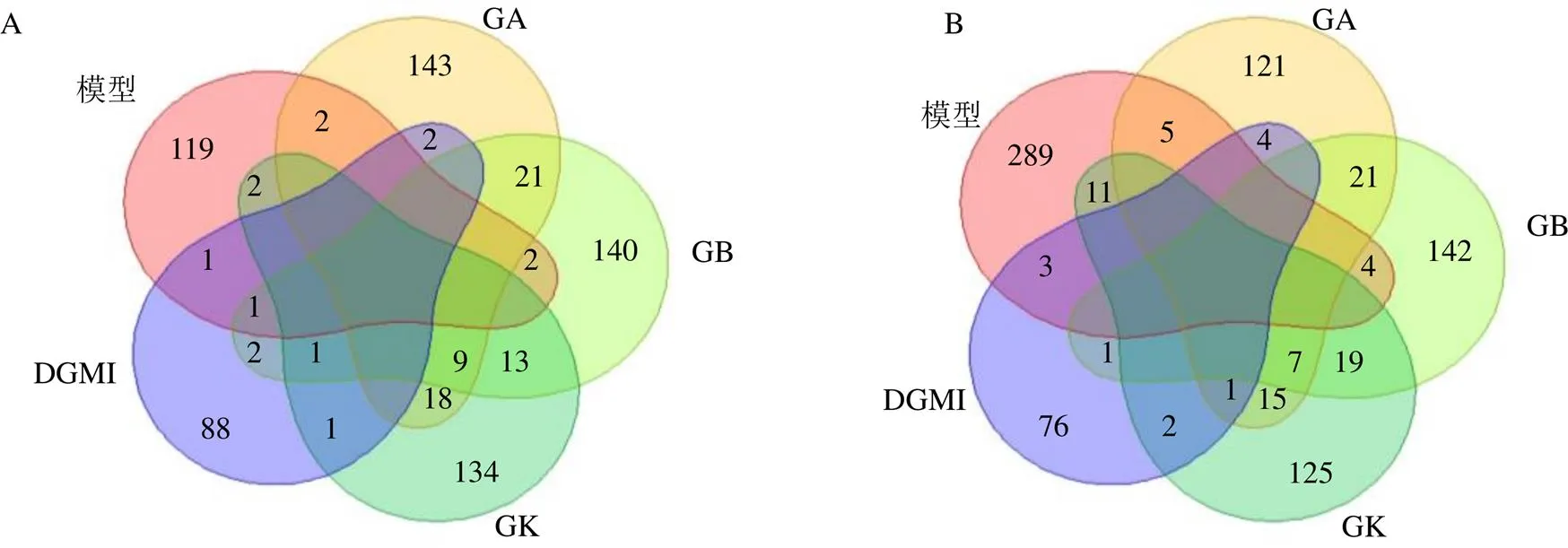
A-模型组上调基因与给药组下调基因的交集 B-模型组下调基因与给药组上调基因的交集

图6 模型组与药物处理组细胞差异基因热图
3.6 受试药物干预对细胞功能的影响
为明确HUVEC-T1细胞OGD处理以及OGD处理+不同浓度药物干预后所涉及的生物学功能变化,本研究对模型组及药物处理组细胞的差异表达基因进行GO功能富集分析,主要包括生物学过程(GO biological process,GO_BP)、细胞组分(GO cellular component,GO_CC)和分子功能(GO molecular function,GO_MF)富集分析。
3.6.1 差异基因GO_BP富集分析 结果显示,HUVEC-T1细胞OGD处理后主要富集在机体内凝血功能、血氧运输、细胞对外界刺激(生物刺激、剪切应力刺激)等生物过程(图7-a)。药物干预后,GA组细胞富集在血管生成、碳水化合物代谢等生物过程;GB组细胞富集在生长发育、TORC1信号的调节等生物过程;GK组细胞富集在信号转导、细胞分化等生物过程;DGMI组富集在钙离子跨膜转运、对铵离子的反应等生物过程(图8)。
3.6.2 差异基因GO_CC富集分析 结果显示,模型组细胞主要富集在细胞质膜、肌动蛋白细胞骨架与细胞核等组分(图7-b)。药物处理后,GA组细胞主要富集在细胞核、细胞质与细胞复合物等组分;GB组细胞主要富集在突触膜等组分;GK组细胞主要富集在细胞器、突触膜等组分;DGMI组细胞主要富集在突触后膜等组分(图9)。
3.6.3 差异基因GO_MF富集分析 结果显示,模型组细胞主要富集在GTP酶激活及活性调节等功能(图7-c)。药物处理后,GA、GB和GK组细胞均主要富集在蛋白结合、酶活性调节等功能;GK组细胞还在钙释放通道活性调节功能富集;DGMI组细胞则主要在酶活性调节功能富集(图10)。
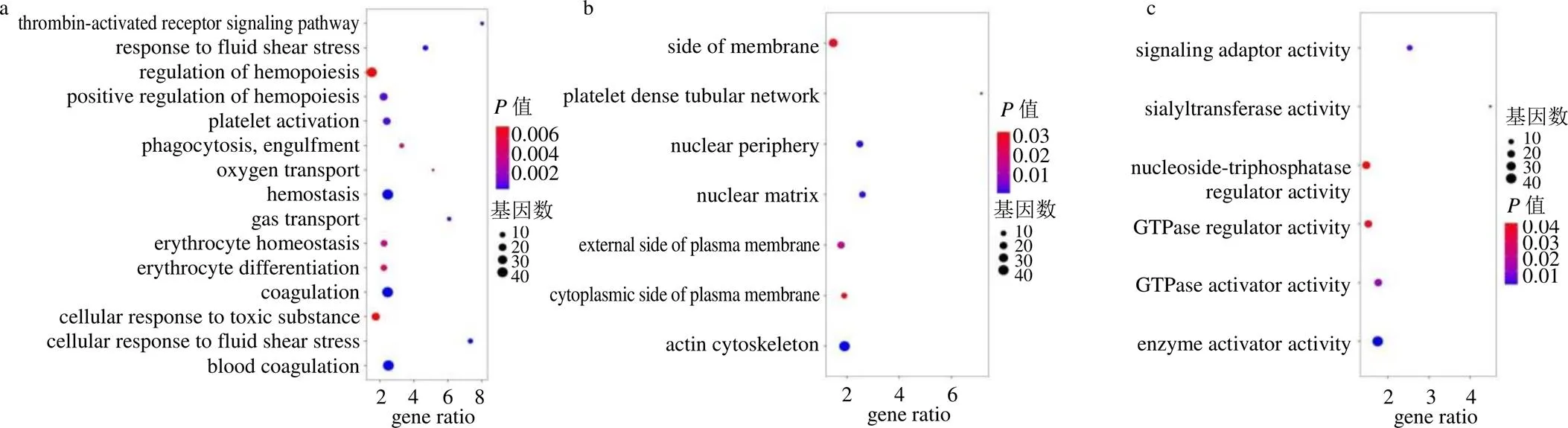
a-GO_BP分析 b-GO_CC分析 c-GO_MF分析
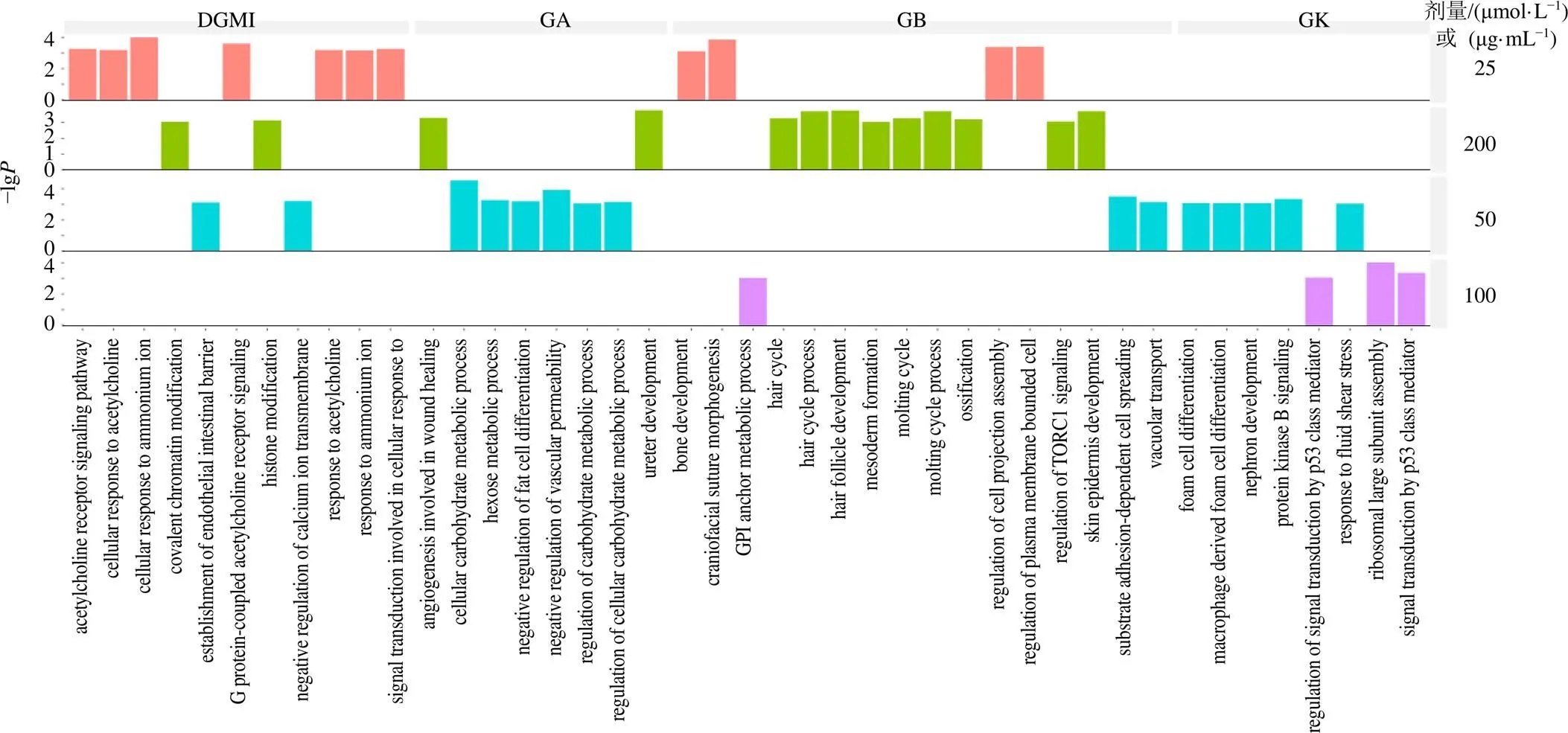
图8 给药组差异基因GO_BP富集分析
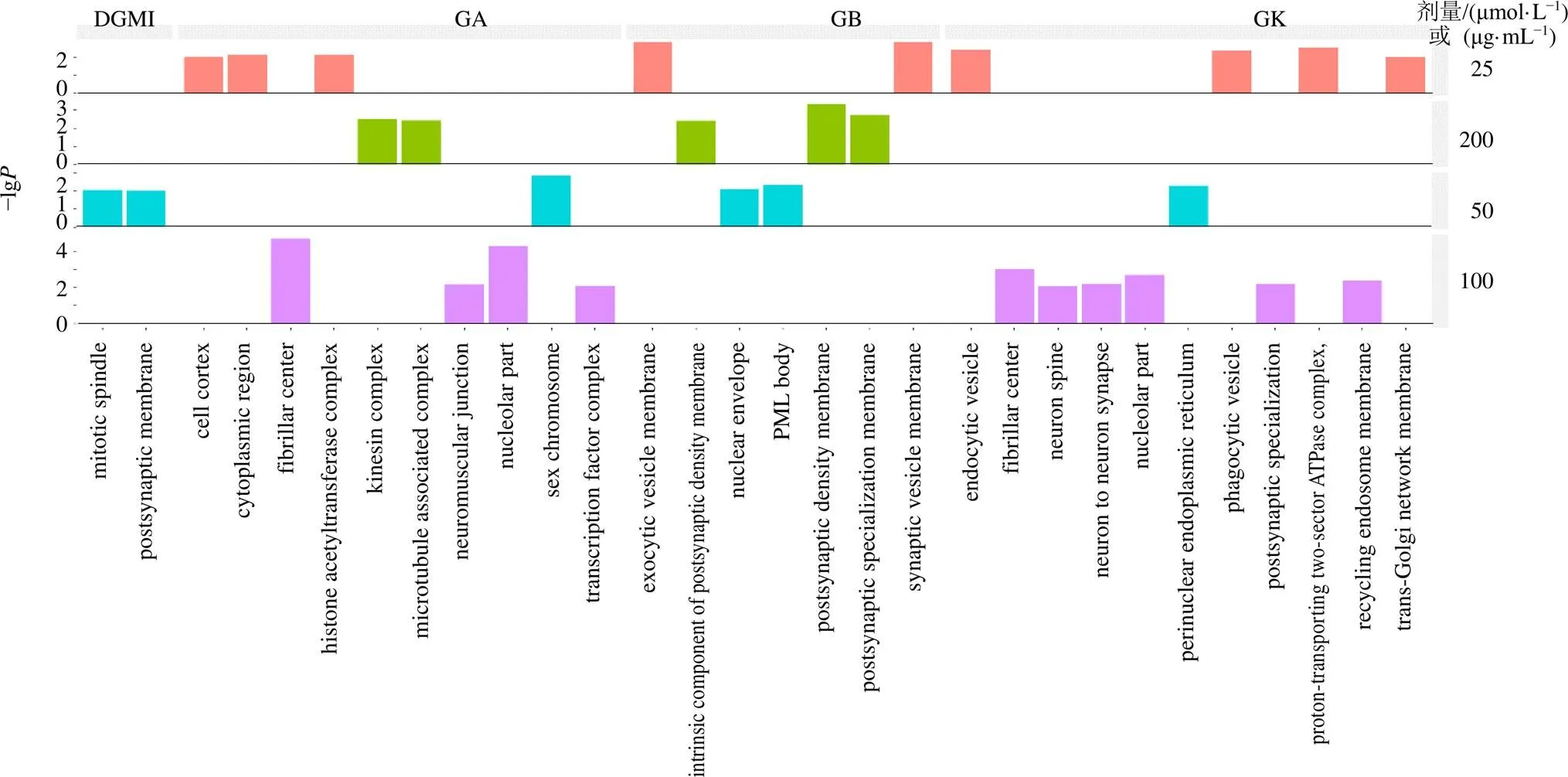
图9 给药组差异基因GO_CC通路富集分析
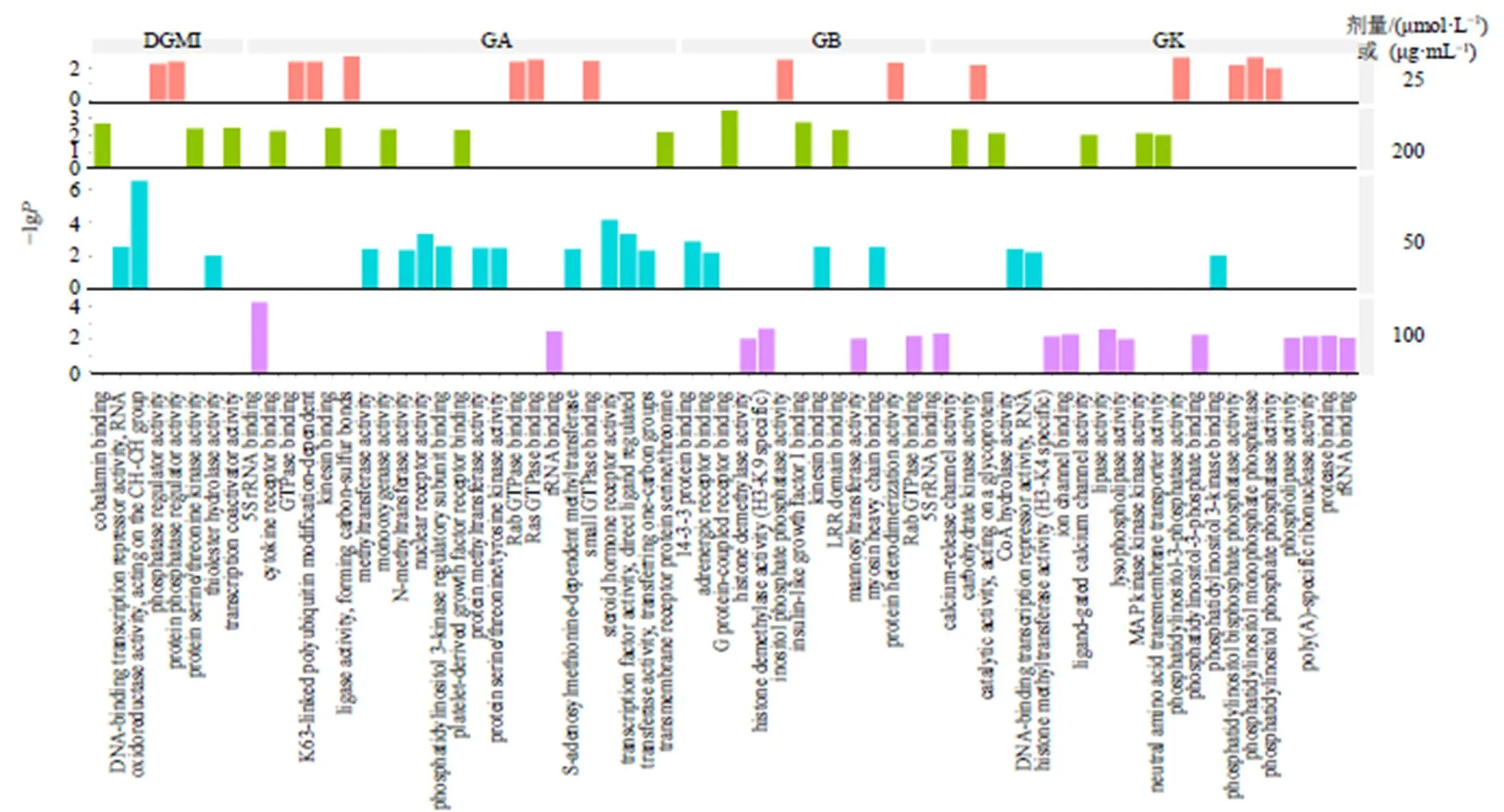
图10 给药组差异基因GO_MF通路富集分析
3.7 差异基因KEGG通路富集分析
为明确DGMI及其功效成分影响OGD处理后HUVEC-T1细胞的功能和状态的KEGG作用通路,本研究对获得的差异基因进行KEGG通路富集分析。结果显示,模型组差异基因富集于13条KEGG疾病通路,主要涉及炎症、凋亡和免疫反应。与模型组相比,16个药物处理组中有4组在13条KEGG疾病通路上富集(图11),主要包括血管平滑肌收缩、血小板活化、自然杀伤细胞介导的细胞毒性和磷脂酶D信号通路。
中药制剂及活性成分具有多靶点特性,可能涉及对其他通路的影响,本研究进一步对给药组差异基因进行KEGG分析,筛选在药物处理组中显著富集且属于心血管疾病、细胞生长与死亡、发育与再生、免疫系统、脂质代谢、神经系统、信号转导7类二级通路中的KEGG通路。结果显示,不同浓度药物处理后,细胞还在神经发育、能量供应、血管再生和神经保护相关通路显著富集(图12)。
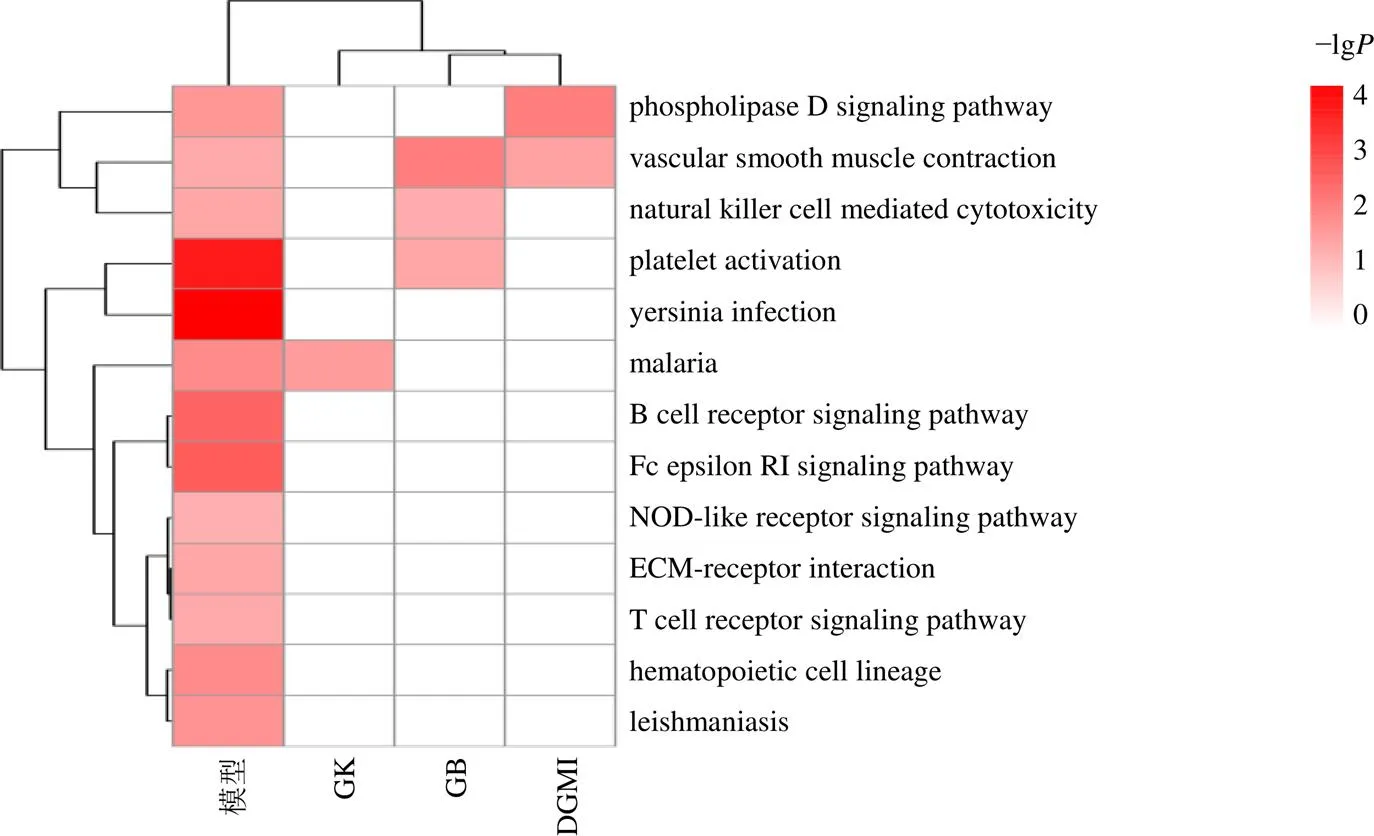
图11 差异基因KEGG富集分析
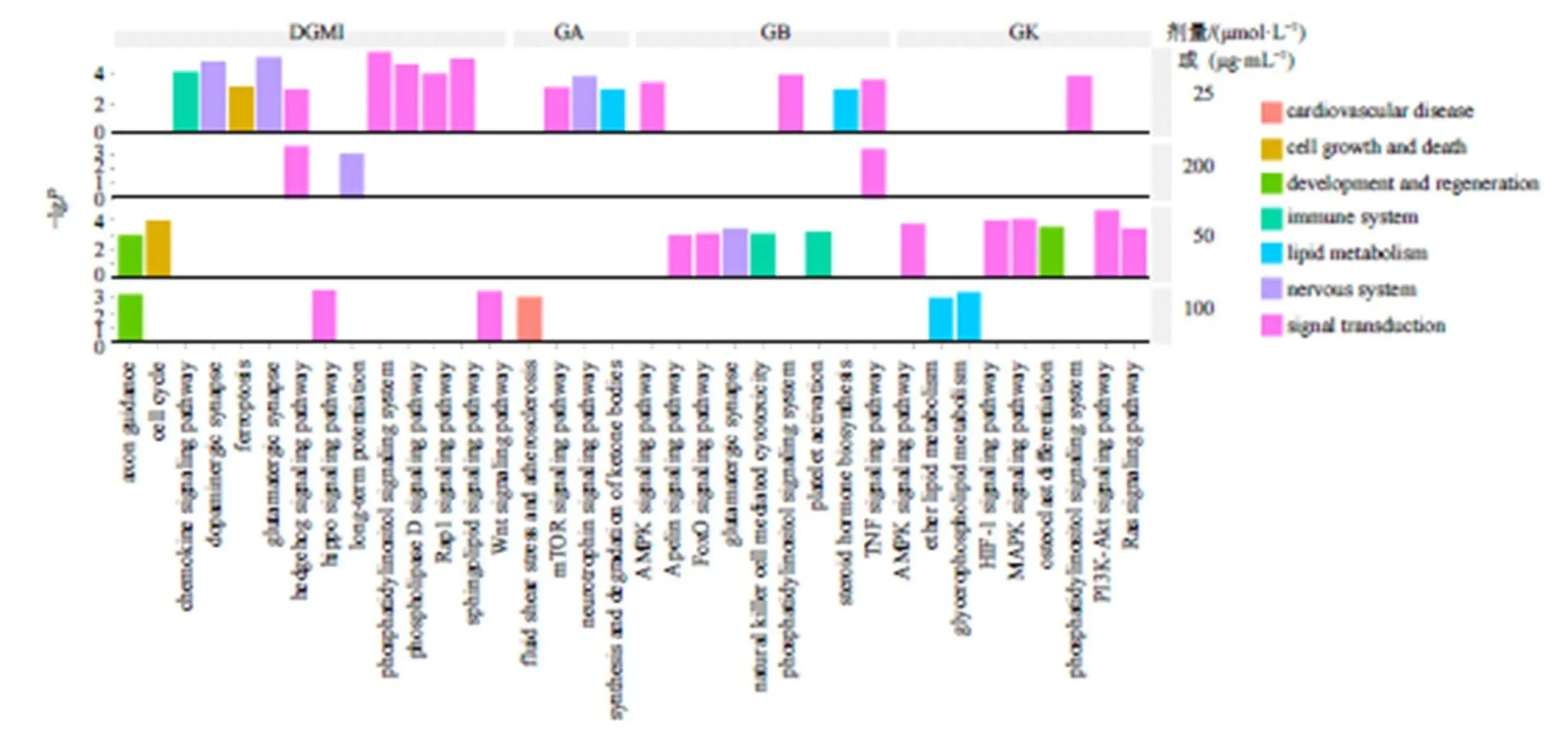
图12 药物处理组差异基因在7类KEGG通路中的富集情况
4 讨论
近年来,大量的研究证实部分银杏叶提取物制剂对缺血性脑卒中后脑损伤具有改善作用,如金纳多[20-22]、DGMI[9,23-24]等。DGMI作为主要的银杏叶提取物制剂之一[8],已有较多抗脑缺血相关的研究,但这些研究大多以动物为载体且主要针对特定通路或靶标,具有研究偏好,忽略了对潜在作用通路的探索;此外,在动物体内开展中药提取物制剂作用机制研究存在动物个体差异大,研究成本高,实验周期长等缺陷。因此,开发针对多个通路、低成本、可重复性强且普遍适用的研究策略对于开展中药及中药功效成分的作用机制研究具有重要意义。转录组学能全面地反映细胞内的基因表达情况,通过比较细胞内基因表达情况可以明确对照组、模型组以及药物处理组细胞的差异,更全面地研究药物作用机制及通路。
本研究基于二代测序技术的高通量转录组测序策略,在体外OGD诱导的HUVEC-T1细胞模型上评价中药提取物注射液DGMI及其功效成分的抗OGD损伤能力及潜在作用通路。通过对GEO数据库中缺血性脑卒中患者与正常人群转录组数据及模型组与对照组细胞转录组数据进行GSEA分析并比较,明确了OGD处理后的HUVEC-T1细胞具有部分缺血性脑卒中的病理特征,提示本研究选用的体外细胞模型是模拟缺血性脑卒中的合理模型。
进一步GSEA分析发现,经DGMI、GA、GB、GK干预后,模型组细胞中的OGD特征通路表达趋势被不同程度逆转,提示DGMI及GA/GB/GK均具备一定的抗OGD损伤活性。缺血性脑卒中患者及本研究模型组细胞的GSEA通路中,NOD样受体、MAPK、FcεRI、VEGF通路均为上调趋势,在DGMI、GA、GB、GK干预后,NOD样受体、MAPK、FcεRI、VEGF通路均变为下调趋势。过往的研究证实,卒中发生后,由于脑内ATP供应减少,胞内K+外流、Ca2+内流,NOD样受体炎性小体被激活,进而激活MAPK和核因子-κB(nuclear factor-κB,NF-κB)通路,诱导NOD样受体家族中炎性小体相关蛋白的转录翻译,导致促炎细胞因子释放增加,炎症加剧,最终诱导细胞凋亡,导致大脑损伤[25-27]。也有研究证明FcεRI受体可与IgE分子结合激活肥大细胞释放促炎细胞因子,加剧炎症[27-28]。VEGF对缺血性脑卒中恢复具有重要作用,但在缺血性脑卒中急性期,急剧增加的VEGF可能会导致血脑屏障和血管破坏[29]。在系列针对临床缺血性脑卒中患者的转录组研究中,有研究者也认为NOD样受体、MAPK和FcεRI信号通路是缺血性脑卒中患者诊断与治疗的关键通路[30-31]。提示DGMI、GA、GB、GK均具有抗OGD损伤作用,其作用机制可能为诱导下调NOD样受体、MAPK、FcεRI和VEGF信号通路,发挥减轻炎症、抑制细胞凋亡和保护血脑屏障等作用,进而减轻脑缺血损伤。GSEA分析还发现与DGMI相比,GA、GB、GK单体对免疫相关通路的调节作用更为显著,如调节T细胞受体、B细胞受体等;而DGMI则还对促进血管生成、抑制氧化应激、代谢等通路调节能力更强,如TGF-β信号通路等。
此外,差异基因分析结果显示,与对照组相比,模型组细胞筛选获得439个差异表达基因,其中127个基因上调,312个基因下调;DGMI、GA、GB、GK干预后,可逆转31个差异基因,包括前列腺素内过氧化物合成酶2(prostaglandin-endoperoxide synthase 2,PTGS2)、基质金属肽酶14(matrix metallopeptidase 14,MMP14)、胰岛素样生长因子结合蛋白2(insulin like growth factor binding protein 2,IGFBP2)等。在针对临床缺血性脑卒中患者的研究中,PTGS2、MMP14被认为是与缺血性脑卒中相关的关键基因、是潜在的诊断生物标志物,被推荐为缺血性脑卒中的治疗靶点[32-34],IGFBP2被认为是治疗缺血性脑卒中的新型生物标志物[35-37]。提示DGMI、GA、GB、GK可能通过调控MMP14、PTGS2、IGFBP2等多个基因参与缺血性脑卒中后的大脑修复过程。
DGMI、GA、GB、GK干预可以改变OGD处理后HUVEC-T1细胞内的主要生物学过程,由血氧运输和应对外界刺激反应转变为血管生成、生长发育与代谢调节等。在差异基因KEGG分析中,模型组共富集到13条通路,其中磷脂酶D信号通路与脑缺血密切相关,磷脂酶D活性增加会促进脑缺血的发生,加剧大脑损伤[38-39];T细胞受体、B细胞受体信号通路与细胞内免疫反应相关[40];FcεRI、NOD样受体信号通路与炎症和凋亡相关[41]。在系列针对临床缺血性脑卒中患者与健康人群转录组数据的差异基因KEGG富集分析中,FcεRI、NOD样受体、T细胞受体、B细胞受体等信号通路也被显著富集[30-31]。经DGMI、GA、GB、GK干预后,DGMI组细胞差异基因在血管平滑肌收缩和磷脂酶D信号通路富集;GB组细胞差异基因在血管平滑肌收缩、血小板活化、自然杀伤细胞介导的细胞毒性通路富集。提示DGMI可能通过干预血管平滑肌收缩和磷脂酶D信号通路;GB可能通过干预血管平滑肌收缩、血小板活化和自然杀伤细胞介导的细胞毒性发挥抗OGD损伤作用。此外,对药物处理组KEGG分析结果进一步分析发现GA组细胞还在mTOR等信号通路富集;GK组细胞还在MAPK等信号通路富集;DGMI组细胞还在Hedgehog等信号通路富集。尽管这3条通路未在模型组差异基因KEGG分析中被富集,但在模型组GSEA分析中,该3条通路均被富集到。有研究表明mTOR信号通路可维持细胞基本功能,促进轴突再生和神经功能恢复,促进缺氧诱导因子1合成以增加能量供应,维持线粒体功能,改善大脑损伤[42-44]。也有研究显示Hedgehog信号通路参与诱导缺血后新生血管的生成[45],其中音猬因子(Shh)可以控制部分促进新生血管形成和血管成熟的生长因子表达[46],指导血管形成和成熟[47]。提示这部分通路可能也是DGMI、GA、GB、GK抗OGD损伤的潜在作用通路。
本研究采用2类分析方法,即基于全部基因的GSEA分析方法和基于差异基因的GO和KEGG分析方法。在本研究中,与差异基因GO和KEGG分析结果相比,GSEA分析得出的结果与临床缺血性脑卒中患者转录组分析结果更吻合。一般而言,中药提取物制剂及中药活性成分作用机制比较复杂,且具有弱结合、多靶点的特性,能同时影响多个基因的表达[48],差异基因相关分析仅关注差异最显著的部分基因,可能无法完全展示中药制剂或中药活性成分潜在的作用机制及通路。与差异基因分析方法相比,GSEA分析方法可能更适用于中药制剂及中药活性成分的作用机制研究。
综上,本研究应用转录组学研究方法对DGMI及其功效成分抗OGD损伤的作用机制及通路进行探索,首先通过对缺血性脑卒中患者与本研究中模型组细胞数据进行分析对比,证实HUVEC-T1 OGD模型能够模拟部分缺血性脑卒中的病理特征。然后对本研究中的细胞转录组数据进行GSEA、差异基因GO和KEGG分析,明确了DGMI及其功效成分具有抗OGD损伤能力以及发挥抗OGD损伤作用的主要作用机制及通路,即通过下调FcεRI、NOD样受体、MAPK和VEGF信号通路发挥减轻炎症、抑制细胞凋亡和保护血脑屏障作用;通过影响磷脂酶D、血小板活化等信号通路发挥抗OGD损伤作用。此外,本研究还发现了部分DGMI及其功效成分抗OGD损伤的潜在作用通路。本研究为后续深入挖掘DGMI及其功效成分治疗缺血性脑卒中的分子机制和靶点提供了研究思路及参考。
利益冲突 所有作者均声明不存在利益冲突
[1] Campbell B C V, De Silva D A, MacLeod M R,. Ischaemic stroke [J]., 2019, 5: 70.
[2] Wang W Z, Jiang B, Sun H X,. Prevalence, incidence, and mortality of stroke in China: Results from a nationwide population-based survey of 480 687 adults [J]., 2017, 135(8): 759-771.
[3] Sun K, Fan J Y, Han J Y. Ameliorating effects of traditional Chinese medicine preparation, Chinese materia medica and active compounds on ischemia/reperfusion-induced cerebral microcirculatory disturbances and neuron damage [J]., 2015, 5(1): 8-24.
[4] 张鹏飞, 廖丽君, 邓祯, 等. 银杏叶提取物的药理作用及其临床应用研究进展 [J]. 辽宁中医杂志, 2017, 44(2): 4.
[5] 刘磊, 卫昊, 陈丹丹, 等. 银杏叶提取物调控TLR4/NF-κB通路减轻急性脑缺血小鼠脑皮质缺血研究 [J]. 中草药, 2019, 50(21): 5282-5288.
[6] 陈璟, 吕志阳, 汪洁, 等. 银杏总内酯在脑缺血损伤模型大鼠体内的PK-PD研究 [J]. 中草药, 2018, 49(4): 885-890.
[7] 孙毅, 朱永红, 童正兵, 等. 银杏内酯注射液及其制备方法: 中国, CN102626383A [P]. 2012-08-08.
[8] 杜雨芯, 操娇娇, 张倩霞, 等. 银杏二萜内酯通过拮抗PAFR和调节SIRT1/STAT3抑制氧化应激诱导的PC12神经元衰老研究[J]. 中草药, 2023, 54(9): 2793-2801.
[9] Zhang D D, Wang Y, Meng Z H,. Efficacy of Diterpene Ginkgolides Meglumine Injection in elderly patients with ischemic stroke: A post hoc analysis of a randomized controlled trial [J]., 2022, 106: 154391.
[10] 杜晓, 韩舟, 何斌, 等. 银杏二萜内酯葡胺注射液对急性缺血性脑卒中再通成功患者预后的影响[J]. 药物评价研究, 2023, 46(3): 607-613.
[11] 黄维玲, 马宇昕, 刘靖, 等. 银杏内酯A对中枢神经系统作用及机制的研究进展 [J]. 解剖学研究, 2017, 39(2): 149-151.
[12] Li Y, Wu Y N, Yao X L,. Ginkgolide A ameliorates LPS-induced inflammatory responsesand[J]., 2017, 18(4): 794.
[13] Nabavi S M, Habtemariam S, Daglia M,. Neuroprotective effects of ginkgolide B against ischemic stroke: A review of current literature [J]., 2015, 15(21): 2222-2232.
[14] Tsai J Y, Su K H, Shyue S K,. EGb761 ameliorates the formation of foam cells by regulating the expression of SR-A and ABCA1: Role of haem oxygenase-1 [J]., 2010, 88(3): 415-423.
[15] 马舒伟, 张现涛, 何盛江, 等. 银杏叶内酯K对大鼠脑缺血再灌注损伤的保护作用 [J]. 中国药学杂志, 2011, 46(13): 993-997.
[16] Bolger A M, Lohse M, Usadel B. Trimmomatic: A flexible trimmer for Illumina sequence data [J]., 2014, 30(15): 2114-2120.
[17] Kim D, Langmead B, Salzberg S L. HISAT: A fast spliced aligner with low memory requirements [J]., 2015, 12(4): 357-360.
[18] Pertea M, Pertea G M, Antonescu C M,. StringTie enables improved reconstruction of a transcriptome from RNA-seq reads [J]., 2015, 33(3): 290-295.
[19] Anders S, Huber W. Differential expression analysis for sequence count data [J]., 2010, 11(10): R106.
[20] Feng Z L, Sun Q, Chen W,. The neuroprotective mechanisms of ginkgolides and bilobalide in cerebral ischemic injury: A literature review [J]., 2019, 25(1): 57.
[21] Li S S, Zhang X J, Fang Q,.extract improved cognitive and neurological functions of acute ischaemic stroke: A randomised controlled trial [J]., 2017, 2(4): 189-197.
[22] Kressmann S, Müller W E, Blume H H. Pharmaceutical quality of differentbrands [J]., 2002, 54(5): 661-669.
[23] Wang T J, Wu Z Y, Yang C H,. Multiple mechanistic models reveal the neuroprotective effects of diterpene ginkgolides against astrocyte-mediated demyelination via the PAF-PAFR pathway [J]., 2022, 50(6): 1565-1597.
[24] 张学非, 曹泽彧, 许治良, 等. 银杏内酯治疗脑缺血作用机制的研究进展 [J]. 中草药, 2016, 47(16): 2943-2948.
[25] Kufer T A. Signal transduction pathways used by NLR-type innate immune receptors [J]., 2008, 4(5): 380-386.
[26] Liu H Q, Wei X B, Kong L J,. NOD2 is involved in the inflammatory response after cerebral ischemia-reperfusion injury and triggers NADPH oxidase 2-derived reactive oxygen species [J]., 2015, 11(5): 525-535.
[27] Xu Q X, Zhao B, Ye Y Z,. Relevant mediators involved in and therapies targeting the inflammatory response induced by activation of the NLRP3 inflammasome in ischemic stroke [J]., 2021, 18(1): 123.
[28] Klemm S, Ruland J. Inflammatory signal transduction from the Fc epsilon RI to NF-kappa B [J]., 2006, 211(10): 815-820.
[29] Geiseler S, Morland C. The Janus face of VEGF in stroke [J]., 2018, 19(5): 1362.
[30] Wei D C, Chen J, Chen X P,. Screening for differentially expressed circRNAs in ischemic stroke by RNA sequencing [J]., 2021, 21(1): 370.
[31] Cui S S, Zhao Y F, Huang M H,. Integrated microarray analysis to identify genes and small-molecule drugs associated with stroke progression [J]., 2022, 2022: 7634509.
[32] Yang Y, Rosenberg G A. Matrix metalloproteinases as therapeutic targets for stroke [J]., 2015, 1623: 30-38.
[33] Zhu W H, Nan Y N, Wang S Q,. Bioinformatics analysis of gene expression profiles of sex differences in ischemic stroke [J]., 2019, 2019: 2478453.
[34] Chen G Z, Li L, Tao H M. Bioinformatics identification of ferroptosis-related biomarkers and therapeutic compounds in ischemic stroke [J]., 2021, 12: 745240.
[35] Fan Q R, Zhou J, Wang Y L,. Chip-based serum proteomics approach to reveal the potential protein markers in the sub-acute stroke patients receiving the treatment of Ginkgo Diterpene Lactone Meglumine Injection [J]., 2020, 260: 112964.
[36] Prentice R L, Zhao S S, Johnson M,. Proteomic risk markers for coronary heart disease and stroke: Validation and mediation of randomized trial hormone therapy effects on these diseases [J]., 2013, 5(12): 112.
[37] Tao H M, Dong L H, Li L. N6-methyladenosine modulation classes and immune microenvironment regulation in ischemic stroke [J]., 2022, 15: 1013076.
[38] Stegner D, Thielmann I, Kraft P,. Pharmacological inhibition of phospholipase D protects mice from occlusive thrombus formation and ischemic stroke: Brief report [J]., 2013, 33(9): 2212-2217.
[39] Lee M Y, Kim S Y, Min D S,. Upregulation of phospholipase D in astrocytes in response to transient forebrain ischemia [J]., 2000, 30(3): 311-317.
[40] Kim Y Y, Je I G, Kim M J,. 2-Hydroxy-3-methoxybenzoic acid attenuates mast cell-mediated allergic reaction in mice via modulation of the FcεRI signaling pathway [J]., 2017, 38(1): 90-99.
[41] Wen H, Miao E A, Ting J P. Mechanisms of NOD-like receptor-associated inflammasome activation [J]., 2013, 39(3): 432-441.
[42] Li M X, Weng J W, Ho E S,. Brain delivering RNA-based therapeutic strategies by targeting mTOR pathway for axon regeneration after central nervous system injury [J]., 2022, 17(10): 2157-2165.
[43] Düvel K, Yecies J L, Menon S,. Activation of a metabolic gene regulatory network downstream of mTOR complex 1 [J]., 2010, 39(2): 171-183.
[44] Cunningham J T, Rodgers J T, Arlow D H,. mTOR controls mitochondrial oxidative function through a YY1-PGC-1alpha transcriptional complex [J]., 2007, 450(7170): 736-740.
[45] Mooney C J, Hakimjavadi R, Fitzpatrick E,. Hedgehog and resident vascular stem cell fate [J]., 2015, 2015: 468428.
[46] Chinchilla P, Xiao L Q, Kazanietz M G,. Hedgehog proteins activate pro-angiogenic responses in endothelial cells through non-canonical signaling pathways [J]., 2010, 9(3): 570-579.
[47] Dohle E, Fuchs S, Kolbe M,. Sonic hedgehog promotes angiogenesis and osteogenesis in a coculture system consisting of primary osteoblasts and outgrowth endothelial cells [J]., 2010, 16(4): 1235-1237.
[48] Wang J, Guo Z, Fu Y,. Weak-binding molecules are not drugs?-toward a systematic strategy for finding effective weak-binding drugs [J]., 2017, 18(2): 321-332.
Transcriptome study of Diterpene Ginkgolides Meglumine Injection and its components against oxygen-glucose deprivation damage in HUVEC-T1 cells
XU Xiao-bo1, WU Zi-yin2, 3, ZHANG Xin-zhuang2, 3, CAO Liang2, 3, WANG Zhen-zhong2, 3, XIAO Wei1, 2, 3
1. Nanjing University of Chinese Medicine, Nanjing 210023, China 2. Jiangsu Kanion Pharmaceutical Co., Ltd., Lianyungang 222001, China 3. State Key Laboratory of New Technology for Pharmaceutical Process of Traditional Chinese Medicine, Lianyungang 222001, China
To study the potential pathway of Diterpene Ginkgolides Meglumine Injection (银杏二萜内酯葡胺注射液, DGMI) and its ginkgo diterpene lactone components against oxygen-glucose deprivation (OGD) injury in human umbilical vein endothelial cells-T1 (HUVEC-T1).CCK-8 method was used to determine the toxicity of ginkgolide A (GA), ginkgolide B (GB), ginkgolide K (GK) and DGMI at different concentrations on HUVEC-T1 cells, and determine the drug treatment cell concentration. Transcriptomic sequencing was performed on the cell samples of solvent control group (DMSO), model group (OGD/R 4 h/24 h) and the drug administration group (modeling + different doses of GA, GB, GK, DGMI treatment), respectively. Through bioinformatics analysis, the transcriptomic data of ischemic stroke patients in GEO database was used as reference, gene set enrichment analysis (GSEA) and differential genes enrichment analysis methods were used to evaluate the HUVEC-T1 OGD model and the anti-OGD ability of different concentrations of drugs, and to clarify the potential mechanism of action of DGMI and its functional components.GSEA analysis showed that the similarity between the disease enrichment pathway obtained from the analysis of blood transcriptome data of clinical ischemic stroke patients and the enrichment pathway obtained from the cell model sequencing results in this experiment was 55.6%. Compared with model group, the main signaling pathways in DGMI, GA, GB, GK treatment group were significantly enriched, including FcεRI, NOD like receptors, mitogen-activated protein kinase (MAPK), vascular endothelial growth factor (VEGF), etc. Differential genes analysis showed that 439 differential genes were detected in model group compared with control group. Gene ontology (GO) analysis of differential genes was mainly enriched in the stress response process, while Kyoto encyclopedia of genes and genomes (KEGG) analysis was mainly enriched in phospholipase D, FcεRI, Nod-like receptor and platelet activation signaling pathways. Compared with model group, GO analysis of differential genes in administration group was mainly enriched in hematopoietic and metabolic processes, while KEGG analysis was mainly enriched in signal pathways such as platelet activation and phospholipase D, etc.The HUVEC-T1OGD model simulated the pathological features of partial ischemic stroke. DGMI, GA, GB, GK have anti-OGD damage effects. The key genes and signaling pathways of DGMI, GA, GB, GK in anti-OGD injury mainly focus on anti-inflammatory, anti-apoptosis, regulation of platelet activation and other biological processes, which may down-regulate FcεRI, Nod-like receptor, MAPK and VEGF signaling pathways, and intervene in platelet activation and phospholipase D and other signaling pathways.
Diterpene Ginkgolides Meglumine Injection; ginkgolide A;ginkgolide B; ginkgolide K; human umbilical vein endothelial cells; oxygen-glucose deprivation model; transcriptomic sequencing
R285.5
A
0253 - 2670(2023)13 - 4233 - 12
10.7501/j.issn.0253-2670.2023.13.016
2022-11-25
江苏省自然科学青年基金资助项目(BK20210139)
徐小波,男,硕士研究生,研究方向为中药新药的研究与开发。E-mail: 1165992664@qq.com
通信作者:肖 伟,中国工程院院士,研究员,博士生导师,研究方向为中药新药的研究与开发。E-mail: kanionlunwen@163.com
武子寅,博士,研究方向为中药新药研发。E-mail: cs416@qq.com
[责任编辑 李亚楠]
