黑柳树皮化学成分及其抑制脂肪生成活性研究
2023-07-06甲次拉母蒲沙龙张吉仲李丽梅
刘 欢,甲次拉母,蒲沙龙,张吉仲,李丽梅
黑柳树皮化学成分及其抑制脂肪生成活性研究
刘 欢,甲次拉母,蒲沙龙,张吉仲,李丽梅*
西南民族大学药学院四川 成都 610041
研究黑柳树皮的化学成分,并对部分化合物进行抑制脂肪生成活性研究。采用多种色谱分离技术进行分离和纯化,并运用核磁共振波谱技术鉴定其结构。以秀丽隐杆线虫为实验模型,利用油红O和苏丹黑B染色,研究从黑柳树皮中分离到的部分化合物对秀丽隐杆线虫脂肪生成的影响。从黑柳树皮甲醇提取物的正丁醇萃取部位中共分离得到12个化合物,分别鉴定为柳皮苷(1)、特里杨苷(2)、7-水杨酰-2′-苯甲酰水杨苷(3)、cochinchiside A(4)、2′-苯甲酰水杨苷(5)、胡萝卜苷(6)、rosin(7)、水杨苷(8)、chalcononaringenin-2′--β--glucopyranoside(9)、3,4-二羟基苯甲酸(10)、苯甲酸(11)和水杨酸(12)。其中化合物1、2、5和9能够显著抑制秀丽隐杆线虫脂肪生成。12个化合物均为首次从黑柳中分离得到。化合物5对秀丽隐杆线虫脂肪生成的抑制作用最强。
黑柳;秀丽隐杆线虫;抑制脂肪生成活性;柳皮苷;特里杨苷;2′-苯甲酰水杨苷
杨柳科柳属L. 植物资源丰富,全球约有520种,主要分布于北半球温带及寒带地区,极少数分布在亚热带和南半球地区;我国有257种、122变种、33变型,在各省均有分布[1]。其树皮、枝、叶、花等部位均可入药,具有悠久的药用历史。19世纪40年代,化学家首次从柳树皮中分离出水杨酸并发现其具有显著的解热和镇痛作用,后来以之为先导化合物诞生了医药史上的经典药物——阿司匹林,至今仍是世界上应用最广泛的解热、镇痛和抗炎药[2]。后续的研究表明柳属植物主要含有黄酮类、水杨酸衍生物类、苯丙素类等酚性成分,具有抗肿瘤、镇痛抗炎、抗氧化、降血糖、调节神经系统等药理作用[3]。其中酚类成分的减肥作用受到研究者的持续关注,例如Han等[4-5]研究证实旱柳Koidz叶中的多酚组分具有减肥作用;刘可越等[6]发现垂柳L.叶中木犀草素等黄酮类化合物能够促进去甲肾上腺素分解脂肪,抑制小肠吸收脂肪酸;Lee等[7]从朝鲜垂柳Lévl.树枝中发现柳皮苷衍生物,该类成分可通过调节C/EBPα和SREBP1c通路,显著减少脂质积累,抑制前脂肪细胞3T3-L1分化。因此,富含酚类成分的柳属植物可能是发现减肥药物的源泉之一。
黑柳Marshall(black willow)别名北美黑柳、沼泽柳、西南黑柳、海湾黑柳、镰叶柳,原产北美洲,用于治疗咳嗽、痢疾、风湿、关节炎和痛风等[8]。现代药理学研究表明黑柳醇提物具有抗炎、抗菌活性。Verma等[9]证实黑柳甲醇提取物具有抗炎活性;此外,Sharma等[10]发现黑柳甲醇提取物还可以通过抑制前炎症因子和氧化压缓解胶原诱导的关节炎症状;Tahir等[11]报道黑柳乙醇提取物具有抗革兰阳性菌和革兰阴性菌活性。然而,暂未见黑柳树皮化学成分及其抑制脂肪生成活性方面的相关报道。因此,本研究采用多种现代色谱和波谱方法对黑柳树皮化学成分进行分离纯化和结构鉴定,并以秀丽隐杆线虫为实验模型,利用油红O和苏丹黑B染色,探究分离得到的部分化合物抑制脂肪生成活性,以期为黑柳化学成分研究及减肥药物研发提供参考。从黑柳树皮70%甲醇提取物中分离鉴定12个化合物,分别为柳皮苷(salicortin,1)、特里杨苷(tremulacin,2)、7-水杨酰-2′-苯甲酰水杨苷(salicyloyltremuloidin,3)、cochinchiside A(4)、2′-苯甲酰水杨苷(tremuloidin,5)、胡萝卜苷(daucosterol,6)、rosin(7)、水杨苷(salicin,8)、chalcononaringenin-2′-- β--glucopyranoside(9)、3,4-二羟基苯甲酸(3,4- dihydroxybenzoic acid,10)、苯甲酸(benzoic acid,11)和水杨酸(salicylic acid,12)。12个化合物均为首次从黑柳中分离得到;其中化合物1、2、5和9具有显著抑制秀丽隐杆线虫脂肪生成的作用,化合物5的作用最强。
1. 仪器与材料
1.1 仪器与试剂
ME204E型电子天平(德国Mettler Toledo公司);半制备色谱柱(250 mm×10 mm,5 μm,日本YMC公司;250 mm×21.2 mm,10 μm,苏州纳微生物科技有限公司);LC-P100型高效液相色谱仪(上海伍丰科学仪器有限公司);AVANCE III-400型核磁共振仪(德国Bruker公司);Leica DM750型显微镜(德国Leica公司);LDZX-50KBS型立式压力蒸汽灭菌器(上海申安公司);DH-600型电热恒温培养箱(北京中兴伟业仪器有限公司);ZHWY-211B、ZHWY-2102C型恒温培养震荡器(上海智诚分析仪器制造有限公司);H1650-W型离心机(湖南湘仪实验室仪器开发有限公司)。
柱色谱硅胶(80~100、200~300目)、薄层硅胶板GF254(青岛海洋化工厂);Sephadex LH-20(GE Healthcare Bio-Sciences AB);反相硅胶(苏州纳微生物科技有限公司);油红O和苏丹黑B(美国阿拉丁工业公司);其余试剂均为国产分析纯。奥利司他(浙江海正药业股份有限公司;规格:0.12 g/片)。
1.2 材料
黑柳树皮药材购于成都健腾生物技术有限公司,由西南民族大学药学院任艳副教授鉴定为杨柳科柳属植物黑柳Marshall的干燥树皮,标本保存在药学院中药标本室;秀丽隐杆线虫和大肠杆菌OP50(OP50)来源于中国科学院成都生物研究所应用与环境微生物中心。
2. 方法
2.1 提取与分离
取干燥的黑柳树皮药材20 kg,粉碎后,用70%甲醇-水提取3次,滤过,浓缩,随后加水使其成悬浊液,用正丁醇萃取得总浸膏(100.5 g)。总浸膏用纯水溶解后,进行反相柱色谱,分别以40%甲醇-水和60%甲醇-水进行洗脱,得40%甲醇-水(A,10.5 g)、60%甲醇-水(B,15.3 g)2个组分。
40%甲醇-水组分(A,10.5 g),用正相硅胶柱色谱(200~300目)分离,以二氯乙烷-丙酮(25∶1、15∶1、10∶1、5∶1、3∶1)洗脱,共得5个组分A1~A5。化合物6(3 mg)从A2(8 mg)的甲醇溶液中以白色松软固体析出;A3(3 g)经半制备液相色谱(12%乙腈-水,30 mL/min)分离得到化合物8(1.1 g,R=6 min)和10(15 mg,R=24 min);A4(1.2 g)进行Sephadex LH-20柱色谱,以二氯乙烷-甲醇(1∶1)洗脱,分得3个组分A3-1~A3-3,其中A3-3(300 mg)经半制备液相色谱分离(15 mL/min),得化合物9(22 mg,R=16 min);A5(3 g)用正相硅胶柱色谱(200~300目)分离,以石油醚-丙酮(2∶1)混合溶剂洗脱,得A5-1(2.4 g),A5-1经半制备液相色谱(22%乙腈-水,30 mL/min)分离得到A5-1-1(0.65 g,R=9.5 min)和化合物7(9 mg,R=13 min),A5-1-1再进行Sephadex LH-20柱色谱,以甲醇-水(1∶1)洗脱,得到化合物1(0.61 g)。
60%甲醇-水组分(B,15.3 g),经半制备液相色谱(60%甲醇-水,50 mL/min)分离得到6个组分B1~B6。B1(2.2 g)经半制备液相色谱(30%乙腈-水,30 mL/min)分离得B1-1(1 g,R=5 min),B1-1用正相硅胶柱色谱(200~300目)分离,依次以二氯乙烷-丙酮(10∶1、3∶1)洗脱,得化合物11(12 mg)、4(61.6 mg)和5(130 mg);B6(2.9 g)用正相硅胶柱色谱(200~300目)分离,分别以二氯乙烷-丙酮(25∶1、15∶1、3∶1)混合溶剂洗脱,得B6-1~B6-3,其中B6-1的甲醇溶液中析出化合物12(1.7 g),B6-2进行Sephadex LH-20柱色谱,以甲醇-水(1∶1)为溶剂洗脱,分离得到化合物2(0.69 g)和3(8 mg)。
2.2 抑制脂肪生成活性筛选
2.2.1的培养与同期化 将接种于长满OP50的线虫生长培养基(nematode growth medium,NGM)上,于18.5 ℃的恒温培养箱中培养3~5 d,约3 d转板1次,防止线虫过老或处于饥饿抑制状态,同时要保证线虫干净[12]。培养完成后,选取50~70条用700 μL M9缓冲液冲洗转移至1.5 mL EP管中,离心后弃去上清液。用M9缓冲液定容至500 μL,加入等体积的现配裂解液,再次离心弃去上清液。加入M9缓冲液,孵化12 h,得L1期的。离心后,沉淀转入含有OP50的NGM培养基上培养48~72 h,即可得到L4期的。
2.2.2 加样培养 预实验结果显示化合物质量浓度为50 μg/mL时抑制体内脂肪生成的作用较强。因此,设置样品质量浓度为50 μg/mL以测定其对脂肪生成抑制活性。吸取等量配制好的样品溶液和活化后的OP50于EP管中混合均匀,均匀涂布于NGM培养基上,置于恒温培养箱(37 ℃)中,培养18 h,待NGM培养基上长满OP50后,将同期化至L1期的转移到该培养基上(为了方便区分,只接种于NGM培养基的半边),于恒温培养箱(18.5 ℃)培养3~5 d即可进行后续实验。观察样品对脂肪生成的影响,阳性对照和阴性对照分别为奥利司他和DMSO。
2.2.3 油红O染色 给药3~5 d后,挑选出50条至EP管中,在室温下,加入500 μL 4%多聚甲醛固定,30 min后,迅速转移至−80 ℃的冷冻箱内冷藏15 min,紧接着快速置于水浴锅(43 ℃)中使之融化,其后加入700 μL M9缓冲液清洗,并于1500 r/min离心3 min后弃去上清液,重复清洗操作3次。加入油红O染液染色12 h后,用PBS缓冲液清洗3次,置于显微镜下观察、拍照[13]。
2.2.4 苏丹黑B染色 给药3~5 d后,挑选出50条至EP管中,在室温下,加入500 μL 4%多聚甲醛固定,30 min后,离心弃去上清液,并依次用25%甲醇溶液、50%甲醇溶液和70%甲醇溶液(500 μL)对进行脱水处理(8~10 min),每次脱水结束后,置于1500 r/min离心机中离心3 min,弃去上清液。脱水处理后用苏丹黑B染液染色,浸润,待过夜后用70%乙醇冲洗,然后再加入M9缓冲液冲洗3次,置于显微镜下观察、拍照[14]。
3 结果
3.1 结构鉴定
化合物1:白色无定形吸湿性粉末,易溶于甲醇。分子式C20H24O10。1H-NMR (400 MHz, CD3OD): 7.32 (1H, m, H-5), 7.30 (1H, d,= 7.52 Hz, H-3), 7.20 (1H, d,= 8.1 Hz, H-6), 7.01 (1H, t,= 7.4 Hz, H-4), 6.14 (1H, dt,= 9.7, 3.8 Hz, H-11), 5.75 (1H, dt,= 9.8, 1.6 Hz, H-10), 5.37, 5.26 (各1H, d,= 12.4 Hz, H-7), 4.92 (1H, d,= 7.5 Hz, H-1′), 3.88 (1H, dd,= 12.0, 1.8 Hz, H-6a′), 3.69 (1H, dd,= 12.0, 5.2 Hz, H-6b′), 3.37~3.47 (4H, m, H-2′~5′), 2.89 (1H, m, H-13a), 2.71~2.60 (3H, m, H-12, 13b);13C-NMR (100 MHz, CD3OD): 207.5 (C-14), 171.4 (C-8), 157.0 (C-1), 133.2 (C-10), 131.1 (C-5), 130.7 (C-11), 129.4 (C-3), 125.9 (C-6), 123.4 (C-4), 117.0 (C-2), 102.3 (C-1′), 79.5 (C-9), 78.1 (C-3′), 78.0 (C-5′), 74.9 (C-2′), 71.2 (C-4′), 64.4 (C-7), 62.5 (C-6′), 36.8 (C-13), 27.2 (C-12)。上述数据与文献报基本一致[15-16],故鉴定化合物1为柳皮苷。
化合物2:白色无定形粉末,易溶于氯仿。分子式C27H28O11。1H-NMR (400 MHz, CDCl3): 8.00 (2H, d,= 7.3 Hz, H-3′′′, 7′′′), 7.51 (1H, t,= 7.4 Hz, H-5′′′), 7.36 (2H, t,= 7.7 Hz, H-4′′′, 6′′′), 7.24 (1H, td,= 7.9, 1.4 Hz, H-5), 7.16 (1H, dd,= 7.5, 1.0 Hz, H-3), 7.02 (1H, d,= 8.2 Hz, H-6), 6.98 (1H, t,= 7.5 Hz, H-4), 6.03 (1H, dt,= 9.6, 3.7 Hz, H-3′), 5.69 (1H, d,= 9.8 Hz, H-2′), 5.32 (1H, t,= 8.5 Hz, H-2′′), 5.15 (1H, d,= 7.8 Hz, H-1′′), 5.09, 4.95 (各1H, d,= 12.5 Hz, H-7a, 7b), 3.90 (3H, m, H-3′′~6′′), 3.52 (1H, m, H-5′′), 2.94 (1H, dt,= 14.7, 8.0 Hz, H-5′), 2.39~2.66 (3H, m, H-5′, 4′);13C-NMR (100 MHz, CDCl3): 207.6 (C-6′), 170.0 (C-7′), 166.2 (C-1″′), 156.1 (C-1), 133.5 (C-5″′), 132.1 (C-3′), 130.0 (C-5), 129.9 (C-3″′, 7″′), 129.6 (C-2″′), 129.5 (C-3), 128.7 (C-4″′, 6″′), 127.6 (C-2), 127.4 (C-2′), 123.2 (C-4), 115.7 (C-6), 99.7 (C-1″), 78.3 (C-1′), 76.1 (C-5″), 75.0 (C-3″), 74.0 (C-2″), 70.1 (C-4″), 63.5 (C-7), 60.9 (C-6″), 35.4 (C-5′), 26.7 (C-4′)。上述数据与文献报道基本一致[17],故鉴定化合物2为特里杨苷。
化合物3:白色无定形粉末,微溶于甲醇。分子式C27H26O10。1H-NMR (400 MHz, DMSO-6): 10.43 (1H, s, 10-OH), 7.93 (2H, d,= 7.3 Hz, H-2′′, 6′′), 7.41~7.55 (3H, m, H-12, 14, 4′′), 7.40 (2H, t,= 7.8 Hz, H-3′′, 5′′), 7.35 (2H, m, H-3, 5), 7.25 (1H, d,= 8.2 Hz, H-6), 7.04 (1H, t,= 7.4 Hz, H-4), 6.95 (1H, d,= 8.3 Hz, H-11), 6.80 (1H, t,= 7.5 Hz, H-13), 5.51 (1H, d,= 5.8 Hz, 3′-OH), 5.33~5.41 (2H, m, 4′-OH, H-1′), 5.12 (2H, s, H-7), 5.05~5.11 (1H, m, H-2′), 4.74 (1H, t,= 5.5 Hz, 6′-OH), 3.78 (1H, dd,= 9.8, 5.3 Hz, H-6′), 3.71 (1H, td,= 9.2, 5.9 Hz, H-3′), 3.51~3.59 (2H, m, H-5′, 6′), 3.35 (1H, m, H-4′);13C-NMR (100 MHz, DMSO-6): 168.7 (C-8), 165.2 (C-7″), 160.4 (C-10), 155.0 (C-1), 135.7 (C-12), 133.0 (C-4″), 130.1 (C-3, 5), 129.7 (C-14), 129.5 (C-1″), 129.3 (C-2″, 6″), 128.5 (C-3″, 5″), 124.0 (C-2), 122.2 (C-4), 119.5 (C-11), 117.3 (C-13), 115.0 (C-6), 112.7 (C-9), 98.5 (C-1′), 77.5 (C-5′), 74.3 (C-2′), 74.0 (C-3′), 70.1 (C4′), 61.7 (C-7), 60.2 (C-6′)。上述数据与文献报道基本一致[18],故鉴定化合物3为7-水杨酰-2′-苯甲酰水杨苷。
化合物4:浅黄色无定形粉末,微溶于甲醇。分子式C27H28O11。1H-NMR (600 MHz, DMSO-6): 7.95 (2H, dd,= 8.2, 1.2 Hz, H-2′′′, 6′′′), 7.58 (1H, t,= 7.4 Hz, H-4′′′), 7.46 (2H, t,= 7.8 Hz, H-3′′′, 5′′′), 7.24 (1H, t,= 6.8 Hz, H-5), 7.17 (1H, dd,= 7.6, 1.3 Hz, H-3), 7.12 (1H, d,= 8.1 Hz, H-6), 6.96 (1H, t,= 7.3 Hz, H-4), 6.03 (1H, dt,= 9.8, 3.8 Hz, H-3′′), 5.66 (1H, dt,= 9.8, 1.8 Hz, H-2′′), 5.18 (1H, d,= 13.1 Hz, H-7a), 5.14~5.07 (2H, m, H-7b, 3′), 5.02 (1H, d,= 7.7 Hz, H-1′), 3.45~3.65 (5H, m, H-2′, 4′~6′), 2.46~2.64 (4H, m, H-4′′, 5′′);13C-NMR (150 MHz, DMSO-6): 206.1 (C-6′′), 170.1 (C-7′′), 165.4 (C-7′′′), 154.7 (C-1), 133.1 (C-4′′′), 131.7 (C-3′′), 130.4 (C-5), 129.5 (C-3, 2′′′, 6′′′), 128.8 (C-1′′′), 128.6 (C-3′′′, 5′′′), 128.4 (C-2′′), 124.6 (C-2), 122.1 (C-4), 115.1 (C-6), 100.4 (C-1′), 78.5 (C-1′′), 77.4 (C-5′), 76.7 (C-3′), 71.5 (C-2′), 67.6 (C-4′), 62.2 (C-7), 60.4 (C-6′), 35.7 (C-5′′), 26.0 (C-4′′)。上述数据与文献报道基本一致[19],故鉴定化合物4为cochinchiside A。
化合物5:白色粉末,微溶于甲醇。分子式C20H22O8。1H-NMR (400 MHz, DMSO-6): 7.99 (2H, d,= 7.5 Hz, H-2′′, 6′′), 7.65 (1H, t,= 7.3 Hz, H-4′′), 7.52 (2H, t,= 7.7 Hz, H-3′′, 5′′), 7.30 (1H, d,= 7.4 Hz, H-3), 7.17 (1H, t,= 7.5 Hz, H-5), 7.08 (1H, d,= 8.1 Hz, H-6), 6.98 (1H, t,= 7.4 Hz, H-4), 5.49 (1H, d,= 5.7 Hz, 3′-OH), 5.34 (1H, d,= 5.4 Hz, 4′-OH), 5.24 (1H, d,= 8.0 Hz, H-1′), 5.06 (1H, t,= 8.8 Hz, H-2′), 4.89 (1H, t,= 5.6 Hz, 7-OH), 4.71 (1H, t,= 5.3 Hz, 6′-OH), 4.38, 4.11 (各1H, dd,= 15.1, 5.5 Hz, H-7), 3.76 (1H, dd,= 10.3, 5.1 Hz, H-6′), 3.65~3.72 (1H, m, H-3′), 3.49~3.57 (3H, m, H-6′~4′);13C-NMR (100 MHz, DMSO-6): 165.5 (C-7′′), 153.8 (C-1), 133.8 (C-4′′), 131.6 (C-2), 130.3 (C-1′′), 129.8 (C-2′′, 6′′), 129.2 (C-3′′, 5′′), 127.8 (C-5), 126.8 (C-3), 122.4 (C-4), 114.4 (C-6), 98.7 (C-1′), 77.7 (C-5′), 74.7 (C-2′), 74.3 (C-3′), 70.4 (C-4′), 61.0 (C-6′), 57.7 (C-7)。上述数据与文献报道基本一致[18],故鉴定化合物5为2′-苯甲酰水杨苷。
化合物6:白色固体,微溶于甲醇。分子式C35H60O6。1H-NMR (400 MHz, DMSO-6): 5.32 (1H, brs, H-6), 4.87 (3H, m, OH), 4.43 (1H, t,= 5.7 Hz, H-3), 4.20 (1H, d,= 7.7 Hz, H-1′), 2.88~3.63 (m, 5H of glucose), 0.94 (3H, s, H-19), 0.89 (3H, d,= 6.3 Hz, H-21), 0.80 (9H, overlapped, H-26, 27, 29), 0.64 (3H, s, H-18)。上述数据与文献报道基本一致[20],且与胡萝卜苷对照品对照,多种展开体系下TLC的Rf值一致,故鉴定化合物6为胡萝卜苷。
化合物7:白色无定形粉末,易溶于甲醇。分子式C15H20O6。1H NMR (400 MHz, CD3OD): 7.40 (2H, d,= 7.3 Hz, H-2, 6), 7.28 (2H, t,= 7.5 Hz, H-3, 5), 7.20 (1H, m, H-4), 6.67 (1H, d,= 16.0 Hz, H-7), 6.36 (1H, dt,= 16.0, 6.1 Hz, H-8), 4.52 (1H, ddd,= 12.8, 5.6, 1.3 Hz, H-9a), 4.35 (1H, d,= 7.8 Hz, H-1′), 4.31 (1H, ddd,= 12.9, 9.6, 1.1 Hz, H-9b), 3.87 (1H, d,= 11.9 Hz, H-6a′), 3.66 (1H, dd,= 11.9, 5.4 Hz, H-6b′), 3.20~3.37 (4H, overlapped, H-2′~5′);13C-NMR (100 MHz, CD3OD): 136.8 (C-1), 132.4 (C-7), 128.2 (C-3, 5), 127.3 (C-4), 126.1 (C-2, 6), 125.3 (C-8), 101.9 (C-1′), 76.7 (C-3′), 76.6 (C-5′), 73.7 (C-2′), 70.3 (C-4′), 69.3 (C-9), 61.4 (C-6′)。上述数据与文献报道基本一致[21],故鉴定化合物7为rosin。
化合物8:白色针状结晶(甲醇),易溶于甲醇。分子式C13H18O7。1H-NMR (400 MHz, DMSO-6): 7.36 (1H, d,= 7.3 Hz, H-3), 7.19 (1H, t,= 7.2 Hz, H-5), 7.09 (1H, d,= 8.0 Hz, H-6), 7.00 (1H, t,= 7.3 Hz, H-4), 5.35 (1H, d,= 4.0 Hz, 4′-OH), 5.09 (1H, d,= 3.4 Hz, 3′-OH), 5.03 (1H, d,= 5.2 Hz, 2′-OH), 4.99 (1H, t,= 5.9 Hz, 7-OH), 4.76 (1H, d,= 7.2 Hz, H-1′), 4.64 (1H, dd,= 14.3, 5.5 Hz, H-7a), 4.59 (1H, t,= 5.7 Hz, 6′-OH), 4.46 (1H, dd,= 14.3, 6.2 Hz, H-7b), 3.74~3.66 (1H, m, H-6a′), 3.47 (1H, dt,= 11.8, 6.0 Hz, H-6b′), 3.33~3.16 (4H, m, H-2′~5′);13C-NMR (100 MHz, DMSO-6): 155.1 (C-1), 132.4 (C-2), 128.1 (C-5), 127.7 (C-3), 122.5 (C-4), 115.4 (C-6), 101.6 (C-1′), 82.9 (C-5′), 82.3 (C-3′), 73.7 (C-2′), 70.0 (C-4′), 61.0 (C-6′), 58.8 (C-7)。上述数据与文献报道基本一致[22],故鉴定化合物8为水杨苷。
化合物9:黄色针状结晶(甲醇),易溶于甲醇。分子式C20H22O8。1H-NMR (400 MHz, DMSO-6): 7.99 (1H, d,= 15.5 Hz, H-α), 7.64 (2H, d,= 8.4 Hz, H-2, 6), 7.60 (1H, d,= 15.6 Hz, H-β), 6.82 (2H, d,= 8.2 Hz, H-3, 5), 6.15 (1H, brs, H-5′), 5.94 (1H, brs, H-3′), 5.07 (1H, d,= 7.3 Hz, H-1′′), 3.23~3.71 (6H, m, of glucose);13C-NMR (100 MHz, DMSO-6)191.9 (C=O), 166.1 (C-2′), 164.8 (C-4′), 160.4 (C-4), 160.0 (C-6′), 142.7 (C-β), 130.8 (C-2, 6), 126.3 (C-1), 124.3 (C-α), 116.02 (C-3, 5), 105.3 (C-1′), 100.4 (C-1′′), 97.1 (C-3′), 94.9 (C-5′), 77.4 (C-5′′), 76.8 (C-3′′), 73.7 (C-2′′), 69.5 (C-4′′), 60.5 (C-6′′)。上述数据与文献基本一致[23],故鉴定化合物9为chalcononaringenin-2′--β--glucopyranoside。
化合物10:白色粉末,易溶于甲醇。分子式C7H6O4。1H-NMR (400 MHz, CD3OD): 7.46 (1H, d,= 2.1 Hz, H-2), 7.43 (1H, dd,= 7.9, 2.1 Hz, H-6), 6.82 (1H, d,= 7.9 Hz, H-5);13C-NMR (100 MHz, CD3OD): 170.3 (C-7), 151.5 (C-4), 146.0 (C-3), 123.9 (C-1), 123.0 (C-6), 117.7 (C-2), 115.7 (C-5)。上述数据与文献报道基本一致[24],故鉴定化合物10为3,4-二羟基苯甲酸。
化合物11:白色粉末,易溶于甲醇。分子式C7H6O2。1H-NMR (400 MHz, CDCl3): 8.12 (2H, m, H-2, 6), 7.59 (1H, m, H-4), 7.46 (2H, m, H-3, 5);13C- NMR (100 MHz, CDCl3): 172.4 (C-7), 134.0 (C-4), 130.5 (C-2, 6), 129.5 (C-1), 128.5 (C-3, 5)。上述数据与文献报道基本一致[25],故鉴定化合物11为苯甲酸。
化合物12:白色针状结晶(甲醇),mp 160~161 ℃。在3种展开体系中TLC行为与水杨酸对照品一致,且混合熔点不下降。故鉴定为水杨酸。
3.2 抑制脂肪生成活性筛选结果
由于苯乙醇苷类化合物是从黑柳树皮中分离得到的主要成分,所以本研究选择3个代表性化合物即柳皮苷(1)、特里杨苷(2)和2′-苯甲酰水杨苷(5)进行抑制脂肪生成活性筛选,同时也选择了黄酮类化合物chalcononaringenin-2′--β-- glucopyranoside(9),以对比2类化合物的抑制脂肪生成活性,为后续研究提供参考。
3.2.1 油红O染色结果 油红O染色结果如图1所示,脂肪率根据脂肪颗粒占线虫整体体积的比例确定。实验样品作用于后,与阴性对照组比较(脂肪率为42.05%),体内被染色部分明显减少,线虫体内脂肪率分别降低为柳皮苷11.77%、特里杨苷25.23%、2′-苯甲酰水杨苷11.35%和chalcononaringenin-2′--β--glucopyranoside 15.98%,说明4个化合物对体内脂肪生成均有明显的抑制作用,其中化合物1、5和9的活性强于阳性对照(脂肪率为21.57%)。
3.2.2 苏丹黑B染色结果 苏丹黑B对染色结果如图2所示,与阴性对照组相比较(脂肪率为26.70%),可看到体内被染成黑色的脂肪颗粒明显减少,线虫体内脂肪率分别降低为柳皮苷13.35%、特里杨苷14.15%、2′-苯甲酰水杨苷10.15%和chalcononaringenin-2′--β--gluco- pyranoside 11.75%,这表明4个化合物对体内脂肪生成均有明显的抑制作用,且强于阳性对照(脂肪率为14.46%)。
4 讨论
本研究从黑柳树皮中分离鉴定了12个化学成分,包括6个水杨苷类化合物(化合物1~5和8)、1个查耳酮类化合物(化合物9)、1个甾体皂苷类化合物(化合物6)、1个苯丙烯醇苷类化合物(化合物7)和3个苯甲酸衍生物(10~12),所有化合物均为首次从黑柳中分离得到。选择其中4个化合物进行了线虫体内抑制脂肪生成活性研究,油红O和苏丹黑B 2种染色结果都显示,4个化合物样品具有较好的抑制脂肪生成的作用,其中2′-苯甲酰水杨苷(5)在2种染色实验中均呈现最强的抑制活性。
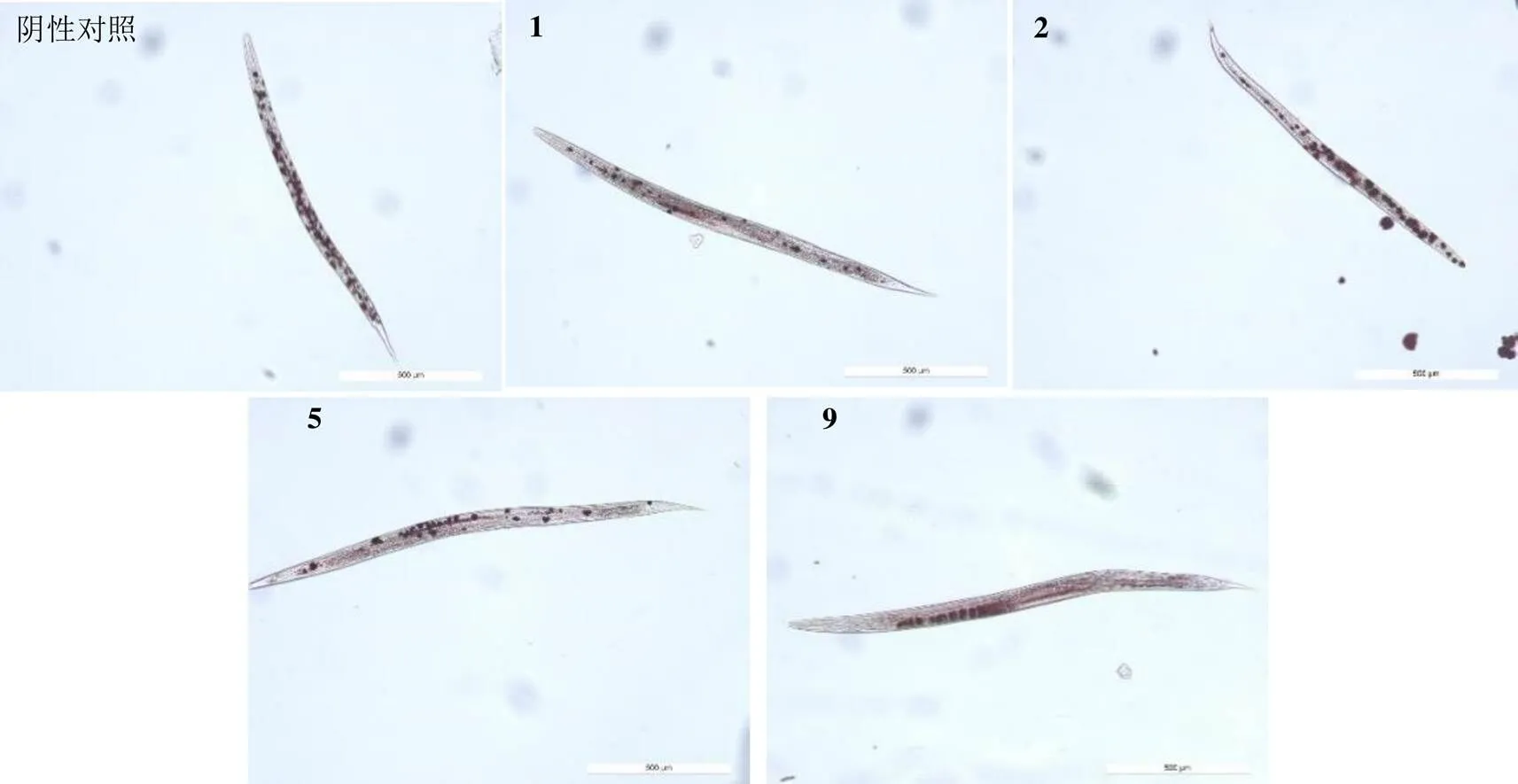
图1 化合物1、2、5、9抑制C. elegans体内脂肪生成的油红O染色结果

图2 化合物1、2、5、9抑制C. elegans体内脂质累积的苏丹黑B染色结果
此外,通过对实验结果的观察,发现油红O能将脂肪染成滴状,易观察,而苏丹黑B很难将脂肪染成滴状或颗粒,通常呈现为黑色堆积,但是苏丹黑B能够将内脂肪显示的更完整。因此,结合2种染色方法,才能够更好地观察体内脂肪的分布和数量。
本研究首次报道了黑柳树皮提取物的化学成分,并探究了部分化合物对脂肪生成的影响,为从该植物中发现具有抑制脂肪生成作用的化合物提供了一定的参考,并为黑柳植物的开发与应用提供科学基础。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国科学院中国植物志编辑委员会. 中国植物志 (第二十卷第二分册) [M]. 北京: 科学出版社, 1984: 81.
[2] Noleto-Dias C, Ward J L, Bellisai A,. Salicin-7-sulfate: A new salicinoid from willow and implications for herbal medicine [J]., 2018, 127: 166-172.
[3] 祝星宇, 张贻强, 陈雨晴, 等. 柳属植物化学成分及药理作用研究进展 [J]. 中草药, 2018, 49(24): 5952-5960.
[4] Han L K, Sumiyoshi M, Zhang J,. Anti-obesity action ofleaves (Part 1). Anti-obesity action by polyphenols ofin high fat-diet treated rodent animals [J]., 2003, 17(10): 1188-1194.
[5] Han L K, Sumiyoshi M, Zheng Y N,. Anti-obesity action ofleaves (Part 2). Isolation of anti-obesity effectors from polyphenol fractions of[J]., 2003, 17(10): 1195-1198.
[6] 刘可越, 刘海军, 周斌, 等. 垂柳叶化学成分及其促进脂肪分解的活性研究 [J]. 复旦学报: 自然科学版, 2008, 47(4): 520-523.
[7] Lee M N, Lee S H, Kang J,. Salicortin-derivatives from-lasiogyne twigs inhibit adipogenesis in 3T3-L1 cells via modulation of C/EBPα and SREBP1c dependent pathway [J]., 2013, 18(9): 10484-10496.
[8] United States Department of Agriculture Natural Resources Conservation Service.Marshall [DB/OL]. [2010]. https://plants. usda. gov/home/ plantProfile?symbol=SANI.
[9] Verma N, Tripathi S K, Sahu D,. Evaluation of inhibitory activities of plant extracts on production of LPS-stimulated pro-inflammatory mediators in J774 murine macrophages [J]., 2010, 336(1): 127-135.
[10] Sharma S, Sahu D, Das H R,. Amelioration of collagen-induced arthritis bybark extract via suppression of pro-inflammatory cytokines and oxidative stress [J]., 2011, 49(12): 3395-3406.
[11] Tahir U, Fakhar M, Zameer M,. Antibacterial activity, phytochemical analysis and FT-IR analysis ofplant extract against gram positive and gram negative bacteria [J]., 2022, 31(8): 7535-7542.
[12] 苗祥贞, 张潇, 袁炎炎, 等. 黄连水提物对秀丽隐杆线虫毒性效应评价 [J]. 中草药, 2018, 49(4): 874-878.
[13] 屈长青, 徐林丽, 陆娟, 等. 罗勒水提物对秀丽隐杆线虫脂肪沉积的影响 [J]. 中国生化药物杂志, 2012, 33(2): 165-166.
[14] 冯婉娟, 黄文明, 许想平, 等. 秀丽隐杆线虫脂肪染色的方法比较(英文) [J]. 生命科学研究, 2012, 16(1): 9-14.
[15] Wu Y Q, Dobermann D, Beale M H,. Acutifoliside, a novel benzoic acid glycoside from[J]., 2016, 30(15): 1731-1739.
[16] Lee H J, Kim J S, Kim Y K,. Phenolic glycosides as inhibitors of inducible nitric oxide synthase fromin LPS-activated RAW 264.7 murine macrophages [J]., 2012, 67(10): 870-873.
[17] Rasmussen B, Nkurunziza A J, Witt M,. Dovyalicin-type spermidine alkaloids fromspecies [J]., 2006, 69(9): 1300-1304.
[18] Mizuno M, Kato M, Misu C,. Chaenomeloidin: A phenolic glucoside from leaves of[J]., 1991, 54(5): 1447-1450.
[19] Ishikawa T, Nishigaya K, Takami K,. Isolation of salicin derivatives fromand their antiviral activities [J]., 2004, 67(4): 659-663.
[20] 李静, 宋启示, 项伟, 等. 大苞蛇根草化学成分的研究 [J]. 天然产物研究与开发, 2009, 21(3): 433-434.
[21] Wan C P, Yuan T, Cirello A L,. Antioxidant and α-glucosidase inhibitory phenolics isolated from highbush blueberry flowers [J]., 2012, 135(3): 1929-1937.
[22] 王金兰, 孙大鹏, 吕伟强, 等. 银中杨落叶的化学成分及活性研究 [J]. 中草药, 2013, 44(23): 3276-3281.
[23] Zhang S X, Tani T, Yamaji S,. Glycosyl flavonoids from the roots and rhizomes of[J]., 2003, 5(1): 25-30.
[24] 黄永林, 陈月圆, 颜小捷, 等. 红背山麻杆叶的化学成分研究(I): 酚酸类及相关化合物 [J]. 广西植物, 2014, 34(1): 126-129.
[25] 钱纯果, 金路, 朱龙平, 等. 桂枝中化学成分及抗肿瘤和抗炎活性研究 [J]. 中草药, 2022, 53(1): 31-40.
Chemical constituents from barks ofand its anti-adipogenic activity
LIU Huan, JIACI Lamu, PU Sha-long, ZHANG Ji-zhong, LI Li-mei
College of Pharmacy, Southwest Minzu University, Chengdu 610041, China
To study the chemical composition from the barks ofMarshall and its anti-adipogenic activity.The chemical constituents from the barks ofwere isolated by chromatographic methods and the structures of the isolated compounds were elucidated on the basis of NMR spectroscopic analyses. The anti-adipogenic activity of some compounds was evaluated inby oil red O and Sudan black B staining methods.A total of 12 compounds were isolated from barks ofand identified as salicortin (1), tremulacin (2), salicyloyltremuloidin (3), cochinchiside A (4), tremuloidin (5), daucosterol (6), rosin (7), salicin (8), chalcononaringenin-2′--β--glucopyranoside (9), 3,4-dihydroxybenzoic acid (10), benzoic acid (11), and salicylic acid (12), respectively. Among them, compounds 1, 2, 5 and 9 could significantly reduce adipose accumulation in.All twelve compounds were isolated fromfor the first time. Compound 5 exhibited the strongest effect to reduce adipose accumulation in
Marshall;; anti-adipogenic activity; salicortin; tremulacin; tremuloidin
R284.1
A
0253 - 2670(2023)13 - 4111 - 07
10.7501/j.issn.0253-2670.2023.13.004
2023-01-09
大学生创新创业训练计划项目(S202210656135)
刘 欢,本科生。E-mail: 1115935565@qq.com
通信作者:李丽梅,教授,研究方向为中药与民族药研究与开发。E-mail: limeili@swun.edu.cn
[责任编辑 王文倩]
