植物质体基因工程调控元件研究进展
2023-07-05于一凡欧阳臻郭娟赵瑜君黄璐琦
于一凡,欧阳臻,郭娟,赵瑜君,黄璐琦
植物质体基因工程调控元件研究进展
于一凡1,2,欧阳臻2,郭娟1,赵瑜君1,黄璐琦1,2
1. 中国中医科学院中药资源中心,科技部与国家中医药管理局道地药材国家重点实验室,北京 100700 2. 江苏大学食品与生物工程学院,镇江 212013
随着植物合成生物学的发展,质体逐渐成为许多具有商业价值的次生代谢产物和治疗性蛋白异源生产的理想平台。与核基因工程相比,质体基因工程在外源基因高效表达和生物安全性等方面具有其独特优势。然而,外源基因在质体系统中的组成型表达或对植物生长不利,因此需进一步挖掘、设计调控元件实现对外源基因的精准调控。本文概述了质体基因工程调控元件的研究进展,内容包括操纵子设计与优化思路、多基因共表达调控策略及新型表达调控元件的挖掘等,为植物合成生物学的发展提供参考。
植物合成生物学;质体基因工程;遗传转化;操纵子;调控元件
质体基因工程的发展历程最早可追溯到20世纪80年代。1987年,Daniell等[1]发现,经EDTA体外处理的黄瓜()白色体可吸收来自细菌的基因和蓝藻的基因,且能够在体内表达这些基因。早期的质体基因工程涉及复杂的质体分离与体外培养过程,操作难度较大[1~3],基因枪的出现简化了该操作流程,质体基因工程也由此进入了新的发展阶段[4,5]。1988年,Boynton等[4]将野生型基因整合至该基因突变型莱茵衣藻()的叶绿体基因组中,使莱茵衣藻恢复正常的光合作用功能,首次实现了质体基因工程在单细胞真核生物中的应用。1990年,Svab等[6]报道了烟草()质体基因组的稳定遗传转化,标志着高等植物质体基因工程的开端,此后Svab等[7]将壮观霉素抗性基因靶向整合至烟草质体基因组,得到了同质化的转质体烟草品系并能够以母系遗传的方式稳定遗传给子代,为高等植物质体基因工程的发展奠定了基础。
在过去的一个世纪中,杂交育种是栽培作物获得理想农艺性状的主要手段。随着基因工程的兴起,使得转基因作物较传统栽培作物更易获得理想农艺性状,在提升产量的同时降低农药的使用量,这极大促进了生态农业的发展。然而,大部分转基因作物通过核基因工程实现外源基因的转化,存在外源基因表达量低或生物安全问题[8]。质体基因工程可以有效避免上述情况的发生,在同质化的转质体细胞中,外源基因高达10,000个拷贝,可以实现外源基因的高效表达[9]。更重要的是,质体基因组的母系遗传特性能够有效减少或消除外源基因通过花粉逃逸的可能性[10]。
质体(plastid)包括叶绿体、色质体(或称有色体)和白色体,根据内共生学说,质体起源于与真核宿主细胞发生内共生相互作用的蓝细菌,因而质体在基因转录及翻译等方面具有原核特性,且在漫长的进化过程中,大部分原先存在于质体基因组中的基因已转移至细胞核中,仅有少部分基因保留在质体基因组[11~15]。植物叶绿体基因组是一个大小约为 150 kb的环状分子,包含120~130个基因,其中大部分基因与光合作用或叶绿体基因表达(即编码核糖体的RNA和蛋白质亚基、RNA聚合酶亚基和tRNA)相关[8]。叶绿体作为植物重要的代谢合成中心,可通过光合作用将太阳能转化为化学能。此外,叶绿体还参与核酸、氨基酸、脂肪酸以及次生代谢产物的生物合成,是植物生长发育过程中重要的细胞器[16,17]。随着高通量测序技术不断升级迭代,已有越来越多物种的叶绿体基因组信息被揭示[18],这在一定程度上也促进了质体基因工程的持续发展。随着研究的不断深入,开展质体基因工程的高等植物数量已十分可观,如烟草[7]、拟南芥()[19]、马铃薯()[20]、番茄()[21]、大豆()[22]、莴苣()[23]和黄花蒿()[24]等。相比于其他高等植物物种,烟草具有产量高、质体转化体系成熟、遗传操作简便等优势[25],且开展以烟草为底盘的质体基因工程研究可以有效降低对食物链的污染,因此烟草已成为当前质体基因工程的模式植物。
由于质体表达系统具有原核表达特性,具备相对独立的区室,拥有丰富的代谢模块,这些特性使质体成为代谢工程及合成生物学的理想受体[26~30]。截至目前,质体基因工程已广泛应用于性状改良、生物医药以及合成生物学等领域,并取得了丰硕的研究成果[27,28,31~34]。与此同时,质体基因工程也为质体系统的RNA转录调控、蛋白翻译机制、调控元件筛选与鉴定等研究领域提供了帮助[35~40]。近年来,质体基因工程主要致力于质体转化载体(图1)的设计方案优化(表1),其中选择稳定且具有高效转录、翻译能力的表达调控元件是实现外源基因高效表达的关键[40],但外源基因的组成型高效表达会对植物的生长和发育造成代谢负担。为了最大程度地避免这种负面影响,需要采用适当的合成操纵子构建策略实现外源基因在特定时期或空间的表达[40]。因此,本文对质体基因工程的表达调控元件进行了总结,并重点介绍了近5年质体基因工程合成操纵子构建策略的最新研究进展。
1 启动子
1.1 启动子的结构与类型
高等植物的质体中含有两种类型启动子:PEP (plastid-encoded RNA polymerase)型/NEP (nuclear- encoded RNA polymerases)型,PEP型启动子能够被质体基因组编码的rpoA、rpoB、rpoC1和 rpoC2亚基组成的细菌型RNA聚合酶核心识别,在结构上与细菌σ70型启动子非常相似,在–35区和–10区均含有保守序列[46,47],因此在大肠杆菌中也能正常发挥作用。NEP型启动子由核基因组编码的噬菌体型RNA聚合酶识别[48],大多数都包含一个核心的序列基序(YRTA),与植物线粒体基因组中启动子的共有序列十分相似[49]。从转录水平来看,NEP型启动子的转录效率似乎要弱于PEP 型启动子[50],因此,绝大多数质体转化研究会优先选择PEP型启动子来驱动外源基因的表达。

图1 质体转化载体结构示意图
黑色方框:左右两侧质体同源重组序列,用于外源蛋白质合成操纵子的定向整合;绿色方框:代表启动子区域;红色方框:5′UTR区域;黄色方框:3′UTR区域。启动子可以是质体启动子或诱导型启动子,用于调控目的基因的表达。当使用IEE元件表达多个基因时,目的基因2前应含有SD(Shine-Dalgarno)序列。
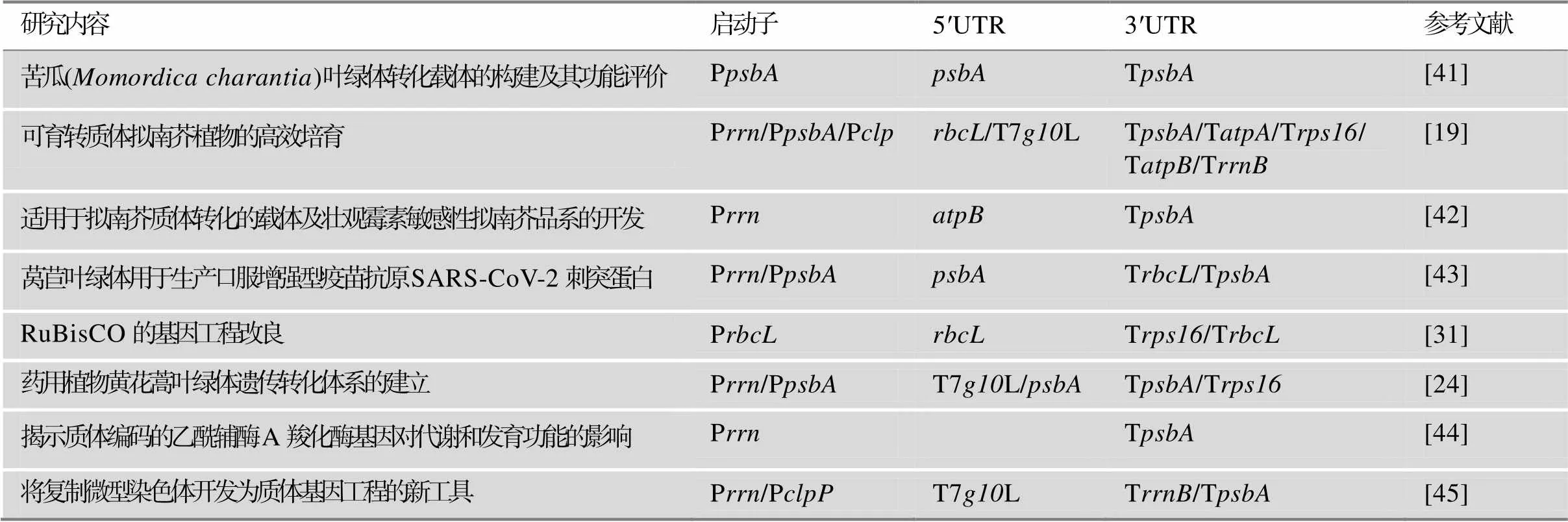
表1 近5年常用表达调控元件在质体基因工程中的应用
1.2 启动子的应用
1.2.1 外源基因高效表达
自从P与P被应用于质体转化研究以来[7,51],这两条启动子已经成为近几十年合成操纵子构建中最常用的两个高效启动子[24,32,33,52~55]。启动子P源自于16S rDNA基因,该启动子能够以极高速率驱动核糖体RNA操纵子转录,是高等植物质体转化活性最强的启动子[34]。De Cosa等[54]利用P启动子,将细菌操纵子整合至烟草质体基因组,外源蛋白在成熟叶片中的表达量占植物总可溶性蛋白的45.3%,即使在老化的白色叶片中也保持着极为稳定的积累水平(46.1%)。值得注意的是,由于rRNA自身不能够被翻译,故在选用P作为启动子时,需要添加适当的翻译起始信号,用以保证外源蛋白的积累[56,57]。
基因在叶绿体中翻译效率最高,且通过改变光照强度能够调控该基因的表达[58,59]。Boyhan等[60]将胰岛素原叶绿体操纵子分别整合至烟草和莴苣质体基因组,并使用基因的启动子P驱动胰岛素原叶绿体操纵子的表达。胰岛素原在成熟烟草和莴苣叶片中的积累水平分别占叶片总蛋白(total leaf protein,TLP)的47%和53%,在衰老干燥的莴苣叶片中,胰岛素原的积累水平仍高达约40% TLP。
1.2.2 植物遗传改良
在光合作用中,起固定CO2作用的关键酶核酮糖二磷酸羧化酶(Rubisco)是决定碳同化速率的关键酶。通过提高位于叶绿体中的光合酶Rubisco的CO2固定来提高碳同化速率是提升作物产量的有效策略之一[61]。植物Rubisco是一种16蛋白复合物,由核基因编码的8个小亚基和叶绿体基因编码的8个大亚基构成,小亚基与大亚基的相互作用会对Rubisco的CO2固定产生影响,因此对其改造包括核转化和质体转化两个方面[62~66]。Martin-Avila等[31]首先沉默烟草的核基因,之后利用烟草内源启动子P,将4种合成操纵子(-、-、-和-rbcS)靶向整合至转基因烟草RNAi-的叶绿体基因组,获得4种转基因烟草品系,分别表达不同马铃薯Rubisco小亚基(叶肉小亚基pS1、pS2、pS3以及马铃薯毛状体pST亚基)组成的植物同源Rubisco,其中pS3 亚基降低了Rubisco的积累水平,但提高了其羧化比率及羧化效率,pST亚基降低了Rubisco的羧化比率及羧化效率,并严重影响了转基因烟草的光合作用及生长发育。通过该研究,作者明确了改善马铃薯 Rubisco催化作用的小亚基的氨基酸组成,证实优化操纵子设计可以提高外源基因在叶绿体中的表达水平,并为Rubisco的基因工程改良提供了有效的生物工程基础。
此外,由于Rubisco本质上是一种催化效率低的酶,使用效率更高的外源Rubisco取代植物内源Rubisco,也是提高光合作用效率和作物产量的有效方法。然而,Rubisco的表达和组装需要分子伴侣,缺乏分子伴侣会阻碍叶绿体中功能性外源Rubisco的有效生产。因此,Chen等[67]利用烟草内源启动子P,将能够串联表达和基因的合成操纵子靶向整合至烟草叶绿体基因组,成功在烟草叶绿体中表达了来源于那不勒斯卤硫杆菌()的外源Rubisco。值得注意的是,转质体烟草能够高效表达功能性的外源Rubisco16 蛋白复合物,约占野生型烟草Rubisco含量的40%,且不需要外源分子伴侣。外源Rubisco显示2倍以上的羧化率,并使得转质体烟草与野生型具有相似的自养生长率。这项研究表明,用效率更高的外源Rubisco取代植物内源Rubisco,具有可行性,并为通过Rubisco的基因工程改良提升作物光合作用效率和生长率的研究提供技术支撑。
治疗前后237例使用万古霉素且行血药浓度监测的患者的肾功能指标(Scr、BUN、胱抑素C)比较,差异均无统计学意义(P>0.05),详见表2。
2 非质体特异性调控序列
由于质体基因表达受转录后调控,因此5′UTR和3′UTR对于维持mRNA的稳定性及转基因的表达效率尤为重要。迄今为止,已筛选出多条5′UTR序列[56,68~70]并广泛应用于质体基因工程研究,如1,5-二磷酸核酮糖羧化酶/加氧酶基因()的5′UTR[19,31]、叶绿体D1蛋白基因()的5′UTR[52,71]、ATP合酶β亚基基因()的5′UTR[31,72]以及来自T7噬菌体基因 10 的先导序列T7L[24,33,73]。近5年来,大部分涉及外源蛋白的高效积累的质体转化研究均使用了T7L[24,33,73],由于该序列所包含的二级结构以及SD序列能够介导外源基因在大肠杆菌中的高效翻译[56,57],且众多表达调控元件的组合中,P启动子序列与5′UTR序列T7L的组合能够有效保证目标蛋白的表达水平,故使用频率较高。当前应用较为广泛的3′UTR序列主要有基因的3′UTR[55,74]、基因的3′UTR[75,76]、基因的3′UTR[77,78]以及来自大肠杆菌操纵子的终止序列T[19,45]。
2.1 5′UTR的结构与功能
质体中存在两种翻译方式,二者的区别在于是否具有SD序列依赖性。常见的翻译起始方式依赖于SD序列,该序列位于起始密码子上游 4~9个核苷酸的保守区域[35];另一种翻译起始方式与SD序列无关,而是由mRNA特异性翻译激活蛋白与5′UTR结合并将核糖体30S亚基引导至AUG起始密码子。基于原核表达系统的翻译机制,通常认为SD序列依赖性的翻译效率总体上要高于SD序列非依赖性的翻译效率,但目前仍没有相关研究对两种翻译起始方式进行系统比较。
由于70S细菌型核糖体是质体中蛋白质的生物合成场所[79],因此5′UTR序列和结构很大程度上决定了SD序列依赖性翻译的速率[36]。最近的研究表明[35],SD序列与16S rRNA 3′末端序列结合的强弱与翻译效率有关,并且这种结合会显著影响二级结构稳定的mRNA的翻译效率,但对于二级结构稳定性较差的mRNA的翻译效率影响较小。因此,结合强度并不是决定SD序列依赖性翻译速率的唯一性因素,质体基因的表达主要受到转录后调控的影响[80,81]。
2.2 5′UTR的应用
2.2.1 提高重组蛋白表达量
Zhou等[32]检测了4种来自质体转基因的HIV (human immunodeficiency virus)抗原结合操纵子(、、-和-)的表达,其中表达量最高的操纵子将p24蛋白序列N端与Nef蛋白序列C端融合,并利用启动子P与T7L组合驱动,使蛋白产物的积累水平高达植物总蛋白的40%,是以往常规核转化生产p24研究的100倍,且p24-Nef 融合蛋白的过表达仅对植物表型造成了轻微的影响,该研究揭示了质体基因工程在高水平生产药物蛋白上的巨大潜力。此外,Oey等[9]使用同样的方式将充分优化后的合成操纵子整合到叶绿体基因组中,使PlyGBS裂解酶的表达水平达到了植物总可溶性蛋白的70%以上,这是迄今为止在植物中实现的最高外源蛋白表达水平,在叶片发育和衰老过程中该蛋白在叶绿体中仍保持稳定,且蛋白表达量始终维持在较高水平。
2.2.2 提高目标化合物产量
青蒿素是目前治疗疟疾的首选药物,以青蒿素为基础的联合疗法是世界卫生组织推荐的疟疾治疗的最佳疗法。为了满足全世界范围内对青蒿素不断增长的需求,Fuentes等[73]开发了一种新的合成生物学方法,首先将青蒿酸生物合成的关键酶基因以及整合到叶绿体基因组,进而将影响青蒿酸通量的相关酶基因及进行核转化,最终获得了青蒿酸含量达120 mg/kg鲜重(fresh weight,FW)的烟草品系,该品系所表达的叶绿体操纵子利用莱茵衣藻启动子CrP和CrP,分别与T7L组合,以多顺反子的形式驱动青蒿酸生物合成途径关键酶基因的表达,实现了将次生代谢产物生物合成途径从原植物向高生物量作物的转移。
光系统是由蛋白质和叶绿素等光合色素组成的复合物,是将吸收的太阳能转化为化学能的功能单位,包括光系统I(PS I)和光系统II(PS II)。叶绿体基因编码PS II反应中心D2蛋白,细胞核编码的Nac2蛋白可与基因mRNA的5′UTR特异性结合,二者的相互作用是维持基因mRNA稳定性及PS II反应中心D2蛋白正常表达所必需的。Dinc等[82]将转质体莱茵衣藻基因的5′UTR 替换为基因的5′UTR,并利用诱导型启动子MetE驱动核基因的表达。使用维生素对转质体莱茵衣藻进行处理后,MetE启动子的转录活性被抑制,导致基因mRNA和编码蛋白的水平逐渐下降,进一步抑制了叶绿体的翻译活性;使用维生素处理转质体细胞后的48~96 h,叶绿素a与叶绿素b含量的比值显著降低,可变荧光(Fv)与最大荧光(Fm)的比率显著下降,转质体细胞停止生长。此外,转质体细胞低温荧光发射光谱中PS I的发射峰发生了蓝移(blue shift),与PS I的发射荧光(N700 nm)强度相比,PS II的发射荧光(686 nm)强度有所下降。该研究表明,通过在生长培养基中添加维生素对转质体莱茵衣藻的叶绿体翻译进行可逆性抑制,可以用来研究光合复合物在膜中的相对稳定性。
2.3 3′UTR的结构、功能与应用
质体基因编码区下游的3′UTR通常包含一段能够在转录后折叠成稳定茎-环结构的序列,这种结构可以有效避免3′→5′核糖核酸外切酶对mRNA 的降解[83],但不同于真核系统中的终止子或细菌中的终止序列,这种结构在质体中并不具备转录终止功能[84],而是作为转录加工识别位点以及起到维持转录本稳定性的作用[85]。
此前已有多项研究探究了不同3′UTR对叶绿体基因组中报告基因表达的影响[69,86]。其中Tangphatsornruang等[86]比较了不同3′UTR对烟草叶绿体中外源基因表达的影响,分别将来自烟草叶绿体基因编码区下游的T、T、T和T以及大肠杆菌操纵子的终止子序列T置于绿色荧光蛋白基因()的下游,在含有P-- T操纵子的转质体烟草中mRNA的积累水平是含有T和T操纵子的4倍,所有转基因烟草都积累了大约相同水平的GFP,占总可溶性蛋白的0.2%,说明翻译受到转录丰度以外其他因素的影响。以上研究表明,3′UTR会对RNA的积累水平产生影响,但对蛋白积累水平的影响有限。
3 新型表达调控系统的开发与应用
3.1 多基因共表达调控系统
在设计构建复杂生物合成途径的操纵子时,往往需要将多条途径的相关基因构建至载体上,这可能会重复使用表达调控元件,同时也会提高载体构建的难度。而在质体表达系统中,以单一启动子驱动多条基因的转录较为常见[87,88],这种特性为研究人员在质体中构建复杂生物合成途径提供了可能。与细菌以多顺反子为单位直接进行翻译不同,质体中的多顺反子会被加工成单顺反子,但顺反子间的加工是否能够促进操纵子中所有基因的表达仍需进一步研究[36,89]。
当前比较成熟的构建策略是在合成操纵子序列中添加能够将多顺反子加工形成单顺反子的表达调控元件。Zhou等[37]首次鉴定出了这种顺反子间表达元件(IEE),该元件的序列长度仅为50 bp,位于-基因间隔区,序列中含有RNA结合蛋白HCF107的识别位点,该元件有效改善了多顺反子中某个顺反子表达水平过低的情况,也为多基因合成操纵子在叶绿体中的表达提供了有效工具。因此在异源生物合成途径的质体转化研究中被广泛使用[26,33,73,74,90,91]。
为了避免过度重复使用单一元件,Legen等[92]测试了5个含有五肽重复蛋白(pentatricopeptide repeat,PPR)结合位点的 sRNA 序列,发现其中5种sRNA 能够稳定其下游基因的转录本并提高其蛋白的表达水平,说明这些sRNA与IEE一样能够用于叶绿体多顺反子操纵子的构建。值得注意的是,这种元件与核编码PPR蛋白的结合除了会影响多顺反子mRNA的加工之外,也可以提高翻译效率和/或影响 mRNA 稳定性,但是这些元件是如何增加外源基因表达的尚不明确。Macedo-Osorio等[38]测试了来自-、-、-、-和-叶绿体操纵子的基因间隔区序列,并将这些间隔区序列构建至--双顺反子操纵子基因之间。尽管所有的转质体细胞系都具有卡那霉素抗性,但只有其中两条间隔区(-和-的基因间隔区)序列能够介导细胞系中的表达。
3.2 诱导表达调控系统
尽管叶绿体内源强启动子可以实现基因的高效表达,但是随着质体转化研究的不断深入,研究发现某些外源蛋白或异源合成途径在叶绿体中的过度表达可能会对植物本身的生长发育产生负面影响[93~98]。为了能够精细调控外源基因在叶绿体中的表达水平,就需要开发特异性诱导表达调控元件,这类元件通过特定的物理或化学方式诱导后,不仅能够大幅降低持续表达产生的负面影响,还能根据不同的实验目的和设计需求在特定时间启动或停止外源基因的表达。
3.2.1 核诱导表达调控系统
近年来植物质体基因工程诱导表达调控系统的开发已日趋成熟(表2),其中核基因工程诱导表达调控系统动态表达范围高,在未诱导状态下,表达泄漏较少。一种常见的策略是将融合了质体定位信号的外源基因由诱导型或组织特异性启动子驱动在细胞核中表达,该基因编码蛋白与质体基因组内源调控元件特异性结合,进而增强调控元件下游基因的表达。另一种策略是在细胞核中利用诱导型或组织特异性启动子表达可与非质体特异性调控元件结合的外源基因编码蛋白,进而增强调控元件下游基因的表达。
Rojas等[71]发现,当核基因组编码的PPR蛋白被乙醇诱导表达后,能够与叶绿体mRNA的5′UTR特异性结合,进而稳定mRNA的结构,并通过提高翻译效率增强外源基因的表达。Yu等[99]在此基础上开发了基于此元件的表达调控系统,该系统包含了玉米()叶绿体的PPR10变体与基因上游的同源结合位点。由于马铃薯内源PPR10蛋白不识别该位点,因此GFP在叶片中的表达水平较低。当PPR10变体在块茎特异性启动子的驱动下表达时,GFP的积累水平占总可溶性蛋白的1.3%,因此,该系统能够增加非光合质体中外源基因的表达,但不会干扰叶片中的叶绿体基因表达。
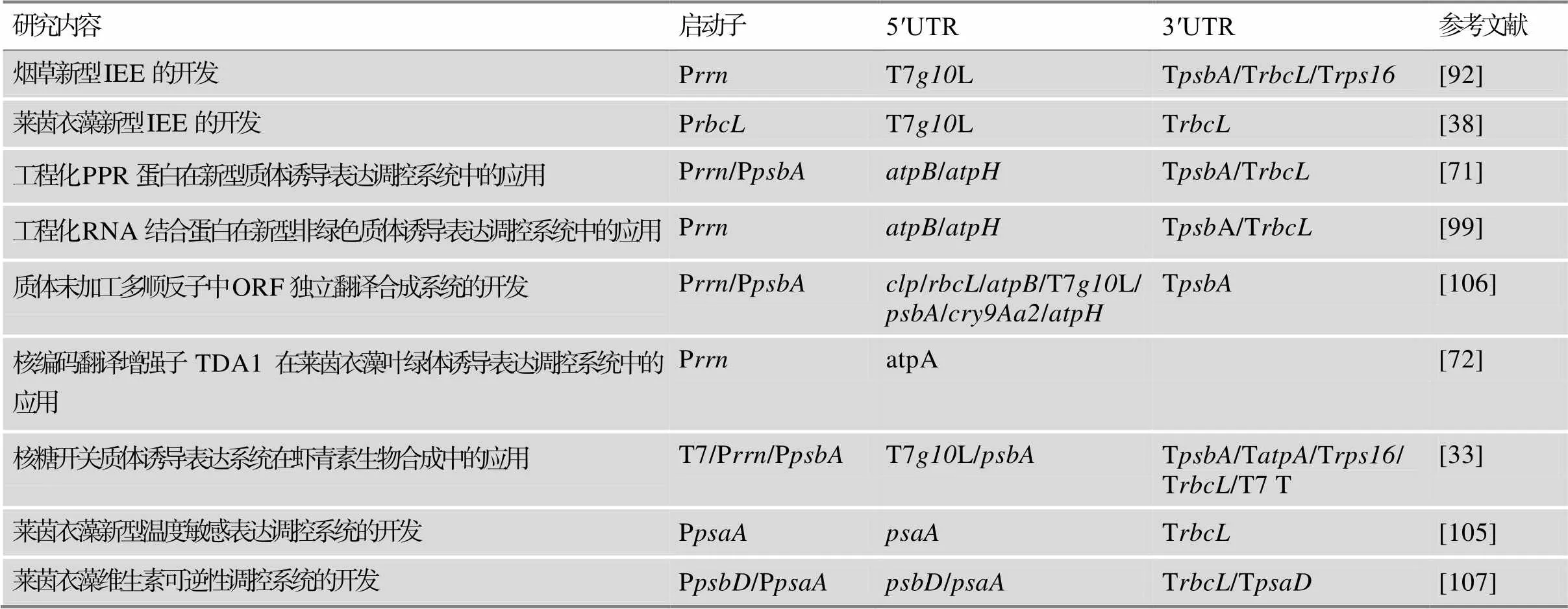
表2 近5年开发的新型诱导表达调控系统
Rochaix等[100]建立了-叶绿体基因诱导表达调控系统,其中铜离子诱导型启动子Cyc6驱动核基因的表达,该基因编码一种靶向叶绿体的蛋白质,特异性作用于叶绿体基因的5′UTR,是保持基因mRNA和光系统II稳定性所必需的。当有铜离子存在时,基因的表达被抑制,导致基因的mRNA稳定性降低,当没有铜离子存在时,基因发生表达,进而提高了基因的mRNA稳定性及其蛋白的表达水平。通过用的5′UTR替换其他质体基因的5′UTR,理论上可将这种诱导表达调控系统应用于任何质体基因的表达调控研究。
此外,Carrera-Pacheco等[72]还开发了用于调控质体表达系统的增强子TDA1,该增强子由核基因组编码,其C端(cTDA1)可通过与5′UTR的相互作用促进的翻译。该研究将诱导型启动子HSP70A-RBCS2驱动的cTDA1在莱茵衣藻细胞核中表达,将5′UTR调控的基因在莱茵衣藻质体中表达;通过对莱茵衣藻进行特定的热休克及光照处理后,检测到莱茵衣藻中GFP的表达水平最高增长了约1.9倍,表明GFP的表达水平与cTDA1的积累水平有关。
3.2.2 质体诱导表达调控系统
质体基因工程可高效表达异源蛋白,避免基因沉默和位置效应,且生物安全性高[101,102],但质体诱导表达调控系统需要利用细菌诱导表达调控元件。为此,研究人员开发了一系列能够在质体中进行诱导表达的调控系统。
虾青素(astaxanthin)是迄今为止自然界中最强的天然抗氧化剂[103,104],当前已实现了其生物合成途径在转质体种子植物中的异源表达及高水平积累[78,91],但虾青素的合成对类异戊二烯前体的消耗限制了叶绿素、类胡萝卜素和植物激素的生物合成,导致转质体植物出现了严重的生长迟缓。因此,在最近的一项研究中,作者利用质体诱导表达调控系统解决了这一问题[33]。该系统利用茶碱依赖性核糖开关,可通过小分子化合物茶碱调控T7 RNA聚合酶基因的表达,诱导产生少量的T7 RNA聚合酶作用于质体基因组T7启动子,在该启动子驱动下的虾青素合成操纵子产生了大量转录本,进一步提高了虾青素的积累水平,且与组成型转质体烟草相比[91]虾青素的含量并未显著减少。更重要的是,诱导型植物与野生型的表型几乎一致,说明该诱导表达调控系统未对植物的正常生长造成影响。
莱茵衣藻叶绿体基因组中不含有终止密码子TGA,Young等[105]利用这一特性开发了一种简单的质体诱导表达系统,将trnW基因整合至莱茵衣藻的叶绿体基因组,该基因可编码一种对温度敏感的突变体tRNA,因此,包含TGA密码子的外源基因在P的驱动下表达水平随培养温度的降低而逐渐升高,当温度降低至15℃时表达水平最高,当温度升高至35℃时,蛋白表达水平降至最低或完全不表达。此外,作者还可通过改变转基因内TGA密码子的数量来精准调控外源基因的表达水平。该系统为莱茵衣藻的质体基因工程提供了新工具,并能够进一步开发为研究叶绿体中必需基因功能的热抑制系统。
4 结语与展望
表达调控元件的选择和组合方式对于质体基因工程研究至关重要,其中启动子决定了转录速率[28],5′UTR决定了mRNA的翻译效率[29],3′UTR主要负责维持mRNA的稳定性[30]。值得注意的是,内源表达调控元件的使用虽然在一定程度上可以保证基因的表达水平,但也存在着发生非预期同源重组从而影响蛋白表达水平的可能性。叶绿体基因组中反向重复区的重组会导致插入序列的翻转,这种重组现象也叫做翻转(flip-flop)重组。Rogalski等[108]在探究烟草质体核糖体蛋白 S18是否影响细胞存活时,意外发现在叶绿体基因组短反向重复序列发生了两次flip-flop重组,这种重组事件的发生使得该研究在使用I酶进行限制片段长度多态性分析时,除产生了预计大小为6 kb的片段外,还额外产生了大小为5 kb的杂交片段。在此基础上,该研究使用限制性内切酶I和R V进一步证实了这一发现,除产生了预计大小为9 kb的片段外,还产生了一个长度明显更小(6.2 kb)的片段。Zhou等[32]在检测转质体中HIV 抗原结合操纵子的表达时,发现转质体植物的不同表型与这种非预期同源重组相关。在未发生flip-flop重组的情况下,由全长P驱动基因的转录,导致了色素缺乏型,即黄色烟草的产生。而flip-flop重组事件发生后,由截短的P启动子驱动基因的转录,使得该基因的表达水平大幅下降,因此未产生色素缺乏型烟草。为了避免内源调控元件之间发生非预期同源重组,近年来研究者们也在积极开发并使用一些异源调控序列,例如在烟草叶绿体操纵子构建中使用玉米来源的启动子ZmP[19]和5′UTR ZmL[71]、衣藻来源的启动子CrP与3′UTR CrT[73]以及大肠杆菌来源的3′UTR T[45]。
利用多基因共表达调控系统可以显著提升异源复杂生化途径引入质体基因组的可行性,但在设计构建多顺反子操纵子时,仍需尽可能避免重复使用单一的IEE样元件。此外,在某些情况下,质体中的多顺反子mRNA也可以直接作为翻译的模板。Staub等[109]为了确定在质体中是否存在启动子远端开放阅读框的翻译起始,将不含有启动子的报告基因整合到了烟草质体基因组基因的下游区域后未产生单顺反子mRNA。然而由于基因的3′UTR转录终止效率较低,产生了包含基因作为第二个顺反子的多顺反子转录单元,转质体植物中仍能检测到报告基因编码的产物GUS的表达,表明启动子远端顺反子可以在质体中进行有效翻译。Quesada-Vargas等[110]首次对烟草叶绿体基因组中异源操纵子的转录、转录后和翻译过程进行表征。含有不同异源操纵子(操纵子、操纵子、操纵子和操纵子)的叶绿体转基因系中,转录产物为多顺反子mRNA。尽管在转质体内缺乏对此类多顺反子mRNA的加工,但仍能检测到较高水平的外源蛋白,说明叶绿体可以直接翻译异源多顺反子mRNA,即使在不存在3′UTR的情况下,加工和未加工的异源多顺反子mRNA均是稳定的。
经过30多年的发展,用于质体转化研究的表达调控元件种类已十分可观,这些元件已基本能够适应绝大多数研究目的及实验设计需求,而关于非绿色组织中质体调控系统的报道仍然较少[99]。此外,利用诱导表达调控系统尽管能够有效降低异源合成所带来的有害影响,实现对质体表达系统的精准调控[72,83,99],但这类系统需要在非诱导状态下避免表达泄露并兼顾更广的动态调节范围,因此需对质体诱导表达调控系统进行更加深入的研究。
[1] Daniell H, McFadden BA. Uptake and expression of bacterial and cyanobacterial genes by isolated cucumber etioplasts., 1987, 84(18): 6349–6353.
[2] Daniell H. Molecular strategies for gene containment in transgenic crops., 2002, 20(6): 581–586.
[3] Devine AL, Daniell H. Chloroplast genetic engineering for enhanced agronomic traits and expression of proteins for medical/industrial applications., 2018, 13(10): 283–320.
[4] Boynton JE, Gillham NW, Harris EH, Hosler JP, Johnson AM, Jones AR, Randolph-Anderson BL, Robertson D, Klein TM, Shark KB. Chloroplast transformation inwith high velocity microprojectiles., 1988, 240(4858): 1534–1538.
[5] Blowers AD, Bogorad L, Shark KB, Sanford JC. Studies onchloroplast transformation: foreign DNA can be stably maintained in the chromosome., 1989, 1(1): 123–132.
[6] Svab Z, Hajdukiewicz P, Maliga P. Stable transformation of plastids in higher plants., 1990, 87(21): 8526–8530.
[7] Svab Z, Maliga P. High-frequency plastid transformation in tobacco by selection for a chimericgene., 1993, 90(3): 913–917.
[8] Daniell H, Lin CS, Yu M, Chang WJ. Chloroplast genomes: diversity, evolution, and applications in genetic engineering., 2016, 17(1): 134.
[9] Oey M, Lohse M, Kreikemeyer B, Bock R. Exhaustion of the chloroplast protein synthesis capacity by massive expression of a highly stable protein antibiotic., 2009, 57(3): 436–445.
[10] Daniell H. Transgene containment by maternal inheritance: effective or elusive?, 2007, 104(17): 6879–6880.
[11] Inaba T. Bilateral communication between plastid and the nucleus: plastid protein import and plastid-to-nucleus retrograde signaling., 2010, 74(3): 471–476.
[12] Inaba T, Ito-Inaba Y. Versatile roles of plastids in plant growth and development., 2010, 51(11): 1847–1853.
[13] Inaba T, Yazu F, Ito-Inaba Y, Kakizaki T, Nakayama K. Retrograde signaling pathway from plastid to nucleus., 2011, 290: 167–204.
[14] Timmis JN, Ayliffe MA, Huang CY, Martin W. Endosymbiotic gene transfer: organelle genomes forge eukaryotic chromosomes., 2004, 5(2): 123–135.
[15] Bock R, Timmis JN. Reconstructing evolution: gene transfer from plastids to the nucleus., 2008, 30(6): 556–566.
[16] Sabater B. Evolution and function of the chloroplast. Current investigations and perspectives., 2018, 19(10): 3095.
[17] Tsai JY, Chu CC, Yeh YH, Chen LJ, Li HM, Hsiao CD. Structural characterizations of the chloroplast translocon protein Tic110., 2013, 75(5): 847–857.
[18] Hua ZY, Tian DM, Jiang C, Song SH, Chen ZY, Zhao YY, Jin Y, Huang LQ, Zhang Z, Yuan Y. Towards comprehensive integration and curation of chloroplast genomes., 2022, 20(12): 2239–2241.
[19] Ruf S, Forner J, Hasse C, Kroop X, Seeger S, Schollbach L, Schadach A, Bock R. High-efficiency generation of fertile transplastomicplants., 2019, 5(3): 282–289.
[20] Sidorov VA, Kasten D, Pang SZ, Hajdukiewicz PT, Staub JM, Nehra NS. Technical advance: stable chloroplast transformation in potato: use of green fluorescent protein as a plastid marker., 1999, 19(2): 209–216.
[21] Ruf S, Hermann M, Berger IJ, Carrer H, Bock R. Stable genetic transformation of tomato plastids and expression of a foreign protein in fruit., 2001, 19(9): 870–875.
[22] Dufourmantel N, Pelissier B, Garçon F, Peltier G, Ferullo JM, Tissot G. Generation of fertile transplastomic soybean., 2004, 55(4): 479–489.
[23] Lelivelt CLC, McCabe MS, Newell CA, deSnoo CB, van Dun KMP, Birch-Machin I, Gray JC, Mills KHG, Nugent JM. Stable plastid transformation in lettuce (L.)., 2005, 58(6): 763–774.
[24] Kaushal C, Abdin MZ, Kumar S. Chloroplast genome transformation of medicinal plant., 2020, 18(11): 2155–2157.
[25] Verma D, Daniell H. Chloroplast vector systems for biotechnology applications., 2007, 145(4): 1129–1143.
[26] Scharff LB, Bock R. Synthetic biology in plastids., 2014, 78(5): 783–798.
[27] Boehm CR, Bock R. Recent advances and current challenges in synthetic biology of the plastid genetic system and metabolism., 2019, 179(3): 794–802.
[28] Fuentes P, Armarego-Marriott T, Bock R. Plastid transformation and its application in metabolic engineering., 2018, 49: 10–15.
[29] Daniell H, Singh ND, Mason H, Streatfield SJ. Plant-made vaccine antigens and biopharmaceuticals., 2009, 14(12): 669–679.
[30] Bock R. Plastid biotechnology: prospects for herbicide and insect resistance, metabolic engineering and molecular farming., 2007, 18(2): 100–106.
[31] Martin-Avila E, Lim YL, Birch R, Dirk LMA, Buck S, Rhodes T, Sharwood RE, Kapralov MV, Whitney SM. Modifying plant photosynthesis and growth via simultaneous chloroplast transformation of Rubisco large and small subunits., 2020, 32(9): 2898–2916.
[32] Zhou F, Badillo-Corona JA, Karcher D, Gonzalez-Rabade N, Piepenburg K, Borchers AMI, Maloney AP, Kavanagh TA, Gray JC, Bock R. High-level expression of human immunodeficiency virus antigens from the tobacco and tomato plastid genomes., 2008, 6(9): 897–913.
[33] Agrawal S, Karcher D, Ruf S, Erban A, Hertle AP, Kopka J, Bock R. Riboswitch-mediated inducible expression of an astaxanthin biosynthetic operon in plastids., 2022, 188(1): 637–652.
[34] Bock R. Engineering chloroplasts for high-level constitutive or inducible transgene expression., 2021, 2317: 77–94.
[35] Scharff LB, Ehrnthaler M, Janowski M, Childs LH, Hasse C, Gremmels J, Ruf S, Zoschke R, Bock R. Shine- Dalgarno sequences play an essential role in the translation of plastid mRNAs in tobacco., 2017, 29(12): 3085–3101.
[36] Zoschke R, Bock R. Chloroplast translation: structural and functional organization, operational control, and regulation., 2018, 30(4): 745–770.
[37] Zhou F, Karcher D, Bock R. Identification of a plastid intercistronic expression element (IEE) facilitating the expression of stable translatable monocistronic mRNAs from operons., 2007, 52(5): 961–972.
[38] Macedo-Osorio KS, Pérez-España VH, Garibay-Orijel C, Guzmán-Zapata D, Durán-Figueroa NV, Badillo-Corona JA. Intercistronic expression elements (IEE) from the chloroplast ofcan be used for the expression of foreign genes in synthetic operons., 2018, 98(4–5): 303–317.
[39] Sun T, Bentolila S, Hanson MR. The unexpected diversity of plant organelle RNA editosomes., 2016, 21(11): 962–973.
[40] Bock R. Engineering plastid genomes: methods, tools, and applications in basic research and biotechnology., 2015, 66: 211–241.
[41] Narra M, Kota S, Velivela Y, Ellendula R, Allini VR, Abbagani S. Construction of chloroplast transformation vector and its functional evaluation inL., 2018, 8(3): 140.
[42] Yu QG, LaManna LM, Kelly ME, Lutz KA, Maliga P. New tools for engineering theplastid genome., 2019, 181(2): 394–398.
[43] Singh R, Lin SN, Nair SK, Shi Y, Daniell H. Oral booster vaccine antigen-Expression of full-length native SARS-CoV-2 spike protein in lettuce chloroplasts., 2023, 21(5): 887–889.
[44] Caroca R, Howell KA, Malinova I, Burgos A, Tiller N, Pellizzer T, Annunziata MG, Hasse C, Ruf S, Karcher D, Bock R. Knockdown of the plastid-encoded acetyl- CoA carboxylase gene uncovers functions in metabolism and development., 2021, 185(3): 1091– 1110.
[45] Jakubiec A, Sarokina A, Choinard S, Vlad F, Malcuit I, Sorokin AP. Replicating minichromosomes as a new tool for plastid genome engineering., 2021, 7(7): 932–941.
[46] Sugiura M. The chloroplast genome., 1992, 19(1): 149–168.
[47] Gruissem W, Tonkyn JC. Control mechanisms of plastid gene expression., 1993, 12(1–2): 19–55.
[48] Weihe A, Börner T. Transcription and the architecture of promoters in chloroplasts., 1999, 4(5): 169–170.
[49] Liere K, Börner T. Transcription and transcriptional regulation in plastids., 2007, 19: 121–174.
[50] Hajdukiewicz PT, Allison LA, Maliga P. The two RNA polymerases encoded by the nuclear and the plastid compartments transcribe distinct groups of genes in tobacco plastids., 1997, 16(13): 4041–4048.
[51] Zoubenko OV, Allison LA, Svab Z, Maliga P. Efficient targeting of foreign genes into the tobacco plastid genome., 1994, 22(19): 3819–3824.
[52] Daniell H, Rai V, Xiao YH. Cold chain and virus-free oral polio booster vaccine made in lettuce chloroplasts confers protection against all three poliovirus serotypes., 2019, 17(7): 1357–1368.
[53] Ivleva NB, Groat J, Staub JM, Stephens M. Expression of active subunit of nitrogenase via integration into plant organelle genome., 2016, 11(8): e0160951.
[54] De Cosa B, Moar W, Lee SB, Miller M, Daniell H. Overexpression of the Btoperon in chloroplasts leads to formation of insecticidal crystals., 2001, 19(1): 71–74.
[55] Tregoning JS, Nixon P, Kuroda H, Svab Z, Clare S, Bowe F, Fairweather N, Ytterberg J, van Wijk KJ, Dougan G, Maliga P. Expression of tetanus toxin Fragment C in tobacco chloroplasts., 2003, 31(4): 1174–1179.
[56] Ye GN, Hajdukiewicz PT, Broyles D, Rodriguez D, Xu CW, Nehra N, Staub JM. Plastid-expressed 5-enolpyruvylshikimate-3-phosphate synthase genes provide high level glyphosate tolerance in tobacco., 2001, 25(3): 261–270.
[57] Kuroda H, Maliga P. Complementarity of the 16S rRNA penultimate stem with sequences downstream of the AUG destabilizes the plastid mRNAs., 2001, 29(4): 970–975.
[58] Klein RR, Mullet JE. Control of gene expression during higher plant chloroplast biogenesis. Protein synthesis and transcript levels of,-, andin dark-grown and illuminated barley seedlings., 1987, 262(9): 4341–4348.
[59] Ruhlman T, Verma D, Samson N, Daniell H. The role of heterologous chloroplast sequence elements in transgene integration and expression., 2010, 152(4): 2088–2104.
[60] Boyhan D, Daniell H. Low-cost production of proinsulin in tobacco and lettuce chloroplasts for injectable or oral delivery of functional insulin and C-peptide., 2011, 9(5): 585–598
[61] Sharwood RE. Engineering chloroplasts to improve Rubisco catalysis: prospects for translating improvements into food and fiber crops., 2017, 213(2): 494–510.
[62] Kanevski I, Maliga P. Relocation of the plastidgene to the nucleus yields functional ribulose-1,5-bisphosphate carboxylase in tobacco chloroplasts., 1994, 91(5): 1969–1973.
[63] Whitney SM, Sharwood RE. Construction of a tobacco master line to improve Rubisco engineering in chloroplasts., 2008, 59(7): 1909–1921.
[64] Sharwood RE, Ghannoum O, Kapralov MV, Gunn LH, Whitney SM. Temperature responses of Rubisco from Paniceae grasses provide opportunities for improving C3 photosynthesis., 2016, 2: 16186.
[65] McCarty NS, Graham AE, Studená L, Ledesma-Amaro R. Multiplexed CRISPR technologies for gene editing and transcriptional regulation., 2020, 11(1): 1281.
[66] Bock R. Genetic engineering of the chloroplast: novel tools and new applications., 2014, 26: 7–13.
[67] Chen TY, Riaz S, Davey P, Zhao ZY, Sun YQ, Dykes GF, Zhou F, Hartwell J, Lawson T, Nixon PJ, Lin YJ, Liu LN. Producing fast and active Rubisco in tobacco to enhance photosynthesis., 2023, 35(2): 795–807.
[68] Herz S, Füssl M, Steiger S, Koop HU. Development of novel types of plastid transformation vectors and evaluation of factors controlling expression., 2005, 14(6): 969–982.
[69] Staub JM, Maliga P. Translation ofmRNA is regulated by light via the 5′-untranslated region in tobacco plastids., 1994, 6(4): 547–553.
[70] Eibl C, Zou Z, Beck A, Kim M, Mullet J, Koop HU. In vivo analysis of plastid,andUTR elements by chloroplast transformation: tobacco plastid gene expression is controlled by modulation of transcript levels and translation efficiency., 1999, 19(3): 333–345.
[71] Rojas M, Yu QG, Williams-Carrier R, Maliga P, Barkan A. Engineered PPR proteins as inducible switches to activate the expression of chloroplast transgenes., 2019, 5(5): 505–511.
[72] Carrera-Pacheco SE, Hankamer B, Oey M. Light and heat-shock mediated TDA1 overexpression as a tool for controlled high-yield recombinant protein production inchloroplasts., 2020, 48: 101921.
[73] Fuentes P, Zhou F, Erban A, Karcher D, Kopka J, Bock R. A new synthetic biology approach allows transfer of an entire metabolic pathway from a medicinal plant to a biomass crop., 2016, 5: e13664.
[74] Lu YH, Rijzaani H, Karcher D, Ruf S, Bock R. Efficient metabolic pathway engineering in transgenic tobacco and tomato plastids with synthetic multigene operons., 2013, 110(8): E623–E632.
[75] Chebolu S, Daniell H. Stable expression of Gal/GalNAc lectin ofin transgenic chloroplasts and immunogenicity in mice towards vaccine development for amoebiasis., 2007, 5(2): 230–239.
[76] Fernández-San Millán A, Ortigosa SM, Hervás-Stubbs S, Corral-Martínez P, Seguí-Simarro JM, Gaétan J, Coursaget P, Veramendi J. Human papillomavirus L1 protein expressed in tobacco chloroplasts self-assembles into virus-like particles that are highly immunogenic., 2008, 6(5): 427–441.
[77] Yabuta Y, Tanaka H, Yoshimura S, Suzuki A, Tamoi M, Maruta T, Shigeoka S. Improvement of vitamin E quality and quantity in tobacco and lettuce by chloroplast genetic engineering., 2013, 22(2): 391–402.
[78] Hasunuma T, Miyazawa SI, Yoshimura S, Shinzaki Y, Tomizawa KI, Shindo K, Choi SK, Misawa N, Miyake C. Biosynthesis of astaxanthin in tobacco leaves by transplastomic engineering., 2008, 55(5): 857–868.
[79] Drechsel O, Bock R. Selection of Shine-Dalgarno sequences in plastids., 2011, 39(4): 1427–1438.
[80] Eberhard S, Drapier D, Wollman FA. Searching limiting steps in the expression of chloroplast-encoded proteins: relations between gene copy number, transcription, transcript abundance and translation rate in the chloroplast of., 2002, 31(2): 149–160.
[81] Kahlau S, Bock R. Plastid transcriptomics and translatomics of tomato fruit development and chloroplast- to-chromoplast differentiation: chromoplast gene expression largely serves the production of a single protein., 2008, 20(4): 856–874.
[82] Dinc E, Ramundo S, Croce R, Rochaix JD. Repressible chloroplast gene expression in: a new tool for the study of the photosynthetic apparatus., 2014, 1837(9): 1548–1552.
[83] Stern DB, Goldschmidt-Clermont M, Hanson MR. Chloroplast RNA metabolism., 2010, 61: 125–155.
[84] Stern DB, Gruissem W. Control of plastid gene expression: 3′ inverted repeats act as mRNA processing and stabilizing elements, but do not terminate transcription., 1987, 51(6): 1145–1157.
[85] Monde RA, Greene JC, Stern DB. The sequence and secondary structure of the 3′-UTR affect 3′-end maturation, RNA accumulation, and translation in tobacco chloroplasts., 2000, 44(4): 529–542.
[86] Tangphatsornruang S, Birch-Machin I, Newell CA, Gray JC. The effect of different 3′ untranslated regions on the accumulation and stability of transcripts of a gfp transgene in chloroplasts of transplastomic tobacco., 2011, 76(3–5): 385–396.
[87] Cavaiuolo M, Kuras R, Wollman FA, Choquet Y, Vallon O. Small RNA profiling in: insights into chloroplast RNA metabolism., 2017, 45(18): 10783–10799.
[88] Gallaher SD, Fitz-Gibbon ST, Strenkert D, Purvine SO, Pellegrini M, Merchant SS. High-throughput sequencing of the chloroplast and mitochondrion ofto generate improved de novo assemblies, analyze expression patterns and transcript speciation, and evaluate diversity among laboratory strains and wild isolates., 2018, 93(3): 545–565.
[89] Hirose T, Sugiura M. Both RNA editing and RNA cleavage are required for translation of tobacco chloroplastmRNA: a possible regulatory mechanism for the expression of a chloroplast operon consisting of functionally unrelated genes., 1997, 16(22): 6804–6811.
[90] Gnanasekaran T, Karcher D, Nielsen AZ, Martens HJ, Ruf S, Kroop X, Olsen CE, Motawie MS, Pribil M, Møller BL, Bock R, Jensen PE. Transfer of the cytochrome P450-dependent dhurrin pathway fromintochloroplasts for light-driven synthesis., 2016, 67(8): 2495–2506.
[91] Lu YH, Stegemann S, Agrawal S, Karcher D, Ruf S, Bock R. Horizontal transfer of a synthetic metabolic pathway between plant species., 2017, 27(19): 3034–3041.e3.
[92] Legen J, Ruf S, Kroop X, Wang GW, Barkan A, Bock R, Schmitz-Linneweber C. Stabilization and translation of synthetic operon-derived mRNAs in chloroplasts by sequences representing PPR protein-binding sites., 2018, 94(1): 8–21.
[93] Lössl A, Eibl C, Harloff HJ, Jung C, Koop HU. Polyester synthesis in transplastomic tobacco (L.): significant contents of polyhydroxybutyrate are associated with growth reduction., 2003, 21(9): 891–899.
[94] Bohmert-Tatarev K, McAvoy S, Daughtry S, Peoples OP, Snell KD. High levels of bioplastic are produced in fertile transplastomic tobacco plants engineered with a synthetic operon for the production of polyhydroxybutyrate., 2011, 155(4): 1690–1708.
[95] Hennig A, Bonfig K, Roitsch T, Warzecha H. Expression of the recombinant bacterial outer surface protein A in tobacco chloroplasts leads to thylakoid localization and loss of photosynthesis., 2007, 274(21): 5749– 5758.
[96] Scotti N, Sannino L, Idoine A, Hamman P, De Stradis A, Giorio P, Maréchal-Drouard L, Bock R, Cardi T. The HIV-1 Pr55 gag polyprotein binds to plastidial membranes and leads to severe impairment of chloroplast biogenesis and seedling lethality in transplastomic tobacco plants., 2015, 24(2): 319–331.
[97] Magee AM, Coyne S, Murphy D, Horvath EM, Medgyesy P, Kavanagh TA. T7 RNA polymerase- directed expression of an antibody fragment transgene in plastids causes a semi-lethal pale-green seedling phenotype., 2004, 13(4): 325–337.
[98] Petersen K, Bock R. High-level expression of a suite of thermostable cell wall-degrading enzymes from the chloroplast genome., 2011, 76(3–5): 311–321.
[99] Yu QG, Barkan A, Maliga P. Engineered RNA-binding protein for transgene activation in non-green plastids., 2019, 5(5): 486–490.
[100] Rochaix JD, Surzycki R, Ramundo S. Regulated chloroplast gene expression in., 2021, 2317: 305–318.
[101] Greiner S, Sobanski J, Bock R. Why are most organelle genomes transmitted maternally?, 2015, 37(1): 80–94.
[102] Bock R. Topics in current genetics., 2007, 29–63.
[103] Giuliano G, Aquilani R, Dharmapuri S. Metabolic engineering of plant carotenoids., 2000, 5(10): 406–409.
[104] Ralley L, Enfissi EMA, Misawa N, Schuch W, Bramley PM, Fraser PD. Metabolic engineering of ketocarotenoid formation in higher plants., 2004, 39(4): 477– 486.
[105] Young R, Purton S. CITRIC: cold-inducible translational readthrough in the chloroplast ofusing a novel temperature-sensitive transfer RNA., 2018, 17(1): 186.
[106] Yu QG, Tungsuchat-Huang T, Verma K, Radler MR, Maliga P. Independent translation of ORFs in dicistronic operons, synthetic building blocks for polycistronic chloroplast gene expression., 2020, 103(6): 2318–2329.
[107] Ramundo S, Rochaix JD. Controlling expression of genes in the unicellular algawith a vitamin-repressible riboswitch., 2015, 550: 267–281.
[108] Rogalski M, Ruf S, Bock R. Tobacco plastid ribosomal protein S18 is essential for cell survival., 2006, 34(16): 4537–4545.
[109] Staub JM, Maliga P. Expression of a chimericgene indicates that polycistronic mRNAs are efficiently translated in tobacco plastids., 1995, 7(5): 845–848.
[110] Quesada-Vargas T, Ruiz ON, Daniell H. Characterization of heterologous multigene operons in transgenic chloroplasts: transcription, processing, and translation., 2005, 138(3): 1746–1762.
Progress on regulatory elements of plant plastid genetic engineering
Yifan Yu1,2, Zhen OuYang2, Juan Guo1, Yujun Zhao1, Luqi Huang1,2
With the advancement of plant synthetic biology, plastids have emerged as an optimal platform for the heterologous production of numerous commercially valuable secondary metabolites and therapeutic proteins. In comparison on nuclear genetic engineering, plastid genetic engineering offers unique advantages in terms of efficient expression of foreign genes and biological safety. However, the constitutive expression of foreign genes in the plastid system may impede plant growth. Therefore, it is imperative to further elucidate and design regulatory elements that can achieve precise regulation of foreign genes. In this review, we summarize the progress made in developing regulatory elements for plastid genetic engineering, including operon design and optimization, multi-gene coexpression regulation strategies, and identification of new expression regulatory elements. These findings provide valuable insights for future research.
plant synthetic biology; plastid genetic engineering; genetic transformation; operon; regulatory element
2023-01-30;
2023-04-29;
2023-05-22
中央本级重大增减支项目“名贵中药资源可持续利用能力建设”(编号:2060302)和中央级公益性科研院所基本科研业务费专项资金(编号:ZZ15-YQ-061,ZZXT202103)资助[Supported by the Key Project at Central Government Level(No.2060302) and the Fundamental Research Funds for the Central Public Welfare Research Institutes(Nos. ZZ15-YQ-061, ZZXT202103)]
于一凡,在读博士研究生,专业方向:分子生药学。E-mail: 18641603721@163.com
赵瑜君,助理研究员,研究方向:中药资源与分子生药学。E-mail: zhaoyj@nrc.ac.cn
黄璐琦,研究员,研究方向:中药资源与分子生药学。E-mail: huangluqi01@126.com
10.16288/j.yczz.23-021
(责任编委: 宋任涛)
