重视识记知识强化推理能力
———以涉磷高考题为例
2023-07-03湖南省茶陵县第一中学716班周刘洋指导老师张宗明
■湖南省茶陵县第一中学716班 李 琼 周刘洋 (指导老师 张宗明)
高考近几年对物质结构与性质的考查,覆盖了高中内容的核心基础。在备考中要重点突破原子结构与性质、分子结构与性质、晶体结构与性质三个模块。现以涉磷高考题为例,探寻高效复习模式,做好应考准备。
一、做好知识识记
物质结构与性质知识从微观到宏观、从原理到应用,以作用力、空间构型为线索,探究不同类型物质的性质,大多数内容比较抽象,学习处于被动接受状态。根据循序渐进的理念,首先要记住一些学科常识,以不变应万变。
例1磷酰三叠氮是一种高能分子,结构简式为O= P (N3)3。下列有关P 及其化合物的说法正确的是( )。
A.O= P (N3)3为非极性分子,分解产物NPO 的电子式为
B.第一电离能:Cl>S>P>Si
C.相同条件下,与水反应由慢到快的顺序:OPBr3、OPCl3、OPF3
D.HNO3的分子间作用力较小,可推断HNO3的熔点比H3PO4的低
解析:磷酰三叠氮是陌生物质,依据其分子结构简式可以判断,该分子正电中心与负电中心没有重合,化学键的极性的向量和不等于零,属于极性分子;生成物NPO 为共价化合物,其电子式应为,选项A 错误。
当原子的价层电子排布状态为半充满或全充满时较为稳定。在Cl、S、P、Si四原子的p轨道中只有P 是半充满的,即此时P 的第一电离能比S、Si的第一电离能都大,故选项B错误。
F的原子半径比Br的小,F 的电负性比Br的大,故P—F 键比P—Br键更稳定。化学键越稳定,发生反应时越难断裂,相应的化学反应速率越慢,选项C错误。
已知HNO3的分子间作用力较小(原因是存在分子内氢键),故比较 HNO3与H3PO4的熔点,主要考虑相对分子质量影响。由M(H3PO4)>M(HNO3)可以判断H3PO4的分子间作用力比HNO3的强,即HNO3的熔点比H3PO4的低,选项D 正确。
答案:D
例2(1)在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是_____(填离子符号)。
(2)磷酸根离子的空间构型为_____,其中P 的价层电子对数为_____、杂化轨道类型为____。
(3)NH4H2PO4中,电负性最高的元素是____;P的____杂化轨道与O 的2p轨道形成____键。
(4)三价铬离子能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中配体分子NH3、H2O 以及分子PH3的空间结构和相应的键角如图1所示。

图1
NH3的沸点比PH3的沸点_____(填“高”或“低”),原因是____,H2O 的键角小于NH3的键角,原因是____。
解析:(1)K、H、P、O 四种元素分别能形成K+、H+(或H-)、P3-和O2-等简单离子,其中仅有K+和P3-核外电子排布相同。
(3)在元素周期表中,电负性的分布趋势与非金属性相似,靠右靠上非金属性逐渐增强,电负性依次增大,即在K、H、P、O 四种元素中电负性最大的是氧。
(4)因为氮元素的电负性比磷元素的大,NH3的分子间氢键比PH3的分子间作用力强,所以NH3的沸点比PH3的高。孤电子对会排斥孤电子对且斥力较大,孤电子对也会排斥成键电子对但斥力相对较弱。H2O含有两对孤电子对,NH3只有一对孤电子对,虽然都是sp3杂化轨道,但H2O 中静电斥力较强,H2O 的键角相对较小。
答案:(1)K+和P3-
(2)正四面体形 4 sp3
(3)氧(O) sp3σ
(4)高 NH3存在分子间氢键 NH3含有一对孤对电子,而H2O 含有两对孤对电子,H2O 中的孤对电子对成键电子对的排斥作用较大
二、强化证据意识
新课程标准对学习有创新方面的要求。以现有知识为前提,辅以思考分析、归纳类比等措施,在继承已有经验和成功做法的基础上,做一些总结提炼,促成学习方式的转变,确保学习活动的连续性、灵活性,以实现阶段性目标。
例3(1)已知有关氮、磷的单键和三键的键能(kJ·mol-1)如表1。
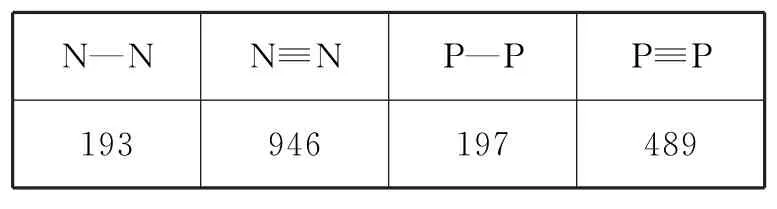
表1
从能量角度看,氮以N2、而白磷以P4(结构式可表示为)形式存在的原因是____。
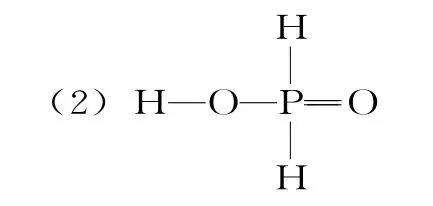
(2)已知KH2PO2是次磷酸的正盐,H3PO2的结构式为____。
(3)与PO34-电子总数相同的等电子体的分子式为____。
解析:(1)根据表中有关共价键的键能可以“构造”两个化学反应:
显然,在原子数目相同的条件下,N2比N4具有更低的能量,而P4比P2具有更低的能量,能量越低越稳定。
(2)由于含氧酸中只有羟基在水溶液中可以电离出H+,而含氧酸分子中H 又不一定都以—OH 的形式出现,如乙酸。依据KH2PO4是正盐,可以判断H3PO2为一元酸,其分子中只有一个羟基。即该分子中还有2个H—P单键、1个O P= 双键,分子结构式为
(3)等电子体多指原子总数和价电子总数都相同的微粒,不只限于分子。可用先加后减、先减后加、总数不变的计数方法找到PO3-4的等电子体分子,如SiF4、SO2F2等;还能找到等电子体离子,如ClO-4、SO2-4等。
答案:(1)在原子数目相同的条件下,N2比N4具有更低的能量,而P4比P2具有更低的能量,能量越低越稳定
(3)SiF4、SO2F2等
三、灵活应用跨学科知识
为解决具有高阶思维属性的问题,可借助熟悉的数理模型构建适合自己的物质结构认知模式,以适应发展的多样化需求。综合跨学科知识的力量,促成学科素养、必备品格与关键能力同步提升。
例4(1)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图2所示。
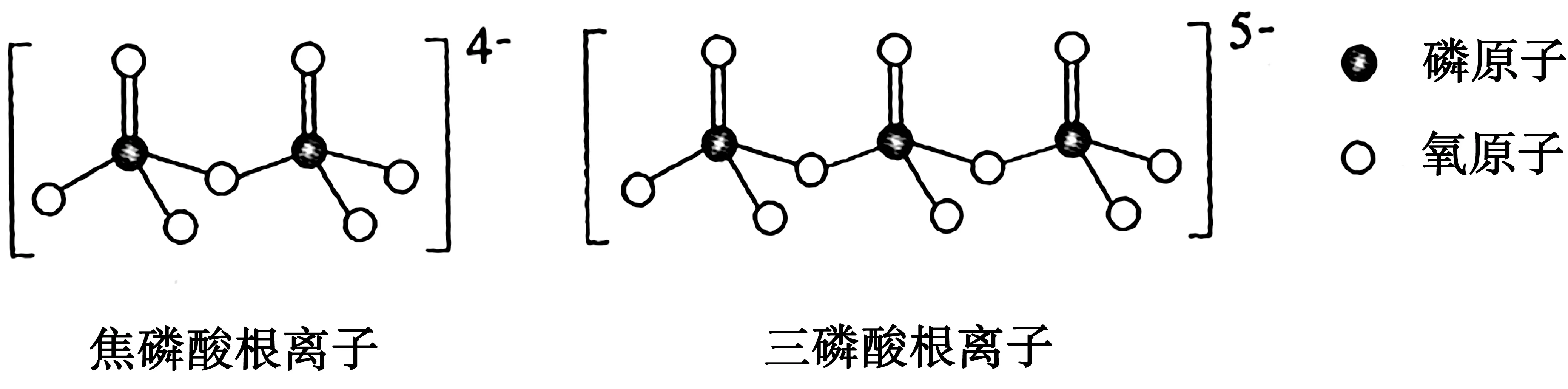
图2
这类磷酸根离子的化学式可用通式表示为_____(用n代表P原子数)。
(2)分别用○、●表示H2PO-4和K+,KH2PO4晶体的四方晶胞如图3(a)所示,图3(b)、图3(c)分别显示的是H2PO-4、K+在晶胞xz面、yz面 上 的 位 置:
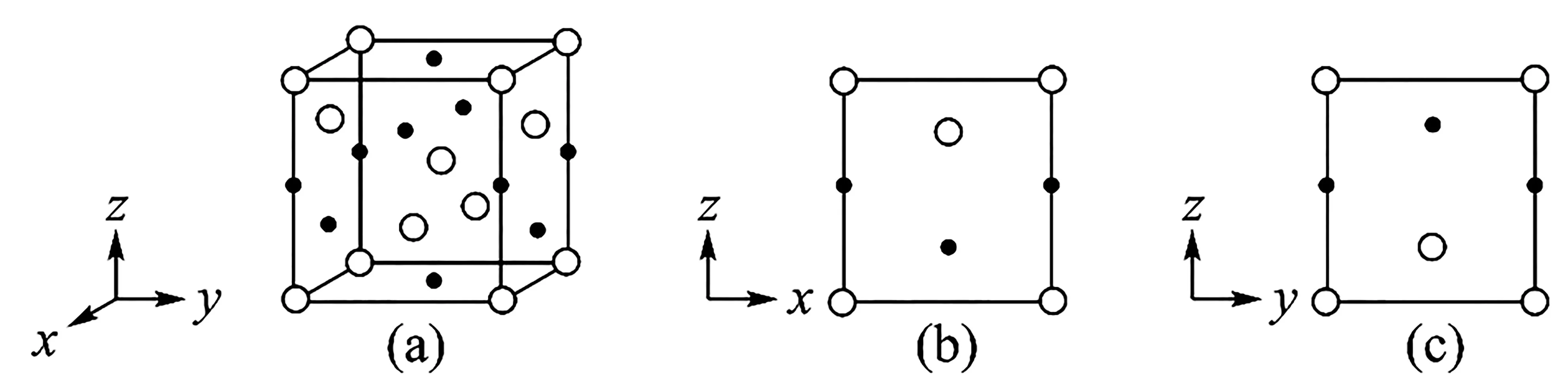
图3
①若晶胞底边的边长均为apm,高为cpm,阿伏加德罗常数的值为NA,晶体的密度为_____g·cm-3(写出表达式)。
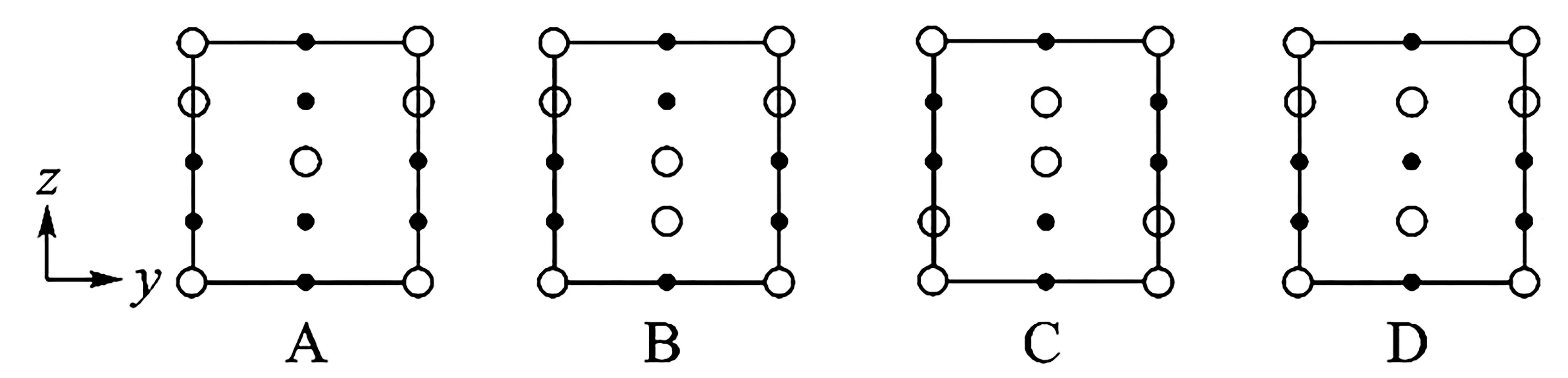
②晶胞在x轴方向的投影图为____(填标号)。
解析:(1)根据焦磷酸根离子、三磷酸根离子的图示结构,补充熟悉的磷酸根离子,可以写出系列化学式PO3-4、P2O4-7、P3O5-10……显然,这是“等差数列”,其首项为“PO3-4”,公差为“PO-3”,由通项公式可写出第n项表达式为(PnO3n+1)(n+2)-。

②物体投影的形状、大小与它相对于投影面的位置和角度有关,晶胞(a)在x轴方向的投影图就是前后方向的正投影图。分析图3中(a)、(b)、(c)可知,我们寻求的答案其实是在图3(c)现有图案不变的前提下,增加若干小圆圈或黑点。图3(c)中三个黑点位置与选项C、D 图案不一致;再看图3(a),中下部空间都是小圆圈,即晶胞(a)在x轴方向的投影图是。因为指定数轴定位,所以不能简单地把选项C 看作选项B 旋转180°所得,或者说这里只能单选B,而不能双选B、C。这次求解没有考虑学科特点,仅凭从定性到定量(逐步求精)的思维方式就轻松找到了答案。显然,考生有熟悉的立体几何基础,倒要当心第一印象先入为主错失“最优”方案。