2023年高考化学模拟试题B卷
2023-07-03河南省濮阳市第一高级中学王清泉正高级教师田秋平
■河南省濮阳市第一高级中学 王清泉(正高级教师) 田秋平
可能用到的相对原子质量:H 1 C 12 O 16 K 39 Mn 55 Fe 56 Cu 64 Ce 140 Bi 209
一、选择题:本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项符合题目要求。
1.古诗词是我国传统文化的瑰宝。下列诗词解读错误的是( )。
A.“常恐秋节至,焜黄华叶衰”,树叶由绿变黄是发生了化学变化
B.“落红不是无情物,化作春泥更护花”蕴含着自然界中的碳循环
C.“朝坛雾卷,曙岭烟沉”,雾有丁达尔效应是因为胶体粒子对光有散射作用
D.“心忧炭贱愿天寒”中的炭与“嫦娥五号”月球探测器所用的碳纤维互为同素异形体
A.是苯的同系物
B.一个分子中最多8个碳原子共平面
C.一氯代物有6种(不考虑立体异构)
D.一个分子中含有4个碳碳双键
3.NA为阿伏加德罗常数的值,下列说法正确的是( )。

B.电解精炼铜时,若转移了NA个电子,阳极溶解铜32g
C.将一定量的Cl2通入FeBr2溶液中,当有1 mol Br-转化为Br2时,转移电子总数为NA
D.标准状况下,22.4 L HF 中所含的分子数约为NA
4.二氧化氯(ClO2)是易溶于水且不与水反应的黄绿色气体,沸点为11 ℃。某小组在实验室中制备ClO2的装置如图1 所示[已知:SO2+2NaClO3+H2SO4==2ClO2+2NaHSO4]。
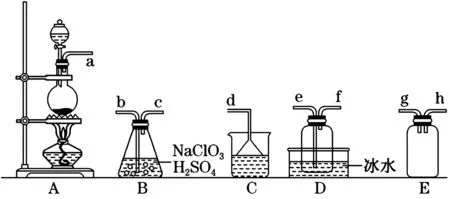
图1
下列说法正确的是( )。
A.装置C中装的是饱和食盐水,a逸出的气体为SO2
B.连接装置时,导管口a应接h或g,导管口c应接e
C.装置D 放冰水的目的是液化SO2,防止污染环境
D.可选用装置A 利用1 mol·L-1盐酸与MnO2反应制备Cl2
5.已知:A、B、C 三种元素, A 元素的族序数是周期数的3 倍,B 元素的最外层电子数是次外层电子数的2 倍,C 是一种过渡金属元素,A 与C 形成的化合物可作双氧水分解的催化剂。化合物CBA3在空气中加热,易转化为不同价态的C 与A 的化合物,其固体残留率(纵坐标)随温度的变化如图2 所示。下列说法中正确的是( )。
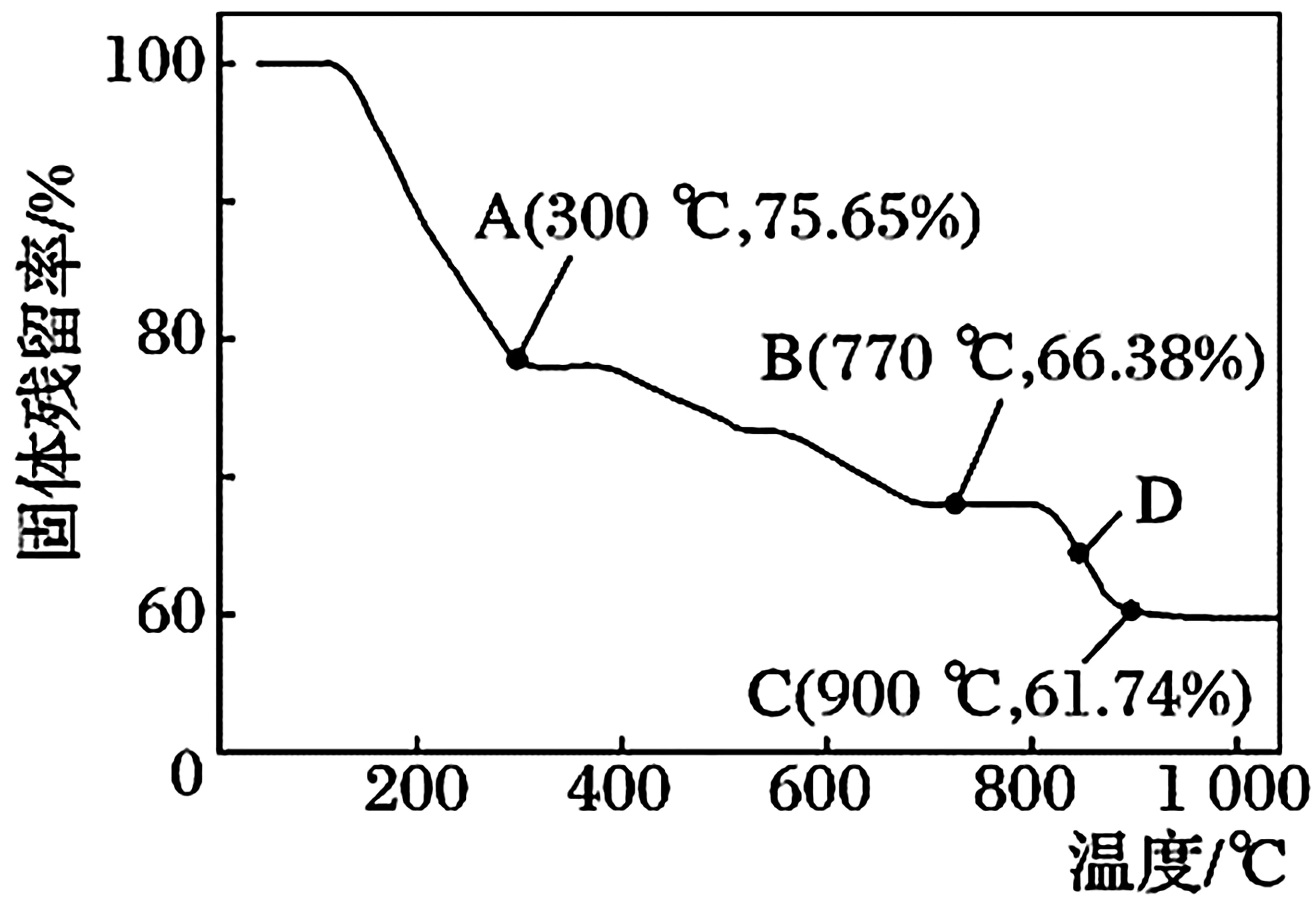
图2
A.BA2是大气的污染物,BA能使人中毒
B.图中点A 对应固体的成分为MnO
C.图中点B对应固体的成分为Mn3O4
D.图中点C对应固体的成分为MnO2
6.利用光伏电池与膜电解法制备Ce(SO4)2溶液的装置如图3所示,下列说法正确的是( )。
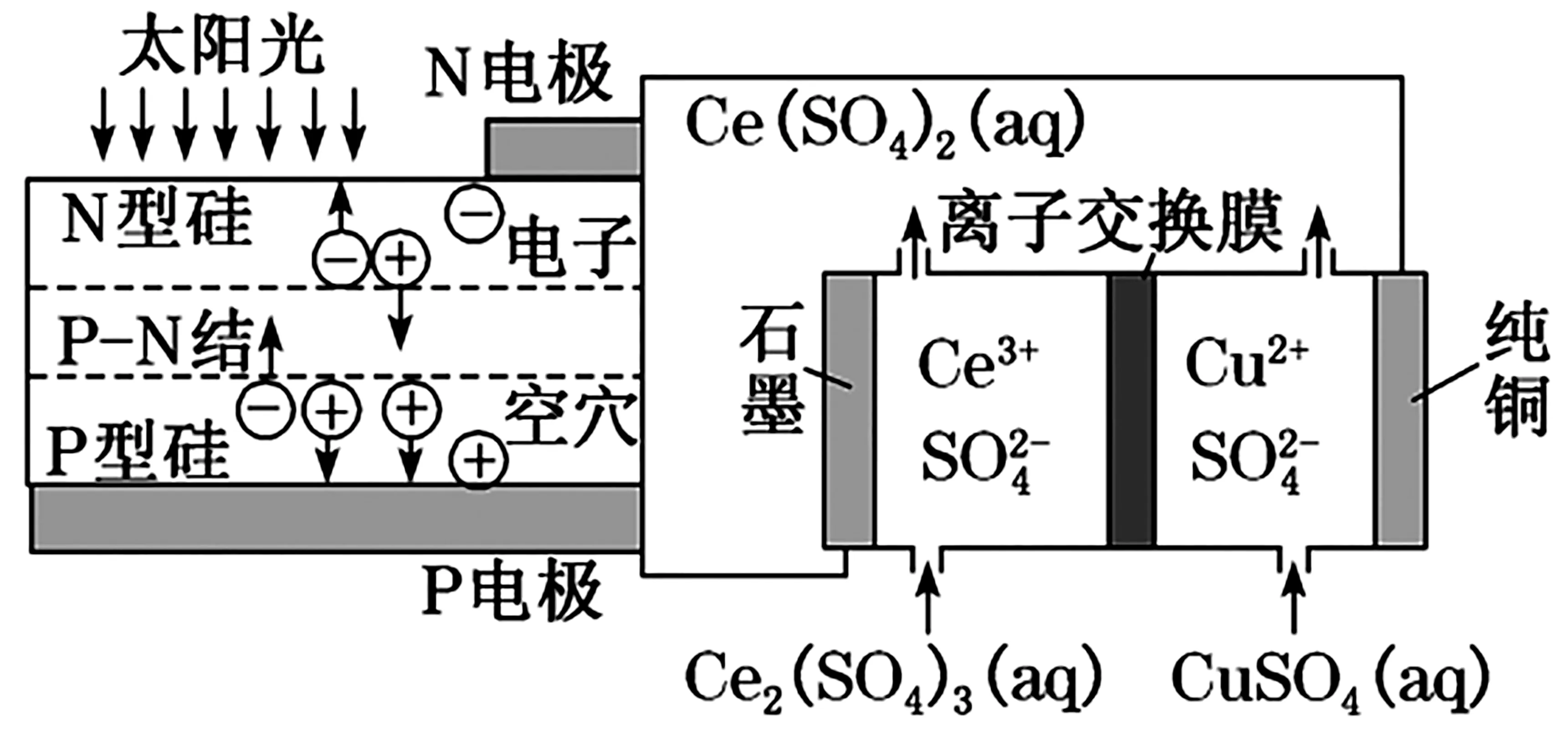
图3
A.该装置工作时的能量形式只有两种
B.石墨电极发生反应:Ce4++e-==Ce3+
C.该离子交换膜为阴离子交换膜,SO2-4由左池向右池迁移
D.由P电极向N 电极转移0.01 mol电子时,阳极室生成3.32gC e(SO4)2
7.25 ℃时,用0.050 0 mol·L-1H2C2O4溶 液 滴定 25.00mL 0.100 0 mol·L-1NaOH 溶液所得滴定曲线如图4所示。下列说法正确的是( )。

图4

二、非选择题:共58分,第8~10题为必考题,每个试题考生都必须作答。第11~12题为选考题,考生根据要求作答。
(一)必考题:共43分。
8.(14 分)钴钼系催化剂主要用于石油炼制等工艺,从废钴钼催化剂(主要含有MoS2、CoS和Al2O3)中回收钴和钼的工艺流程如下。
已知:浸取液中的金属离子主要为MoO2+2、Co2+、Al3+。
(1)钼 酸 铵[(NH4)2MoO4]中Mo 的 化合价为____,MoS2在空气中高温焙烧产生两种氧化物:SO2和_____(填化学式)。
(2)为了加快酸浸速率,可采取的措施为_____
(任写一条)。
(3)若选择两种不同萃取剂按一定比例(协萃比)协同萃取 MoO2+2和Co2+,萃取情况如图5所示,当协萃比为____时,更有利于MoO2+2的萃取。
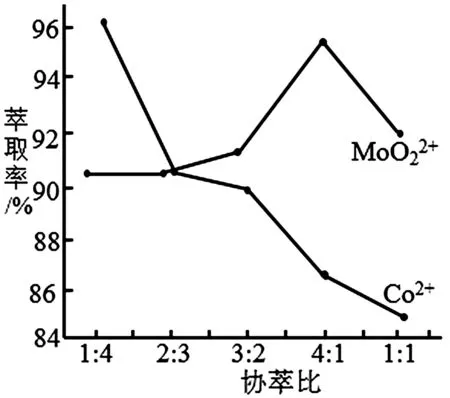
图5
(4)操作Ⅰ的名称为____。
(5)向有机相1中滴加氨水,发生的离子方程式为_____。
(6)Co2+萃取的反应原理为Co2++2HR,向有机相2 中加入H2SO4能进行反萃取的原因是____。
(7)水相2中的主要溶质除了H2SO4,还有____(填化学式)。
(8)Co3O4可用作电极,若选用KOH 电解质溶液,通电时可转化为CoOOH,其电极反应式为_____。
9.(15分)高铁酸钾(K2FeO4)是一种高效净水剂。已知:K2FeO4易溶于水,微溶于浓KOH 溶液;在酸性或中性溶液中不稳定,在0~5 ℃的强碱性溶液中较稳定。某实验小组欲制备高铁酸钾并测定其纯度。
Ⅰ.制备高铁酸钾(如图6,夹持装置略)。
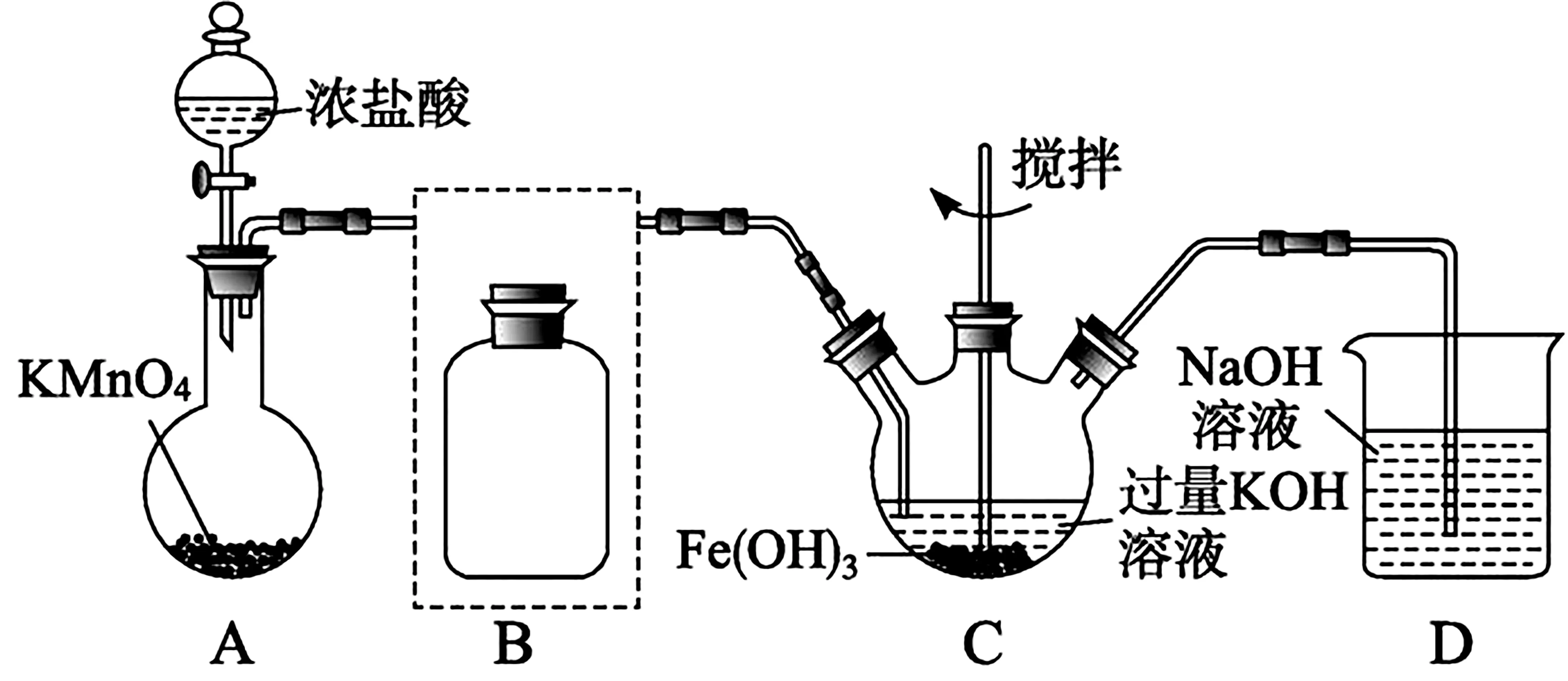
图6
(1)装置A 为氯气发生装置,A 中发生反应的离子方程式为____;装置C 中盛 放KOH 溶液的仪器名称为_____。
(2)将除杂装置B 补充完整并标明所用试剂。
(3)装置C 中Cl2与Fe(OH)3、KOH 反应生成K2FeO4的化学方程式是____。
(4)实验时将装置C置于冰水浴中,其原因是____。
(5)实验后经结晶法得到的K2FeO4晶体仍含较多杂质,要得到更纯的晶体,还应采取操作方法的名称是____。
Ⅱ.测定产品纯度。
(6)将wg K2FeO4粗产品溶于过量的碱性亚铬酸盐溶液中,充分反应后,加入稀硫酸酸化至溶液pH 为2,在所得的重铬酸盐溶液中加入5 滴二苯胺磺酸钠溶液作指示剂,然后用cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液VmL。已知该过程中涉及的离子反应主要有三个:
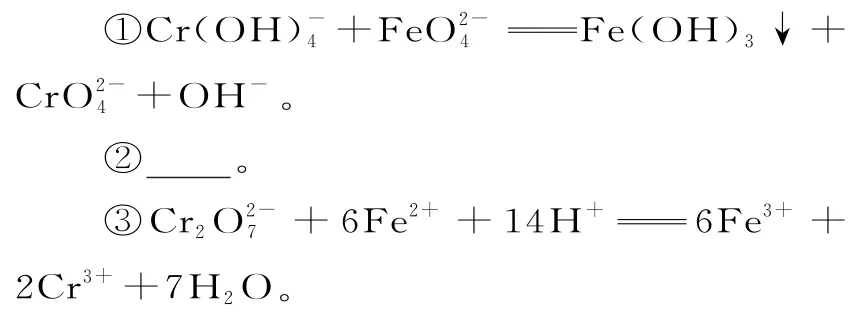
该粗产品中K2FeO4的质量分数为____(用含w、c、V的代数式表示)。若滴定管没有用标准液润洗,则测得的结果_____(填“偏高”“偏低”或“无影响”)。
10.(14 分)Cu2O 是一种重要的工业原料,广泛用作催化剂。
Ⅰ.制备Cu2O。
(1)微乳液—还原法:在100 ℃的Cu(NO3)2溶液中加入一定体积的NaOH 溶液,搅拌均匀,再逐滴加入肼(N2H4)产生红色沉淀,抽滤、洗涤、干燥,得到Cu2O。
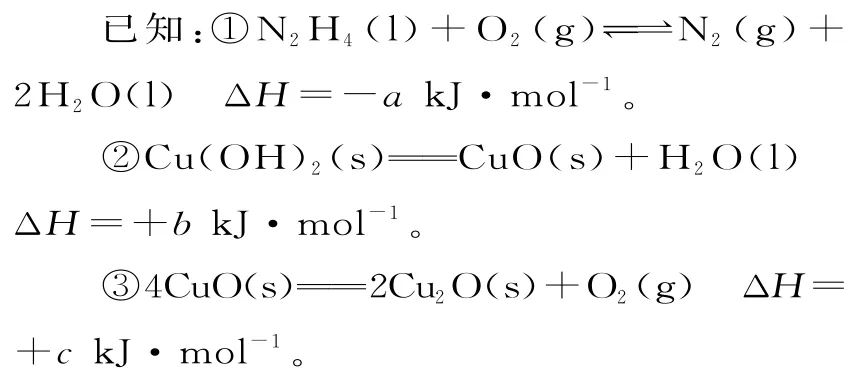
则由N2H4(l)和Cu(OH)2(s)反应制备Cu2O(s)的热化学方程式为_____。
(2)电解法:纳米级Cu2O 由于具有优良的催化性能而受到关注。
采用阴离子交换膜制备纳米级Cu2O 的装置如图7所示。
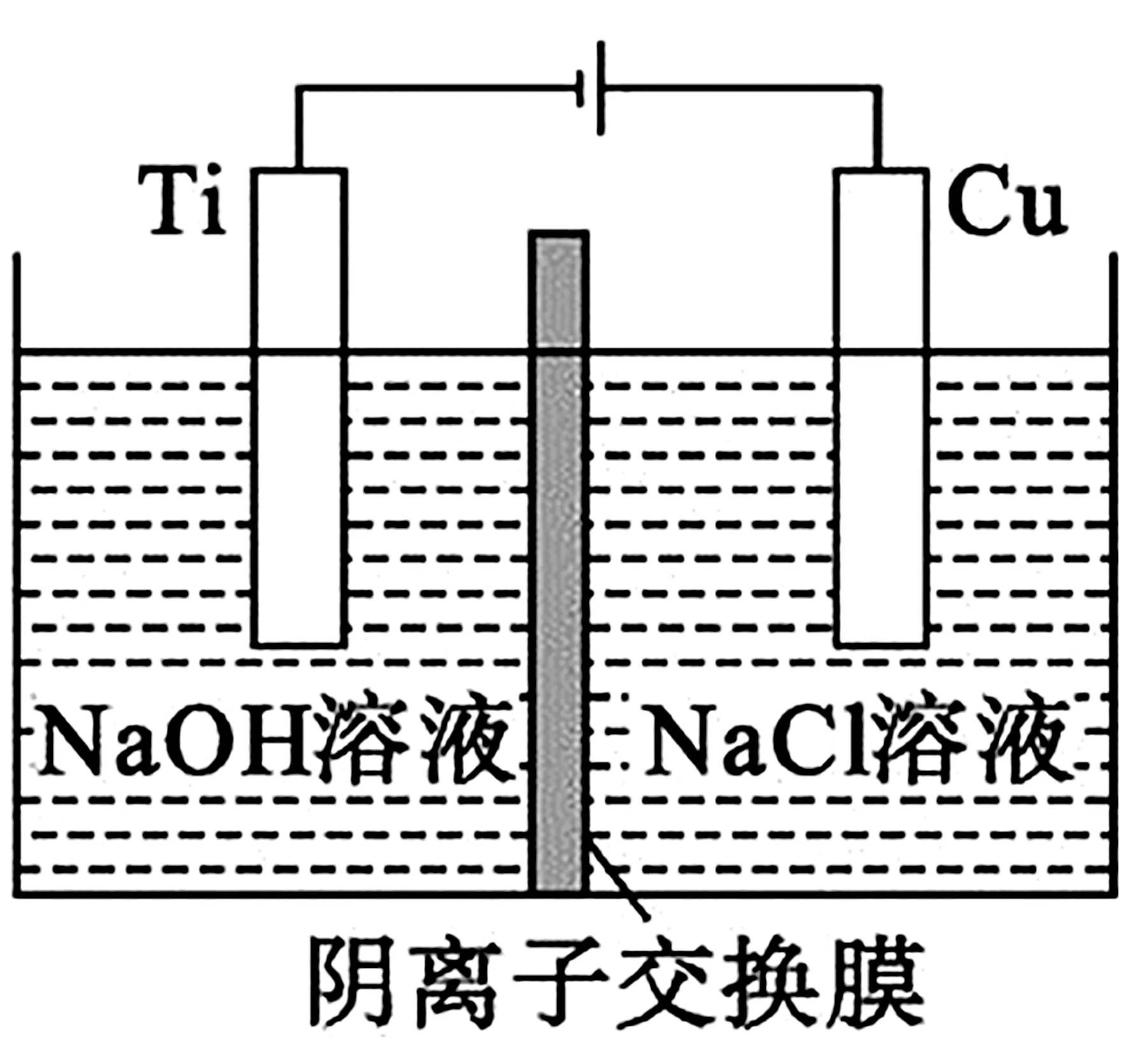
图7
阳极的电极反应式为____。
A.CO 的消耗速率等于CH3OH 的生成速率
B.一定条件下,CO 的转化率不再变化C.在绝热恒容的容器中,反应的平衡常数不再变化
(4)t℃时,在容积为2 L 的固定容积的密闭容器中加入2.00 mol H2(g)和1.00 mol CO(g),反应过程中CO 的物质的量随时间的变化如表1。
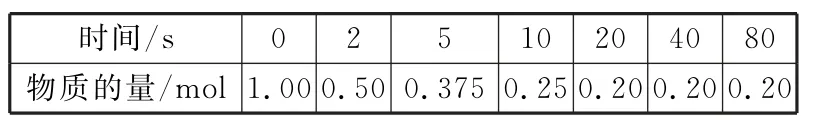
表1
根据表中数据回答:
①氢气平衡转化率为____。
②t℃时该反应的平衡常数为____。
③保持其他条件不变,再向平衡体系中充入1 mol CO(g)、2 mol H2(g)和1 mol CH3OH(g),此时反应的v(正)_____v(逆)(填“>”“<”或“=”)。
(5)工业实际合成CH3OH 生产中,采用如图8 M 点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由:___。
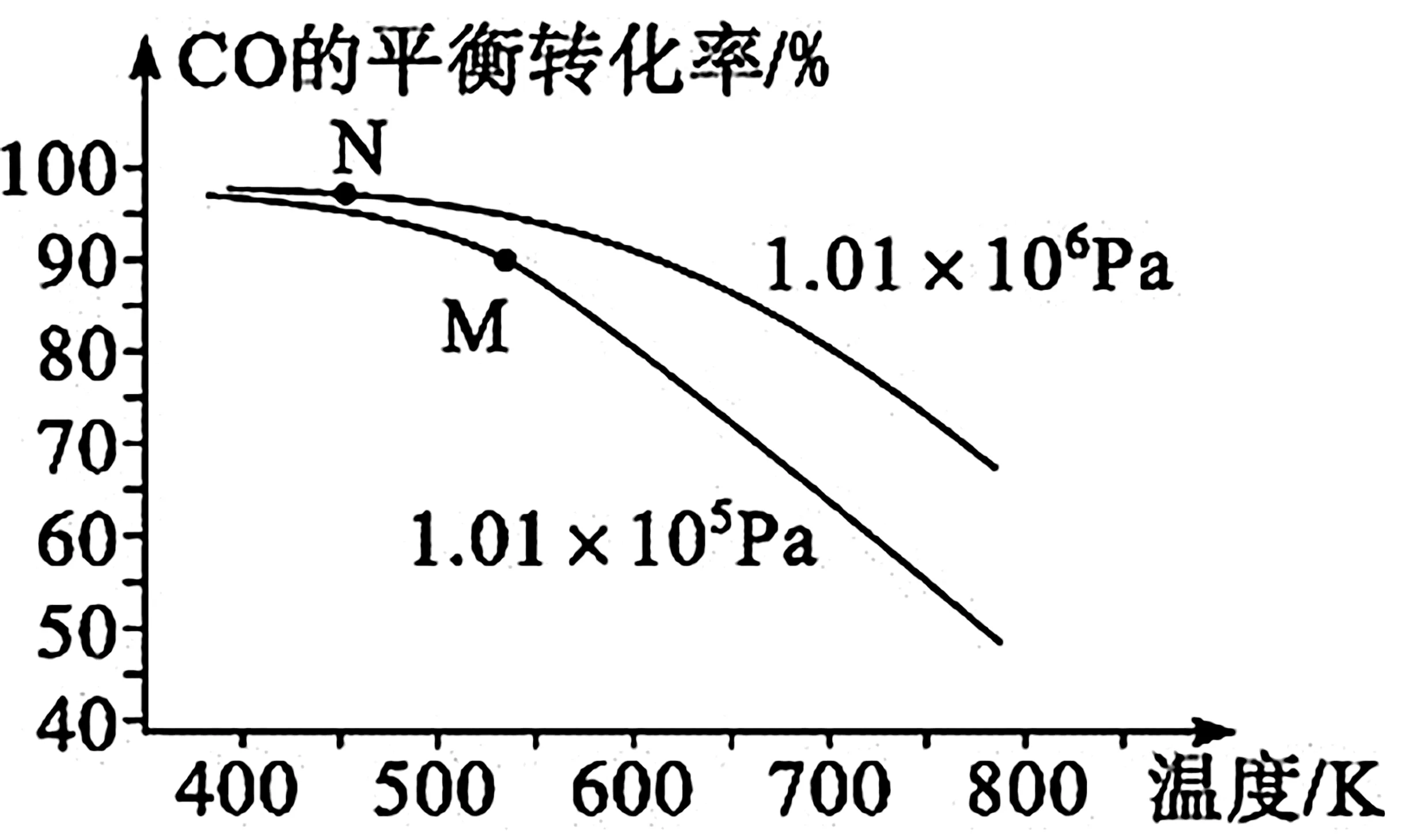
图8
(二)选考题:共15分。请从两道题中任选一题作答。如果多做,则按所做的第一题计分。
11.【选修3:物质结构与性质】(15分)
氮族元素包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi),在性质上表现出从典型的非金属元素到典型的金属元素的一个完整的过渡。
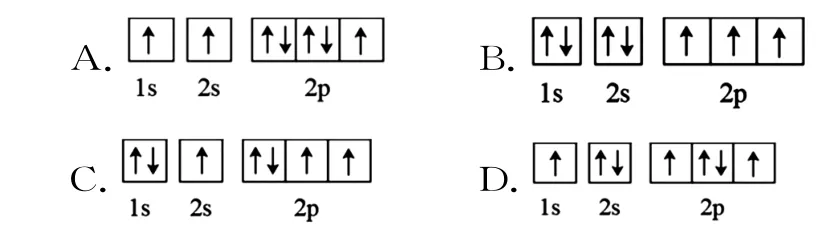
(1)下列氮原子的能量最低的是____。
(2)①氮族元素简单氢化物的键角NH3>PH3>AsH3,其原因是____。
②如图9,某课题组成功合成了无机二茂铁类似物[Fe(η4-P4)2]2-。环状P24-是芳香性π配体,P 的杂化方式是____,P24-中的大π键应表示为____(分子中的大π 键可用符号表示,其中m代表形成大π 键的原子数,n代表形成大π键的电子数)。
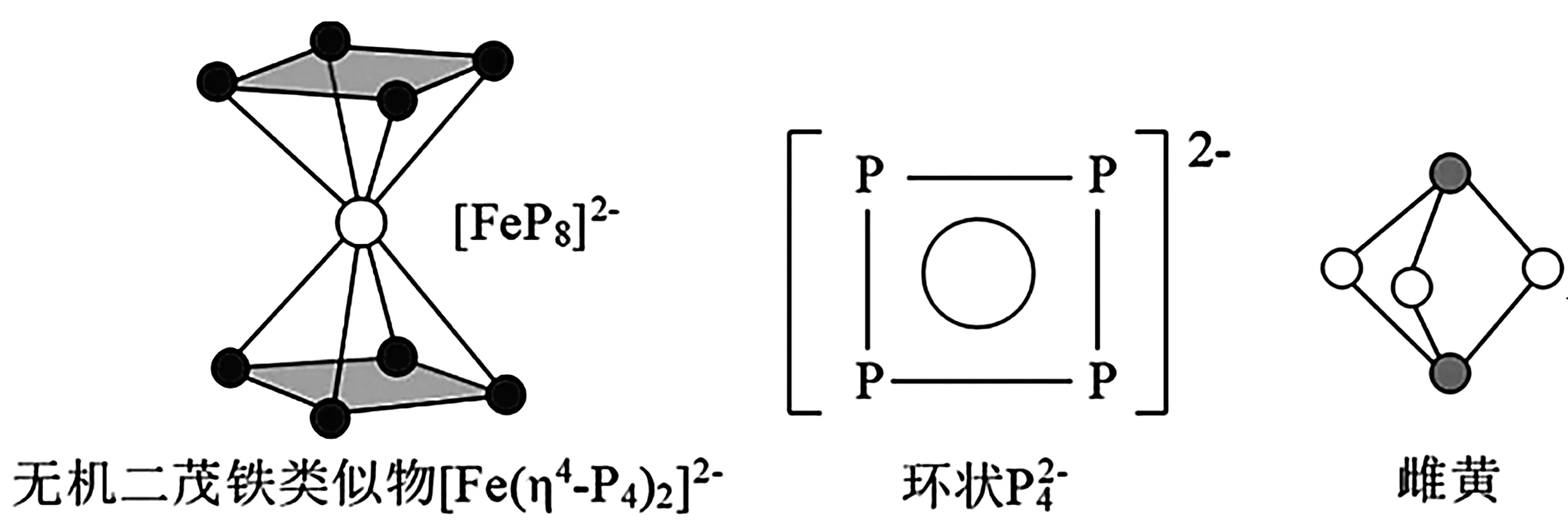
图9
(3)雌黄的分子式为As2S3,1 个As2S3分子中孤电子对数目为____。
(4)某科研团队制备出一种智能离子交换剂,由平行堆积的一维链阴离子(部分结构如图10)和K+阳离子组成,含有n个最简单元的阴离子可表示为 。
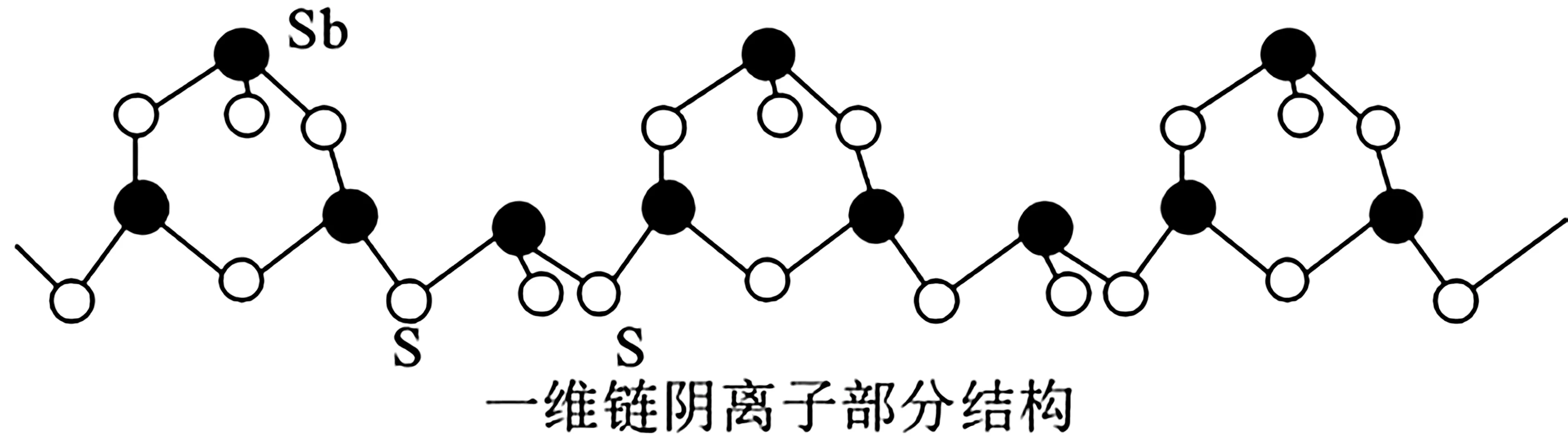
图10
(5)①基态铋原子的价电子排布式为____。
②铋的一种氧化物的立方晶胞结构如图11所示,已知最近的两个铋离子之间的距离为apm,阿伏加德罗常数为NA,则该晶体的密度为____g·cm-3(列出计算式即可)。
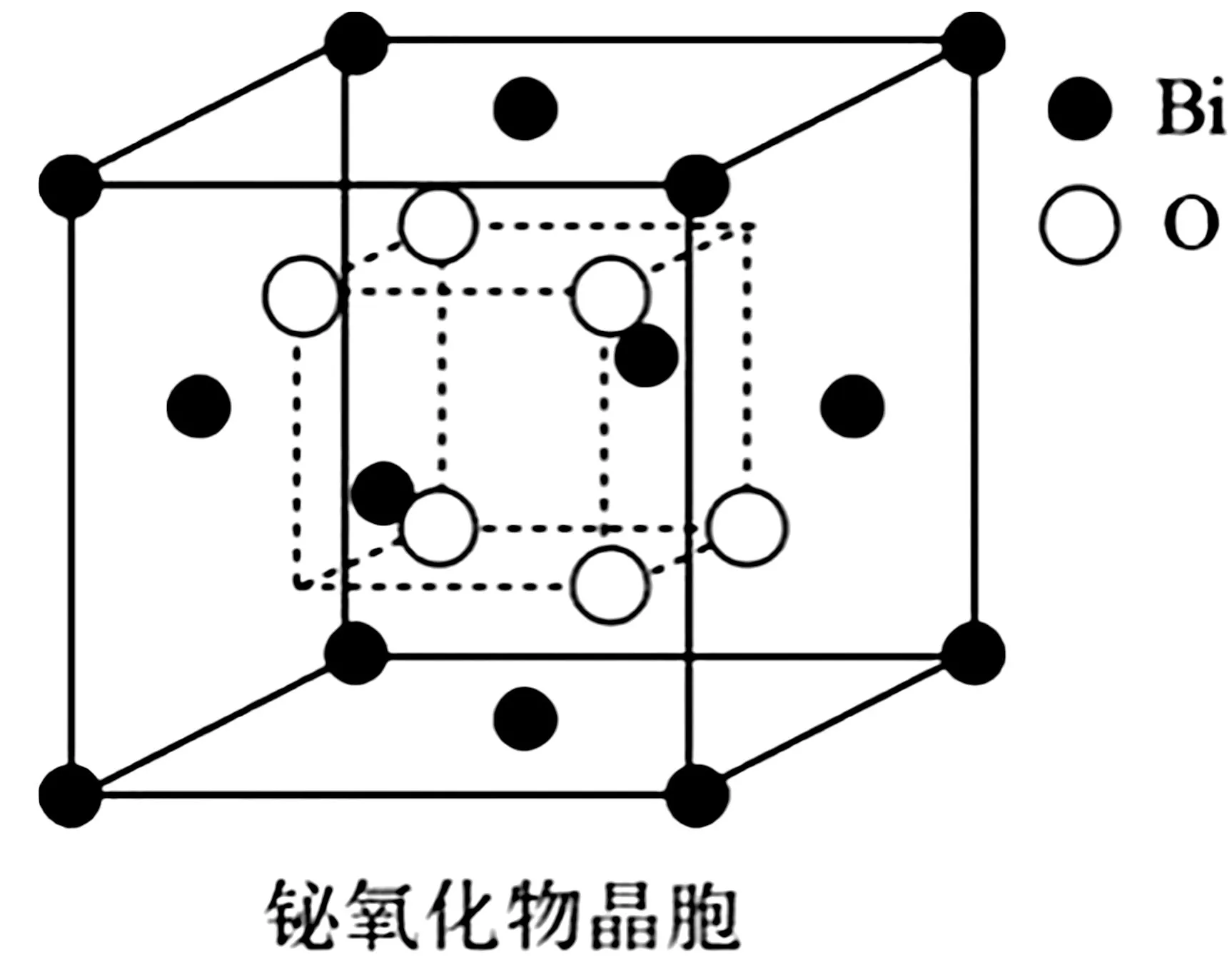
图11
12.【选修5:有机化学基础】(15分)
有机物W 在医药和新材料等领域有广泛应用。W 的一种合成路线如下。

_____已知部分信息如下:
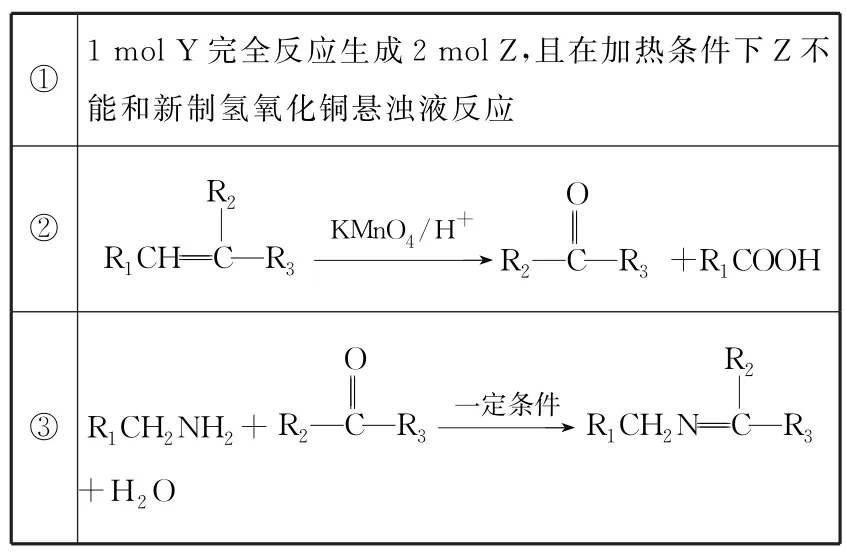
Z,且在加热条件下Z不_____能和新制氢氧化铜悬浊液反应Y 完全反应生成2mol①1mol R2② R1CH C=O__=__R3 KMnO4/H+→R2 C R3+R1COOH O=__R2③ R1CH2NH2+R2 C R3一定条件→R1CH2N C=R3+H2O
请回答下列问题:
(1)Y 的化学名称是____;Z 中官能团的名称是____。
(2)图示中X转化为Y的反应类型是_____。
(3)生成W 的化学方程式为____。
(4)G 是对硝基乙苯的同分异构体,G 能和碳酸钠反应产生气体且分子中含有—NH2(氨基),G 的同分异构体有_____种(不考虑立体结构),其中在核磁共振氢谱上峰的面积比为1∶2∶2∶2∶2的结构简式为____。
(5)设计以苯乙烯和丙酮为原料制备药物中间体的合成路线:___(无机试剂自选)。
