急性缺血性卒中血管内治疗中国指南2023
2023-07-03中国卒中学会中国卒中学会神经介入分会中华预防医学会卒中预防与控制专业委员会介入学组
中国卒中学会,中国卒中学会神经介入分会,中华预防医学会卒中预防与控制专业委员会介入学组
卒中是致残和致死的主要疾病之一,急性缺血性卒中约占全部卒中的80%。急性缺血性卒中治疗的关键在于尽早开通阻塞血管,挽救缺血半暗带。目前被证实有效的急性缺血性卒中早期血管再通的治疗方法主要是静脉rt-PA溶栓[1-3]。对静脉溶栓随机对照试验(random control trial,RCT)的荟萃分析证实发病4.5 h内静脉rt-PA溶栓有明确获益,而且溶栓时间越早,获益越大[4]。由于静脉溶栓具有严格的时间窗限制,能够通过其获益的患者不到缺血性卒中患者的3%,同时其治疗效果依然有巨大的优化空间:与对照组相比,静脉溶栓后3~6个月死亡率未明显降低,高达17.9%,且2/3的患者依然遗留有不同程度的残疾,尤其对合并大血管闭塞或病情较重的患者治疗效果不佳,其静脉溶栓的血管再通率低(13%~18%)[5]。因此,国内外学者一直在探索对大血管闭塞急性缺血性卒中患者的血管内治疗方法。
2013年初发表的3项多中心、前瞻性RCT均未能证明血管内治疗相比静脉溶栓的优越性[6-8]。随着技术、材料以及筛选策略的更新,自2014年底开始,一系列相关研究相继得出了较为一致的研究结果:在经过筛选的前循环大血管闭塞性急性缺血性卒中患者中,以机械取栓为主的血管内治疗可带来明确获益[9-14]。基于主要针对可回收支架治疗缺血性卒中的6项机械取栓RCT的结果,2015年国内外相关指南对特定人群急诊血管内治疗给予了最高级别的推荐。
2015年至今,急性缺血性卒中血管内治疗在多方面取得了研究进展。DWI或CTP联合临床不匹配对醒后卒中和晚就诊卒中患者使用Trevo装置行神经介入治疗(DWI or CTP assessment with clinical mismatch in the triage of wake up and late presenting strokes undergoing neurointervention with trevo,DAWN)研究和影像评估筛选缺血卒中患者血管内治疗(endovascular therapy following imaging evaluation for ischemic stroke,DEFUSE)3研究的发表将急诊血管内治疗时间窗由原来的6 h扩展到24 h[15-16]。结合多项最新研究结果,美国心脏学会(American Heart Association,AHA)/美国卒中学会(American Stroke Association,ASA)在2018年急性缺血性卒中早期治疗指南中对急诊血管内治疗的推荐进行了大幅度修改,欧洲卒中组织(European Stroke Organization,ESO)也更新了其相关指南推荐[17]。
近年来,中国血管内治疗的数量逐年大幅增长,新的研究也在不断拓展血管内治疗的适宜人群,基于这些最新研究证据,中国卒中学会组织国内本领域专家通过查阅文献、反复征求建议并讨论,在《急性缺血性卒中血管内治疗中国指南2018》的基础上,根据新发现和新证据进行了推荐和建议的更新,制定了《急性缺血性卒中血管内治疗中国指南2023》,旨在总结目前有关急性缺血性卒中血管内治疗的最新研究进展,提出适合我国急性缺血性卒中血管内治疗临床可参考的标准及管理方法。建议临床医师在参照本指南推荐的基础上,结合实际情况对急性缺血性卒中患者采取有针对性的个体化治疗。
本指南采用的推荐分类及证据水平参照中国卒中学会的指南推荐意见分类和证据等级级别(表1)。

表1 推荐分类和证据级别
1 急性缺血性卒中血管内治疗的循证医学证据
1.1 动脉溶栓治疗
急性缺血性卒中动脉溶栓的证据主要来自两项RCT:动脉内应用重组尿激酶原治疗急性脑血栓栓塞Ⅱ(prolyse in acute cerebral thromboembolism Ⅱ,PROACT Ⅱ)研究和大脑中动脉栓塞局部纤溶试验(middle cerebral artery embolism local fibrinolytic intervention trial,MELT)。PROACT Ⅱ研究是一项多中心前瞻性RCT,共纳入180例发病6 h内的大脑中动脉M1段或M2段闭塞患者,比较重组尿激酶原联合肝素动脉溶栓(试验组)与单纯肝素动脉溶栓(对照组)的安全性及有效性[18]。意向治疗分析结果显示,试验组3个月神经功能预后良好(mRS评分≤2分)的比例高于对照组(40%vs.25%,P=0.04);试验组66%的患者实现了大脑中动脉再通,而对照组中这个比例仅为18%(P<0.001);试验组症状性颅内出血(symptomatic intracerebral hemorrhage,sICH)的发生率为10%,对照组为2%(P=0.06);两组死亡率相似。MELT比较了卒中发病6 h内药物治疗与动脉使用尿激酶治疗的效果,主要终点为3个月神经功能预后良好(mRS评分≤2分),研究结果显示,治疗组达到3个月神经功能预后良好的比例较对照组高(49.1%vs.36.8%,P=0.35),总体治疗效果及sICH发生率与PROACT Ⅱ研究的结果一致[19]。前期探索性试验在小样本研究中评估了静脉使用小剂量rt-PA联合动脉溶栓的疗效。卒中急诊管理(emergency management of stroke,EMS)研究、卒中介入治疗研究(interventional management study,IMS)Ⅰ和Ⅱ的结果显示,静脉rt-PA联合动脉溶栓治疗组的神经功能预后显著优于对照组[20-22]。EMS研究旨在验证发病3 h内静脉溶栓联合动脉局部rt-PA溶栓的可行性、有效性及安全性,结果显示,尽管静脉联合动脉溶栓不能改善患者的临床预后,但其具有可行性且更容易达到血管再通。IMS I探讨了静脉联合动脉溶栓的可行性和安全性,结果显示,联合溶栓组的3个月死亡率较对照组低,但该差异未达到统计学意义,另外,联合溶栓组的sICH发生率与对照组相似[20]。IMS Ⅱ比较了低剂量静脉rt-PA(0.6 mg/kg)溶栓和动脉rt-PA(22 mg)溶栓的有效性和安全性,并与美国国立神经疾病和卒中研究院(National Institute of Neurological Disorders and Stroke,NINDS)研究中的rt-PA组比较,结果显示,IMS Ⅱ中3个月时达到mRS评分0~2分的患者比例更高(46%vs.39%),sICH的发生率也更高,但死亡率较低[21]。IMS Ⅱ中血管完全再通(TIMI 3级)率仅为4%,部分再通(TIMI 2或3级)率为60%。
上述研究均是针对前循环急性缺血性卒中患者的临床探索,Lindsberg等[23]报道了静脉或动脉溶栓治疗420例基底动脉闭塞患者的效果,显示动脉溶栓血管再通率更高(65%vs.53%,P=0.05),但死亡率和致残率与静脉溶栓差异无统计学意义。基底动脉国际合作研究(basilar artery international cooperation study,BASICS)是一项前瞻性登记研究,分析了619例急性发病的基底动脉闭塞患者的临床治疗效果,其中592例患者资料被最终纳入分析,分别采用了抗栓治疗(183例)、静脉溶栓治疗(121例)或动脉溶栓治疗(288例),数据分析显示,上述3种治疗方案的效果无显著差异[24]。
在多项血管内治疗研究中,经动脉溶栓治疗的获益有限,常作为挽救性治疗,而不是主要治疗。荷兰急性缺血性卒中血管内治疗多中心随机临床试验(multicenter randomized clinical trials of endovascular treatment of acute ischemic stroke in the netherlands,MR CLEAN)的干预组中有24例患者(12.3%)使用机械取栓联合动脉溶栓治疗,仅有1例患者(0.4%)单纯采用动脉溶栓治疗[25]。MR CLEAN动脉溶栓方案为静脉溶栓后动脉溶栓用量rt-PA不超过30 mg或尿激酶不超过40万IU,单纯动脉溶栓尿激酶最大剂量为120万IU[26]。来自法国的急性缺血性卒中动脉取栓试验及费效评估(trial and cost effectiveness evaluation of intra-arterial thrombectomy in acute ischemic stroke,THRACE)中干预组将动脉内注射rt-PA(最大量为0.3 mg/kg)作为机械取栓后仍有远端血管持续闭塞患者的补充治疗措施之一,但必须是在尝试机械取栓效果不佳时采用。该试验的141例患者中有15例(11%)在机械取栓后进行了动脉内溶栓治疗,平均rt-PA用量为8.8 mg。研究结果显示,与单纯机械取栓相比,联合动脉内溶栓对临床预后没有影响[14]。
1.2 机械取栓治疗
机械取栓因为具有以下诸多理论上的优点,因而受到广泛关注:快速血管再通,更低的出血转化率以及较长的治疗时间窗[27]。美国食品及药品管理局(Food and Drug Administration,FDA)分别在2004年和2008年批准了Merci™Retrieval和Penumbra Aspiration Systems™作为第一代机械取栓装置。
2013年,3项评估血管内机械取栓治疗急性缺血性卒中的试验——IMS Ⅲ、机械血栓切除术治疗卒中栓子的机械取栓血管再通(mechanical retrieval and recanalization of stroke clots using embolectomy,MR RESCUE)研究以及动脉溶栓对比系统溶栓治疗急性缺血性卒中(intra-arterial versus systemic thrombolysis for acute ischemic stroke,SYNTHESIS EXPANSION)研究均报道了阴性结果。这3项研究的结果均发表在NEJM上,受到广泛关注[6-8]。这3项研究均未能证明血管内治疗的优越性,分析可能为以下原因:从发病到治疗的时间较长,采用的影像学方法未能筛选出可能从血管内治疗获益的人群,血管再通率较预期低等。
FDA于2012年批准了Solitaire™和Trevo™支架取栓装置用于缺血性卒中的治疗。支架取栓装置的发明是卒中血管内治疗领域的一项巨大进步,取栓支架具有导航性和快速血管再通的优势,并且发生远期并发症的风险更低。支架取栓装置使用临时支架捕获血栓,通过与外周血管壁的挤压移动血栓来恢复血流。撤出支架时,血栓被捕获到支架间隙内与支架一同被移除。Solitaire™(Covidien)和Trevo™(Stryker)支架取栓装置是最早被FDA批准用于治疗大血管闭塞性卒中的两种支架取栓装置。
早期开展的RCT比较了支架取栓装置和Merci™设备的差异。Solitaire™ FR治疗急性缺血性卒中(Solitaire™ FR with the intention for thrombectomy,SWIFT)研究比较了Solitaire™和MERCI™装置的效果,在入组113例患者后因有效性存在显著差异而提前终止[28]。该研究中的血管再通定义为TIMI 2或3级,结果显示,Solitaire组血管再通率更高(OR4.9,95%CI2.1~11.1)。同样,Solitaire组3个月时mRS评分≤2分的患者比例更高(OR2.8,95%CI1.2~6.2)。Trevo对比Merci装置治疗大血管闭塞所致急性缺血性卒中(Trevo versus Merci retrievers for thrombectomy revascularisation of large vessel occlusions in acute ischaemic stroke,TREVO)2研究在178例大血管闭塞患者中比较了Trevo™ Retriever™和Merci™装置的取栓效果。该研究使用TICI分级评价血流再灌注情况,Trevo组中TICI分级≥2级的患者比例更高(OR4.2,95%CI1.9~9.7),3个月时达到mRS评分≤2分的患者比例更多(40.0%vs.21.8%),但Trevo组有更高的死亡率倾向[29]。
在证实了新一代支架取栓装置的有效性和安全性后,多项以新一代支架取栓装置为主要设备的RCT证实了对大血管闭塞患者进行取栓治疗相比标准内科治疗的优势。
MR CLEAN是第1个证明血管内治疗相比标准内科治疗大血管闭塞患者有显著获益的研究[9]。该研究纳入了500例发病6 h内、经CTA证实的前循环大血管闭塞且NIHSS评分≥2分的患者,随机分为血管内治疗组和标准内科治疗组,血管内治疗组患者有97%使用支架取栓装置(但无一放置支架),主要终点为90 d mRS评分。研究结果显示,血管内治疗组的24 h血管再通率较高(80%vs.32%,OR6.9,95%CI4.3~10.9),1周时中位脑梗死体积较小(49 mLvs.80 mL),并且3个月的良好预后(mRS评分0~2分)率更高(33%vs.19%)。这项研究的阳性结果非常显著,血管内治疗显著提高了前循环大血管闭塞患者的血管再通率、血流再灌注程度以及神经功能预后良好的比例。MR CLEAN的2年随访结果显示,与90 d随访结果一致,血管内治疗患者的长期神经功能仍存在显著的获益[30]。
另一项血管内治疗的前瞻性RCT强调了从CT到血管再通的时间最短化,这项来自加拿大的血管内治疗小梗死灶和前循环近端闭塞并强调CT至再通时间最短化(endovascular treatment for small core and anterior circulation proximal occlusion with emphasis on minimizing CT to recanalization times,ESCAPE)研究同样证实了血管内治疗的显著效果[10]。因中期分析显示血管内治疗具有显著获益,该研究在纳入了316例大动脉闭塞性急性缺血性卒中患者后提前终止。入组患者随机接受标准内科治疗或标准内科治疗联合血管内治疗,主要终点为90 d mRS评分,结果显示血管内治疗组在主要终点方面显著获益(OR2.6,95%CI1.7~3.8,P<0.001)。此外,血管内治疗组90 d神经功能预后良好(mRS评分0~2分)比例显著增加(53.0%vs.29.3%,P<0.001),死亡率显著降低(10.4%vs.19.0%,P=0.04)。另外,该研究的所有亚组分析均发现有相似的获益,包括老年及发病6 h后的患者亚组。
Solitaire™支架取栓治疗急性缺血性卒中(Solitaire™ with the intention for thrombectomy as primary endovascular treatment,SWIFT PRIME)研究在美国和欧洲的39家医院进行,比较静脉rt-PA溶栓与联合血管内治疗(均使用Solitaire™ FR支架)的有效性,结果显示,血管内治疗组90 d mRS评分变化显著改善(P<0.001),血管内治疗组90 d mRS评分0~2分的患者比例更高(60.2%vs.35.5%,P<0.001),需治疗人数(number needed to treat,NNT)为4,血管内治疗有降低死亡率的趋势,所有亚组患者均有相似的获益[12]。
来自澳大利亚的前瞻性RCT——急性神经功能缺损患者扩展时间窗溶栓后联合动脉治疗(extending the time for thrombolysis in emergency neurological deficits with intra-arterial therapy,EXTEND-IA)研究旨在证明相比单纯静脉溶栓,对发病4.5 h内、有血管闭塞和可挽救脑组织的前循环急性缺血性卒中患者静脉r t-PA溶栓后尽早行Solitaire™ FR机械取栓可提高缺血组织的早期再灌注率和改善患者的神经功能预后。研究结果显示,相比单纯静脉溶栓,机械取栓后24 h缺血脑组织早期再灌注率显著提高(100%vs.37%,P<0.001),早期(3 d)神经功能改善的患者比例更高(80%vs.37%,P=0.002),90 d mRS评分0~2分的患者比例更高(71%vs.40%,P<0.01,NNT=3),死亡率有降低的趋势[11]。
8 h内前循环卒中Solitaire™取栓与最佳药物治疗比较(endovascular revascularization with Solitaire device versus best medical therapy in anterior circulation stroke within 8 hours,REVASCAT)研究是西班牙的一项前瞻性RCT,共入组206例患者,主要终点为90 d mRS评分[31]。研究结果显示,相比最佳药物治疗组,血管内治疗组中90 d mRS评分0~2分的患者比例更高(43.7%vs.28.2%,校正后OR2.1,95%CI1.1~4.0);1年随访结果提示,血管内治疗组相比药物治疗组神经功能预后的改善仍然存在显著差异。
多项血管内治疗卒中试验高效再灌注评价试验(highly effective reperfusion evaluated in multiple endovascular stroke trials,HERMES)对以上5项阳性RCT(MR CLEAN、ESCAPE、REVASCAT、SWIFT PRIME和EXTEND-IA)进行了荟萃分析,各亚组分析结果进一步证实了机械取栓的临床价值[32]。
评价桥接治疗效果的RCT,如THRACE的目的是比较单纯静脉治疗和桥接治疗的临床预后,研究从法国26个中心入选414例大动脉闭塞所致中至重度卒中的患者。结果表明,静脉溶栓联合支架机械取栓患者的3个月良好预后(mRS评分0~2分)率显著高于单独单纯静脉溶栓治疗,但两种治疗措施的24 h和3个月sICH发生率差异无统计学意义[14]。
以上研究的结果为血管内治疗提供了高质量的证据,因此,2015年多国卒中急性期管理指南推荐对发病6 h内的急性前循环大血管闭塞性卒中患者进行血管内治疗。进一步的急诊血管内治疗研究的关注点在拓展时间窗患者的取栓效果上。
DAWN研究是一项多中心、前瞻性、随机化、开放标签研究,其终点使用盲法评价[33]。该研究在美国、加拿大、欧洲、澳大利亚的26家中心开展,由于在进行预设的中期分析时,取栓组较对照组显示出显著优势而提前终止,最终共有206例患者入组。与急性缺血性卒中取栓治疗领域既往的重要RCT相比,DAWN研究除使用Trevo™而非Solitaire™装置外,入组标准有两大不同:①患者从最后看起来正常至随机化时间为6~24 h;②筛选方案为临床神经功能缺损症状严重程度与梗死体积不匹配,即“临床-影像不匹配”(NIHSS评分与MRI DWI/CTP局部脑血流量显示的梗死体积不匹配),定义为:≥80岁,NIHSS评分≥10分,梗死体积<21 mL;<80岁,NIHSS评分≥10分,梗死体积<31 mL;<80岁,NIHSS评分≥20分,梗死体积<51 mL。最终研究结果显示,在有效性终点[90 d效用加权mRS评分和神经功能独立(mRS评分≤2分)]方面,取栓组显著优于对照组;安全性终点(24 h的sICH和90 d全因死亡)在两组间没有显著差异[15]。
DEFUSE 3研究是DEFUSE系列研究中针对血管内治疗的试验,是一项多中心、随机、开放标签、盲法评价终点的临床研究,旨在明确距最后正常时间6~16 h的大血管(颈内动脉/大脑中动脉M1段)闭塞患者能否从取栓治疗中获益[16]。患者入组标准包括:术前mRS评分≤2分,年龄18~90岁,脑梗死核心体积扩展至70 mL,发病到开始血管内治疗时间为6~16 h,缺血区/梗死区体积比≥1.8,缺血区与梗死区体积错配面积>15 mL。治疗方面可以应用FDA批准的任何取栓装置。研究结果显示,机械取栓联合药物治疗组的90 d mRS评分中位分值显著优于单纯药物治疗组,90 d良好预后(mRS评分0~2分)的患者比例也显著优于药物组,在24 h内90%以上再灌注率和24 h血管完全开通率方面,机械取栓联合药物治疗组显著优于单纯药物组。另外,两组sICH发生率差异无统计学意义,机械取栓联合药物治疗组的总体死亡率较取栓组稍低,但差异无统计学意义。DEFUSE 3的结果表明,对于发病6~16 h、缺血半暗带阳性的患者,机械取栓联合药物治疗相比单纯药物治疗有更好的90 d神经功能预后和更高的血管再通率,但两组24 h梗死体积无显著差异[16]。
发病超过6 h卒中取栓治疗的随机研究汇总分析(analysis of pooled data from randomized studies of thrombectomy more than 6 hours after last known well,AURORA)选取了3项取栓支架治疗的Ⅲ期临床研究[DAWN、DEFUSE 3和缺血性卒中患者适合血管内治疗的灌注影像选择(perfusion imaging selection of ischemic stroke patients for endovascular therapy,POSITIVE)研究]的全部数据,以及含有超时间窗患者的ESCAPE和REVASCAT研究中发病超过6 h的患者数据。初步分析显示,对于发病超过6 h的急性卒中患者,血管内治疗仍然非常有效[34]。
综上所述,应用血管内治疗急性缺血性卒中有明确的证据支持。采用新一代取栓装置的RCT中不同机械取栓装置的血管成功开通率均较高。精准的患者筛选方案及高效的血管内治疗技术是急性大血管闭塞患者从血管内治疗中获益的关键。
2 急性缺血性卒中血管内治疗的影像评估
进行急性缺血性卒中血管内治疗病例选择时,除时间窗外,通过影像评估选择适合的患者也是获得良好预后的关键。合适的影像评估方案可为急性缺血性卒中血管内治疗患者的术前筛选及术后评估提供指导。临床研究之所以取得阳性结果,除了选用新一代取栓装置外,还应用影像学技术对患者进行了严格筛选,排除出血性病变、识别血管闭塞部位以及通过直接或间接征象评估梗死核心灶、缺血半暗带及侧支循环情况,以此识别通过取栓治疗可能获得良好预后的患者[7]。
下面从影像学角度对大血管闭塞评估、梗死核心区域和缺血半暗带判定,以及侧支循环评价方面提出相应的建议,进而指导病例筛选。
2.1 大血管闭塞
快速精准地识别大血管病变患者,是顺利开展动脉取栓治疗的关键。对于院前急救而言,在没有影像学检查明确提示大血管闭塞的情况下,有必要通过临床表现初步判定患者是否可能存在大血管病变,并决定患者是否应直接转运到就近有取栓能力的综合卒中中心。对于急诊到院的患者,也有必要根据临床表现来识别卒中和大血管闭塞的可能性,在头颅CT排除颅内出血后,进一步的其他血管影像学评估可更好地指导治疗决策[35]。
一项系统性综述评价了诊断大血管闭塞预测工具的准确性[36]。在急诊室,神经科医师和急诊医师确定患者为缺血性卒中后,预测大血管闭塞最有效的工具是NIHSS评分。荟萃分析显示,NIHSS评分≥10分判断大血管闭塞可达到最佳敏感度(73%)和特异度(74%)平衡;提高敏感度时特异度会降低,NIHSS评分≥6分判断大血管闭塞的敏感度为87%,特异度为52%。使用大血管预测评分可能会漏诊部分大血管闭塞患者,较低的敏感度提示假阳性较为常见。
NCCT能够通过血管改变征象(大脑中动脉高密度征)、脑组织形态学改变(脑肿胀:脑回增粗、脑沟变浅)或密度改变(局部脑实质低密度区:岛带征阳性、壳核低密度、灰-白质交界区变模糊)提示超急性期脑梗死。如需精准判断是否存在大血管闭塞,需要进行血管影像学检查,当前多项RCT均采用无创血管影像来确定大血管闭塞。由于血管内治疗的患者可能存在血管迂曲或路径无法到达颅内血管的情况,因此通过无创影像检查了解血管解剖及颅外血管有无夹层、狭窄或闭塞,对血管内治疗方案的选择和明确患者是否适合进行血管内治疗有重要意义。对于使用对比剂的急诊无创影像检查,观察性研究提示,CTA检查导致的对比剂肾病非常少见,尤其是患者没有肾功能不全时,等待急诊肾功能检查结果可能导致取栓时间的延误,因此没有必要等待肾功能检查结果[37]。在客观条件无法实施无创血管影像评估时,建议通过NCCT排除颅内出血后,如根据患者症状考虑为大血管闭塞,可立即进行DSA检查评估血管闭塞和侧支循环代偿情况,选择适合的患者实施血管内治疗。2021年发表的ANGIO-CAT单中心RCT对发病6 h内急性大血管闭塞患者是否能跳过急诊NCCT+CTA±CTP直接将患者转运至导管室行平板CT排除脑出血后直接行血管内治疗进行了探索,研究结果提示,对于发病6 h内的急性大血管闭塞患者,应直接跳过传统的成像方式直接转运至导管室,这种模式能明显改善患者的预后[38]。
2.2 梗死核心
梗死核心是缺血后发生不可逆性损伤的脑组织,DAWN和DEFUSE 3研究中使用的梗死核心定义为与正常脑组织相比,脑血流量下降至正常脑组织血流量30%以下的区域,在NCCT上显示为低密度区。梗死核心的大小与患者的临床预后密切相关,梗死核心越小,患者预后良好的可能性越大。有文献报道,与急性缺血性卒中患者良好预后相关的预测指标是梗死核心体积,而不是缺血半暗带。同时,评估梗死核心也可预测血管内治疗出现并发症的风险。因此,准确评价梗死核心有助于筛选出适合血管内治疗的卒中患者。
评估梗死核心大小的影像学指标主要为ASPECTS评分,其次是梗死核心体积。依据NCCT评估的ASPECTS评分的可靠性存在一定争议,且存在一定的时间依赖性,其对超早期缺血性病灶的检出率较低,而基于CTA、CTP及多模式MRI的ASPECTS评分对缺血组织的敏感性较高。目前发表的8项阳性结果临床试验中,除了MR CLEAN和THRACE研究外,其余6项研究均对梗死核心有明确纳入标准。SWIFT PRIME研究中部分患者使用MRI排除了梗死核心区≥50 mL的患者[12],EXTEND-IA研究应用CTP以<正常脑血流量的30%为临界值,排除梗死核心区>70 mL的患者,通过影像学排除大面积梗死患者是这两项试验取得阳性结果的重要原因之一[11]。计算ASPECTS评分可通过NCCT、CTP或MRI DWI,评估梗死核心体积可通过CTP、MRI DWI或PWI序列等。有研究显示,ASPECTS评分≥7分对应于梗死体积<70 mL,ASPECTS评分≤3分对应于梗死体积>100 mL。
对于发病超过6 h患者,DAWN和DEFUSE 3研究通过MRI DWI上的梗死区域或CTP上局部脑血流量降低30%以上来计算梗死体积,DAWN研究允许入组的最大梗死体积为51 mL,DEFUSE 3研究在符合错配比基础上,允许入组的最大梗死体积为70 mL,当无法进行灌注评估时,在明确大血管闭塞后,DWI序列上显示梗死核心体积<25 mL也可作为适合取栓的标准[15-16]。
有研究指出,经过适当筛选,对梗死核心较大但合并较大可挽救组织的患者进行血管内治疗能显著减少最终梗死体积,有改善患者预后的倾向[39]。也有研究发现,对DWI-ASPECTS评分较低(≤5分)的患者进行取栓治疗较单纯药物治疗预后更佳,但需要进一步的前瞻性RCT来证实这个结论[40-42]。
2.3 缺血半暗带
缺血半暗带是脑梗死核心病灶周围由于脑血流灌注不足而导致神经功能受损的脑组织,但其仍可维持正常的细胞电活动。急性大血管闭塞后脑组织的缺血区从外向内依次为①良性缺血区:可自行恢复功能的区域;②缺血半暗带区:除非积极有效的治疗,否则将进展为不可逆损伤的区域,是临床治疗及研究的焦点;③梗死核心区。梗死核心和缺血半暗带体积对临床预后有独立的预测作用,在伴有大的半暗带体积时,血管再通治疗具有特别重要的作用[43-44]。
临床研究中,低灌注体积定义为脑血流达峰时间(Tmax)>6 s的区域体积;梗死核心定义为与正常脑组织相比,脑血流量下降超过30%的区域;不匹配量为低灌注体积减去梗死核心体积;不匹配率为低灌注体积/梗死核心体积。EXTEND-IA、REVASCAT、SWIFT PRIME和DEFUSE 3等研究均采用缺血半暗带的概念筛选入组患者。DEFUSE 3研究要求缺血区/梗死区体积比≥1.8,缺血区与梗死区错配体积>15 mL,即可挽救的脑组织体积在15 mL以上。
因此,对于经筛选发病6 h以内、ASPECTS评分<6分、拟接受紧急再灌注治疗的患者,或发病超过6 h、拟接受紧急再灌注治疗的患者,建议完成CTP检查以明确梗死核心区和缺血半暗带体积。一站式CTA+CTP检查方案可缩短多模式CT的检查时间;对于无法完成CTP的卒中中心,可根据CTA源图像进行梗死核心和缺血半暗带的判断,也可通过MRI DWI+MRA+PWI方案进行术前评估(表2)。

表2 不同时间窗患者筛选的影像方案推荐
2.4 侧支循环
脑侧支循环是指当大脑的供血动脉严重狭窄或闭塞时,血流通过其他血管(侧支或新形成的血管吻合)到达缺血区,从而使缺血组织得到不同程度的灌注代偿。既往多项研究证明了侧支循环的重要性,MR CLEAN、IMS Ⅲ亚组分析显示,侧支循环良好与取栓预后密切相关[45-46]。ESCAPE研究采用多时相CTA的侧支循环评估系统作为入组患者的影像筛选方案,排除侧支循环较差的患者[10]。对拟行血管内治疗的急性缺血性卒中患者,推荐完成代偿相关血管的脑血管造影,评估基线侧支循环状态,可应用美国介入和治疗神经放射学学会/美国介入放射学学会(American Society of Interventional and Therapeutic Neuroradiology/Society of Interventional Radiology,ASITN/SIR)侧支分级系统,协助预测血管内治疗的风险和获益;也可在治疗前对患者进行多时相CTA检查评估侧支循环的代偿程度,以进行危险度分层。对于评估侧支循环的分级量表,目前尚无统一的评估体系,各种评估量表的预测价值、信度和效度仍需进一步验证。荷兰血管内治疗对比非血管内治疗在CTA上存在脑侧支循环且发病6~24 h的缺血卒中(endovascular treatment versus no endovascular treatment after 6–24 h in patients with ischaemic stroke and collateral flow on CT angiography,MR CLEAN-LATE)研究结果提示,单纯基于CTA上存在的侧支循环来筛选晚时间窗的急性前循环近端大血管闭塞患者安全且有效[47]。
血管内治疗影像评估——指南推荐意见
①实施血管内治疗前,推荐使用无创影像检查明确有无颅内大血管闭塞(Ⅰ类推荐,A级证据)。
②在有条件的中心,适合机械取栓的患者进行颅内血管影像检查的同时,可以考虑行颅外颈动脉、椎动脉的筛查,为制订血管内治疗计划提供信息(Ⅱa类推荐,B级证据)。
③发病6 h内的前循环大血管闭塞患者,推荐使用CTA或MRA检查明确有无大血管闭塞,可不进行灌注成像检查;发病6~24 h的前循环大血管闭塞患者,推荐进行CTP、MRI DWI或PWI检查,帮助筛选适合机械取栓的患者(Ⅰ类推荐,A级证据)。
④发病6~24 h的前循环大血管闭塞患者,在谨慎筛选后,可以考虑参考脑侧支循环情况决定是否进行机械取栓治疗(Ⅱa类推荐,B级证据)。
⑤在有条件的中心,对发病6 h内、考虑大血管急性闭塞患者,在谨慎评估风险获益比后,可考虑选择跨过急诊多模式影像检查,直接到导管室经平板CT扫描评估后进行机械取栓治疗(Ⅱb类推荐,B级证据)。
3 急性缺血性卒中血管内治疗的患者选择
3.1 血管内治疗的目标
机械取栓的目的是获得血流再灌注而不是仅实现血管再通,实现再灌注是改善预后的关键。临床常以mTICI 2b/3级作为评估有效再灌注的标准[48-49]。目前全部血管内治疗试验,无论支架取栓还是抽吸研究,均使用mTICI 2b/3级作为实现有效再灌注的评估标准[50]。使用球囊导管或中间导管也能够提高血管内治疗的血管再通比例[51-53]。提高血管内治疗后血流达到mTICI 3级的患者比例是否更有效及如何实现是未来研究的方向。
3.2 麻醉方案
在血管内治疗试验中,镇静麻醉被广泛使用(ESCAPE研究中为90.9%,SWIFT PRIME研究中为63%),其对患者预后没有明确的有益或不良影响。MR CLEAN的事后分析提示,全身麻醉组患者90 d良好预后(mRS评分0~2分)率显著低于镇静麻醉组患者[54]。THRACE研究中,67例全身麻醉患者中有51例达到TICI 2b/3级,69例镇静麻醉患者中有43例达到TICI 2b/3级,麻醉方案对预后没有影响(P=0.059);90 d时,全身麻醉组67例患者有35例达到mRS评分0~2分,镇静麻醉组74例患者有36例达到mRS评分0~2分[14]。尽管较多回顾性研究提示全身麻醉患者的临床预后更差,但目前相关的前瞻性RCT数据有限,且均未显示出哪种麻醉方案对临床主要终点有影响。中国一项多中心前瞻性研究——血管内治疗急性缺血性卒中试验(endovascular therapy for acute ischemic stroke trial,EAST)中的麻醉结果分析表明,前循环大血管闭塞患者取栓时全身麻醉与非全身麻醉对预后的影响无显著差异。3项小型单中心RCT比较了全身麻醉和镇静麻醉的治疗效果,均未发现两种麻醉方案孰优孰劣[55-57]。
通常临床实践中,对伴有严重躁动、意识水平降低(GCS评分<8分)、呼吸道保护反射丧失、呼吸障碍的患者使用全身麻醉,对能配合取栓的患者使用局部麻醉或镇静更为适合[21]。麻醉方法本身可能并不影响患者预后,而是麻醉管理策略(药物选择、使用方法,麻醉持续时间和深度,术中循环、呼吸管理)可能影响预后,任何麻醉药物的使用都需要专业人员去管理。根据患者及手术具体情况,个体化选择麻醉方案更为合理。
3.3 桥接治疗
桥接治疗是指在静脉溶栓基础上进行动脉内介入治疗,分为直接桥接治疗和挽救性桥接治疗。直接桥接治疗是指静脉溶栓后不观察等待溶栓效果,直接进行取栓治疗;挽救性桥接治疗是指静脉溶栓后观察患者神经功能变化,无效后再考虑取栓治疗。目前,对于静脉溶栓时间窗内的患者,静脉溶栓是首选的治疗方案,在早期关于取栓的5项获得阳性结果的RCT中,90%以上的患者在接受了静脉溶栓基础上进行机械取栓的桥接治疗方案。
HERMES表明,机械取栓组患者90 d致残率较低,致残率随着发病到开始动脉穿刺时间的延长而增加[32]。在通过血管内治疗获得再灌注的390例患者中,再灌注每延误1 h,均会造成致残率显著增加和良好预后率显著降低,但对死亡率无显著影响[57]。这些数据不能直接表明在取栓前患者接受静脉溶栓治疗后是否应该观察临床反应。然而,90 d的致残率与发病到开始穿刺的时间直接相关,任何导致取栓延误的操作,包括静脉溶栓后观察临床反应,都应该避免。
HERMES的亚组分析提示,桥接治疗(1090例)和直接取栓(188例)对患者预后影响无差异(P=0.43),但直接取栓患者多数是因为有静脉溶栓禁忌证[32]。SWIFT PRIME、Solitaire™装置取栓对急性血管闭塞再通(Solitaire FR thrombectomy for acute revascularisation,STAR)研究及其他一些非RCT也提示直接取栓和桥接治疗效果相似,机械取栓之前静脉溶栓较单独机械取栓并没有提高临床获益[59-61]。有研究提示,桥接治疗预后好,死亡率低,血管开通率高,取栓次数少,可缩短取栓时间且不增加sICH风险[62-65]。也有研究指出,桥接治疗与直接取栓相比,良好功能预后及sICH发生率无差异,但桥接组无症状性颅内出血发生率及死亡率更高;颈内动脉闭塞亚组中桥接治疗组死亡率更高[66]。目前已经完成了6项大型的多中心、前瞻性RCT,分别为中国三级医院直接动脉取栓恢复大血管闭塞性缺血性卒中患者血流(direct intra-arterial thrombectomy in order to revascularize acute ischemic stroke patients with large vessel occlusion efficiently in Chinese tertiary hospitals,DIR ECT-MT)研究、急性缺血性卒中直接血管内治疗与桥接治疗的比较(direct endovascular treatment versus bridging therapy for patients with acute ischemic stroke,DEVT)研究、颈内动脉或大脑中动脉M1段闭塞所致急性缺血性卒中伴或不伴静脉溶栓的血管内治疗随机研究(randomized study of endovascular therapy with versus without intravenous tissue plasminogen activator in acute stroke with ICA and M1 occlusion,SKIP)、颅内动脉近端闭塞所致卒中静脉溶栓后桥接血管内治疗与直接血管内治疗(intravenous treatment followed by intra-arterial treatment versus direct intra-arterial treatment for acute ischaemic stroke caused by a proximal intracranial occlusion,MR CLEAN NO-IV)研究、急性缺血性卒中桥接溶栓与直接机械取栓的比较(bridging thrombolysis versus direct mechanical thrombectomy in acute ischemic stroke,SWIFT DIRECT)研究和卒中发作后4.5 h内直接血管内取栓与标准溶栓桥接血管内治疗(direct endovascular clot retrieval versus standard bridging thrombolysis with endovascular clot retrieval within 4.5 hours of stroke onset,DIRECT SAFE)研究来比较直接取栓和标准桥接治疗发病4.5 h内急性缺血性卒中的优劣性[67-72]。其中DIRCT-MT和DEVT研究均发现直接取栓不劣于标准桥接治疗[67-68];而SKIP、MR CLEAN NO-IV、SWIFT DIRECT和DIRECT SAFE研究均未发现直接取栓不劣于或优于标准桥接治疗[69-72]。值得注意的是,DIRECT SAFE研究的亚组分析中发现,相较于直接取栓,桥接治疗更能使亚洲地区患者获益[72]。随后改善缺血性卒中再灌注策略联盟(Improving Reperfusion Strategies in Ischemic Stroke Collaborators,IRIS)在2023年的国际卒中大会上公布了对上述6项RCT荟萃分析的初步结果,同样也未发现在上述人群中,直接取栓治疗不劣于桥接治疗,目前IRIS荟萃分析的亚组分析正在进行,以寻找适合直接取栓或者桥接治疗的亚组人群。
对于桥接治疗的静脉溶栓首选药物,国内外学者也一直在进行探索。急性神经功能缺损患者扩展时间窗溶栓联合动脉治疗-替奈普酶(extending the time for thrombolysis in emergency neurological deficits-intraarterial using intravenous tenecteplase,EXTEND-IA TNK)研究纳入发病4.5 h内大血管闭塞的急性缺血性卒中患者,发现在桥接治疗前使用替奈普酶静脉溶栓,取栓前的良好再灌注率显著高于使用阿替普酶静脉溶栓(22%vs.10%,P=0.03),且替奈普酶溶栓组的90 d中位mRS评分更优,两组的sICH发生率差异无统计学意义。该研究提示,新型静脉溶栓药物替奈普酶提高了大血管闭塞取栓前血管开通的比例,可促进血流再灌注早期恢复,从而改善患者预后[73]。
3.4 时间窗
MR CLEAN中的阳性结果为时间依赖性,OR值从发病3.5 h的3.0(95%CI1.6~5.6)下降到6 h的1.5(95%CI1.1~2.2)[9]。当再灌注发生在6小时19分钟后,治疗效果不再有统计学意义。在IMS Ⅲ中,取栓治疗同样显示出时间依赖性,恢复再灌注时间的延长与良好功能预后比例下降相关[74]。基于IMS Ⅲ的结果及相关文献的汇总,建议的血管内治疗比单纯静脉溶栓优越的时间窗为347 min内(5小时47分钟)[75]。5项RCT的中位发病-穿刺时间均在6 h以内,提示早期治疗的必要性,证实发病到治疗时间窗在6 h内是合理的。HERMES的结果表明,发病到开始穿刺时间在7小时18分钟内,取栓治疗存在明显的获益[58]。DAWN和DEFUSE 3研究是证实发病6 h以上取栓获益的RCT,这两项研究将取栓获益的时间窗扩展到24 h[15-16]。临床选择患者时需要符合这两项研究的入组标准才能进行取栓。AURORA汇总分析的初步结果也为发病6~24 h患者取栓治疗获益提供了临床证据[34]。经过适合的影像筛选,淡化了时间窗,也将卒中治疗理念从“时间就是大脑(time is brain)”向“不匹配就是大脑(mismatch is brain)”转变,但在急救流程中仍应尽量减少时间延误,缩短发病到再通时间。MR CLEAN-LATE是一项多中心、开放标签、终点盲法评价、随机对照的Ⅲ期临床研究,旨在评估血管内治疗CTA上存在脑侧支循环的晚时间窗(6~24 h)急性前循环近端大血管闭塞患者的有效性和安全性。该研究的入组标准包括①年龄≥18岁;②CTA或MRA证实急性前循环近端大血管闭塞(颈内动脉颅内段、大脑中动脉M1段和大脑中动脉M2段);③发病或最后看起来正常到血管内治疗开始时间在6~24 h;④单时相CTA或多时相CTA动脉期评估患侧大脑半球的大脑中动脉供血区存在侧支循环(定义为对比健侧大脑半球大脑中动脉供血区,1级:0<侧支血管<50%,2级:50%≤侧支血管<100%,3级:侧支血管为100%);⑤基线NIHSS评分≥2分。排除标准为:①颅内出血;②基线mRS评分≥3分;③发病前6周内患有缺血性卒中并存在持续的神经功能缺损;④出血性疾病或有出血倾向;⑤低密度脑组织超过1/3大脑中动脉供血区;⑥参与除当前研究之外的其他内科或手术干预性研究(方案中列出的研究除外)。值得注意的是,该研究在纳入100例侧支循环1级的患者后,停止了对此类患者进行入组。研究最终入组502例患者,其中血管内治疗组255例,非血管内治疗组247例。血管内治疗组较非血管内治疗组的中位90 d mRS评分低[3(2~5)分vs.4(2~6)分],且90 d mRS评分趋于更好的临床预后(共同OR1.67,95%CI1.20~2.32),两组的90 d内全因死亡率差异无统计学意义(24%vs.30%,OR0.72,95%CI0.44~1.18),但血管内治疗组较非血管内治疗组的sICH发生率更高(7%vs.2%,OR4.59,95%CI1.49~14.10)[76]。MR CLEAN-LATE研究结果提示,血管内治疗CTA上存在侧支循环的晚时间窗急性前循环近端大血管闭塞患者是安全且有效的。距最后看起来正常超过24 h患者血管内取栓与内科治疗功能和安全预后对比(association of endovascular thrombectomyvs.medical management with functional and safety outcomes in patients treated beyond 24 hours of last known well,SELECT-LATE)研究对来自美国、西班牙、澳大利亚和新西兰17家卒中中心的301例发病超过24 h的颈内动脉颅内段、大脑中动脉M1段/M2段闭塞的患者进行回顾性分析,发现血管内治疗比最佳内科治疗能更明显地改善发病超过24 h的前循环大血管闭塞患者的预后,但sICH的风险也明显增高[47]。该研究为进一步开展针对上述患者血管内治疗的RCT提供了坚实的基础。值得注意的是,急性缺血性卒中患者超时间窗取栓治疗的前瞻性、多中心RCT——大动脉闭塞超时间窗机械取栓治疗试验(large artery occlusion treated in extended time with mechanical thrombectomy trial,LATEMT)(NCT05326932)正在进行中,期待其为血管内治疗发病超过24 h的急性缺血性卒中患者提供更高级别的循证医学证据。
3.5 中等血管闭塞
中等血管闭塞通常指发生在大脑中动脉M2段/M3段、大脑前动脉A2段/A3段、大脑后动脉P2段/P3段的闭塞。不过目前对中等血管闭塞的定义仍有争议,大脑中动脉M2段闭塞可能会影响功能区域导致严重的神经功能缺失,因此也有人认为功能性M2段闭塞也属于大血管闭塞。HERMES研究协作组对5大研究荟萃分析发现,对大脑中动脉M2段闭塞的患者进行取栓治疗效果有优于标准内科治疗的趋势,但校正后OR值未达到统计学意义(OR1.28,95%CI0.51~3.21)[32]。Solitaire支架血栓切除术的安全性和疗效随机试验中患者数据的荟萃分析(safety and efficacy of Solitaire stent thrombectomy–individual patient data meta-analysis of randomized trials,SEER)协作组对SWIFT PRIME、ESCAPE、EXTEND-IA和REVASCAT这4项应用Solitaire™支架取栓的RCT进行了荟萃分析,以评价Solitaire支架取栓的安全性和疗效,结果显示,对大脑中动脉M2段闭塞患者进行机械取栓治疗与标准内科治疗相比,有改善临床疗效的趋势,但差异未达到统计学意义[77]。SWIFT、STAR、DEFUSE 2研究和IMS Ⅲ的结果提示,对于大脑中动脉M2段闭塞的患者,实现再灌注与良好预后密切相关(mRS评分0~1分,OR2.2,95%CI1.0~4.7)[78]。因此,对于大脑中动脉M2段/M3段闭塞行取栓治疗有潜在的获益,但应综合权衡血管功能、临床症状、取栓操作难度,尽可能减少并发症风险。
针对大脑后动脉闭塞患者,大脑后动脉闭塞缺血性卒中取栓治疗(thrombectomy for primary distal posterior cerebral artery occlusion stroke,TOPMOST)研究探讨了不同取栓技术的有效性及安全性,发现两种技术的成功再通率及良好预后率都较高,sICH及死亡率相对较低,两种技术的安全性和有效性没有显著差异[79]。发表在Stroke上的大脑后动脉闭塞血管内治疗与药物治疗(endovascular versus medical management of posterior cerebral artery occlusion stroke,PLATO)研究发现,对于大脑后动脉闭塞的患者,尽管血管内治疗组有更高的sICH和死亡率,但血管内治疗组获得良好结果的可能性更高[80]。目前,血管内治疗联合最佳药物治疗对比单独最佳药物治疗中度血管闭塞性卒中[endovascular therapy plus best medical treatment(BMT)versus BMT alone for medium vessel occlusion stroke,DISTAL]、血管内治疗改善中等血管闭塞预后(endovascular treatment to improve outcomes for medium vessel occlusions,ESCAPE-MeVO)研究等针对中等血管闭塞的血管内治疗研究正在进行中,期待未来这些研究为中等血管闭塞卒中的诊疗提供更多的临床证据。
3.6 基底动脉闭塞
对基底动脉闭塞患者进行血管内治疗与单纯静脉溶栓相比的获益性,目前尚缺少RCT证据证实[81]。一项荟萃分析收集了45项针对急性基底动脉闭塞再灌注(包括静脉溶栓、动脉溶栓或血管内治疗)的研究,共纳入了2056例患者,结果提示,血管内治疗减少死亡或依赖以及单纯减少死亡的NNT分别为3和2.5[82]。多项单中心小样本的回顾性研究显示,基底动脉取栓治疗的良好预后率为27.8%~50%[83-89]。瑞典Karolinska医院的经验表明,血管内治疗基底动脉闭塞的良好预后率为57%(95%CI37%~75%),治疗前没有急性梗死征象时良好预后率为73%(95%CI50%~89%),死亡率为21%[90]。使用新一代取栓设备后,血管再通率超过75%,这与使用老一代设备的缺血性卒中机械取栓治疗(mechanical embolus removal in cerebral ischemia,MERCI)和多重MERCI(multi-MERCI)研究报道的血管再通率一致,但获益率更高[84,90-95]。
BASICS研究结果未显示出血管内治疗较静脉溶栓优越,可能与其使用老一代取栓装置有关[24]。急性缺血性卒中机械开通的国际多中心登记(international multicenter registry for mechanical recanalization procedures in acute stroke,ENDOSTROKE)研究评估基底动脉闭塞后血管内治疗对临床预后的影响,结果显示血管内治疗组90 d mRS评分0~2分的患者比例达34%,mRS评分0~3分的患者比例达42%[96]。
目前已完成4项大型多中心、前瞻性RCT,分别为基底动脉闭塞取栓与标准内科治疗对比(acute basilar artery occlusion:endovascular interventions vs standard medical treatment,BEST)研究、BASICS、急性基底动脉闭塞血管内治疗临床(endovascular treatment for acute basilarartery occlusion,ATTENTION)研究和中国基底动脉闭塞血管内治疗试验(basilar artery occlusion Chinese endovascular trial,BAOCHE),但研究结果却不相同[97-100]。其中,BEST研究(42%vs.32%)和BASICS(44.2%vs.37.7%)均未发现血管内治疗发病8 h或6 h内的急性基底动脉闭塞患者90 d mRS评分0~3分的比例高于最佳内科治疗。但需值得关注的是,BEST研究符合方案集和实际治疗集中血管内治疗组中90 d mRS评分比例明显高于最佳内科治疗[97-98]。ATTENTION研究(46%vs.23%)和BAOCHE(46%vs.24%)则分别发现在发病12 h内和6~24 h的急性基底动脉闭塞患者中,血管内治疗后90 d mRS评分0~3分的比例明显高于最佳内科治疗[99-100]。
3.7 颈动脉狭窄串联病变
HERMES荟萃分析纳入1254例患者(122例串联病变和1134例非串联病变患者),对串联病变患者进行取栓治疗的效果同样显著优于单纯药物治疗[32]。MR CLEAN中取栓组有30例(12.9%)颈动脉狭窄串联病变患者在急性期进行了支架置入,DAWN研究纳入的患者仅允许使用颈动脉球囊扩张辅助取栓装置通过,不包括颈动脉支架置入,DEFUSE 3研究中允许颈动脉支架置入[9,15-16]。THRACE研究的196例患者中有24例串联病变闭塞和172例非串联病变闭塞,进行取栓治疗相比单纯rt-PA治疗均有获益[14]。目前,对颈动脉串联病变急性期是否放置支架仍有争议,主要权衡的是支架置入后出血和再闭塞风险[101]。有多项研究报道了对串联病变进行血管内治疗的技术成功性,但对串联病变进行血管内治疗的最佳策略仍有待探讨[102-106]。另外,对狭窄较重、需进行支架置入维持血流的患者,干预操作的顺序也有差异,先支架置入还是先行取栓尚无统一认识。临床中具体操作方式和抗栓策略应结合具体病变、手术材料及操作经验进行个体化选择。
3.8 颅内动脉闭塞合并原位狭窄
颅内大血管闭塞所致缺血性卒中患者中合并基础狭窄的比例为17%~60%,其中最高比例来自中国的一项研究结果,这也印证了颅内动脉粥样硬化性狭窄(intracranial atherosclerotic stenosis,ICAS)在亚裔人群中更为常见[107-109]。合并ICAS患者的手术方式选择尚不明确,由于单纯支架取栓困难大、开通率低,临床常会选择血管成形术或支架置入术作为补救措施。EAST中合并ICAS的比例为34%,有21.4%的取栓患者需要进行补救性球囊扩张或支架成形治疗,当取栓后原位狭窄>70%或狭窄影响远端血流或导致反复再闭塞时,通过补救性球囊扩张或支架成形术治疗能够获得较为满意的预后[110]。既往一项登记研究在取栓后高度怀疑ICAS病因及取栓后反复闭塞的患者中探讨补救性支架置入的有效性和安全性,结果显示补救性支架置入可使64.6%取栓开通失败的患者重新获得再通,并显著改善患者预后[111]。
3.9 前循环大梗死核心患者的血管内治疗
前循环大梗死核心是指基线梗死核心体积>70 mL或ASPECTS评分<6分。大梗死核心一直以来都是急诊血管内治疗的禁忌证,但在临床实践中,发现该类患者经血管内治疗后仍有获得90 d良好预后的可能。目前已经完成了3项对比血管内治疗与最佳内科治疗前循环大梗死核心患者疗效的大型多中心RCT,结果均发表在NEJM上[112-114]。日本超急性大梗死核心脑梗死血管内治疗试验(the recovery by endovascular salvage for cerebral ultraacute embolism–Japan large ischemic core trial,RESCUE-Japan LIMIT)纳入了发病24 h内(6~24 h需符合MRI FLAIR序列无信号改变)基于MRI(175例)或CT(28例)判读ASPECTS评分3~5分的急性颈内动脉颅内段、大脑中动脉M1段/M2段闭塞的患者。最终发现血管内治疗组的90 d mRS评分0~3分的比例显著高于最佳内科治疗组(31.0%vs.12.7%)[112]。大梗死核心急性前循环大血管闭塞患者的血管内治疗(study of endovascular therapy in acute anterior circulation large vessel occlusive patients with a large infarct core,ANGELASPECT)纳入了发病24 h内的基于CT判读的ASPECTS评分3~5分或ASPECTS评分0~2分合并梗死核心体积70~100 mL或发病6~24 h的ASPECTS评分>5分合并梗死核心体积70~100 mL的颈内动脉颅内段、大脑中动脉M1段/M2段闭塞的患者,研究结果发现,血管内治疗组的90 d mRS评分显著优于最佳内科治疗组(广义OR1.37,95%CI1.11~1.69)[113]。SELECT 2研究纳入发病24 h内基于CT判读的ASPECTS评分3~5分或梗死核心体积>50 mL的急性颈内动脉颅内段、大脑中动脉M1段或M2段闭塞的患者,最终发现血管内治疗组的90 d mRS评分显著优于最佳内科治疗组(广义OR1.51,95%CI1.20~1.89)[114]。上述研究提示了对大梗死核心患者取栓治疗的获益性。还有其他针对大梗死核心血管内治疗的RCT正在进行,结果即将陆续发布,对这些针对不同治疗方案、不同人群的研究进行荟萃分析将对大梗死核心患者的血管内治疗提供最高的循证依据。
血管内治疗患者选择——指南推荐意见
①发病24 h内的急性前、后循环大血管闭塞患者,经过临床及影像筛选后,当符合现有循证依据时,均推荐血管内取栓治疗(Ⅰ类推荐,A级证据)。
②发病6 h内的前循环大血管闭塞患者,符合以下标准时,建议血管内取栓治疗:卒中前mRS评分0~1分;缺血性卒中由颈内动脉或大脑中动脉M1段闭塞引起;NIHSS评分≥6分;ASPECTS评分≥6分(Ⅰ类推荐,A级证据)。
③有急诊血管内治疗指征的患者应尽快实施治疗,当符合静脉阿替普酶溶栓标准时,建议接受静脉溶栓治疗,但不应等待静脉溶栓效果,应同时桥接血管内治疗(Ⅰ类推荐,A级证据)。
④发病6 h内适合血管内治疗的前循环大血管闭塞患者,在无静脉溶栓禁忌时,可以考虑选择替奈普酶静脉溶栓(静脉团注0.25 mg/kg,最高25 mg),而非阿替普酶,但仍需进一步的随机试验证据证实(Ⅱb类推荐,B级证据)。
⑤距患者最后看起来正常时间在6~16 h的前循环大血管闭塞患者,当符合DAWN或DEFUSE 3研究入组标准时,推荐血管内治疗(Ⅰ类推荐,A级证据)。
⑥距患者最后看起来正常时间在16~24 h的前循环大血管闭塞患者,当符合DAWN研究入组标准时,推荐血管内治疗(Ⅱa类推荐,B级证据)。
⑦发病0~12 h内的急性基底动脉闭塞患者,当符合ATTENTION或BAOCHE研究入组标准时,推荐血管内治疗(Ⅰ类推荐,A级证据)。
⑧发病12~24 h内的急性基底动脉闭塞患者,当符合BAOCHE入组标准时,推荐血管内治疗(Ⅱa类推荐,B级证据)。
⑨对于发病24 h内,伴有大梗死核心的急性前循环大血管闭塞患者,当符合ANGELASPECT,RESCUE-Japan LIMIT或SELECT 2研究的入组标准时,推荐血管内治疗(Ⅰ类推荐,A级证据)。
⑩在急诊血管内治疗过程中,经筛选的串联病变(颅外和颅内血管同时急性闭塞)患者,可以考虑进行血管内治疗(Ⅱa类推荐,B级证据)。
⑪急性中等血管闭塞患者,急诊血管内治疗的获益尚不明确,经过筛选及评估风险获益比后,可慎重的选择急诊血管内治疗,但仍需进一步的随机试验证据证实(Ⅱb类推荐,B级证据)。
⑫卒中前mRS评分>1分,ASPECTS评分<3分或NIHSS评分<6分的颈内动脉或大脑中动脉M1段闭塞的患者,在谨慎评估风险获益比后,可以考虑在发病6 h内(至股动脉穿刺时间)进行血管内治疗,需要进一步随机试验证据证实(Ⅱb类推荐,B级证据)。
⑬急性缺血性卒中患者考虑血管内治疗时,推荐根据患者危险因素、操作技术特点和其他临床特征个体化选择麻醉方案,尽可能避免血管内治疗延误(Ⅱa类推荐,B级证据)。
⑭发病24 h以上的大血管闭塞患者,血管内治疗的获益性尚不明确,应结合中心实际情况,在谨慎筛选的情况下,考虑是否进行急诊血管内治疗(Ⅱb类推荐,B级证据)。
4 急性缺血性卒中血管内治疗术中操作及围手术期管理
目前发表的8项重要阳性结果RCT(MR CLEAN、ESCAPE、EXTEND-IA、SWIFT PRIME、REVASCAT、THRACE、DAWN、DEFUSE 3)均经过严格的入组和排除标准筛选患者,但总体能达到90 d mRS评分0~2分的患者比例仅为47.5%,且死亡率为14.9%[9-16]。因此,血管内治疗在符合严格筛选标准的情况下,其有效性仍不容乐观,但与单纯静脉溶栓相比,血管内治疗对大血管闭塞的治疗效果明显,在经过严格影像筛选的人群中能提高20%以上的良好预后率。为了提高血管内治疗急性大动脉闭塞患者的良好预后率,国内外学者对血管内治疗术前、术中用药和术后血压管理进行了探索研究,其中荷兰急性缺血性卒中血管内治疗围手术期药物治疗的多中心随机临床试验:肝素、抗血小板药物,两者都用或不用(multicenter randomized clinical trial of endovascular treatment for acute ischemic stroke in the Netherlands: the effect of periprocedural medication:heparin,antiplatelet agents,both or neither,MR CLEAN-MED)的结果率先在Lancet上发表。该试验旨在评估对发病6 h内的大动脉闭塞患者动脉穿刺开始时静脉给予阿司匹林和普通肝素能否改善预后,但研究结果最终显示,无论是静脉阿司匹林治疗(90 d mRS评分 3分vs.2分)还是静脉肝素治疗(90 d mRS评分 3分vs.2分)均未改善患者的预后,反而能增加sICH的风险[115]。随后评估血管内治疗前静脉使用替罗非班能否进一步改善急性前循环大动脉闭塞患者临床结局的替罗非班联合血管再通治疗急性缺血性卒中(revascularization pretreated with tirofiban for acute ischemic stroke,RESCUE BT)研究在JAMA上发表了其研究结果。该研究发现,术前静脉给予替罗非班未能改善患者的预后(mRS评分3分vs.3分,OR1.09,95%CI0.87~1.37,P=0.46),但也不会增加颅内出血的风险(9.7%vs.6.4%,P=0.07),不过亚组分析显示,术前静脉替罗非班能改善大动脉粥样硬化型卒中患者的残疾严重程度[116]。急性缺血性卒中血管内血栓切除术后强化血压控制(intensive blood pressure control after endovascular thrombectomy for acute ischaemic stroke,ENCHANTED2/MT)研究对血管内治疗后血压管理(术后1~72 h)进行了探索,研究者发现,相较于中等强度降压组(收缩压目标140~180 mmHg,1 mmHg=0.133 kPa),强化降压组(收缩压目标<120 mmHg)的预后更差(OR1.37,95%CI1.07~1.76,P=0.01),且早期神经功能恶化的风险明显增高,两种降压策略组之间脑出血、死亡率差异无统计学意义[117]。
综上所述,在对卒中患者进行血管内治疗前要明确治疗的适应证和禁忌证;在不同时间窗内的治疗要根据相应研究的入组和排除标准,严格筛选适合的患者,以减少无效再通,最大程度地使患者获益。
4.1 术前准备与术中操作
众所周知,快速实现靶血管再通能明显改善急性大动脉闭塞患者的预后。机械取栓技术可能会影响手术时间进而影响预后。目前机械取栓技术主要有支架取栓、直接抽吸与支架取栓联合直接抽吸治疗。抽吸取栓与可回收支架取栓对比作为大血管闭塞一线治疗方法(aspiration thrombectomy versus stent retriever thrombectomy as firstline approach for large vessel occlusion,COMPASS)研究评估了治疗前循环大动脉闭塞首选直接抽吸取栓是否非劣于首选支架取栓,结果发现首选直接抽吸取栓在90 d mRS评分达到0~2分方面非劣于首选支架取栓治疗,这表明直接抽吸取栓可替代支架取栓成为前循环大动脉闭塞的一线血管内治疗技术[118]。接触式抽吸与可回收支架对成功血管再通(contact aspirationvs.stent retriever for successful revascularization,ASTER)研究是另一项评估首选支架取栓对比首选直接抽吸取栓治疗前循环大动脉闭塞的研究,同样发现首选直接抽吸取栓与首选支架取栓治疗对患者的结局影响相似,也提示直接抽吸取栓能代替支架取栓成为前循环大动脉闭塞患者的一线血管内治疗技术[50]。随后ASTER 2研究继续对首选支架取栓联合抽吸取栓治疗前循环大动脉闭塞患者的疗效是否优于单纯支架取栓,最终该研究发现,首选支架联合抽吸取栓相较于首选支架取栓未能显著提高上述患者术毕达到扩展TICI(extended TICI,eTICI)分级2c/3级的比例[119]。上述研究都是在前循环大动脉闭塞患者中实施的,对于急性基底动脉闭塞患者,尚未明确取栓技术的优劣。目前有两项RCT正在对此进行探索,分别是对比抽吸取栓与单纯支架取栓治疗基底动脉闭塞急性卒中患者疗效(acontact aspiration versus stent retriever for recanalisation of acute stroke patients with basilar artery occlusion,PC-ASTER)研究(NCT05320263)和首选抽吸取栓与支架取栓治疗急性基底动脉闭塞(a comparison of contact aspiration versus stent retriever for acute basilar artery occlusion,ANGEL-COAST)研究(NCT05615038),这两项研究的目的都是比较首选支架取栓与首选直接抽吸取栓治疗急性基底动脉闭塞患者的疗效,期待这两项研究为后循环卒中患者的血管内治疗策略提供更详实的证据。机械取栓治疗急性卒中血栓栓塞药物优化(chemical optimization of cerebral embolectomy in patients with acute stroke treated with mechanical thrombectomy,CHOICE)研究对血管内治疗成功再通后辅助动脉溶栓(rt-PA)能否改善患者的预后进行了探索,结果发现,动脉rt-PA溶栓相较于安慰剂能明显提高达到90 d mRS评分0~1分患者的比例(59.0%vs.40.4%,P=0.047),同时不增加sICH的风险,且降低90 d全因死亡率。但CHOICE研究因为新型冠状病毒感染疫情所致入组缓慢和药物供应问题而提前终止,仍需大型RCT来验证该研究的结果。
结合患者发病时间窗及影像评估结果,在排除血管内治疗禁忌证后,可参考图1操作流程实施取栓治疗。
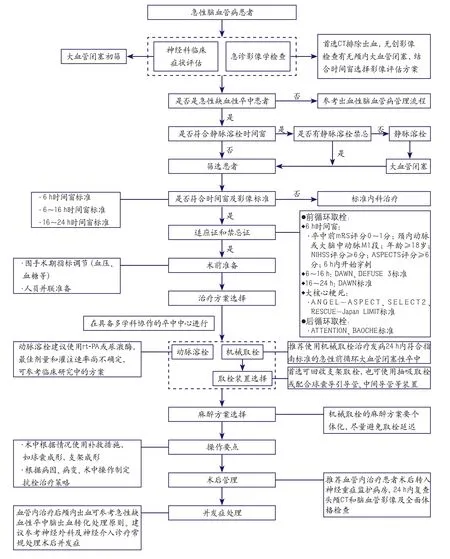
图1 急性缺血性卒中血管内治疗筛选及救治流程
血管内治疗术前准备、术中操作、药物使用及术后评估可参考下列方案(该方案仅供参考,请根据中心具体条件及经验实施)。
①患者能够配合时选择局部麻醉以节省时间,如需要可使用清醒镇静。如估计患者使用清醒镇静在术中配合较差或由于患者的疾病情况使用清醒镇静剂高危或气道情况高危,应使用全身麻醉。术前控制血压在180/105 mmHg以下。术中肝素的使用剂量尚有争论,术中可以使用肝素盐水,但通常不肝素化,除非存在高凝状态或预期手术操作时间较长。
②股动脉穿刺后快速行颅脑DSA检查(建议5~10 min完成病变血管及能提供代偿的血管的造影),评估病变闭塞情况、侧支循环代偿及操作路径。使用球囊导引导管、6F/8F普通导引导管或90 cm长鞘管通过股动脉上行至患侧动脉。使用0.014 in(1 in=2.54 cm)微导丝配合支架微导管穿过血栓到达闭塞远端位置。用少量对比剂超选择造影确认微导管的位置。根据闭塞血管管径及中心经验,推荐:管径>3 mm选择6 mm支架;管径<3 mm选择4 mm支架,也可先用4 mm支架,无效时再用6 mm支架。用生理盐水冲洗微导管内对比剂后,将支架装置通过微导管送入。
③释放支架后造影评估支架位置及张开程度。
④支架到位后放置5 min,以使支架在血栓内完全张开。将充分张开的支架装置与微导管一起轻轻拉出体外,期间导引导管持续负压抽吸控制血流。支架张开锚定血栓后,也可在拉栓前去掉微导管,使用“裸导丝技术”提高近端抽吸效果。如联合使用抽吸导管或中间导管时建议进行双重抽吸,通过近端导引导管抽吸或球囊导引导管控制血流,远端抽吸导管或中间导管抽吸提高支架取栓效果。
⑤血管再通定义为所有可治疗血管血流达到eTICI分级≥2b50级,再通时间定义为首次血流通畅时间。
⑥病因考虑为心源性栓塞时,术后可仅用单一抗血小板药物治疗,不用双联抗血小板治疗;考虑为大动脉粥样硬化形成时,建议术后24 h排除出血转化后给予双联抗血小板治疗。
⑦如果在支架取栓后发现闭塞部位有高度狭窄(>70%),有引起闭塞的风险,可采取以下治疗计划:重复不同角度血管造影,确认该狭窄不是血管痉挛或动脉夹层造成。使用Dyna-CT排除出血,准备进行颅内粥样硬化病变的颅内血管成形术或支架成形术,以改善远端血流,降低再次闭塞风险。40%~50%的残余狭窄是可接受的。
⑧考虑动脉溶栓的患者,单纯动脉溶栓建议选择rt-PA或尿激酶,目前最佳剂量和灌注速率尚不确定。推荐rt-PA 1 mg/min,总剂量不超过40 mg,或尿激酶1~3万IU/min,总剂量不超过100万IU。静脉溶栓后的患者,动脉溶栓时rt-PA剂量不超过30 mg或尿激酶剂量不超过40万IU。造影显示血管再通或对比剂外渗时,应立即停止溶栓。
⑨明确串联病变或原位狭窄病变,需要进行血管成形术时,可术中使用糖蛋白Ⅱb/Ⅲa受体拮抗剂(替罗非班或依替巴肽),如使用替罗非班,可首先通过静脉或联合导管内给予负荷剂量(每公斤体重0.4 µg/min)持续30 min(总剂量不超过1 mg),后静脉泵入(每公斤体重0.1 µg/min)维持24 h。如使用依替巴肽,可首先通过静脉或联合导管内推注135~180 μg/kg,继之持续静脉输注每公斤体重0.5~2.0 μg/min,维持18~24 h。术后根据CT复查结果,在停止糖蛋白Ⅱb/Ⅲa受体拮抗剂治疗前4 h给予重叠双联抗血小板治疗。术后24 h应进行MRA或CTA检查评估靶血管的开通程度。
⑩建议术后即刻使用DSA机器行CT检查,并复查头颅NCCT。术后腹股沟血管穿刺位置常规止血包扎或缝合。
⑪术后患者建议收入神经重症监护病房密切观察,给予标准内科治疗,进行至少24 h心电、血压监护,24 h内复查头颅CT和脑血管影像检查(TCD、MRA、CTA或DSA),同时进行神经系统全面体格检查(NIHSS)。
4.2 围手术期并发症及处理
4.2.1 出血转化 术后出血转化是急性缺血性卒中溶栓或血管内治疗的主要并发症之一。既往阳性结果研究中取栓组的sICH发生率为1.9%~7.0%。术后出血转化应与对比剂滞留相鉴别,对比剂滞留多无明显占位效应,由于血脑屏障破坏导致,多位于术前梗死区域。双能CT或MRI SWI序列可以帮助鉴别,较为可靠的方式为取栓术后19~24 h复查CT影像,观察高密度区域变化,如对比剂可见显著吸收。术后出血转化的原因可能与血管壁损伤、再灌注损伤、溶栓药物使用以及联合抗血小板、抗凝治疗有关。一般认为超时间窗、术前血压偏高(收缩压>180 mmHg,舒张压>100 mmHg)、头颅CT已显示低密度改变的卒中患者接受溶栓或血管内治疗易发生出血转化并发症。术后出血转化的处理以外科治疗和对症处理为主,目的是控制颅内压、维持生命体征。可参考急性缺血性卒中脑出血转化处理原则。
4.2.2 血管穿孔 血管穿孔多由导丝头端穿透动脉壁所致。导丝头端走行太远,头端位置不合适,路径迂曲后撤球囊、支架输送系统时导丝“前窜”穿破远端血管。如果路径不是非常迂曲,只要提供足够支撑力即可,导丝头端不需走行太远,可把导丝头端塑成“J”型,弓背前行减少出血风险。需要血管成形时,导丝头端应避免置于基底动脉尖、大脑中动脉分叉处等易于穿出的部位,尽量置于一段较为平直的血管内;交换动作时一定注意观察导丝头端位置保持不动。如造影发现明确的出血点,可采用减少血管灌注、中和肝素、急诊用弹簧圈或Onyx胶栓塞等处理措施。
4.2.3 血管破裂、穿支撕裂 闭塞血管管径较小、成角明显、支架取栓时如牵拉力量过大或反复取栓操作易造成血管损伤或破裂出血;合并狭窄时,球囊、支架选择过大、快速扩张都易导致血管破裂;严重钙化病变、反复球囊扩张也可致血管破裂;路径迂曲,导丝、球囊、支架送入时导致血管移位过大,穿支撕裂出血;成角病变,球囊扩张、支架释放也可致穿支撕裂出血;导丝进入穿支引起穿支痉挛,以及暴力牵拉也会拉断穿支引起出血。治疗时选择合适的术式,术中需要熟练、精细、规范的操作。预扩球囊及球囊扩张支架应稍小于靶血管直径,压力泵缓慢加压,推荐亚满意扩张。转动扭控子时导丝头端摆动不好,回撤时有阻力,透视下导丝位置远离路图,提示导丝进入穿支,此时不可暴力牵拉导丝,否则可能拉断穿支。一旦血管破裂可立即充盈球囊进行封堵止血,必要时可考虑弹簧圈闭塞,也可选择开颅血管修补术或动脉夹闭术。
4.2.4 新发部位栓塞 取栓过程中栓子移位、碎裂,可能造成闭塞血管的邻近分支或次级分支血管栓塞。对于大脑中动脉M1段远端栓塞,如同侧大脑前动脉存在,可使用中间导管跨越A1段开口进行保护,在回拉血栓时能降低栓子脱落栓塞的风险。如果发生栓塞,对可能导致严重功能缺损的主干血管应积极干预,首选机械取栓方式。
4.2.5 血管再闭塞 血管开通后再闭塞是急性缺血性卒中血管内治疗常见的并发症,再闭塞与临床症状恶化相关,早期再闭塞预示远期预后不良,多见于动脉粥样硬化性中重度血管狭窄伴发原位闭塞的患者。机械取栓术后由于血管内膜损伤导致血小板聚集增多,脂质核心暴露导致血小板激活聚集、原狭窄并未解除导致血流速度减慢,栓子清除能力下降,这些情况均可导致血管发生再闭塞。对于血管成形或支架置入治疗的患者,抗血小板治疗不充分也可导致支架内血栓形成而致闭塞。溶栓联合抗血小板治疗可能会减少再闭塞的发生,但同时也可能增加出血风险。术中应用血小板糖蛋白Ⅱb/Ⅲa受体拮抗剂可减少再闭塞发生和治疗再闭塞,目前研究显示并不增加出血风险,但仍需根据病变情况谨慎使用。
4.2.6 高灌注综合征 高灌注综合征是指闭塞脑动脉再通后,缺血脑组织重新获得血液灌注,同侧脑血流量显著增加,从而导致脑水肿甚至颅内出血发生。高灌注综合征患者需要收住神经重症监护病房进行密切监护,给予适当镇静、有效控制血压、适当脱水治疗及其他相关并发症的预防,对合并颅内血肿伴有占位征象者,必要时需要神经外科实施去骨瓣减压等处理。建议根据患者情况酌情处理。
4.2.7 血管痉挛 血管痉挛多是由导管、导丝等材料的机械刺激所致。血管痉挛可引起远端低血流状态,导致缺血事件发生。预防血管痉挛的常规措施是术前尼莫地平泵入,术中需注意导引导管位置不要过高,路径迂曲可配合中间导管,一般颈内动脉颅内段及大脑中动脉M1段治疗时,导引导管置于颈内动脉C2段即可;后循环治疗时,导引导管置于椎动脉V2段即可。如果出现导引导管处血管痉挛,需将导管回撤造影观察,尽量在较低位置完成手术。一般回撤导管、导丝,停止刺激后痉挛可迅速缓解。如出现不可恢复的血管痉挛,需应用球囊成形术或动脉注射钙离子通道阻滞剂。
4.2.8 动脉夹层 取栓过程中,如果血管局部存在重度狭窄,导管导丝通过时可能进入血管内膜下导致夹层发生。术中反复取栓操作,血管成角或支架选择过大,均易对血管内膜造成损伤,也可能引起血管夹层。术中需注意仔细辨别血管真腔,小心操作减少夹层形成风险。局部狭窄的单纯球囊扩张更容易发生动脉夹层,发生率可达20%。预防措施应注意选择稍小的球囊,缓慢、轻柔地充盈和排空。一旦发生动脉夹层应继续进行支架置入术,术后规范抗凝治疗。
4.2.9 其他并发症 应激性溃疡、心血管并发症、穿刺部位并发症、对比剂过敏、对比剂肾病等参照一般血管内治疗并发症处理方案。
手术操作及围手术期管理推荐——指南推荐意见
①缩短发病到再灌注时间与临床预后密切相关,推荐在治疗时间窗内尽早开通血管,以早期恢复血流再灌注(eTICI分级2b50~3级)(Ⅰ类推荐,B级证据)。
②在急诊血管内治疗过程中,建议达到eTICI分级2b50~3级的血流再灌注,以提高临床良好预后率(Ⅰ类推荐,A级证据)。
③对于适合机械取栓的患者,经过仔细筛选后,首选抽吸取栓不劣于首选支架取栓(Ⅰ类推荐,B级证据)。
④在血管内治疗过程中,推荐结合患者情况慎重筛选下应用球囊导引导管或中间导管等材料以提高血管开通率(Ⅱa类推荐,C级证据)。
⑤急诊血管内治疗后,再通血管存在显著狭窄时,建议密切观察,如狭窄>70%或影响远端血流(eTICI分级<2b50级)或导致再闭塞时,可以考虑血管成形术[球囊扩张和(或)支架置入](Ⅱb类推荐,B级证据)。
⑥急诊血管内治疗时可以考虑应用血管成形、支架置入等补救措施,以使再灌注血流达到eTICI分级2b50~3级(Ⅱb类推荐,B级证据)。
⑦急诊血管内治疗时,在静脉溶栓基础上,谨慎评估风险获益比后,可以考虑对部分适合患者进行动脉溶栓,当患者不适合静脉溶栓或静脉溶栓无效且无法实施血管内治疗时,经过严格筛选后,可慎重选择动脉溶栓治疗(Ⅱa类推荐,B级证据)。
⑧急诊血管内治疗成功开通血管后(eTICI分级2b50~3级),对部分适合的患者,在评估风险获益比后,可考虑慎重选择动脉内阿替普酶溶栓治疗(0.225 mg/kg),但仍需随机对照试验进一步证实(Ⅱb类推荐,B级证据)。
⑨血管内治疗血管恢复再灌注后,在谨慎评估风险获益比后,可以考虑将收缩压控制在140~180 mmHg,避免强化降压至120 mmHg以下(Ⅱb类推荐,B级证据)。
⑩急诊血管内治疗前给予静脉血小板糖蛋白Ⅱb/Ⅲa受体拮抗剂获益性仍不明确,在考虑病因为大动脉粥样硬化型前循环急性大血管闭塞患者中,经谨慎筛选后,术前静脉使用替罗非班可能是安全的(Ⅱb类推荐,B级证据)。
⑪急诊血管内治疗术中进行了球囊扩张或支架成形术的患者,经谨慎筛选后,在术中给予血小板糖蛋白Ⅱb/Ⅲa受体拮抗剂可能是安全的(Ⅱb类推荐,B级证据)。
⑫急诊血管内治疗患者,在术中给予静脉注射肝素或阿司匹林可能会增加风险,不建议在术中无选择地给药,对少数特殊患者,可在谨慎评估风险获益比后慎重选择(Ⅲ类推荐,B级证据)。
⑬对于心房颤动导致的急性缺血性卒中,急诊血管内治疗后,经谨慎评估,可以考虑在发病后早期启动抗凝治疗(Ⅱa类推荐,B级证据)。
⑭急诊血管内治疗开通血管后,不推荐扩容、扩血管治疗(Ⅲ类推荐,B级证据),血管内治疗后脑灌注不足者,可以考虑在密切监测下行扩容治疗(Ⅱb类推荐,B级证据)。
⑮血糖高于10 mmol/L时可以考虑给予胰岛素治疗,血糖低于3.3 mmol/L时可以考虑给予10%~20%葡萄糖口服或注射治疗(Ⅱb类推荐,C级证据)。
⑯血脂异常(过高或过低)均与不良预后相关,急性缺血性卒中后应积极评估血脂以指导降脂治疗及二级预防治疗(Ⅱa类推荐,B级证据)。
执笔者:
霍晓川、高峰
指南讨论组专家名单(按姓氏拼音排列):
David Wang 美国伊利诺伊州立大学Peoria医学中心
曹 毅 昆明医科大学第二附属医院
陈康宁 第三军医大学第一附属医院
陈文伙 福建省漳州市医院
董 强 复旦大学附属华山医院
高 峰 首都医科大学附属北京天坛医院
高连波 中国医科大学附属第四医院
高小平 湖南省人民医院
管 生 郑州大学第一附属医院
韩 巨 山东大学附属千佛山医院
韩红星 山东临沂市人民医院
韩建峰 西安交通大学第一医院
何 俐 四川大学华西医院
胡 波 华中科技大学同济医学院附属同济医院
胡 伟 中国科学技术大学附属第一医院
霍晓川 首都医科大学附属北京安贞医院
吉训明 首都医科大学
姜长春 包头市中心医院
焦力群 首都医科大学宣武医院
李天晓 河南省人民医院
李晓青 首都医科大学附属北京天坛医院
刘建民 海军军医大学第一附属医院
刘丽萍 首都医科大学附属北京天坛医院
刘新峰 中部战区总医院
刘亚杰 南方医科大学深圳医院
陆正齐 中山大学附属第三医院
马高亭 首都医科大学宣武医院
缪中荣 首都医科大学附属北京天坛医院
南光贤 吉林大学中日联谊医院
彭小祥 湖北省第三人民医院
彭 亚 常州市第一人民医院
秦 超 广西医科大学附属第一医院
史怀璋 哈尔滨医科大学附属第一医院
帅 杰 陆军军医大学新桥医院
汪银洲 福建省立医院
王 君 解放军总医院第一医学中心
王守春 吉林大学第一医院
王文志 北京市神经外科研究所
王伊龙 首都医科大学附属北京天坛医院
王拥军 首都医科大学附属北京天坛医院
魏 铭 天津环湖医院
温昌明 河南省南阳市中心医院
吴 伟 山东大学齐鲁医院
徐 运 南京鼓楼医院
徐安定 暨南大学附属第一医院
许予明 郑州大学附属第一医院
杨 华 贵州医科大学附属医院
杨 弋 吉林大学第一医院
袁光雄 湘潭市中心医院
曾进胜 中山大学附属第一医院
张 帆 海南省人民医院
张 猛 第三军医大学大坪医院
张建刚 安阳市人民医院
赵 钢 空军军医大学西京医院
赵性泉 首都医科大学附属北京天坛医院
赵振伟 空军军医大学第二附属医院
郑洪波 四川大学华西医院
朱良付 河南省人民医院
朱其义 山东临沂市人民医院
