腹泻试验兔粪便菌群变化的研究
2023-07-01邢志刚顾永豪
张 江,邢志刚,顾永豪,刘 影*
( 1. 上海农林职业技术学院,上海 201699 ;2. 上海楚豫生物科技有限公司,上海 201800 ; 3. 上海腾达兔业专业合作社,上海 201415 )
腹泻是较常见的家兔消化道疾病,主要表现是粪便不成球、稀软、呈粥状或水样粪便,在不同生长阶段均有发生[1],但以断乳期幼兔(3月龄以内)发病率最高,也是幼兔死亡的主要原因。若不及时治疗易引起大规模发病,不仅影响养兔业的健康发展,也会影响动物试验及食品安全。家兔腹泻与肠道微生物菌群失调关系密切,肠道病原微生物会打破正常微生物区系,使有益微生物大量减少,影响家兔肠道健康。导致家兔腹泻的病原微生物众多,大多数存在多种病原微生物的混合感染,因此肠道和粪便菌群组成变化可成为腹泻疾病筛查和确诊的客观指标之一。目前对兔腹泻病的诊断主要是依靠传统的细菌学和免疫学诊断方法,即分离培养和生化鉴定,再对疑似菌进行血清学检测,操作烦琐费时且阳性率低。而且由于各种细菌培养和鉴定条件不同,单独检测的工作量很大,时间较长[2]。本研究以试验兔为研究对象,采用16S rRNA 基因测序技术,检测健康试验兔和腹泻试验兔粪便微生物组成及丰度,分析菌群变化,遴选出重要的差异菌群,为试验兔腹泻预防、病因学分析及粪菌移植和益生菌干预提供参考。
1 材料与方法
1.1 试验材料
1.1.1 试验动物
试验兔为上海某兔业有限公司饲养的新西兰白兔,采用叠层式笼养,乳头式饮水,自动喂料,全自动清粪,按照饲养技术规范配制日粮并进行饲养管理。日粮原料组成包括玉米、麸皮、豆粕、苜蓿草粉、磷酸氢钙、碳酸钙、氯化钙、赖氨酸、蛋氨酸、复合维生素、复合微量元素等,日粮营养水平见表1。
试验共采集8 只试验兔粪便,6 只为腹泻兔,2 只为健康兔。该项研究得到上海农林职业技术学院动物伦理委员会批准。
1.1.2 主要试剂
DNA 提取试剂盒(E.Z.N.A.®Stool DNA Kit, Omega Bio-Tek,Norcross,GA,U.S.)、凝胶回收试剂盒(Axygen Biosciences,Union City,CA,U.S.)、PCR 试剂盒(TransGen AP221-02: TransStart Fastpfu DNA Polymerase)。
1.1.3 主要仪器
PCR 仪(ABI GeneAmp®9700 型)、Illumina HiSeq platform测序平台(上海凌恩生物科技有限公司)。
1.2 试验方法
1.2.1 粪便采集
试验当天于9:30~10:00 采集粪便。操作人员穿防护服,戴手套及口罩,用75%酒精棉球擦拭试验兔肛门,自然晾干。轻轻按压兔腹部,用无菌棉签及5 mL 粪便采集管接取粪便3~5 g。拧紧管盖,做好标记,立即置于冰上。粪便样品运至实验室后,-80 ℃冰箱保存。
1.2.2 16S rRNA基因测序
按照E.Z.N.A.®Stool DNA Kit说明书提取粪便DNA,用1%琼脂糖凝胶电泳检测基因组DNA。PCR 扩增16S rRNA 基因V3~V4 段,引物序列(341F:5'-CCTAYGGGRBGCASCAG-3';806R:5'-GGACTACNNGGGTWTCTAAT-3')。
PCR 反应程序:95 ℃预变性2 min;95 ℃ 30 s,55 ℃30 s,72 ℃ 30 s,25个循环;72 ℃ 5 min。
PCR 反应体系(20 μL):5×FastPfu 缓冲液4 μL、2.5 mmol/L dNTPs 2 μL、引物(5 μmol/L)0.8 μL、FastPfu聚合酶0.4 μL、模板DNA 10 ng。
采用2% 琼脂糖凝胶电泳检测PCR 产物,按照AxyPrepDNA 凝胶回收试剂盒说明书回收PCR 产物。构建Illumina PE250文库并测序。
1.2.3 生物信息学分析
使用FLASH软件对序列进行拼接,利用qiime软件对序列质量进行质控过滤。采用RDP classifier 贝叶斯算法对97%相似水平的OTU 代表序列进行分类学分析,并分别在各个分类水平统计各样本的群落组成。基于OTU聚类结果分析OTU多样性指数。利用Mothur(v.1.30.1)进行α多样性分析。采用单因素方差分析(ANOVA)、Wilcoxon秩和检验及LDA分析进行菌群差异分析。
2 结果与分析
2.1 试验兔腹泻临床症状
试验兔腹泻多发生于春秋两季,患病率接近1%。试验兔腹泻发病急,从发病到死亡仅2周左右时间,具体症状见表2。

表2 试验兔腹泻临床症状Tab.2 Clinical symptoms of diarrhea in experimental rabbits
2.2 16S rRNA基因测序结果(见表3)

表3 16S rRNA基因测序结果Tab.3 Results of 16S rRNA gene sequencing单位:个
测序结果显示得到369 888 个有效序列,平均长度为416 bp。将相似性达到97%的有效序列归为一类,即1个OTU。
由表3 可知,与健康兔相比,腹泻晚期序列数及OTU数均显著下降(P<0.05)。
2.3 腹泻对试验兔粪便菌群α多样性的影响(见表4)
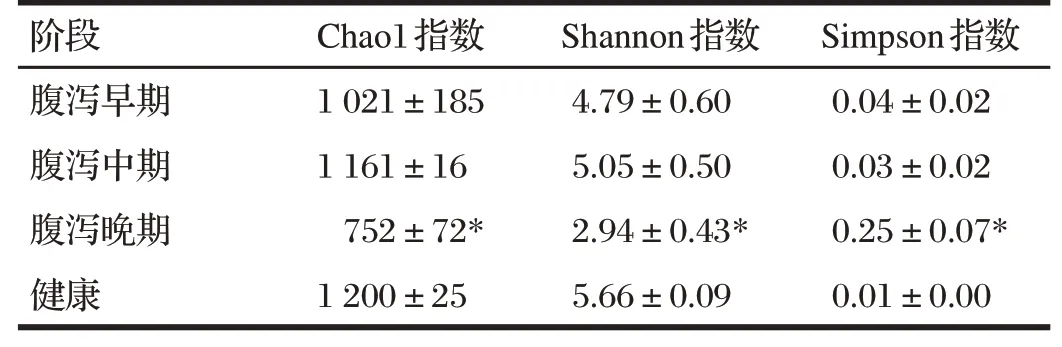
表4 腹泻对试验兔粪便菌群α多样性的影响Tab.4 Effect of diarrhea on α-diversity of fecal microbiota in experimental rabbits
由表4可知,腹泻使兔粪便样本序列数均有所减少,但腹泻晚期兔粪便样本序列数最少。与健康试验兔相比,腹泻试验兔粪便样本的Shannon指数及Chao1指数均有所下降,腹泻晚期的Shannon指数及Chao1指数最小;腹泻试验兔的Simpson指数升高,腹泻晚期Simpson指数最大。
与健康试验兔的粪便相比,腹泻晚期试验兔粪便的Chao1 指数、Shannon 指数及Simpson 指数均显著降低(P<0.05)。
2.4 腹泻对试验兔粪便优势菌群的影响(见表5)
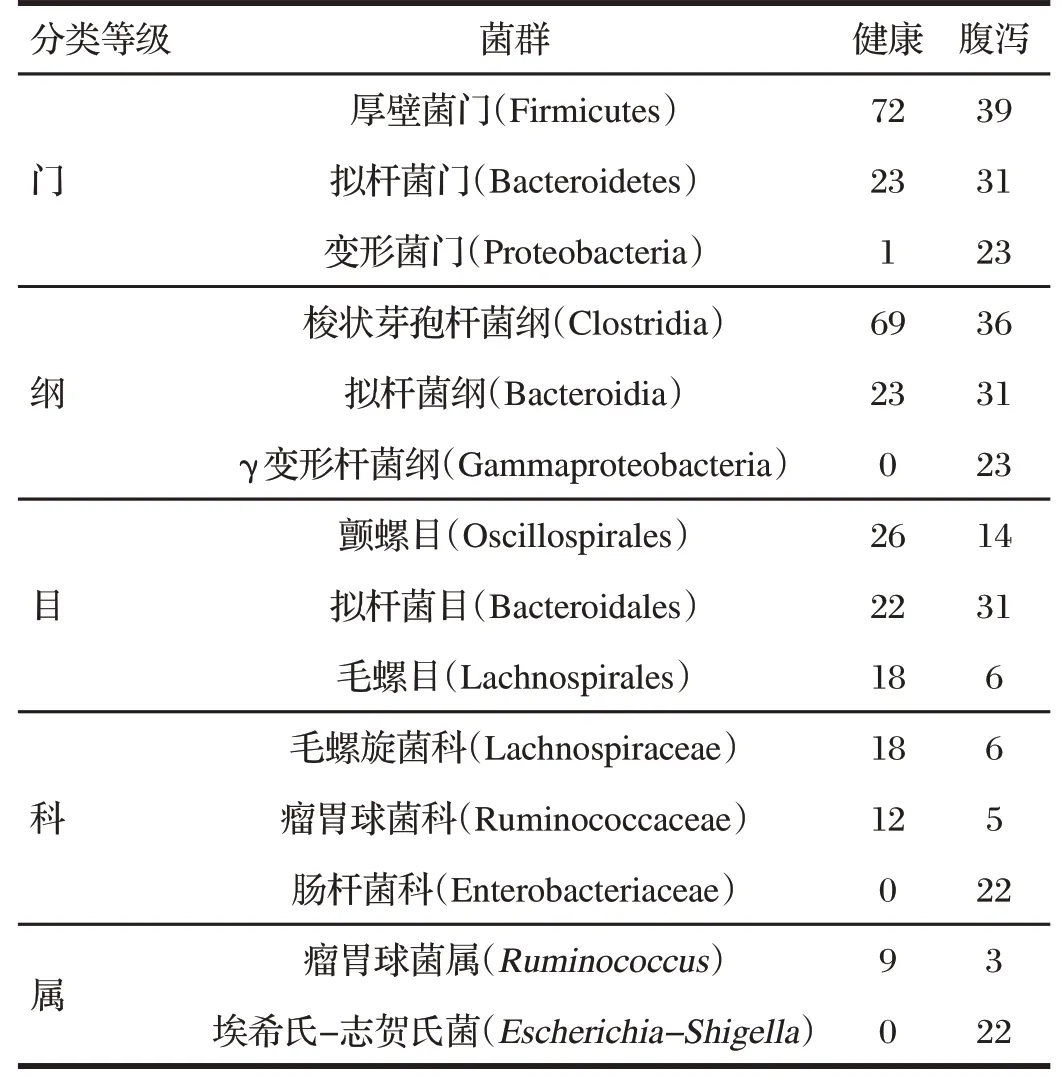
表5 腹泻对试验兔粪便优势菌群的影响Tab.5 Effect of diarrhea on dominant fecal flora of experimental rabbits单位:%
试验共检测到14 个门、21 个纲、53 个目、97 个科及217个属。
由表5可知,在门、纲、目水平,腹泻兔粪便的优势菌群和健康兔基本一致,但腹泻兔粪便变形菌门(Proteobacteria)、γ变形杆菌纲(Gammaproteobacteria)及拟杆菌目(Bacteroidales)丰度显著升高;厚壁菌门(Firmicutes)、梭状芽孢杆菌纲(Clostridia)、颤螺目(Oscillospirales)及毛螺目(Lachnospirales)丰度均明显减少。在科和属水平,腹泻兔肠杆菌科(Enterobacteriaceae)及埃希氏-志贺氏菌属(Escherichia-Shigella)丰度均明显升高,跃居为第一优势科和第一优势属。毛螺旋菌科(Lachnospiraceae)、瘤胃球菌科(Ruminococcaceae)及瘤胃球菌属(Ruminococcus)丰度下降最多。
2.5 腹泻试验兔与健康试验兔粪便菌群的差异分析(见图1)
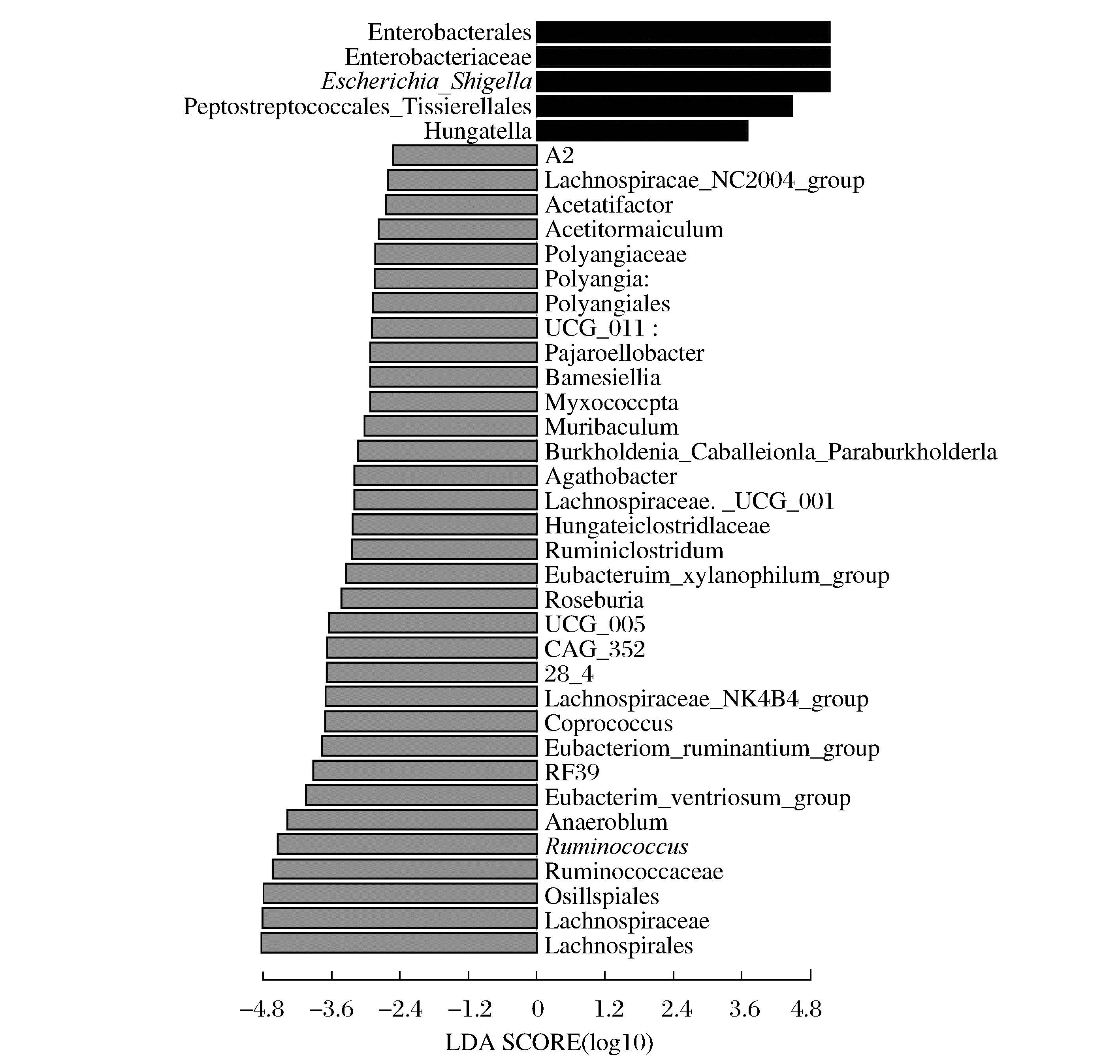
图1 粪便微生物菌群的LDA分析Fig.1 LDA analysis of fecal microbial flora
采用ANOVA 方差分析(F检验),腹泻兔和健康兔粪便中有309 个OTUs 在存在显著差异(P<0.05),250 个OTUs存在极显著差异(P<0.01)。利用Wilcoxon秩和检验分析发现,腹泻兔和健康兔粪便有3个属存在极显著差异(P<0.01),19 个属存在显著差异(P<0.05),其中只有埃希氏-志贺氏菌属(Escherichia-Shigella)在腹泻兔粪便中的丰度高于健康兔。
由图1 可知,通过LDA 分析发现,健康兔和腹泻兔的菌群丰度存在显著差异(P<0.05),并且LDA 值大于2.4 的菌群有38个,其中腹泻试验兔粪便中有5个显著差异菌群(LDA>3.6),分别为肠杆菌目(Enterobacterales)、肠杆菌科(Enterobacteriaceae)、埃希氏-志贺氏菌(Escherichia-Shigella)、Tissierellales菌及亨得特拉菌(Hungatella)。
3 讨论
本研究结果显示,腹泻晚期试验兔粪便的OTU数显著下降,粪便菌群α 多样性指数显著降低,表明腹泻试验兔粪便微生物群落多样性显著下降。腹泻试验兔与健康试验兔的粪便菌群存在显著差异,表明腹泻兔粪便菌群严重失调。有研究表明,肠道菌群失调是诱发肠炎的重要因素[3]。
本研究中,腹泻试验兔粪便厚壁菌门和该门下的梭状芽孢杆菌纲、颤螺目、毛螺目及瘤胃球菌属丰度减少。厚壁菌门是兔肠道的优势菌门[4],其中多数菌群是有益菌,这些有益微生物在代谢过程产生短链脂肪酸[5]。短链脂肪酸能够修复受损肠黏膜,维持肠上皮完整,促进抗炎因子分泌及肠道免疫反应,抑制有害菌生长,恢复菌群平衡,减少肠炎发生[6]。健康菌群不利于致病菌在肠道中定植[7],健康菌群丰度下降,致病菌定植增加,使肠黏膜生物屏障功能下降,肠黏液层破裂导致肠道细菌入侵,最终引起肠道炎症[8]。因此,为改善试验兔肠道健康,可将厚壁菌门、梭状芽孢杆菌纲、颤螺目、毛螺目、毛螺旋菌科、瘤胃球菌科及瘤胃球菌属作为粪菌移植的备选菌群。
本研究中,腹泻兔粪便中拟杆菌门、拟杆菌纲及拟杆菌目丰度升高。有研究指出,拟杆菌门丰度与炎性因子(白细胞介素-1β)水平呈正相关[9-10],结肠炎大鼠脆弱拟杆菌丰度升高[11]。变形菌门是胃肠道中一类适应性强、具有潜在致病性的常见菌,其丰度变化直接影响宿主健康[12]。有研究表明,结肠炎小鼠变形菌门丰度升高[13]。本研究中,腹泻兔粪便变形菌门、γ 变形杆菌纲、肠杆菌科及埃希氏-志贺氏菌属丰度显著升高。Song 等[11]研究发现,溃疡性结肠炎大鼠中大肠杆菌丰度升高,结果与本研究一致。埃希氏-志贺氏菌及亨盖特拉菌是众所周知的致病菌,属于条件致病菌,能够破坏肠道屏障,引发炎症[14]。厚壁菌门的Tissierellales 菌可生产乙酸盐[15],乙酸盐可影响肠道菌群平衡[16]。本研究结果显示,基于LDA 分析,可考虑将肠杆菌目、肠杆菌科、埃希氏-志贺氏菌、Tissierellales菌及亨盖特拉菌作为试验兔腹泻生物标记的备选菌群。
4 结论
本研究结果表明,腹泻兔粪便菌群多样性下降。健康兔与腹泻兔粪便微生物菌群组成存在显著差异,厚壁菌门、梭状芽孢杆菌纲、颤螺目、毛螺目、毛螺旋菌科、瘤胃球菌科及瘤胃球菌属丰度明显下降,可考虑作为改善家兔肠道健康的备选菌群;腹泻兔粪便中肠杆菌目、肠杆菌科、埃希氏-志贺氏菌、Tissierellales菌及亨盖特拉菌的丰度显著高于健康兔,可考虑作为试验兔腹泻生物标记的备选菌群。本研究结果可为试验兔腹泻病预防和病因学分析提供参考。
