我国猪圆环病毒3 型研究进展及概况
2023-07-01姜佳佳刘金凤黎木兰覃绍敏
姜佳佳,刘金凤,黎木兰,覃绍敏
( 1. 南宁市动物疫病预防控制中心,广西 南宁530001 ;2. 广西壮族自治区兽医研究所广西兽医生物技术重点实验室,广西 南宁 530001 )
猪圆环病毒(porcine circovirus virus,PCV)是圆环病毒科(Circoviriridae)圆环病毒属(Circovirus)成员,是直径为(17.0±1.3) nm 的二十面体单链闭合环状无囊膜DNA病毒[1]。迄今已发现4 种不同基因型的PCV,包括猪圆环病毒病1型(PCV1)、猪圆环病毒病2型(PCV2)、猪圆环病毒病3 型(PCV3)及猪圆环病毒病4 型(PCV4)。PCV1 可使血清产生抗体但不致病。PCV2 对猪极为易感,是导致猪圆环病毒病(porcine circovirus disease,PCVD)的主要病原体,可引起断奶仔猪多系统衰竭综合征、繁殖障碍、呼吸道疾病综合征及皮炎肾病综合征[2]。PCV3于2016年在美国首次被发现并鉴定,可引起猪心脏和多系统炎症、皮炎肾病综合征、仔猪消瘦腹泻及母猪繁殖障碍等[3]。PCV4是2019年在中国发现的新病原,可引起猪呼吸道和肠炎症状及皮炎肾病综合征等[4]。至今,PCV 的4 种不同基因型已在我国猪场内普遍存在。目前,PCV3 的流行范围不断扩大,已在中国多地被报道并显示出较高的感染率,且混合感染情况严重,对我国猪养殖业造成了极大危害。本文从PCV3 的分子生物学特征、流行病学、流行病学调查监测、检测方法及亚单位疫苗研究进展等方面进行综述,以期为PCV3的早期监测、诊断、防控等提供参考。
1 PCV3分子生物学特征及流行病学
1.1 分子生物学特征
PCV3是兽医学上迄今发现的已知动物病毒中最小的病毒,为单股负链环状DNA病毒,基因组全长为2 000 bp,包含3个开放阅读框(ORF),其中ORF1与其ORF2分别编码复制酶蛋白Rep 和抗原结构蛋白Cap(主要的结构蛋白与抗原决定簇),且两个ORF 呈反向排列;ORF3 包含231 个编码可预测的氨基酸,但该蛋白的起始密码子和功能目前尚不清楚。基因分析发现,PCV3与PCV2、PCV1基因组之间同源性较低,且PCV3 Cap蛋白与PCV2 Cap蛋白基因序列同源性仅约30%,二者之间的抗原表位也不具有任何相似性,由此推测,PCV3 与PCV2 之间不具有抗原交叉保护性,且现有的PCV2疫苗不会对PCV3产生作用[5]。
1.2 传播途径
目前关于PCV3 传播途径的研究尚少,由于PCV2 可经患病猪的呼吸道、消化道和泌尿生殖道分泌物排出,通过直接或间接接触方式传播,揭示了PCV3 也有可能通过水平方式传播,但该结论仍需进一步研究加以确定。Palinski等[6]已分别从患病母猪的乳汁、流产胎儿及公猪精液中检出PCV3,说明PCV3可垂直传播。段汝亮[7]在母猪妊娠流产胎儿的内脏结构中检测到PCV3,且其他病毒的病原学检测结果如猪瘟病毒、猪蓝耳病病毒、猪伪狂犬病病毒、猪细小病毒、PCV2 等均呈阴性;对PCV3 阳性PCR产物进行基因测序,发现其核苷酸序列与其他PCV3 的同源性超过98%,结果表明,PCV3可能是导致此次母猪流产的关键病原。
2) 算法效率提升。采用线性简化状态方程、对量测方程降维处理。与IMM2-EKF相比,时间增加了35%;与IMM3-EKF相比,时间减少了21%;与IMM2-CKF相比,时间减少了53%。
1.3 易感动物
根据现有研究资料总结分析,PCV3 能够单独感染各个年龄阶段的猪并引起明显的临床症状,且患病猪的症状不尽相同,以妊娠母猪和仔猪更易感染。不同学者在不同哺乳动物(家养或野生)和壁虱中也检测到PCV3[8-11],其中野猪PCV3感染率为30%~50%,与家猪相似甚至更高。上述研究结论表明,PCV3 可以感染猪、野猪、牛、小鼠、犬和壁虱,具有跨物种传播的能力。也有研究发现,PCV1 和PCV2 可感染人类细胞,从接受轮状病毒活疫苗的儿童采集的血清样品中也检出了PCV2 的DNA[12]。基于此,PCV3是否可感染人类细胞需要进一步研究证实。
2 PCV3感染现状
由表2 可知,经流行病学调查监测可知,PCV3 常与PCV2、猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪伪狂犬病病毒(PRV)、猪流行性腹泻病毒(PEDV)等形成混合感染。其中,二重感染以PCV3 与PRRSV混合感染率最高,PCV3与PCV2次之;三重感染以PCV3 与PCV2 和PRRSV 混合感染率最高,且上述二重及三重混合感染在各监测地猪群中均较常见。张爱琼[13]在对贵州省进行PCV3分子流行病学调查研究中发现,PCV3与PCV2、PRRSV、CSFV、PRV还存在五重感染的情况。造成PCV3 与PRRSV、PCV3 与PCV2、PCV3 与PCV2 和PRRSV 混合感染率高的原因,推测可能为以下两点原因:PCV2和PRRSV会损害猪免疫系统,造成机体产生免疫抑制;而且由于PCV2 与其他病毒混合感染能够促进猪发生更严重的PCVD,由此推测,混合感染对PCV3的致病性和发病率的影响也产生了类似的促进作用。综上所述,混合感染增加了疫病防控与诊断难度,造成了更严重的感染及发病情况,应加以重视。
2.1 猪群PCV3单独感染情况统计
综上所述,目前已有多种针对PCV3病原学检测方法,但各有利弊。如常规PCR 法检测速度快、特异性强,但不能定量、灵敏性不高;多重PCR法虽可同时检测几种病原,但敏感性不高、易漏检;半巢氏式PCR 法克服了常规PCR的缺陷,但由于其进行两次扩增,交叉污染的概率大;LAMP 法操作简单、反应速度快、敏感性较高,因不需要PCR仪等仪器而适用于现场检测,但易产生气溶胶污染造成假阳性;荧光定量PCR法特异性、灵敏度和准确性高,但仪器和耗材成本较昂贵,不适用于基层使用;微滴式数字PCR 与传统的恒温扩增技术(LAMP)、实时荧光定量PCR(qPCR)技术相比具有更高的灵敏度、特异性和精确性,但仪器和耗材成本相对高,具有一定局限性。在兽医临床和研究中可根据不同的需要选择适当的检测方法。
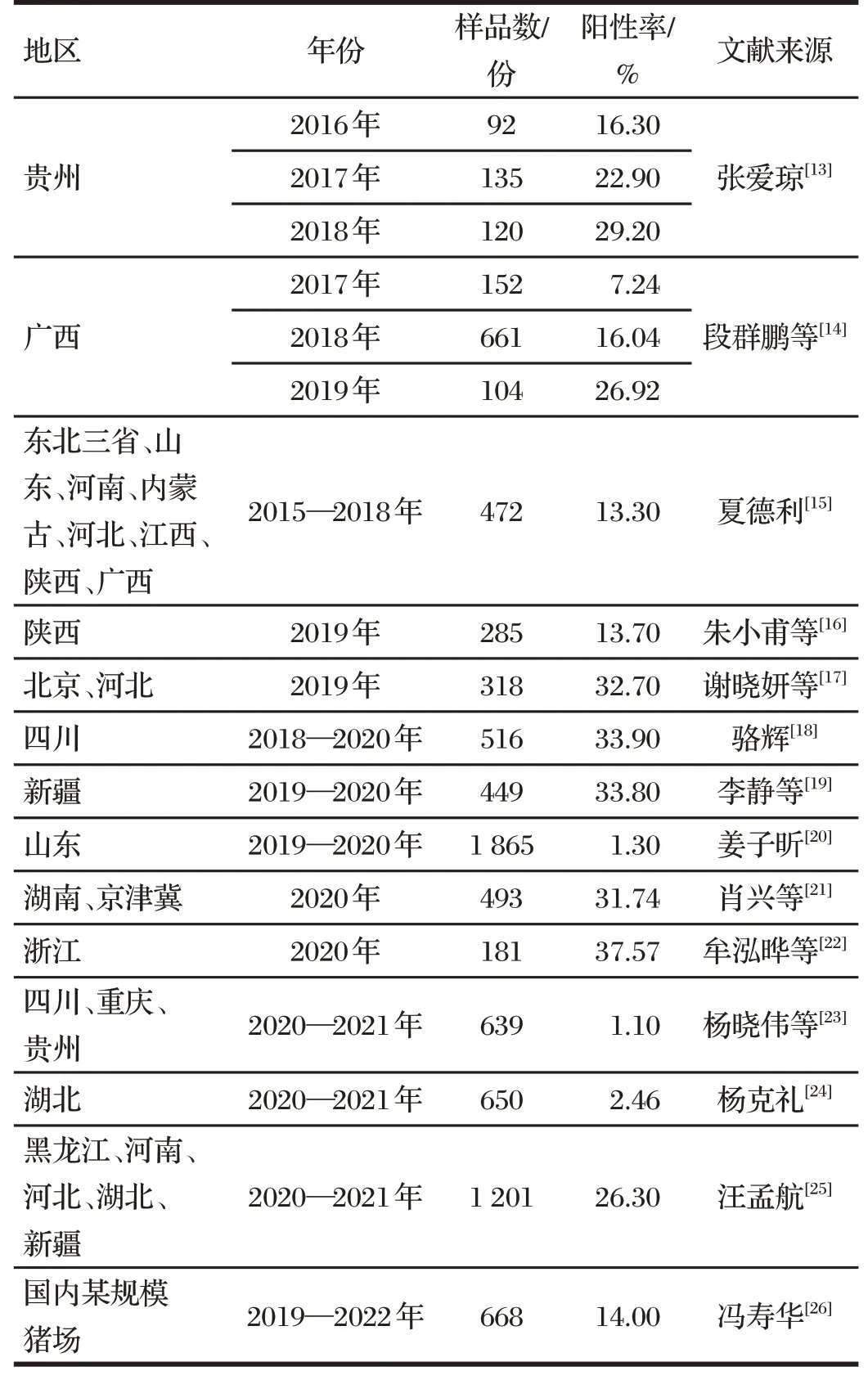
表1 猪群PCV3单独感染情况统计Tab.1 Statistics of individual infection of PCV3 in pigs
根据上述各地流调监测结果可推测,2016—2020 年间,PCV3 在我国感染范围越来越广,阳性率存在上升趋势。杨克礼[24]、姜子昕[20]、杨晓伟等[23]监测到的PCV3阳性率值较其他学者监测到的值均偏低,如杨晓伟等[23]2020—2021 年共检测了四川、重庆、贵州3 个省(市)639 份样本,整体阳性率为1.10%(7/639),与张邑帆等[27]报道的2020年重庆地区PCV3阳性率3.1%较接近,但与骆辉等[18]报道的2018—2020年间四川地区33.9%的阳性率存在较大差别。分析其原因可能有以下3点:首先,不同类型样本的病毒载量不同,杨晓伟等[23]所检测的样本以血清为主,有可能是造成阳性率低的原因,而阳性率较高的报道大多采用组织病料;其次,不同研究样本采集的方式不同,阳性率低的报道多选择一些管理水平较高的规模猪场或无特定临床症状的样品进行采集,而阳性率较高的报道多为已发病或有典型临床症状的样本;最后,养殖规模、管理方式以及不同地域等均有可能造成阳性率差异。
2.2 PCV3与其他病原混合感染情况统计
课程评价成绩构成是全过程综合性的评价,评价点包含对课程基础知识的掌握程度、自主学习活动能力、软件开发能力、团队协作能力以及创新能力等职业素养能力。
为进一步了解PCV3 与其他常见病原混合感染的情况,本文对近几年的一些监测结果进行统计,结果见表2。

表2 PCV3与其他病原混合感染情况统计Table.2 Statistics of PCV3 mixed infection with other pathogens
近年来,我国一些学者对国内PCV3 的感染情况进行了大量的流行病学调查,文章对一些调查结果进行了整理汇总,具体情况如下。
3 检测方法研究进展
本文就近年来我国学者针对PCV3病原学检测方法及其抗体检测方法的一些研究进展进行统计[16,29-37],见表3。

表3 PCV3检测方法统计Tab.3 Statistics of PCV3 detection methods
PCV3 流行范围已遍布我国山东、浙江、新疆、内蒙古等地区,具体感染情况[13-26]见表1。
[8]It is building the most capable and well-funded military in the world,after our own.
4 PCV3亚单位疫苗研究进展
由于PCV1 和PCV2 Cap 蛋白相似性低,现有的PCV2疫苗对PCV3无法提供保护。目前世界范围内尚未成功分离出PCV3,无法利用全病毒研制传统灭活或弱毒疫苗,而基于基因工程技术的亚单位疫苗不需要培养病毒,因此,开发亚单位疫苗是防控PCV3的有效措施。王俊伟[38]获得了两种均可在体外自我组装成直径20 nm左右的病毒样颗粒(VLPs),经动物试验表明,两种VLPs均可有效诱导机体的体液免疫和细胞免疫,为评估随后研制以VLPs 为基础的亚单位疫苗提供了参考依据。姜宇航等[39]成功地利用昆虫表达系统表达了PCV3 Cap,经IFA 和Western blot 结果表明,利用杆状病毒表达系统能够正确表达Cap 蛋白,且Cap 蛋白具有良好的抗原性,为今后PCV3 新型疫苗的研发奠定基础。高斌[40]用原核表达技术重组表达PCV Cap,并以重组表达的蛋白作为抗原去免疫试验动物兔制备多克隆抗体,为进一步研制PCV3 商品化ELISA 检测试剂盒和疫苗奠定基础。王硕[41]成功拯救了一株表达去除核定位信号的PCV2 截短Cap 蛋白和PCV3 Cap 蛋白的重组杆状病毒,通过间接免疫荧光、Western Blot等试验验证了Cap蛋白的免疫原性,为研制可同时预防PCV2和PCV3的疫苗、制备PCV2 和PCV3 的诊断试剂盒打下了前期基础,同时解决了融合蛋白上游表达纯化操作复杂、含量低等缺点。王宇[31]成功地在大肠杆菌中表达密码子优化的PCV3 Cap 全长基因,重组基因能够高效并以可溶的形式表达,还能够自行组装成直径为10 nm 左右的VLPs,Western blot 结果表明其具有高度特异性。徐鹏等[42]成功制备了共表达PCV2/PCV3 Cap 蛋白的VLPs,为深入开展PCV二价新型疫苗研发奠定了坚实基础。
将5%的混合菌群(YJ01)接种至含1.0%(W/V)原油的无机盐培养基中,在30℃、150 r/min下培养7天、14天后,利用气相色谱对残油进行定性和定量分析.
5 结论
目前,市面上尚无有效疫苗和针对性治疗药物用于PCV3 防治,导致临床防控PCV3 的难度较大,疫情蔓延呈逐年上涨趋势,对世界养猪业造成严重危害和经济损失。因此在实际工作中,通过生物安全防控阻止外部病原传入,及时监测并淘汰患病猪和带毒猪,注重改善场内卫生和检疫水平,加强消毒切断传播途径,是目前PCV3最切实有效的防控措施。
