基于分子印迹技术的细菌传感检测*
2023-06-20何勇飞庞义全溢1
何勇飞 庞义全 葛 闯 徐 溢1,3)
(1)重庆大学新型微纳器件与系统技术重点学科实验室&光电技术与系统教育部重点实验室,重庆 400044;2)重庆大学化学化工学院,重庆 400044;3)重庆大学光电工程学院,重庆 400044;4)重庆大学肿瘤医院肿瘤转移转化与个体化治疗重点实验室,重庆 400030)
自然界中种类繁多的细菌会引发各种疾病,因此细菌检测备受关注。但细菌在环境或生理样本中通常浓度极低且基底背景复杂,导致对细菌进行准确快速检测面临着极大的挑战[1-3]。传统的致病菌检测主要依靠常规培养方法[4]、聚合酶链反应[5](PCR)和酶联免疫吸附试验[6](ELISA)等,存在操作条件苛刻、灵敏度不高,以及在发生紧急事件时无法转移到现场检测的缺点。光电传感检测技术和方法以其所具有的高灵敏度、方便快捷和易于集成等优势,成为细菌细胞等微生物高效检测的新途径。针对细菌等微生物分析,本课题组将传感检测技术与微流控芯片分析技术结合[7-11],研究发现芯片集成传感监测是极具潜力的检测模式,该检测方法的核心依然是敏感膜识别元件和传感检测方式。 就敏感膜而言, 通过分子印迹技术(molecular imprinted technology,MIT)制备的分子印迹聚合物(molecular imprinted polymers,MIPs)与抗体或酶等天然受体相比具有高度的物理和化学稳定性,可以长期重复使用。目前,基于MIPs 的传感器已被用于检测生化样本中的各种化学和生物组分,从小分子[12-14](霉菌毒素和非法食品添加剂)到大分子[15-16](致敏蛋白和细菌外毒素),甚至是致病菌和病毒的检测[17-19]。利用MIPs 对靶标物高效捕获的优势,将MIT 与传感器检测技术结合,实现生化样本中细菌高灵敏、特异性和高稳定性的检测,正逐渐成为生化传感检测技术发展的新亮点和新途径之一。
本文针对建立特异性强、快速、灵敏的细菌等微生物检测和鉴定方法及相关研究需求,在简要介绍MIT 原理基础之上,分析讨论印迹材料与细菌的相互作用模式,总结细菌印迹的方法和途径,重点关注基于MIT 的细菌传感分析技术及其在细菌检测中的应用,并对相关领域面临的挑战和研发前景进行展望。
1 分子印迹与细菌印迹
1972 年,Wulff 和Sarhan[20]首 次 报 道 了 以D-甘油酸为模板的分子印迹的理念及相关研究。MIT 即利用MIPs 模拟酶-底物或抗体-抗原之间的相互作用,对模板分子进行专一识别的技术。MIPs 的制备是利用单体和交联剂在模板分子的存在下,通过相互作用,形成预聚合复合物,该复合物由分子相互作用稳定,然后通过聚合作用“冻结”,使模板的“印迹”被保留在形成的聚合物上,从而产生能够识别模板及其类似物的特定结合位点[21-22](图1)。该技术的特异性、高灵敏性和稳定性,使其在色谱分离[23]、固相萃取[24]、生物成像[25]、组织工程[26]、药物递送[22]等领域得到广泛应用。

Fig. 1 Schematic diagram of the molecular imprinting process[22]图1 分子印迹过程示意图[22]
2001年,Dickert等[21]以酵母为模板制备了聚氨酯(polyurethane,PU)印迹膜,由此提出了微生物印迹法并进行了相关的研究。其中,细菌印迹技术即以细菌作为模板制备细菌印迹聚合物(bacteria imprinted polymers,BIP),通过BIP 三维空腔的物理结构与聚合物和细菌表面的化学结构共同作用下,特异性识别细菌的技术(图2)。近年来,细菌印迹在病毒[27-28]、细菌[29-31]和哺乳动物细胞[32]等的分析检测中也已有研究及应用。
2 细菌印迹的材料和制备方法
2.1 细菌印迹材料
以BIP特异性捕获目标细菌,功能单体的合理选择是印迹成功的关键步骤,其选择通常依据模板的结构以及与模板作用力大小。细菌印迹材料主要包括有机聚合物、导电聚合物、溶胶-凝胶和复合型印迹材料等。表1归纳了几种典型的细菌印迹材料及其应用情况。

Table 1 Classification of materials in bacteria imprinting and their applications表1 细菌印迹的材料分类及其应用
有机聚合物是一种常用于制备BIP 的材料。Mosbach[34]提出,模板和功能性单体之间存在非共价相互作用,在适当的溶剂中,模板与单体配合物通过各种相互作用聚合,如氢键、静电作用、范德华力、π-π 键等,在去除模板之后,官能化的聚合物基质可以通过相同的非共价作用重新和靶标物结合。主要单体包括丙烯酰胺(acrylamide,AAm)、甲基丙烯酸(methacrylic acid,MAA)、乙 烯 吡 咯 烷 酮 (N-vinyl-2-pyrrolidinone,NVP)等[35]。
导电聚合物(conductive polymers,CP)中每个重复单元之间的电子共轭提供了适合于传感应用的结构和性质[36]。对原始CP 进行结构修改或在CP 中加入功能性改性组件来开发功能化CP[37-38],既可以加入产生非共价作用的功能单体,也可以引入能够产生共价作用的特定官能团或单体;其中共价作用制备的BIP中能够获得更均匀的结合位点分布,但是在去除模板的处理上比较复杂。
溶胶-凝胶(sol-gel)是用于制备BIP的一种高效材料[39-40],主要以共价作用的方式制备BIP。通过溶胶-凝胶法获得的硅基材料显示出良好的生物相容性、亲水性和易于表面改性,这使它们易于生物医学应用。
复合型印迹材料[41]是根据各种材料的不同功能性,合成制备得到的多组分材料,可获得更多独特性质,这种独特性质包括新的化学性质或在原有成分的某一性质上进行改进。其制备常采用半共价法,在温和条件下通过共价结合有效地掺入模板单体,通过非共价作用重结合[42-43]。
2.2 表面印迹的制备方法
根据模板的大小,可以选择不同的印迹策略。对于整体印迹方法包含沉淀聚合、乳液聚合等,其所具备的识别位点遍布聚合物基质[54-55],有利于小分子的吸收和释放,但这种方法不适合细菌印迹,细菌的尺寸为微米级别,在高度交联的基质中洗脱会受到阻碍或破坏[56],模板的去除毫无疑问是印迹膜制备的关键环节。基于此,印迹细菌主要是基于表面印迹的全细胞印迹法[19],其能将更多的印迹位点保留在印迹膜的表面,表面印迹又可以分为直接压印、间接印迹和电聚合等多种印迹方式。表2归纳了不同表面印迹方法的比较。

Table 2 Comparison of bacteria surface imprinting methods表2 细菌表面印迹法的比较
2.2.1 直接压印法
在细菌表面印迹中最简单方法是直接印迹[57],其可分为3种主要类型:邮票压印、薄膜压印和牺牲层印迹。邮票压印[51]方法简单方便,采用整个细胞作为模板,当细菌压印在预聚物的表面上时,预聚物必须足够柔软,以形成压印空腔。薄膜压印是随着细菌印迹的发展出现的,可用于印迹细胞[50]。牺牲层印迹法结合了表面压印去除模板容易和全细胞印迹能产生更多结合位点的优势,在样品和预聚物之间加入了可与形成聚合物共价结合的牺牲层,阻止样品和聚合物单体之间的反应,并引入新的官能团,该方法主要通过溶胶-凝胶工艺实现。
2.2.2 间接印迹法
对于细菌、细胞、病毒等表面结构较为复杂的靶标物,直接压印法效果往往并不理想。因此,更多采用包括子结构印迹法、人工模板印迹法和人工抗体法等间接印迹法[57]对这些复杂的靶标物进行处理。如针对细菌细胞表面的糖类[58]、蛋白质[59-61]等具有特异性的结构部分进行印迹,通过表面特异性结构片段的识别来检测细菌和细胞,或者通过印迹细菌细胞分泌的内毒素等特殊物质,间接确定细菌细胞的存在。
2.2.3 电聚合法
电聚合是指在模板存在的情况下,在电极/支撑衬底材料上形成印迹聚合物层的沉积过程[62]。电聚合可以通过伏安法[63]、恒电位法[64]和恒电流法[65]等多种电化学技术实现。其允许通过控制单体在电极表面反应的速度/扫描速率,调节电聚合周期、电位和电流等参数,制备得到不同厚度的聚合物印迹膜层。
3 基于BIP的细菌传感检测研究进展
3.1 电化学传感检测
以具有特异性捕获效能的BIP修饰的电极作为电化学传感界面,是一种新型的基于印迹技术对细菌进行高效检测方式。Idil 等[72]以N-甲基丙烯酰基-L- 组氨酸甲酯(N-methacryloyl-L-histidine methylester, MAH)、 甲 基 丙 烯 酸2- 羟 乙 酯(2-hydroxyethyl methacrylate,HEMA)为单体,乙二 醇 二 甲 基 丙 烯 酸 酯 (ethyleneglycol dimethacrylate,EGDMA)为交联剂,采用微接触印迹技术制备了大肠杆菌印迹膜修饰的金电极,这两种技术的独特组合使其能够选择性检测目标菌,当与已知具有相似形状的竞争细菌菌株共存时,能够区分大肠杆菌,检测限为70 CFU/ml。Jafari等[39]使用四乙氧基硅烷和(3-巯基丙基)三甲氧基硅烷制备的大肠杆菌UTI89印迹有机硅溶胶-凝胶膜,采用阻抗法检测,检测限低至1 CFU/ml。Wu等[46,73]研 制 的BIP 印 迹 膜,具 有 位 于 聚 吡 咯(polypyrrole,PPy)表面的非屈光性印迹位点,其更易于且可以预期增强传质和结合动力学,对大肠杆菌O157∶H7(E.coliO157∶H7)有高选择性,检测限为103CFU/ml,检测水平与常规基于BIP 的传感器相比更好,特别是能够具体鉴定细菌血清型,能够用于实际样品中E.coliO157∶H7的检测。
电聚合法近些年来逐渐成为了细菌印迹膜制备的热点,单体浓度、扫描次数等多种参数对其制备的影响是不可忽略的。Lahcen等[74]通过循环伏安法电聚合PPy制备炭疽芽孢杆菌孢子印迹聚合物功能化的碳糊电极,研究了超声波处理和带电荷的表面活性剂对模板去除的影响,优化了单体浓度、扫描次数、去除剂种类和浓度、孵育时间等参数对印迹膜制备的影响。为了克服印迹空洞明显受损和细菌细胞壁部分滞留的问题,Golabi 等[52]以表皮葡萄球菌为BIP 的模板菌, 3-氨基苯硼酸(aminobenzeneboronic acid,3-APBA)作为功能单体,制备了全细胞印迹膜(图3a),选择性研究表明,BIP 可以区分目标菌和形状相似的非目标细菌,与其他非靶细菌如蛋白水解链球菌、大肠杆菌和肺炎链球菌相比,该研究的阻抗传感器对表皮葡萄球菌具有高度特异性。

Fig. 3 Schematic diagram of the bacterial imprinting process for doping 3-APBA(a)[52] and scheme of the Escherichia colisensor(b)[68]图3 掺杂3-APBA的细菌印迹过程示意图(a)[52]和E.coli印迹传感器示意图(b)[68]
结合电化学传感检测技术,通过对电极表面的印迹膜材料进行掺杂和改性修饰,实现对电信号的放大,进一步提高细菌检测的灵敏度。Mugo等[68]使用聚苯胺(polyaniline,PANI)掺杂苯硼酸、多壁碳纳米管、纳米纤维素薄膜对电极表面多层修饰(图3b),采用电容和阻抗传感检测模式,对E.coli的 检 测 限 低 至(8.7±0.5) CFU/ml,响 应 时 间≤5 min。
研究显示,将BIP作为敏感界面,对其修饰改性,结合电聚合等制备方法在电极表面制备印迹膜,其可与安培法、电容法、阻抗法[75-76]等电化学传感检测方法结合,将BIP对细菌的吸附转化为电信号输出,实现快速、高选择、原位细菌检测。
3.2 石英晶体微天平传感检测
已有的研究表明,以具有特异性捕获效能的BIP 修饰石英晶体微天平(quartz crystal microbalance,QCM)的电极,电极表面印迹膜吸附或捕获细菌后质量变化而导致的谐振频率变化,可为细菌细胞的检测提供新的技术途径。检测时间的长短是细菌检测中急需解决的一个问题。Tokonami 等[44]在QCM 电极上制备了铜绿假单胞菌的PPy印迹膜,经过氧化处理,在PPy印迹膜中形状互补的空腔,形成过氧化PPy印迹膜(oPPy),采用双向电泳技术,在3 min 内检测到浓度为103CFU/ml的铜绿假单胞菌,在一定程度上解决了检测时间过长的缺点。Schnettelker等[66]通过沉降和邮票压印技术,直接在QCM表面上生成的大肠杆菌印迹层,也在3 min 内获得了细菌的响应信号,能够达到快速检测的目的。
基于BIP 的QCM 传感检测中,表面印迹的方法被广泛应用于制备细菌印迹膜,不仅能够获得很好的印迹位点,相对于全细胞印迹技术能够更好地清洗印迹膜表面的细菌,保留完整的印迹空腔。Seifner 等[50]采用表面印迹技术在QCM 电极上制备了对红细胞具有选择性识别位点的BIP,其显示出血液亚组之间的选择性,当暴露于模板血型时,A1红细胞印迹层产生40 kHz的效果,而A2红细胞在同一印迹层上仅产生该值的11%,细胞密度低至0.5×1011/L 时,仍可观察到千赫范围内的质量敏感效应。Yilmaz 等[77]利用微接触印迹技术,以MAH、HEMA 为单体,EGDMA 为交联剂,使大肠杆菌表面与修饰后的金表面形成三明治结构,制备E.coli的BIP 获得与天然抗体相似的识别能力(图4)。对于表面印迹材料的研究,Spieker 等[67]采用沉降法和邮票压印法,获得蜡样芽孢杆菌的BIP,实验筛选了聚苯乙烯(polystyrene,PS)、聚丙烯酸酯(polyacrylate,PA)、聚乙烯吡咯烷酮(polyvinyl pyrrolidone, PVP)、 聚 丙 烯 酰 胺(polyacrylamide,PAA)和PU 五种聚合物,发现PU和PAA对蜡样芽胞杆菌的亲和力最高。
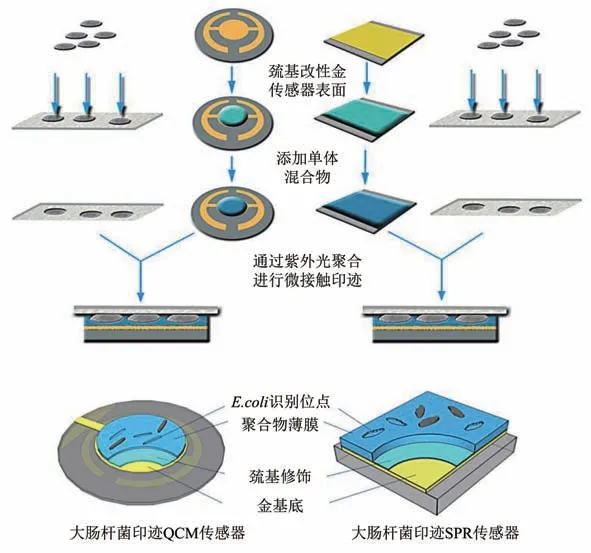
Fig. 4 Schematic diagram of microcontact imprinted SPR and QCM sensor surfaces[77]图4 微接触印迹法制备SPR和QCM传感表面的示意图[77]
可以看到,基于BIP和抗体相近的特异性识别性能,表面印迹法的应用,将诸如双向电泳等电场技术应用于表面带电的细菌的检测,结合QCM 传感监测能实现极低的质量变化监测优势[78-79],对细菌细胞的快速、特异性和高灵敏检测具有很大的发展潜力。
3.3 荧光传感检测
在荧光传感检测中,量子点(quantum dots,QDs)作为一种吸收光谱宽、发射光谱窄且可调谐的半导体纳米晶体,具有良好的光致发光性能[80]。其既可以作为荧光信号源,又可以作为与生物分子结合的多功能支持物。量子点独特的光学性能和BIP 的特异性识别结合,为细菌检测提供了一种新型荧光检测方式。Chen 等[53]在电极表面直接电聚合制备E.coliO157∶H7 的聚多巴胺(polydopamine,PDA)印迹膜,构建了电化学发光(ECL)传感器(图5)。将E.coliO157∶H7 多克隆抗体(pAb) 用氮掺杂石墨烯量子点(N-GQDs)标记,BIP-E.coliO157∶H7 和pAb-NGQDs的生物结合在K2S2O8的作用下,可以产生强烈的ECL,检测限为8 CFU/ml,测试的线性响应范围为101~107CFU/ml。这种基于N-GQDs 的ECL分析方法,对E.coliO157∶H7 具有高选择性(记录了添加沙门氏菌的ECL信号作为比较),成功应用于水样检测。
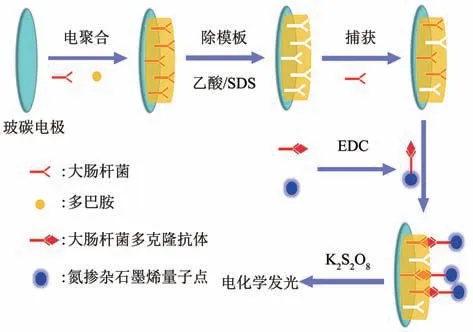
Fig. 5 Schematic diagram of the fabrication procedure of the BIP and the detection process[53]图5 BIP制作和检测过程示意图[53]
将荧光的方法应用于实际样品的检测是一种更加简便的方法,能够简化检测的预处理过程。Zhao 等[81]以 整 个 单 核 细 胞 增 生 李 斯 特 菌(L. monocytogenes)为模板,采用水包油Pickering乳液聚合法,合成了包含水溶性CdTe QDs 的BIP微球,在嵌入CdTe QDs的微球表面产生识别位点。在靶标菌存在下,可直接通过荧光猝灭进行视觉荧光检测,对牛奶和猪肉样品中的L. monocytogenes进行定性检测。Bezdekova 等[82]采用金黄色葡萄球菌磁性BIP对患有乳腺炎的奶牛的原料奶、健康奶牛的牛奶、熟米饭和非液体食品样品进行荧光检测,检测限为1×103CFU/ml,这对应于欧盟立法中对食品微生物控制设定的限制。
将BIP和量子点耦合到一个系统中产生了一种新型的荧光传感器,不仅使细菌印迹成为可能,简化细菌检测的前处理过程,而且还提高了细菌识别的特异性和细菌检测的灵敏度。
上述不同的传感检测方式其检测原理各有不同,在应用中需要依据实际测试的需求进行选择,表3给出了不同传感检测方法的简单比较。

Table 3 Comparison of three sensing detection methods表3 三种传感检测方法的优缺点
3.4 集成BIP传感监测模式的微流控芯片分析技术
微流控芯片分析技术已经在化学[83]、细胞分析[84]和临床诊断[85]、生物医学及即时检测[86](point-of-care testing,POCT)等领域中获得广泛应用。本课题组长期开展基于微流控芯片的细菌传感检测研究,研制了多种不同类型的集成微流控细菌传感芯片[10,87-88],针对肉类、牛奶、自来水等样本中金黄色葡萄球菌、大肠杆菌等的检测开展了大量研究,发现选择性捕获和采集样本中细菌并通过光电信号予以展示是实现高效检测的关键环节。将BIP与微流控芯片有机结合,构建设计细菌检测的传感芯片,对于检测过程中的多个环节以及功能化具有重大的意义,可实现更宽范围和更高灵敏度的细菌检测,必将为细菌的高效检测提供新的技术途径。
Birnbaumer 等[27]以烟草花叶病毒(TMV)和人鼻病毒2 血清型(HRV2)为模板,在微流控芯片检测区通过NVP和MAA共聚物表面压印获得了印迹膜,采用4 个非接触式叉指电容器(μIDC)与集成到2个微流控通道网络中印迹聚合物的新颖组合构建了具有高灵敏度和高选择性的非接触微传感芯片,可创建无噪音检测环境,实现了病毒污染情况的连续监测。在5~500 kHz 的应用频率范围内,获得最佳传感器的表现在203 kHz。在流体流速增加50 倍后,能够完全清除BIP 上的病毒并证明了设备的可重用性。Bao 等[89]利用表达绿色荧光蛋白的大肠杆菌作为模板,通过细菌模板表面引发的原子转移自由基聚合(SI-ATRP)来印记细菌表面电荷的异质性,选择了两个单体作为构筑基团,一种是甲基丙烯酰氧乙基三甲基氯化铵,这是一种永久性阳离子单体,能够在带负电荷的细菌外表面自组装,另一种是两性离子单体3-二甲基(甲基丙烯酰氧乙基)丙磺酸铵,用两性离子单体填充识别位点之间的空隙可以抑制非特异性细菌在所生成BIP膜上的附着,从而提高细菌的选择性;使用单细胞力谱量化了单个细菌细胞和BIP之间的黏附力。将细菌识别与EIS 的耦合,两电极体系(BIP接枝金电极和对电极)连接到电化学工作站(图6a),这种基于微流控芯片BIP 膜的检测限低于一些基于生物受体的传感器,竞争性细菌识别和EIS测试的结果表明,BIP 膜仍表现出良好的细菌选择性。

Fig. 6 Schematic diagram of EIS-BIP coupling system and microfluidic chip(a)[89];schematic representation of the TWTA setup(b)[51]图6 EIS-BIP耦合系统和微流控芯片(a)[89]以及TWTA设计示意图(b)[51]
通过调节传感检测、流体控制等方式,可以在更大的范围内、更高灵敏度的条件下检测细菌细胞,达到实际应用的目标。Redeker 等[51]采用表面印迹的方法在铝片表面制得基于PU材料的BIP,作为合成的“细菌受体”,与热波转运分析(thermal wave transport analysis,TWTA)结合(图6b),可分析通过功能界面的热波传播,较之前使用的传热法(heat-transfer method,HTM)灵敏度至少提高了2倍。实验将3 ml细菌悬浮液以2.5 ml/min的流速通过传感界面进行测试,对9种细菌进行了分析。最后还提供了首次应用的证据,能够检测加标尿液样本中临床相关浓度低至3×104CFU/ml 的细菌,证明了该传感器在尿样中的性能。
4 总结与展望
基于BIP细菌传感检测方法的研究和应用对细菌的高效检测具有重要意义。其中敏感膜材料的设计和效能,很大程度上决定了细菌传感检测的优劣,研制高灵敏度和高选择性的敏感膜是细菌传感检测的一个重要研究方向。近年来MIT 在细菌检测方面显示出良好的发展潜力和应用前景,表面印迹的方法毫无疑问已经成为印迹制备的主流方向,但如何解释细菌与印迹腔的特异性结合是有效应用的必要条件,如何去除模板获得完整有效的印迹空腔是重中之重,如何选择印迹材料以及印迹材料的修饰改性是优化印迹膜效能的重要环节,如何将印迹膜、传感检测手段和微流控芯片有机地结合起来是实现其应用的关键。这些挑战也为基于BIP的细菌检测带来了更好的前景。随着发展不断提高BIP的稳定性、选择性和灵敏度,这不仅有助于细菌细胞分析、病毒疾病治疗和POCT等方面的应用,也极大地丰富了MIT的研究内涵。
