海洋微藻碳酸酐酶研究进展
2023-06-13陈曦贝石哲萱王宏伟
林 昕,陈曦贝,石哲萱,王宏伟
(1.厦门大学海洋与地球学院,近海海洋环境科学国家重点实验室,厦门市海湾生态保护与修复重点实验室,福建 厦门 361102;2.重庆市九龙坡区生态环境局,重庆 400050)
光合生物通过光合固碳过程,吸收CO2和H2O,产生有机物并释放O2,提供地球上几乎所有生命赖以生存的物质和能量,重要意义不言而喻.碳酸酐酶(CA;EC 4.2.1.1)是碳浓缩机制(CCM)的关键酶,能有效催化HCO3-与CO2间的可逆转换,是决定光合固碳效率的重要因素,也是深入了解藻类光合固碳机制必不可少的关键环节.CA基因家族具有复杂的遗传多样性,体现为不同的类型、亚细胞分布和功能多样性.随着近年来对多种模式微藻光合固碳过程认识的逐步加深,藻类中不同类型CA的亚细胞分布和功能研究屡见突破性进展.本文综述CA的类型、分布及基因家族多样性,阐述其在不同微藻光合固碳中的作用,进而对其在生态系统碳循环过程中的重要意义及其应用转化前景展开讨论.
1 海洋藻类的光合固碳与CCM
海洋中的光合藻类是地球上重要的初级生产者,通过光合作用贡献了海洋初级生产力的95%[1]和全球初级生产力的46%[2],在全球的碳循环和生态平衡过程中扮演着重要角色.光合固碳由一系列复杂的生化反应组成,固碳效率受多种因素制约,其中有两个关键因子起着不可忽视的作用,分别是光合作用卡尔文循环中的关键酶——捕获CO2执行同化反应的核酮糖-1,5-二磷酸羧化酶/加氧酶(RuBisCO),及其同化反应所在微空间内底物CO2的浓度.
RuBisCO的特性是它能同时执行双向催化反应——“光合固碳”与“光合呼吸”.前者进行羧化反应,底物CO2被同化;后者进行氧化反应,O2成为竞争底物.氧化反应形成的磷酸乙醇酸会抑制RuBisCO羧化反应效率,因此羧化反应效率极低[3].RuBisCO氧化反应的竞争使得一些植物固定CO2的量仅占RuBisCO单独进行羧化反应时的55%[4].
已知自然界中存在3种类型的RuBisCO,结构各不相同,催化效率和底物亲和力也存在差异.高等植物和绿藻、硅藻、蓝藻等藻类均含有Ⅰ型RuBisCO[5];大部分甲藻均采用Ⅱ型RuBisCO进行碳同化,对CO2和O2分子的特异性识别能力明显低于Ⅰ型RuBisCO[6];Ⅲ型RuBisCO迄今只在古菌中发现;此外,在一些细菌中还发现了RuBisCO类似蛋白,归为Ⅳ型RuBisCO,但已有研究显示它们的催化功能可能与甲硫氨酸循环、硫代谢和芹菜糖分解代谢有关[7-8].
CO2是RuBisCO羧化反应的底物,其浓度很大程度上影响同化速率,进而影响光合效率.在海洋环境中无机碳总量较为丰富,约2.2 mmol/L,但99%以上的无机碳以HCO3-的形式存在[9],海洋中CO2浓度几乎不会超过25 μmol/L[10].由于RuBisCO羧化反应的低效性和固碳反应底物CO2浓度的限制,光合生物演化出CCM[11],通过吸收环境中的无机碳,调控胞内无机碳形式及其转运,借助分布于不同亚细胞位点的转运蛋白以及CA实现RuBisCO周围CO2的富集,提高光合效率.CCM广泛分布于多个物种,从单细胞的蓝藻、硅藻等微藻[5]到紫菜[12]等大型藻类,此外以珊瑚为代表的海洋无脊椎动物中也发现存在CCM[13].
C4代谢和景天酸代谢(CAM)是最早详细报道的CCM[14],二者以生物化学泵的方式通过物质转换实现碳浓缩过程.藻类CCM的报道多存在于大型藻类[12,15],也有报道发现绿藻中的钙扇藻(Udoteaflabellum)[16]和硅藻中的威氏海链藻(Thalassiosiraweissflogii)[17]具有C4代谢途径.大多数藻类的固碳机制属于C3类型,通过生物物理泵和化学泵结合的方式使CO2在RuBisCO周围富集以实现碳浓缩.
2 CA的功能及其多样性
2.1 CA及其催化功能
CA是光合藻类CCM的重要组成部分,能快速催化HCO3-与CO2的相互转化,促进无机碳在细胞内的跨膜运输,最终在RuBisCO周围富集CO2[5,18].CA催化的可逆反应参与羧化反应、酸碱平衡、离子交换、脂肪合成、糖原异生等一系列生理生化过程,有着重要的生理意义[19-20].CA在催化HCO3-和CO2互相转化时,催化活性域两侧各有一个疏水腔和亲水腔,疏水腔的氨基酸残基能捕获CO2分子,亲水腔的氨基酸残基结合HCO3-,保证可逆反应进行[20].
作为一种金属酶,几乎所有已知的CA都以特定的氨基酸残基与金属离子结合而表现活性.与CA结合的金属离子以锌(Zn)最为常见,也有镉(Cd)、钴(Co)和铁(Fe)[20].以人类的HCAⅡ为例,其高效催化效率[Kcat/Km为108L/(mol·s),每秒转换1.4×106个底物分子][21-22]依赖酶活性中心的Zn2+以及与之连接的氨基酸对水分子的解离作用[23],而与金属离子相连氨基酸的改变会削弱小鼠中CA的催化活性[24].因此,金属离子结合域是CA抑制剂和激活剂的作用位点,常见的CA抑制剂磺胺类药物及其异位化合物就是通过磺胺基团(SO2NH-)替代水分子或OH-与金属离子结合,抑制CA活性.目前也发现了其他原理的抑制剂,但均作用于活性区域,比如锚定与金属离子结合的配位基团或封闭活性位点[20].
2.2 CA的类型
自1933年确定血液中CA的存在以来[25],动物、植物、藻类以及细菌中陆续发现CA[26-29](表1),按照被发现的顺序以希腊字母α~ι命名.不同类型CA的氨基酸序列存在明显差异,功能也不尽相同.
2.2.1 α-CA
α-CA是最早发现的CA[25],研究也最为广泛,在动物、植物、藻类和细菌中均存在.根据序列相似性,α-CA又可以划分为两类:一类主要分布于高等植物、藻类,另一类存在于动物、细菌以及病毒中.
2.2.2 β-CA
1936年在植物中发现了新的CA[33],但直到1939年其活性才经实验证实[34].根据序列差异程度,β-CA可分为6种亚型.2004年在蓝藻中发现一种新的CA,命名为ε-CA,它不仅起催化作用还是蓝藻羧酶体结构组成的一种辅助蛋白,而进一步的晶体结构分析证实ε-CA是β-CA蛋白家族的一种新亚型,因此该名称后续并未再使用[34-36].在莱茵衣藻(Chlamydomonasreinhardtii)中,限制性CO2诱导蛋白B/C(LCIB/LCIC)复合体能够捕获叶绿体蛋白核中溢出的CO2并以HCO3-的形式运输回蛋白核中,其中LCIB基因编码的也是一种β-CA,位于叶绿体基质中,环绕蛋白核,在CCM中起重要作用[37].
2.2.3 γ-CA
γ-CA最初发现于古菌甲烷八叠球菌(Methanosarcinathermophila)[35],后来在植物和光合细菌中也陆续发现γ-CA[38-39].在部分藻类和其他植物细胞中鉴定到的γ-CA为线粒体电子传递链中复合物Ⅰ的组成部分,并不具有催化功能,推测其参与线粒体与叶绿体间CO2的传送过程[4],但具体功能仍有待进一步研究[40].
2.2.4 δ-CA
1997年在硅藻威氏海链藻中鉴定到δ-CA[41],迄今仅在藻类中报道发现此类型CA.δ-CA氨基酸序列与之前发现的CA差别很大,但其预测的二级结构和三级结构域均与α-CA相似[42].X射线吸收光谱法对δ-CA活性位点的研究进一步验证了上述结论[43],同时δ-CA与α-CA类似,具有酯酶活性[44].此外,δ-CA活性位点处也可结合Co2+,被认为是藻类适应低锌浓度环境的生存策略[45].γ-CA和δ-CA的活性位点均与α-CA类似,但结合的金属离子有所差异.
2.2.5 ζ-CA
最初认为ζ-CA仅分布于海洋原生生物中,随后在威氏海链藻中发现了ζ-CA,命名为CDCA1[46].除Zn2+和Co2+外,ζ-CA也结合其他金属离子,最常见的是Cd2+[47].其氨基酸序列与其他类型CA差异很大,但活性位点结构与β-CA类似[45].δ-CA、ζ-CA分别与α-CA、β-CA的活性位点结构存在相似性,这被认为是趋同进化的结果[32].
2.2.6 θ-CA
θ-CA是一类新鉴定的CA,目前仅在硅藻、绿藻、蓝藻等藻类中被发现[48].在硅藻三角褐指藻(Phaeodactylumtricornutum)中,已证实类囊体中的基因Pt43233编码一种θ-CA,其功能是催化类囊体中的HCO3-转化为CO2以供光合作用.
2.2.7 ι-CA
2019年在硅藻假微型海链藻(T.pseudonana)的基因组中首次发现ι-CA[49].与其他CA不同的是,在ι-CA结构中未发现金属离子的存在,但有研究指出Zn2+可引起ι-CA活性改变,这表明在ι-CA中金属离子行使的可能不是催化功能,而是结构功能[50].
2.3 藻类CA的多样性
CA在光合生物CCM中起着重要作用.在已报道的8大类CA中,目前在藻类中已发现7种,且不同类群拥有不同的类型,呈现复杂的多样性,包括活性位点氨基酸残基和金属辅因子、蛋白结构,以及亚细胞分布3个方面(表2)[5,18,32,49-50].
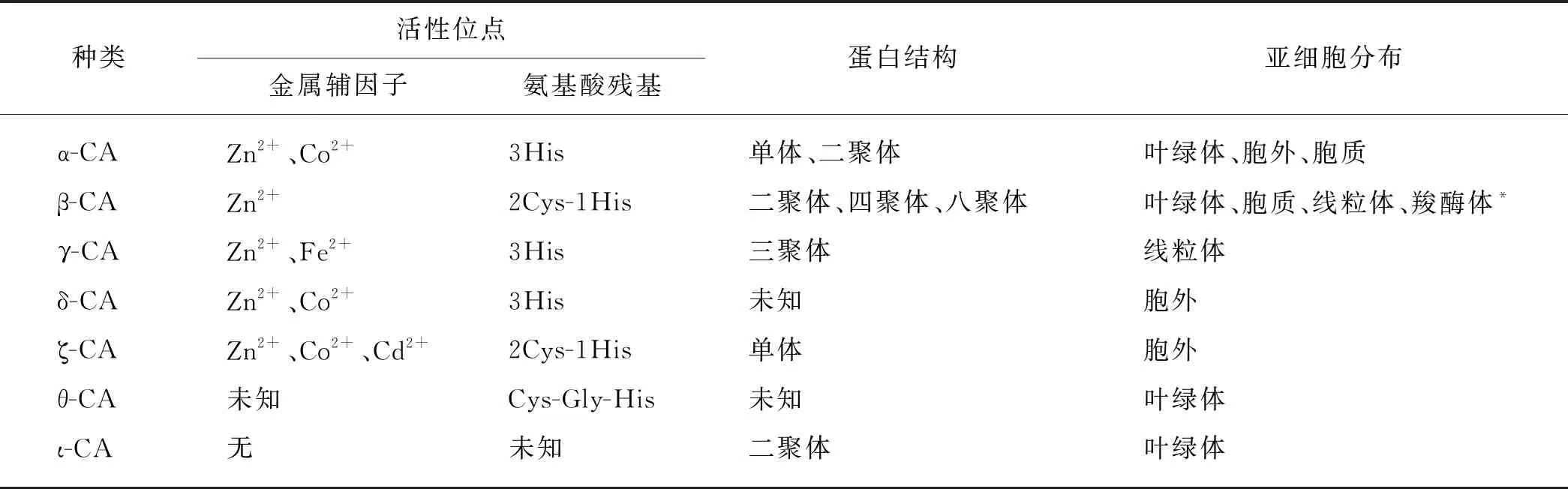
表2 藻类中不同类型CA的活性位点、蛋白结构、亚细胞分布
1992年聚球藻SynechococcusPCC7942中发现在固碳过程中起重要作用的β-CA,与高等植物叶绿体CA的蛋白序列相似度约20%,随后又在蓝藻中陆续发现了α-CA和γ-CA[28,35,51-52].随着基因组学研究的发展,近年来在绿藻的青绿藻(Ostreococcuslucimarinus)[53]和小球藻(Chlorellasp. NC64A)[54]、红藻的紫球藻(Porphyridiumpurpureum)[55],以及硅藻的三角褐指藻和假微型海链藻[56-58]的基因组分析中均鉴定到不同类型的CA.
已知不同类型的CA广泛分布于不同藻类中,同一藻类中存在不同类型的CA,数目也不同,这与不同类型CA的功能差异以及不同藻细胞的生境有关(表3).即使是藻类中同一类型的CA,功能也不尽相同.如莱茵衣藻中,同样分布在叶绿体的CAH3和CAH6同为β-CA,但它们对磺胺类抑制剂的敏感性相差100倍,蛋白功能也存在差异[68].藻类中同一类型的CA也存在不同亚型,其分子特征、蛋白结构以及亚细胞分布和功能均有差异[10].同时不同类型的CA在不同藻类中可能执行相同功能,如莱茵衣藻中由α-CA实现HCO3-和CO2的转化,而三角褐指藻中θ-CA也能行使这一功能[32].
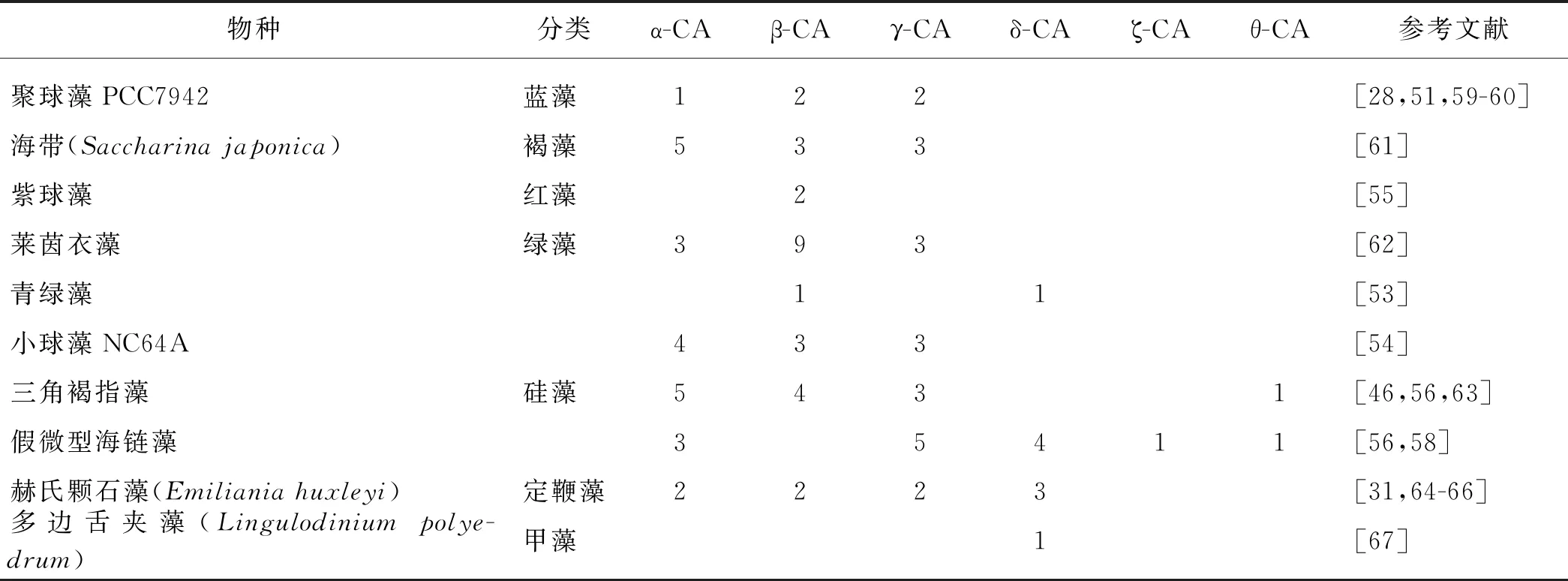
表3 部分藻类中的CA分布
3 微藻模式种的CA与CCM
在不同光合藻类中,光合质体内共生过程造成细胞中光合质体膜结构有所不同[69](图1),参与无机碳输送的转运蛋白在不同种类的各级膜结构上分布不同,进而使得CA的类型与分布呈现多样性,这是构成藻类CCM复杂特质的重要生物学基础.虽然研究人员对于CA的催化活性早有认识,但是对于多种类型CA在各类群CCM中的具体作用尚未完全阐明,目前仅对个别微藻模式种有较为深入的了解,下文对具有不同光合质体的典型微藻CCM及CA在其中的作用进行概述.
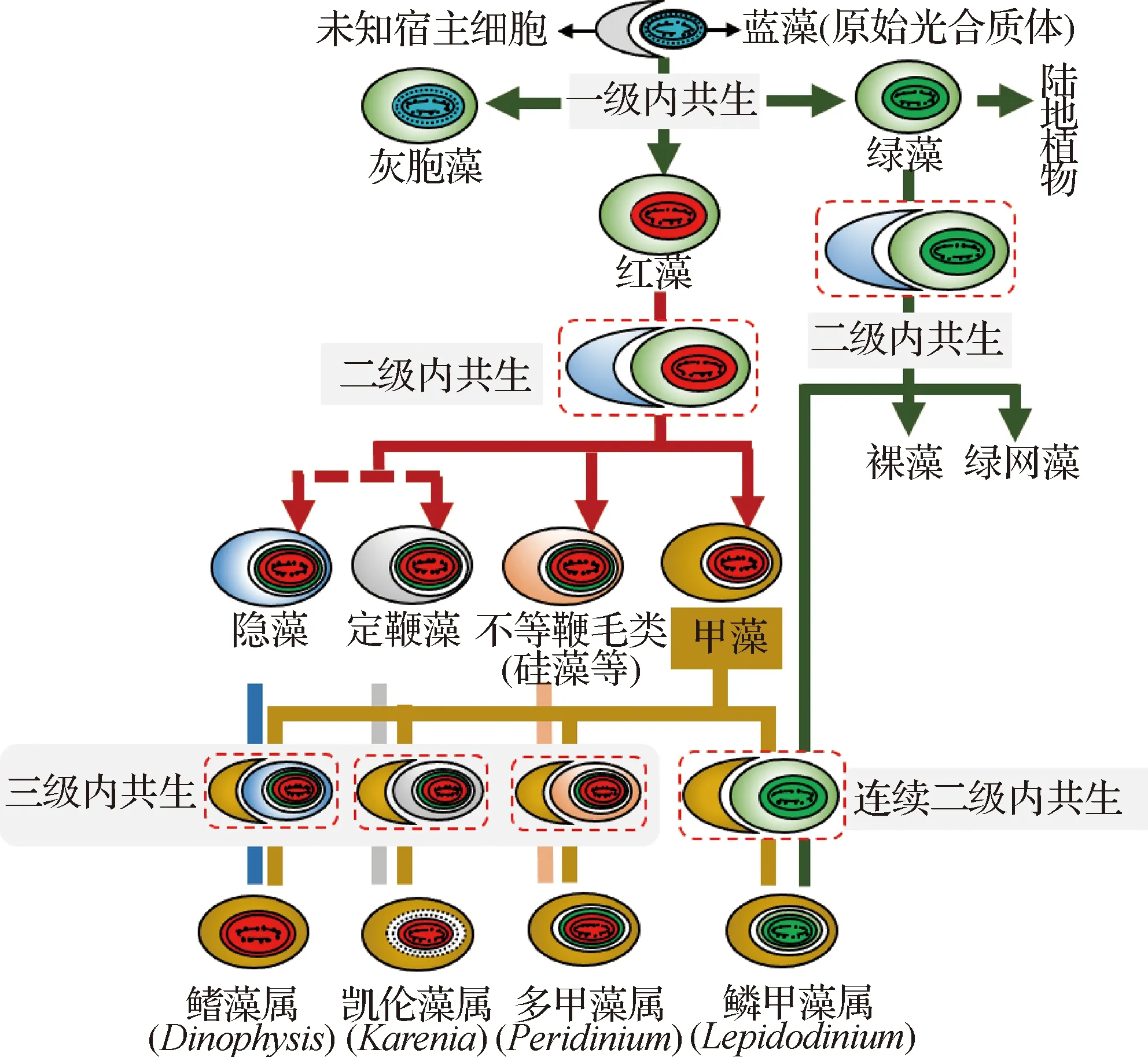
红色虚线框为各级内共生的过程,粗红色虚线(中左侧)表示该内共生过程尚存在争议;红色光合质体起源于红藻,绿色光合质体起源于绿藻;光合质体中的实线表示已证实存在的膜结构,虚线表示尚未证实的膜结构.图1 藻类光合质体内共生演化示意图(参照文献[69]绘制,有修改)Fig.1 Schematic depicting the endosymbiotic events of plastid (modified from Ref.[69])
3.1 蓝藻(原始光合质体)
蓝藻早在20亿年前就已出现[70],为原核生物,拥有最原始的光合固碳系统,不具光合质体,由类囊体执行光合作用.蓝藻CCM通过无机碳转运系统将胞外无机碳运输进细胞,最后在含有RuBisCO的微室(羧酶体)实现羧化反应(图2)[5,71].无机碳通过多种方式跨越细胞质膜和类囊体膜,CO2通过自由扩散,而HCO3-通过转运系统穿过质膜.质膜上HCO3-的转运蛋白包括与Na+同向转运的低亲和力转运蛋白和低CO2胁迫诱导下表达的高亲和力蛋白,其中后者需消耗ATP完成转运.ε-CA(β-CA的亚型)不仅作为羧酶体的结构组成蛋白分布于类囊体中,同时催化HCO3-转化为CO2,促使羧酶体中的RuBisCO执行光合固碳反应;而同为羧酶体组装蛋白的γ-CA和CcmM不具催化活性[5].此外在羧酶体中还鉴定到具有催化活性的β-CA——CcaA和CsoSCA,同样为羧酶体组装蛋白[52].
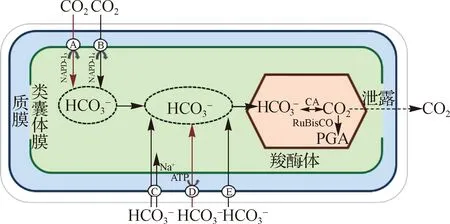
A、D、E为高亲和力转运系统,B、C为低亲和力转运系统;NADP为氧化型铺酶Ⅱ,ATP为三磷酸腺苷.图2 蓝藻CCM示意图(参照文献[5,71]绘制,有修改) Fig.2 Schematic diagram of CCM in cyanobacteria (modified from Ref.[5,71])
3.2 绿藻(一次内共生)
真核藻类中CCM最早报道于绿藻[72].与蓝藻不同,绿藻作为真核生物,叶绿体、线粒体等细胞器都参与碳浓缩过程,以莱茵衣藻作为模式种,其CCM的研究最为深入(图3)[73-74].真核生物叶绿体中有功能类似于蓝藻羧酶体的结构——蛋白核,富集RuBisCO和CA以实现最大化羧化反应效率.莱茵衣藻中存在多种类型CA,包括3种α-CA、9种β-CA和3种γ-CA[62,75].莱茵衣藻细胞外间质中有多种CA[76],质膜上还具有无机碳转运系统用来转运HCO3-,胞质中的无机碳则通过叶绿体膜上的转运系统进入质体内[77].莱茵衣藻的一种β-CA(CAH6)分布于细胞鞭毛上,作用可能为感应外界无机碳浓度;而另一种α-CA(CAH3)分布于贯穿蛋白核的类囊体中,承担最终富集生成CO2供给RuBisCO的任务[74,78].此外,在莱茵衣藻线粒体中发现了2种β-CA和3种γ-CA[75,79-80],它们对CCM的贡献尚需进一步验证.
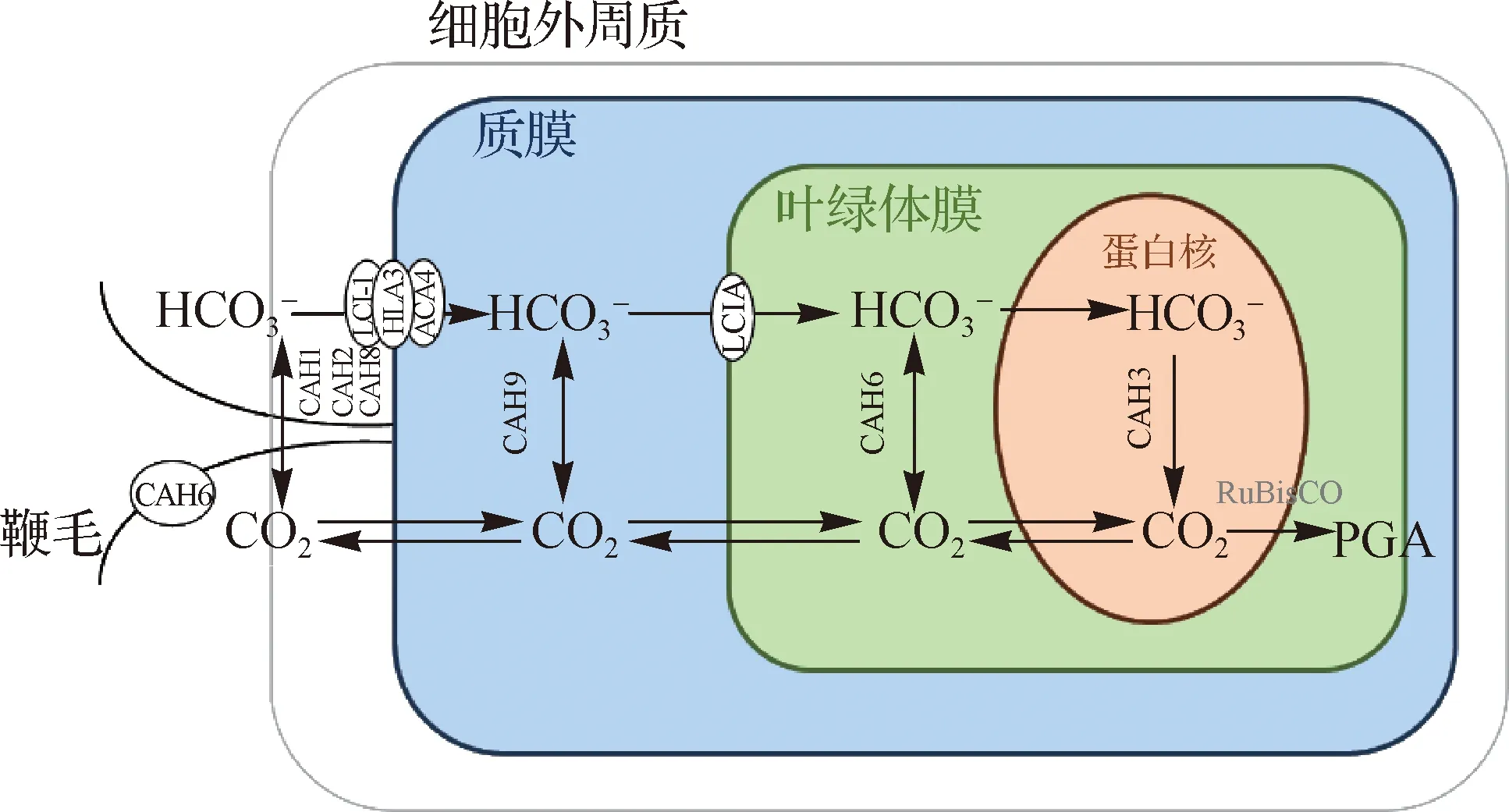
HLA3.高光激活蛋白3;ACA4.自抑制Ca2+依赖性腺苷三磷酸酶4;LCI1.质膜无机碳转运蛋白.图3 莱茵衣藻CCM示意图(参照文献[73-74]绘制,有修改)Fig.3 Schematic diagram of CCM in C.reinhardtii (modified from Ref.[73-74])
3.3 硅藻(二次内共生)
硅藻是分布最广泛的初级生产者,其光合质体经历了二次内共生后具有4层膜结构(图1),包括2层叶绿体-内质网膜(CER)以及2层叶绿体被膜(CEV),因此硅藻的CCM研究极具挑战性.目前三角褐指藻和假微型海链藻中不同CA的亚细胞分布研究较为清晰(图4)[10],CA在两种硅藻中参与逐步输送无机碳,最终将其富集于RuBisCO周围的过程,但是两者胞内CA的类型和亚细胞分布存在明显差异,表明两者采用的策略可能存在差异[10,48];同时在两种硅藻的线粒体中均发现CA,但其具体功能尚不清楚,有待进一步研究[9,48]
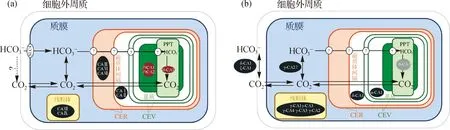
红色椭圆中的CA定位和活性均已证实;黑色椭圆中的CA定位已被证实,但尚未证实活性;灰色椭圆中的CA来自基因组数据,尚未验证定位和活性;PPT为穿透蛋白核的类囊体;SLC4为溶质转运蛋白4.图4 三角褐指藻(a)和假微型海链藻(b)中不同类型CA的亚细胞分布(参照文献[74]绘制,有修改)Fig.4 Subcellular localization of different types of CA in P.tricornutum (a) and T.pseudonana (b) (modified from Ref.[74])
目前三角褐指藻中仅β-CA和θ-CA已明确催化活性,其中θ-CA与绿藻的α-CA相似,位于PPT腔中,在RuBisCO周围富集CO2,表明在真核藻类中不同类型的CA在功能上存在趋同进化[32].假微型海链藻中δ-CA和ζ-CA分布于细胞外周质空间,其催化活性已在同属的威氏海链藻中被证实.最新研究发现假微型海链藻基因组中存在θ-CA的新亚型,序列分析显示其含有叶绿体和类囊体的结合区[58].
除上述模式种外,近年来借助于组学技术的发展,其他藻类CA的研究也有所突破.与硅藻同属不等鞭毛类的微拟球藻(Nannochloropsisoceanica)光合质体结构不具有蛋白核,其CCM的必需α-CA(CAH1)分布于光合质体4层膜中最外层的内腔,催化HCO3-向CO2的转化[81].红藻条斑紫菜(Pyropiayezoensis)的无机碳利用研究表明,其CA家族扩张,含α-CA、β-CA、γ-CA这3种类型,其中α-CA在基因组中含有最多基因拷贝数及多种亚型,分布于胞外的α-CA亚型可促进甲壳HCO3-释放,是其获取无机碳的一个来源[82].
4 环境因子对藻类CA表达及活性的影响
藻类的CA表达水平及CCM的活性水平受环境因子调控,无机碳是最直接的影响因素[83].在低CO2浓度下绿藻胞外CA表达显著上升,而在高CO2浓度下CA表达均有下降[84].当外界CO2浓度足够高时,有些藻类的CA会完全不表达[5].有趣的是,CO2浓度升高并不会导致所有CA表达下降,有些CA表达甚至上升,反之亦然,CO2浓度下降也伴随着某些CA表达下降[75],这与不同类型CA在藻细胞中的不同功能有关[27,58,75].除CO2外,HCO3-也是影响CA活性的重要无机碳形式.随着HCO3-浓度的升高,绿藻的寡枝刚毛藻(Cladophoraoligoclora)的CA活性呈现先降低后升高的趋势:浓度升高起始,藻体获得的无机碳供给较充足,不需要过度依赖CCM来获取CO2,因此CA活性下降;但当浓度过高,藻体快速生长,使无机碳源耗竭,从而诱导CA表达升高[85-86].
温度、光强和痕量金属等因素也会影响CA的表达和 CCM 效率[5,87].温度升高通过抑制CCM可以限制藻类光合固碳[88],光强也会对莱茵衣藻的CA表达以及三角褐指藻的CA活性造成影响[89-90].威氏海链藻中的δ-CA(TwCA1)表达水平不仅受外界CO2浓度影响,也受痕量金属影响,这与大部分CA必须结合金属离子才能发挥活性有关;此外,TwCA1表达还存在昼夜差异,夜间表达量更低[45].
赫氏颗石藻因其独特的钙化功能,成为研究全球变化与海洋碳循环的经典模式微藻.在北太平洋ALOHA观测站的原位营养盐添加培养实验中,相较于磷营养盐,不同类型CA基因的转录本在添加氮营养盐时呈现更显著的富集和上调表达[65];而当环境参数的双因子和多因子发生变化时,其CA基因的表达模式更为复杂.以2100年情景(低营养盐、高光、升温和酸化)模拟开展多重环境因子变化的培养实验,结果显示在双因子和多因子变化实验中,赫氏颗石藻中分布在细胞膜上的δ-CA基因表达均显著下调,而细胞内的γ-CA基因在不同实验中均维持相对稳定的表达,同样分布在细胞内的α-CA基因在不同双因子和多因子变化实验中的表达趋势各不相同[66].
5 藻类CA未来研究展望
CA在自然界广泛存在,其结构与功能多样性是藻类CCM的重要生物学基础,也是厘清藻类光合固碳机制的关键环节.尽管对于部分藻类模式种CA的类型和功能差异有所认知[74],但CA研究仍然有待学者进一步探究,下文从4个方面对未来研究展开讨论.
5.1 藻类CA及CCM对海水升温与酸化的响应机制
在海洋生态系统中,光合固碳的微型藻类是全球变化的重要响应者,作为初级生产者对海洋生态系统的服务功能有着深远的影响.目前藻类CA的研究多聚焦于其生物学本质问题,而在生态学视角下对其如何响应海水升温和酸化的科学认识仍然十分缺乏.
颗石藻与硅藻因具有“压舱”效应,是生物泵与海洋碳循环研究中常见模式物种.在上述赫氏颗石藻双因子和多因子模拟全球变化的培养实验中,高CO2浓度和其他环境因子会对细胞表面δ-CA基因表达产生协同负效应,进一步影响细胞的生长速率[66,91].研究表明在高CO2浓度培养多代后,硅藻三角褐指藻可通过调控线粒体中的碳通量以应对海洋酸化,但来源于不同海域的三角褐指藻不同株系调整碳通量的代谢通路各不相同,在酸化条件下不同株系的CA基因表达情况也有所差异,表明在驱动硅藻对海洋酸化的适应过程中环境适应性特征可能扮演着重要角色[92].因此有必要以生态学视角,探究不同藻类在海水升温和酸化条件下CA及CCM的响应机制,从而进一步了解全球变化对海洋初级生产力以及碳的生物地球化学循环过程的影响.
5.2 珊瑚礁生态系统中共生藻CA的多样性与生理生态功能
与刺胞类动物共生的甲藻虫黄藻(Symbiodiniaceae)是珊瑚礁生态系统中必不可少的初级生产者,可从宿主获取无机碳进行光合作用,并将光合产物有机碳化合物回馈宿主,二者的互利共生构成了珊瑚礁生态系统的营养基础[93].珊瑚宿主与虫黄藻配对组成的多样性对于珊瑚礁生态系统功能有着重要的影响,诸如生长速度、光合固碳效率与光合产物的运输交换以及环境适应性等.
虫黄藻所属的甲藻,其光合质体内共生演化历史更加复杂多样(图1).包括虫黄藻在内的大部分甲藻具有Ⅱ型RuBisCO,对CO2和O2分子的识别能力更低[6],因此推测甲藻更依赖CCM运转以确保固碳效率.与绿藻和硅藻等模式藻类相比,受限于庞大的基因组[94-95],过往关于甲藻CA与CCM的认识仅限于个别种类的初步研究[67,96-97].随着高通量测序的广泛应用,虫黄藻科中现有5个属的7个种已完成基因组测序[98-103],并在环境样品中发现甲藻CA基因转录本的活跃表达[104-106],这为探讨甲藻CA基因家族的多样性,探索其光合固碳及碳浓缩过程的分子机制提供了有力支撑.
本课题组在研究中发现,与硅藻和绿藻相比,虫黄藻基因组中CA基因家族显著扩张,HCO3-转运蛋白显著富集,这一遗传适应性特征说明无机碳的输运对其生长至关重要[99].有研究报道珊瑚体内共生藻混合体的CA具有高活性,且在不同珊瑚种类及不同虫黄藻中存在差异[107].当受到环境胁迫时,共生体中会出现碳限制,并衍生到光氧化损伤破坏共生[108-110];而在一些适应高温环境的珊瑚中,虫黄藻可以传递更多的有机碳给宿主进行协同抗逆[110].
虫黄藻与宿主之间的“碳-碳”物质交换构成了珊瑚生态系统物质流动和能量循环的营养基石,具有重要生态意义.虫黄藻中CA的多样性与亚细胞分布决定其从宿主中获取和运送无机碳的能力,进而影响光合固碳、共生关系的建立与稳定,亟需开展进一步的鉴定、类型分析及相应的生理功能研究.在未来的工作中,建议将虫黄藻作为甲藻的模式物种开展CA类型鉴定、亚细胞分布、酶活性和CCM的研究,这不仅在理论上有助于厘清甲藻光合固碳的细胞生物学机制,而且对于深入解析珊瑚-虫黄藻共生体形成和维持的分子机制具有重要科学意义.
5.3 开放大洋环境中金属离子共限制对CA的影响
CA作为一种金属酶,需要结合金属辅因子发挥催化活性.CA结合的金属辅因子以Zn2+最为常见,也有Cd2+、Co2+和Fe2+等.在北太平洋表层海水中Zn2+浓度不到2 pmol/L[111],大洋环境中Zn2+常处于限制状态,CA与其他金属离子结合被认为是适应低Zn2+浓度环境的生存策略.在威氏海链藻的研究中发现Co2+对δ-CA(TwCA1)表达及活性的影响与Zn2+基本相同[45].值得注意的是,δ-CA目前仅在藻类中被发现;而对于广泛分布于多类物种中的α-CA,当Co2+取代Zn2+与其结合时,酶活性显著降低[112].
环境因子对CA表达影响的研究已经广泛开展,其中对于不同CO2浓度、温度以及光照等的影响都有了一定认识,但对于金属离子对CA的限制以及在大洋环境中是否存在溶解无机碳-Zn共限制情况的讨论和研究还十分有限.通过不同种类金属离子及不同浓度梯度培养实验,探究CA转录和翻译水平的变化及活性差异,进一步理解CA中金属离子潜在的调节作用,可为进一步认识海洋浮游植物的CA功能、CCM及其对海洋初级生产力的影响提供新视角.
5.4 CA在“碳中和”背景下的应用前景
近年来,为实现《巴黎协定》1.5~2.0 ℃的控温目标,“碳中和”已成为全球应对气候变化的统一认识[113].工业废气中CO2的处理被视为一种有效的“碳中和”手段,由于CA的快速催化活性,在工业上将细菌CA(工业固定化酶)应用于碳捕获,采用多种方法对CA进行固定,以获得具有良好的抗高温性能和可重复利用的固定化酶[114-116].藻类CA具备丰富的遗传多样性和高效的转化活性,但目前针对藻类CA的应用极为缺乏.通过鉴定筛选藻类中不同类型的CA,可开展工业固定化藻类来源CA的尝试,及在光合工程微藻中实现异源表达,评估其对光合作用的促进作用,增加光合作用产物的产量,对于探索微藻在碳捕集以及生物质能源开发中的作用具有重要的科技应用价值.2015年美国能源环境部提出利用微藻工业化培养作为吸收器,并通过固定化CA提高反应效率,以实现CO2的高效捕集和利用这一目标[117].在生态环境监测中,珊瑚-虫黄藻共生体的健康发展依赖于稳定的光合作用,因此有研究者提出可以采用CA活性作为生物标记,用于珊瑚礁生态系统的环境监测[118].
海洋吸收了工业革命以来排放至大气中的26%CO2,海水碳平衡的改变导致海洋酸化[119].在全球气候变化大背景下,海洋酸化、气温上升均会改变海洋化学的各种平衡,生存其中的海洋光合藻类是环境变化的一级响应者,其重要意义不言而喻.任何生态系统或物种对未来的适应性都在于其所包含的遗传多样性及其蕴含的生态适应分子机制,是当前海洋生态研究的前沿主题[120-121].聚焦海洋光合微藻中CA功能多样性和应用潜力的研究与开发,具有重要的科学理论意义和实践应用价值.
