2020年夏季青岛近海及毗邻海域浮游动物群落特征
2023-06-13潘筱倩张志浩许增超叶振江庄昀筠刘光兴陈洪举
潘筱倩,张志浩,许增超,叶振江,庄昀筠,刘光兴,陈洪举*
(1.中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100;2.青岛海洋科学与技术试点国家实验室,海洋生态与环境科学功能实验室,山东 青岛 266071;3.厦门大学环境与生态学院,近海海洋环境科学国家重点实验室,福建 厦门 361102;4.中国海洋大学水产学院,山东 青岛 266003)
浮游动物是海洋生态系统中物质和能量交换的枢纽,在调节生态系统功能方面发挥着重要的生态作用.浮游动物一方面可以通过上行效应控制高营养级类群的数量和分布,另一方面可以通过摄食浮游植物而影响初级生产力.海洋水质、温度和盐度等环境因子对浮游动物的数量和群落结构都有影响,浮游动物群落对微小的环境扰动具有明显的响应,对环境的变化具有指示作用[1].
由于近海海域与人类活动关系密切,水体环境极易受到人为影响,这可能会改变浮游动物群落结构,进而影响到整个近海生态系统的结构和功能.通过研究浮游动物群落的组成和变化,可以有效地反映近海环境的生态特征.
青岛近海及其毗邻海域位于山东半岛东南,是南黄海重要的养殖及港口海区.近年来青岛地区经济迅速发展不可避免地对近海海域生态环境产生影响,可能会使海洋浮游动物群落发生变化.因此,在青岛近海开展浮游动物群落结构跟踪监测十分必要,这将有助于了解生态系统的变化,并为海洋环境保护和治理提供科学依据.目前对青岛近海海域浮游动物的研究大多集中于胶州湾[2-6]和崂山湾[7]等海湾区域,对于海湾之外毗邻海域的研究则相对较少.王晓等[8]报道了2006年夏季青岛近海浮游动物的种类组成、群落结构及多样性;朱丽岩等[9]分析了2006—2007年青岛南部近海浮游桡足类群落的季节变化及其与环境因子的关系;王宁等[10]利用2015—2016年在青岛近海的5个航次断面调查资料,探究了青岛近海浮游动物群落的特征和季节变化.
本研究通过2020年7月在青岛近海及毗邻海域进行的浮游动物及环境因子观测,分析了该海域浮游动物群落的种类组成、优势种、数量分布和生物多样性等群落特征,以及环境因素对浮游动物群落的影响.本研究可加深对青岛近海浮游动物群落结构特征的了解,以期为南黄海浮游动物生态学的研究提供基础资料,同时也为青岛近海的海洋环境保护以及生物资源的开发利用提供科学依据.
1 材料与方法
1.1 站位设置及采样方法
于2020年7月26日—8月11日在青岛近海及毗邻海域(35.00°~36.50° N,119.73°~123.00° E)乘“鲁日山渔61077”渔船进行采样.研究海域共设置21个站位,位置与水深情况见图1.浮游动物样品使用WP2网(网口内径57 cm,筛绢孔径202 μm)由底至表垂直拖网采集.样品采集后保存于5%(体积分数)甲醛海水溶液.实验室内利用体视显微镜(Leica S8APO)对浮游动物进行种类鉴定和计数.以上操作均按照《海洋调查规范 第6部分:海洋生物调查》(GB/T 12763.6—2007)[11]进行处理和分析.温度、盐度和水深等环境参数由温盐深(CTD)仪(型号rbr-xr-420)现场测定.

图1 调查海域和采样站位Fig.1 Survey area and sampling stations
1.2 数据处理
浮游动物栖息密度(后简称密度)以单位体积水体中的个体数(m-3)表示.采用优势度(Y)表示物种的优势性,计算公式为:
(1)
式中,ni为第i种的个体数,N为所有物种个体总数,fi为第i种的出现频率.Y≥0.02的种类为优势种.
浮游动物群落多样性指数采用种类数(S)、丰富度(Margalef)指数(d)、香农-威纳(Shannon-Wiener)多样性指数(H′)以及均匀度(Pielou)指数(J′)表示,计算公式分别为:
d=(S-1)/log2N,
(2)
(3)
J′=H′/log2S,
(4)
式中,Pi为ni与N的比值.
浮游动物群落聚类分析采用PRIMER 6.0软件.使用组间平均聚类方法,将密度数值进行对数转化以降低极化程度,计算Bray-Curtis相似性系数[12],再将得到的矩阵进行Cluster分析并划分群落结构.绘制K-优势度曲线,通过降序排列浮游动物的优势度,得到累计百分比曲线.
采用Ocean Data View 5.2软件绘制站位图、环境要素和浮游动物密度平面分布图.使用Canoco 5软件进行浮游动物密度与环境因子之间的冗余分析(RDA),其中环境因子包括表层温度(SST)、底层温度(SBT)、表层盐度(SSS)和底层盐度(SBS).使用SPSS 25.0软件进行浮游动物密度与环境因子之间的皮尔森(Pearson)相关性分析.
2 结果与分析
2.1 环境参数
观测期间研究海域的SST和SBT分别为(24.1±1.4) ℃和(18.8±5.2) ℃,平均SST和平均SBT的最高值分别出现在14号(26.6 ℃)和20号站位(24.7 ℃),最低值分别出现在4号(22.0 ℃)和10号站位(10.6 ℃).SSS和SBS分别为31.2±0.5和31.7±0.7,平均SSS和平均SBS的最高值均出现在8号站位(32.1和33.2),最低值分别出现在14号(30.0)和1号站位(30.7).水深为(32.2±16.9) m.SST和SBT整体呈现由近岸向远岸逐渐降低的趋势;而SSS和SBS的变化趋势相反,随着离岸距离增加盐度逐渐增加,盐度高值区都位于离岸较远的东南海域(图2).

图2 温度和盐度的平面分布Fig.2 Horizontal distribution of temperature and salinity
2.2 浮游动物群落的种类组成和数量分布
研究海域共鉴定出浮游动物成体51种和浮游幼虫26类[附录(http:∥jxmu.xmu.edu.cn/Upload/html/20230306.html)表S1].浮游动物成体包括原生动物1种、刺胞动物11种(水螅水母9种、管水母2种)、栉水母动物1种、节肢动物34种(枝角类2种、介形类2种、桡足类23种、等足类1种、端足类3种、糠虾类1种、十足类2种)、毛颚动物2种、被囊动物1种和头索动物1种(表1).各类浮游动物中,浮游幼虫的种类数百分比最高,达33.8%,其次是桡足类和水螅水母,所占百分比分别为29.9%和11.7%.

表1 浮游动物种类组成及密度
研究海域浮游动物的总密度为(1 147.2±1 315.1) m-3.密度最高值出现在14号站位(4 787.0 m-3),最低值出现在8号站位(53.8 m-3)[图3(a)].浮游动物密度主要由桡足类和枝角类贡献,占比分别达到54.4%和28.2%.其中,桡足类密度最高值出现在最北部的14号站位(4 388.8 m-3)[图3(b)];枝角类密度最高值则位于研究海域南部的4号站位(2 712.9 m-3)[图3(c)];毛颚类密度高值区位于北部和南部海域,最高值位于1号站位(118.4 m-3)[图3(d)];浮游幼虫密度分布与枝角类类似,最高值出现在5号站位(685.9 m-3)[图3(e)].此外,原生动物夜光虫(Noctilucascintillans)集中于西南近岸海域,并在1号站位大量聚集,密度高达1 231.3 m-3[图3(f)].

图3 浮游动物密度的平面分布Fig.3 Horizontal distribution of zooplankton density
2.3 浮游动物群落多样性
研究海域浮游动物的种类数S呈现由近岸向外海递减的趋势(图4).丰富度指数d范围为2.26~4.73,平均值为3.70,最高值出现在1号站位,最低值出现在8号站位,呈现由西北沿岸向东南方向递减的趋势.均匀度指数J′范围为0.30~0.60,平均值为0.43,最高值出现在7号站位,最低值出现在1号站位.香农-威纳多样性指数H′范围为1.28~2.46,平均值为1.95,最高值出现在7号站位,最低值出现在13号站位.1号站位的丰富度指数最高,但均匀度指数最低,7号站位的均匀度指数和香农-威纳多样性指数均最高.
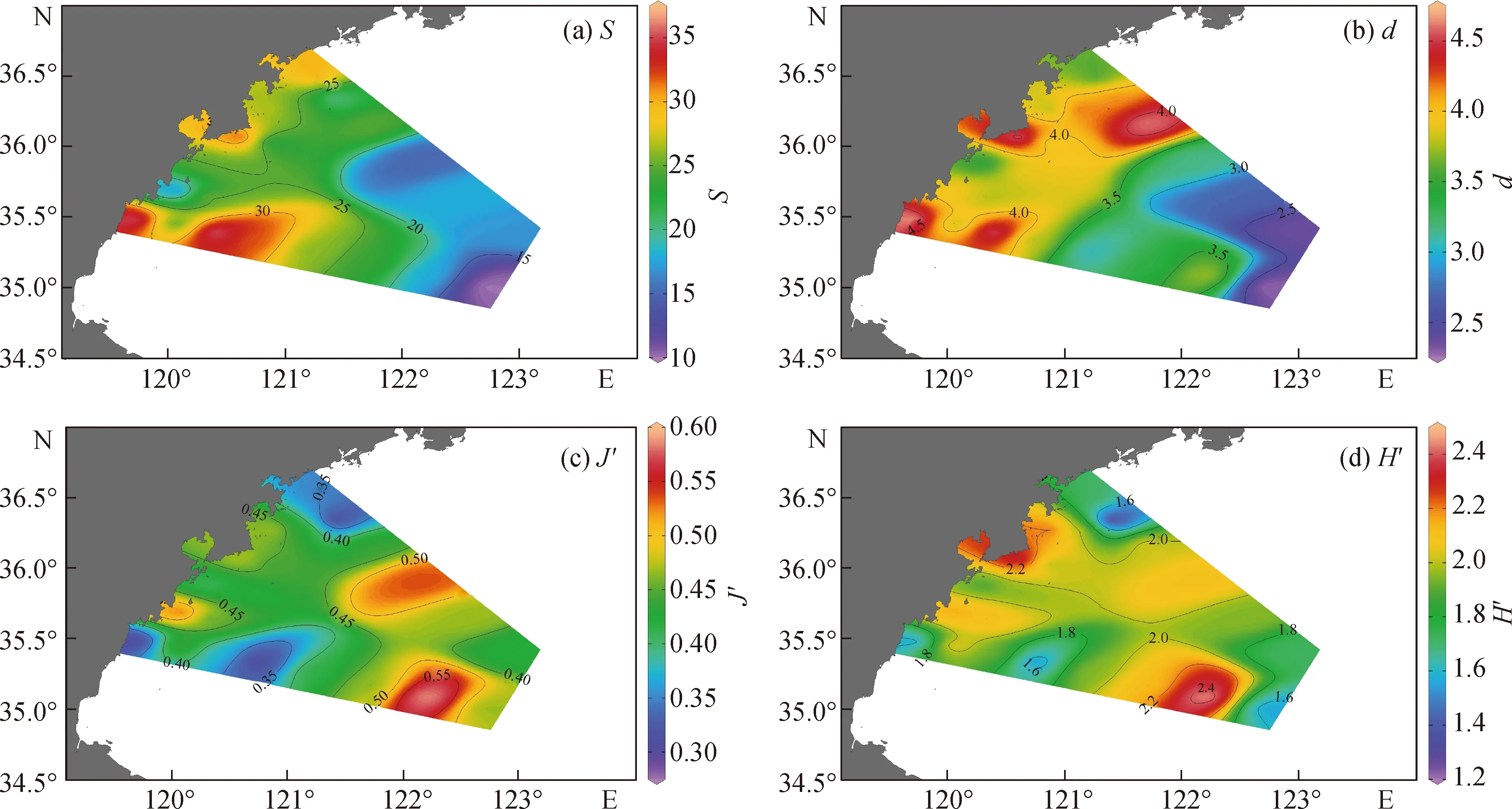
图4 浮游动物多样性的平面分布Fig.4 Horizontal distribution of zooplankton diversity
2.4 浮游动物群落聚类分析
聚类分析结果表明,研究海域浮游动物可划分为两个组群,即黄海中部组群和南黄海沿岸组群(图5).相似性分析(ANOSIM)显示,两个组群的种类组成之间具有显著性差异(r=0.68,P<0.001),对应的环境因子之间也具有显著性差异(r=0.51,P<0.001).黄海中部组群位于东部SSS较高的海域,几乎所有站位的SSS均>31.5,同时该区域受黄海冷水团影响,SBT低,平均SBT仅为13.0 ℃,平均水深则超过50 m;南黄海沿岸组群分布在近岸海域,平均水温较高,平均盐度<31.5,平均水深<30 m(表2).
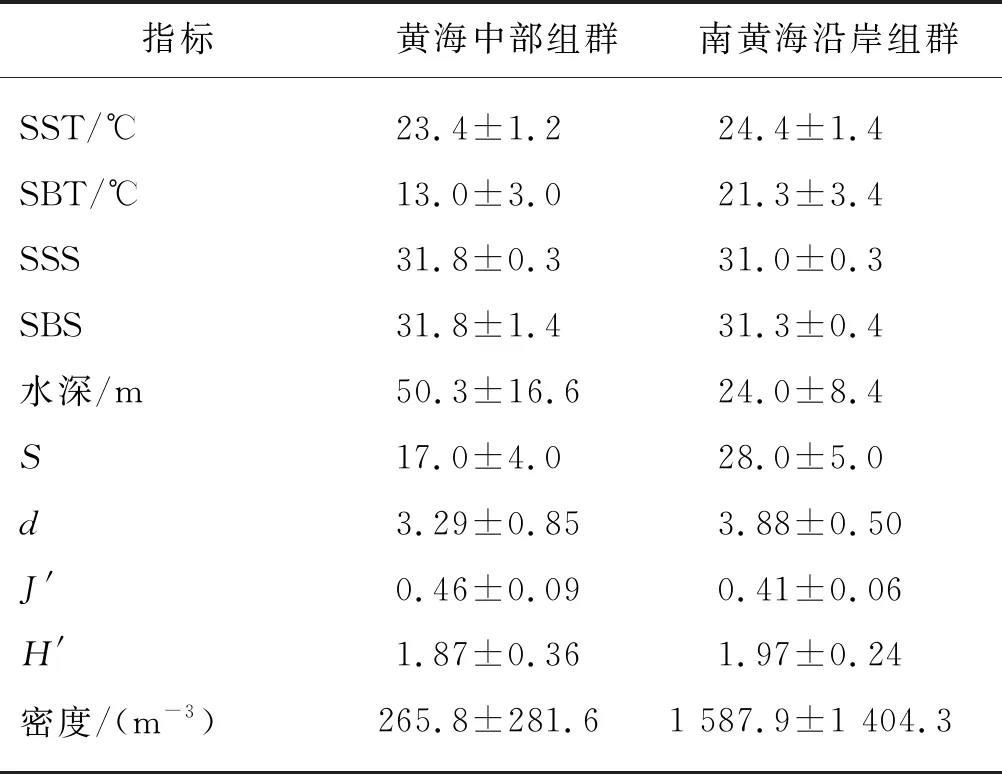
表2 两组群的环境因子、生物多样性指数和密度

图5 浮游动物群落聚类分析(a)和地理分布(b)Fig.5 The cluster analysis of zooplankton (a) and geographical distribution (b)
黄海中部组群记录到浮游动物成体22种、浮游幼虫16类,共38种;南黄海沿岸组群有浮游动物成体48种、浮游幼虫26类,共74种,种类数远高于黄海中部组群,主要是水螅水母、桡足类和浮游幼虫的种类数较大.此外,黄海中部组群的丰富度指数d和香农-威纳多样性指数J′低于南黄海沿岸组群,密度也较低(表2).K-优势度曲线也表明,南黄海沿岸组群的生物多样性高于黄海中部组群(图6).黄海中部组群的4个优势种全部为桡足类,包括中华哲水蚤(Calanussinicus)、小拟哲水蚤(Paracalanusparvus)、拟长腹剑水蚤(Oithonasimilis)和近缘双毛大眼剑水蚤(Ditrichocorycaeusaffinis),其中小拟哲水蚤占据绝对优势,优势度达0.601.除桡足类外,其余类群数量极低;南黄海沿岸组群包含5个优势种,分别为小拟哲水蚤、近缘双毛大眼剑水蚤、鸟喙尖头溞(Peniliaavirostris)、强壮滨箭虫(Aidanosagittacrassa)和多毛类幼体(Polychaeta larvae),其中小拟哲水蚤的优势度为0.324,为第一优势种,鸟喙尖头溞的优势度也高达0.317,为第二优势种(表3).

表3 两组群的优势种密度和优势度

图6 浮游动物K-优势度曲线Fig.6 K-dominance curve of zooplankton
2.5 浮游动物群落各类群数量分布与环境因子的关系
对浮游动物群落与环境因子进行RDA(图7).结果表明,第一主轴的特征值为0.44,第二主轴的特征值为0.08,前两个主轴的解释拟合变化累计百分比达到99.3%.其中,对浮游动物群落影响最显著的环境因子为SST和SSS,两者对浮游动物群落差异的解释度分别为44.3%和42.5%(P<0.05),在所有环境因子解释度中最高.相关性分析结果显示,浮游动物总密度与SSS呈显著负相关(r=-0.51,P<0.01);中华哲水蚤密度与SBT呈显著负相关(r=-0.56,P<0.01);小拟哲水蚤密度与SSS呈显著负相关(r=-0.57,P<0.01);拟长腹剑水蚤密度与SST呈显著负相关(r=-0.63,P<0.01);强壮滨箭虫密度与SSS呈显著负相关(r=-0.54,P<0.05);近缘双毛大眼剑水蚤密度与SBT呈显著正相关(r=0.61,P<0.01),与SSS呈显著负相关(r=-0.74,P<0.01);鸟喙尖头溞密度与SST呈显著负相关(r=-0.44,P<0.05).
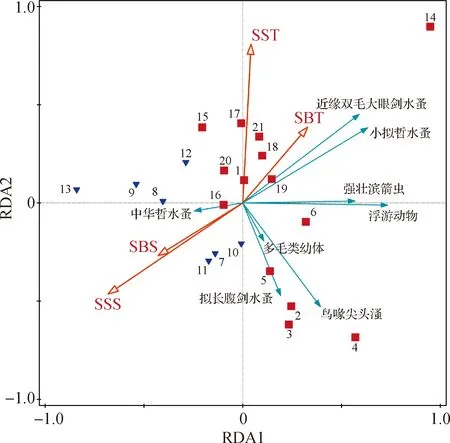
图7 浮游动物密度与环境因子的RDAFig.7 RDA of zooplankton densities and environmental factors
3 讨 论
2020年夏季青岛近海及其毗邻海域共记录浮游动物成体51种、浮游幼虫26类.与以往夏季的调查资料相比,本研究记录的浮游动物种类组成以及优势种等变化不大,但密度相对较低.研究海域浮游动物可以划分为黄海中部组群和南黄海沿岸组群,大致以31.5等盐线为界,两组群的优势种组成有较大差异.SST和SSS是对浮游动物群落影响较显著的环境因子.
3.1 浮游动物群落种类组成及数量分布
研究海域在2020年夏季共记录到的浮游动物群落种类组成以浮游幼虫、桡足类和水螅水母为主(表1).本研究中优势种主要以小拟哲水蚤、拟长腹剑水蚤和鸟喙尖头溞等小型浮游动物为主,这主要与采样所选取的网型有关.王晓等[8]和寇建山[13]分别使用大型网和浅水Ⅰ型网在夏季青岛近海均采集到浮游动物66种,且均以中华哲水蚤、强壮滨箭虫等大型浮游动物为主,这两种网型的筛绢孔径较大,远大于本研究中使用的WP2型网的筛绢孔径,对小型浮游动物的捕获能力较弱[14],会低估小拟哲水蚤等小型浮游动物的种类数和密度.王宁等[10]采用WP2型网在青岛近海海域发现浮游动物优势种有中华哲水蚤、小拟哲水蚤和近缘双毛大眼剑水蚤,仅记录到浮游动物29种,这可能与调查区域范围有关.本研究调查海域的范围不仅涉及到沿岸水域,还向东覆盖了黄海冷水团的部分区域.
2020年夏季青岛近岸及毗邻海域浮游动物的平均密度为1 147.2 m-3,对比以往研究[7-8,10,13,15-17]发现(表4):2006年7月和8月青岛近海浮游动物的平均密度仅为151.7 m-3[8]和121.0 m-3[13],这主要也与其采用孔径较大的网型有关,某些占据优势的小型浮游动物的数量被严重低估.一般来说,小孔径网型(如WP2型网)采集到的浮游动物数量要多于大孔径网型采集到的数量[7,10,16-17],因此采用小孔径网型采集更能反映小型优势种的分布情况.小型优势种的密度通常是决定浮游动物群落总密度的重要因素.夏季南黄海的浮游动物密度在相邻年份之间也存在巨大的年际差异[17],这主要是由环境因子的差异导致小型优势种密度剧烈波动造成的,本研究中作为主要优势种的小型桡足类的密度远低于此前夏季南黄海的相关调查.2014年夏季在崂山湾采用浅水Ⅱ型网得到浮游动物平均密度大于26 000 m-3,其中小型桡足类为主要优势种[7];2016年青岛近海的调查中虽然浮游动物种类数较低,但是小型优势种密度很高,6月其平均密度达到8 053.5 m-3[10];2016年和2017年夏季南黄海的小型优势种平均密度分别为4 041.4和2 177.9 m-3[17],而本研究中小型优势种的密度仅为920.8 m-3,这可能也是环境因子导致浮游动物密度发生年际波动的表现.
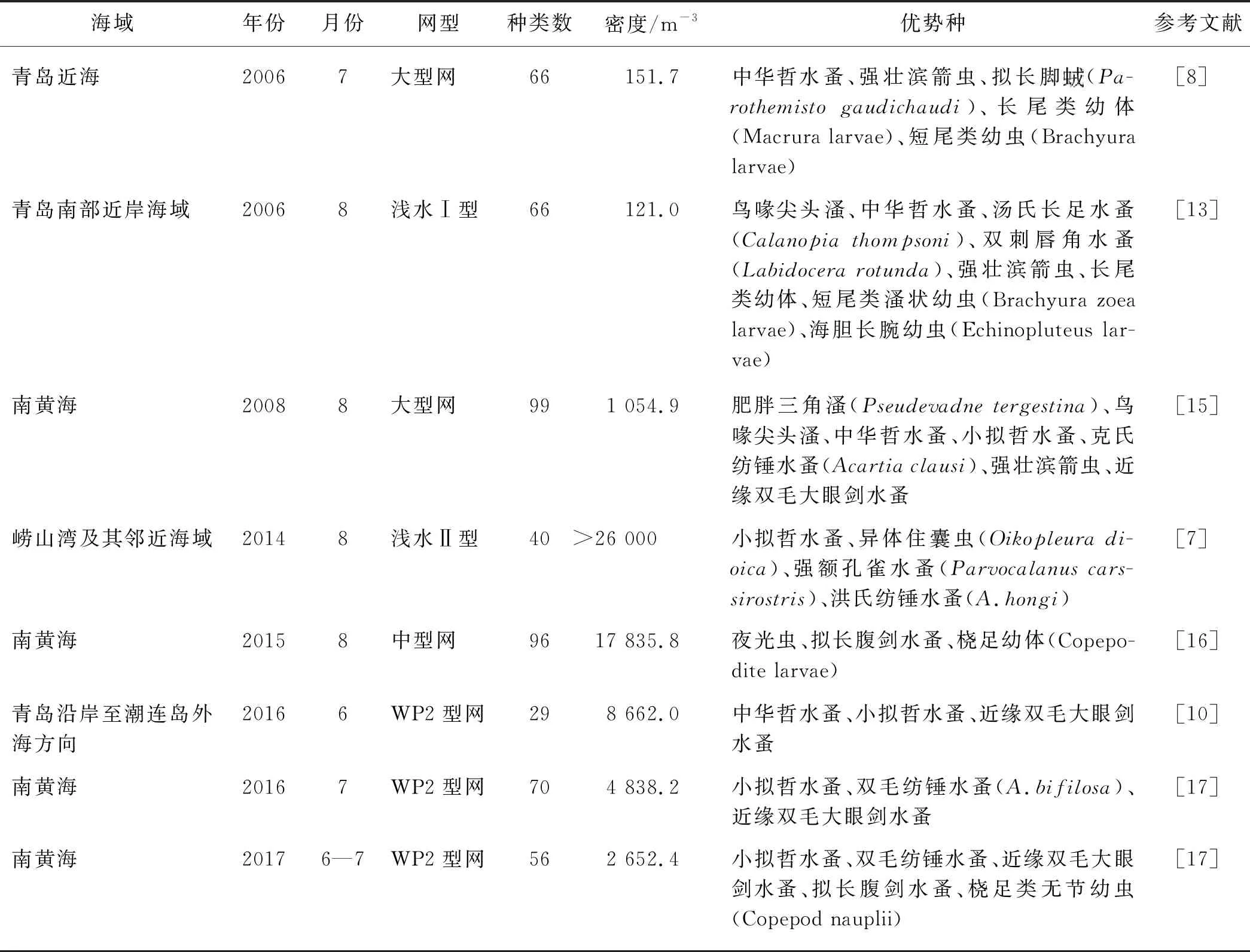
表4 夏季青岛近海及南黄海部分海域浮游动物历史资料
3.2 浮游动物群落优势种
本研究中的浮游动物群落优势种主要以小型浮游动物为主,这与在夏季南黄海采用相同网型的调查结果类似(表4).除小拟哲水蚤、近缘双毛大眼剑水蚤等在南黄海WP2型网和中型浮游生物网采集样品中常见的优势种外[17-21],还包括以鸟喙尖头溞为代表的枝角类和强壮滨箭虫等毛颚动物.枝角类在南黄海的暴发极具偶然性,在环境有利的情况下会暴发性增殖[22-23].在本研究中鸟喙尖头溞在南黄海沿岸组群中优势度极高(表3),在2006年8月青岛近海[13]以及2008年夏季南黄海[15]的观测中也出现鸟喙尖头溞成为优势种的记录.枝角类的最适温度范围为5~25 ℃[24],一般来说在适温范围内温度越高越有利于枝角类以孤雌生殖的方式大量增殖[25].在本研究中,枝角类大量聚集在南部SST约22 ℃的海域[图3(c)],且相关性分析表明鸟喙尖头溞的密度与SST呈显著负相关,这可能是因为南部海域温度低于25 ℃,此温度范围更适合其繁殖,而北部海域温度偏高,有些站位的水温甚至高于25 ℃,超过该海域鸟喙尖头溞的最适温度范围,不利于其生长繁殖.
强壮滨箭虫属于暖温带近岸低盐表层种[18],是南黄海海域常见的优势种,常年分布于黄海沿岸和中部海域[8,10,15,26-27].强壮滨箭虫喜低盐水,在盐度>32的海域很少出现,可作为黄海水团低盐水的指示种[18],本研究中以强壮滨箭虫为代表的毛颚动物集中分布在SSS较低的近岸海域[图3(d)].此外,强壮滨箭虫作为典型的捕食者,以桡足类等中小型浮游动物为主要食物来源[24],而本研究海域的小拟哲水蚤和鸟喙尖头溞为绝对优势种,因此毛颚动物和桡足类、枝角类的分布相似,高值区重叠(图3).
3.3 浮游动物组群划分
南黄海海域浮游动物群落结构划分的报道很多[10,15,28-30],普遍采用的是将其分为南黄海沿岸低盐组群和黄海中部组群[10,15,28-29].郑执中[28]提出以31等盐线为界划分沿岸组群和中部组群,还有研究认为以32等盐线为界划分更为合理[29-30].本研究发现:大致以31.5等盐线为界,黄海中部组群属于中部高盐组群,水深超过50 m,温度低,盐度高;而南黄海沿岸组群则属于典型的沿岸低盐组群,水深不超过30 m,温度高,盐度低[图5(b)].造成等盐线选取差异的原因可能与调查海域的范围有关;对于南黄海的研究大多包含青岛外海区域而不涉及青岛近岸海域,本研究范围则仅在青岛近海,沿岸海域盐度低,站位很少覆盖外海高盐水区域,因此等盐线的选取低于以往大面积南黄海研究的情况.
通过对各组群的深入研究发现,黄海中部组群的种类数较少,生物多样性较低(表2),这与贺雨涛等[15]的研究结果一致.沿岸组群的生物多样性高于中部组群,这可能是由于中部组群所处的东部海域受到黄海冷水团的影响,而夏季正是黄海冷水团处于强盛的时期,海流等难以入侵,其他海域的物种难以随海流向该海域补充[15,31].黄海冷水团的存在也为中华哲水蚤的生存提供了条件.往年调查研究显示中华哲水蚤是南黄海海域的优势种[9-10,29],其存在“度夏”的生存策略[32],23 ℃以上的高温会显著提高成体死亡率[33].黄海中部组群的东部处于水深较深的黄海冷水团影响范围,SBT低[图2(b)和图5(b)],适宜中华哲水蚤存活.本研究中黄海中部组群的密度远低于南黄海沿岸组群,这与贺雨涛等[15]的结果不同,他们的结果显示了高栖息密度对应低生物多样性的模式.类似模式在其他研究中也有发现[34],这主要是由个别物种的数量激增造成的,种类间数量的极化程度大幅增强,不同组群之间密度差异较大.
RDA结果表明,对浮游动物群落影响最显著的环境因子组合为SST和SSS.王宁等[10]发现SBS和水深是影响青岛近海浮游动物群落结构的最佳环境因子组合,本研究结果与其有差异,这可能与调查海域的时空尺度有关.王宁等[10]在时间上选取了4个季节,空间分布上选取的站位是从胶州湾内部到黄海中部的一个断面,水深以及SBS变化显著;而本研究只选择夏季青岛近岸海域,并未涉及其他时间和海域,对于中华哲水蚤这种对温盐变化敏感的优势种来说,SBT对其影响更大.
综上,2020年夏季青岛近海及其毗邻海域的浮游动物种类组成以及优势种等变化与以往研究类似,但密度较低.南黄海沿岸组群和黄海中部组群的环境因子以及浮游动物群落的物种组成均有较大差异,对浮游动物群落影响最大的环境因子是SST和SSS.青岛近海及毗邻海域夏季浮游动物群落结构的现状和特征,可为南黄海浮游动物生态学研究补充基础资料,并可为环境保护及生物资源利用提供依据.
