东风螺生物学与遗传育种研究进展
2023-06-13付敬强游伟伟柯津伟柯才焕
付敬强,游伟伟,骆 轩,柯津伟,柯才焕*
(1.厦门大学环境与生态学院,海洋与地球学院,近海海洋环境科学国家重点实验室,福建 厦门 361102;2.福建省海洋经济生物遗传育种重点实验室,福建 厦门 361102;3.福建省特色水产品种质资源保护利用与共享平台,福建 厦门 361102)
东风螺俗称花螺、旺螺、黄螺,在我国台湾地区又称凤螺,分布于热带、亚热带地区,属肉食性浅海底栖贝类,味道鲜美,是一类符合现代营养需求的高蛋白、低脂肪的名贵海鲜.世界上现有东风螺种类11种,均为可食种类,目前投入养殖生产的仅有方斑东风螺(Babyloniaareolata)和泥东风螺(B.lutosa)2种[1].我国是世界东风螺养殖最主要的国家,目前东风螺在国内的养殖主要分布在福建省以南沿海地区,其中海南省因得天独厚的地理环境和气候条件优势,成为我国东风螺种苗培育和养殖的最适宜地区.
我国东风螺的生物学研究始于1986年,由厦门大学率先开展东风螺的繁殖生物学研究,随后进行了人工育苗和养殖试验[2-4].20世纪90年代后期福建省、广东省和海南省的诸多科研机构也先后成功实现东风螺育苗和养殖,21世纪初期形成规模化养殖生产,以方斑东风螺为主,泥东风螺为辅.另外,我国台湾地区20世纪80年代初开展过台湾东风螺(B.formosaeformosae)的试养,并在20世纪90年代对台湾东风螺和泥东风螺进行了分类学和生物学研究,但未形成养殖产业[5].国际上,早在20世纪70年代,日本就开展了日本东风螺(B.japonica)的人工育苗技术研究和放流增殖工作,但未形成规模化养殖,现今多集中于毒理学研究[6-7];泰国于20世纪90年代开展了方斑东风螺的人工育苗和养殖研究,但目前养殖规模较小[8];越南于近年开展了方斑东风螺的养殖模式研究,并实现小规模养殖[9];印度曾开展过深沟东风螺(B.spirata)的生物学研究,但未开展人工养殖[10].过去30余年,厦门大学贝类遗传育种团队在东风螺的分类与进化、生物学特征、营养价值与需求、选择育种、杂交育种、DNA分子标记开发和利用等方面取得了显著的成果,本文主要综述相关研究进展.
1 东风螺属的分类与系统进化
东风螺隶属于软体动物门(Mollusca)腹足纲(Gastropoda)前鳃亚纲(Prosobranchia)新腹足目(Nerobanchia)东风螺属(Babylonia),起初被归为蛾螺科(Buccinidae),而最新的分类已将其移出并单独作为东风螺科(Babyloniidae)[11],全世界已发现的现生11种仅分布于印度-太平洋地区[12].中国大陆沿岸迄今报道该属种类2种,即方斑东风螺和泥东风螺,均为经济养殖种,两者的染色体数目2N=66,核型为32m+20sm+8st+6t[13].
关于东风螺的分类曾存在一些疑义,如早期根据贝壳花纹特征将泥东风螺误定为台湾东风螺和波部东风螺(B.formosaehaber),后又重新鉴定为泥东风螺[1].为了厘清东风螺属的系统进化关系,对分布于印度-太平洋地区的锡兰东风螺(B.zeylanica)、深沟东风螺(B.spirata)、台湾东风螺、方斑东风螺湛江群体、方斑东风螺泰国群体和泥东风螺进行线粒体基因组测序,结果显示方斑东风螺湛江群体、方斑东风螺泰国群体和泥东风螺的线粒体全基因组大小分别为15 445,15 298和15 380 bp,均包含13个蛋白质编码基因.基于线粒体基因组的系统学分析发现,方斑东风螺湛江群体和泰国群体的线粒体部分序列的遗传距离仅为0.007,而其他种间的遗传距离在0.126~0.186范围,由此能够推断方斑东风螺湛江群体和泰国群体系种内群体间的差异水平.同时,泥东风螺和台湾东风螺之间的遗传距离为0.124,达到种间的水平,而非早期误认为的亚种关系(图1)[1].
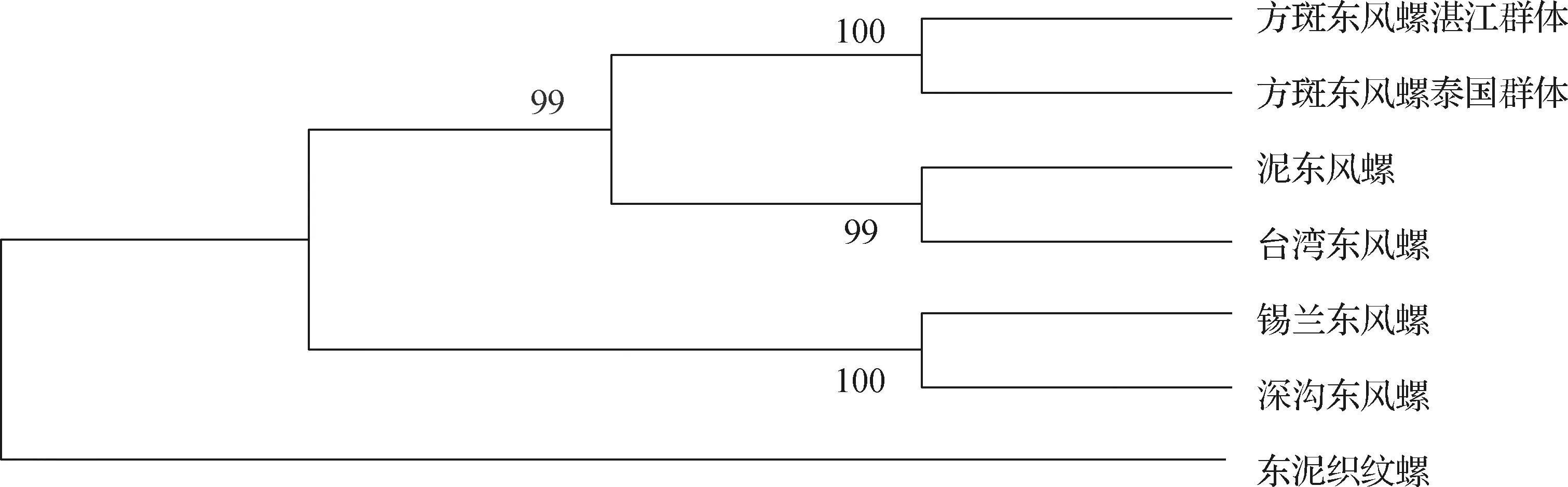
图1 基于线粒体部分序列构建的不同东风螺系统进化树(邻接法)[1]Fig.1 Phylogenetic neighbor-joining tree of different Babylonia based on partial mitochondrial sequences[1]
2 东风螺的生物学特征
自然环境下,东风螺一般分布于潮下带数米至数十米水深的浅海区,不同种类对底质的要求不同,一般为沙质、泥质或泥沙质.东风螺的活动具有昼伏夜出的周期性,白天潜伏在砂泥中并露出水管,仅在涨、退潮时稍作移动,夜间借助腹足爬行四处觅食.
2.1 生殖与繁殖生物学特性
东风螺为雌雄异体,雌雄比例约1∶1,从贝壳和厣形态上无法辨别其性别,只能根据软体部的交接器形态、卵囊腺有无和性腺颜色等特征加以区分[4].
雄性生殖系统由精巢、输精管及附属腺和雄性交接器等器官组成.精巢位于内脏团中轴右侧,紧贴肝脏,并随肝脏螺旋部的旋转而扭曲(图2(a))[14].根据组织学观察,将精巢的发育分为精原细胞期、精母细胞分裂期、成熟与排放期以及退化期4个时期;精子的发生最初从精原细胞开始,然后经历初级精母细胞和次级精母细胞的发育,最后形成精细胞[15].在光学显微镜下,精子呈发丝状;在透射电镜下,精子由头部和尾鞭两部分构成.根据本课题组对3种东风螺精子形态的研究,判断东风螺的精子为进化型精子,不同种东风螺的精子长度有显著差别,如台湾东风螺、泥东风螺和方斑东风螺的精子长度分别约130,150和160 μm[16-17].

图2 东风螺的雄性(a)和雌性(b)生殖系统示意图[14]Fig.2 The male (a) and female (b) reproductive systems of Babylonia[14]
雌性生殖系统包括卵巢、输卵管、附属腺、交接囊和阴道,卵巢在位置上与精巢相同(图2(b))[14].根据对卵巢周年组织学切片观察,将卵母细胞的发育划分为卵原细胞期、生长期、成熟期和退化期,而卵巢的发育以卵母细胞的发育时相分期为基础划分为增殖期、生长期、成熟和排放期及退化期4个时期[15].
东风螺为体内受精,雌雄个体在繁殖期进行交配.在福建省和广东省东部海域,东风螺属的方斑东风螺和泥东风螺的繁殖期一般在5—9月,10月后性腺退化;而在海南岛沿岸,方斑东风螺四季均可交配产卵,但冬季产卵量较少.在交配过程中,雄性通过交接器将精子储存于雌性生殖管道内,待卵子排出到蛋白腺腔中完成受精作用;受精后的卵子进入卵囊腺内,形成卵囊雏形并被产出体外,然后紧贴足部侧壁输送到腹足口中并在其内进行成形作用,形成一定形状的卵囊附着在基底上[4].
2.2 胚胎与幼体发育
东风螺的受精卵由卵囊包裹,根据种类的不同,东风螺幼体早期发育的营养方式分为卵黄营养和浮游植物营养2种类型(表1).如台湾东风螺和日本东风螺的幼体为卵黄营养,从受精卵发育成稚螺的整个阶段都在卵囊内完成,整个发育过程的营养来源由自身卵黄囊提供;而方斑东风螺和泥东风螺等多数种
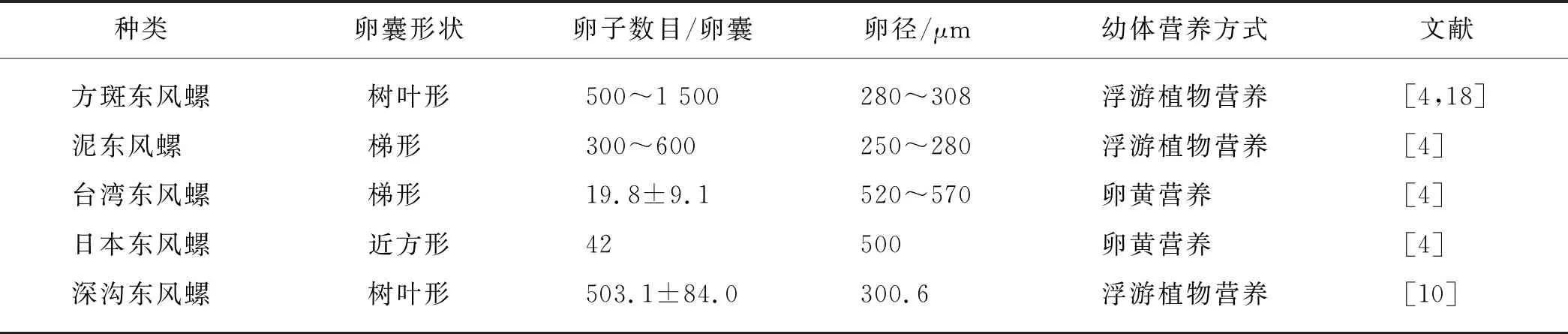
表1 不同种类东风螺的卵囊、卵子及幼体营养类型特征
类的幼体营养则为浮游植物营养,幼体发育分为卵囊内和卵囊外两个阶段.在卵囊内发育过程中,受精卵经过多次卵裂发育到多细胞时期,然后经历桑葚期、囊胚期、原肠期后发育至早期面盘幼体时期;待发育至中期面盘幼体时期,幼体陆续从卵囊内游出开始浮游生活[4].整个卵囊内发育阶段,营养物质由自身卵黄囊提供,当幼体开始浮游生活,体内的营养能量代谢发生剧烈变化,卵黄囊在3~4 d被消耗殆尽,幼体由内源性营养向外源性营养转变,开始从海水中摄食单胞藻以供自身生长发育.在营养充足和环境适宜的条件下,一般2周内幼体面盘退化消失,变态成为稚螺后开始营底栖生活;同时,食性也从浮游阶段的植食性转变为肉食性[4,19-20].而在幼体从早期面盘幼体发育变态为稚螺的过程中,消化酶的活性、蛋白质的合成及能量代谢处在不断变化中.已有研究证实贝类具有分泌纤维素酶的能力,并提出以(淀粉酶+纤维素酶)/(蛋白酶+脂肪酶)的酶活比指示方斑东风螺食性变化更准确合理[21-23].
幼体在发育过程中会受到多种环境因子的影响,其中主要影响因子为温度和盐度.在突变条件下的胚胎发育温、盐度适应范围均比渐变条件下的窄;突变和渐变条件下胚胎发育的最适温度范围分别为23.5~30.0 ℃和21.5~31.0 ℃,相应的胚胎发育最适盐度范围分别为20.5~28.5和18.5~32.5,而温盐交互分析表明低温高盐对胚胎发育的影响更大;此外,对幼体发育而言,其生长和变态的最适温、盐度范围分别为25.0~30.0 ℃和21.0~27.5[24-25].
光因子对东风螺的幼体发育具有明显影响,其中绿光对幼体的受精、孵化和变态具有显著的促进作用,但作用效果受光照强度和光周期的影响,在光照强度和光周期分别为888.9 lx和12 h光照:12 h黑暗的条件下,幼体的受精率、孵化率和变态率最高;而蓝光则对幼体发育起抑制作用[26].此外,根据1996年柯才焕等[3]对泥东风螺和方斑东风螺幼体发育的研究报道,0.012 mol/dm3K+在持续24 h作用下能够有效诱导以上两种东风螺的90%以上浮游幼体完全变态,10-4mol/dm3多巴胺诱导时可达到上述K+诱导时约一半的变态率,获得变态能力时泥东风螺和方斑东风螺幼虫的壳高分别为860.2~1 009.8 μm和849.6~956.0 μm[3].这也证实化学因子对东风螺幼体的附着和变态有显著诱导作用,但具体作用机制目前尚不清楚.
东风螺幼体的发育受环境因子和化学因子等多种因素影响,上述研究对东风螺幼体的培养和人工育苗技术的发展起积极的促进作用.
2.3 摄食生态学
针对经历浮游生活史的东风螺幼体,其摄食、生长和变态受幼体培养密度、饵料丰度和种类等多种因素影响.幼体培养密度对摄食率起负作用,当培养密度超过0.25 mL-1时,幼体的摄食率和滤水率显著下降(P<0.05);幼体对粒径相对大的藻类的摄食率高于粒径小的藻类,对硅藻的摄食率高于绿藻,而混合藻类投喂能增加幼体的摄食率.为了获得幼体最大的生长和存活结果,幼体的培养密度应低于0.25 mL-1,同时需要增大藻液的投喂浓度,其中牟氏角毛藻(Chaetocerosmuelleri)和湛江等鞭金藻(Isochrysiszhanjiangensis)的投喂细胞浓度以2.0×105mL-1为宜[27-28].此外,东风螺幼体的摄食受光照条件影响.在0~2 000 lx光照强度范围内,东风螺幼体的摄食率随着光照强度增加而升高,且幼体的摄食具有昼夜节律性,其全天最高摄食率出现在清晨,最低摄食率出现在傍晚;同时,光照条件和昼夜节律对东风螺幼体摄食率的影响有显著交互作用.如在不同光照条件下,全天保持1 000 lx光照强度,除傍晚外其他时段幼体的摄食率均保持在较高水平,且无显著变化;而白天黑暗与夜里保持1 000 lx的光照,幼体全天最低摄食率出现在无光照的中午,全天最高摄食率出现在始终有光照的子夜[29].因此,在进行东风螺幼体培育时,为获得更高的生长率和存活率,应综合考虑幼体培养的密度、饵料供给、光照条件及幼体的摄食节律等因素.
食物限制对幼体的生长、存活和变态有显著影响.如饥饿导致泥东风螺幼体的变态时间延长,幼体饥饿时间少于48 h再提供饵料能够快速恢复正常生产发育水平;而当饥饿时间超过104.5 h再补充饵料供应,幼体则无法发育到变态阶段[20].此外,饥饿胁迫下东风螺体内的抗氧化酶系统、消化酶活力及营养物质组成呈现动态变化.在饥饿过程中的前25 d,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GPx)活力逐渐增强,饥饿时间超过40 d则酶活力显著下降;同时脂肪酶、淀粉酶、蛋白酶的活力及RNA与DNA的比值均随饥饿时间延长而降低;饥饿前期东风螺主要消耗脂肪和糖原,蛋白质含量在饥饿80 d前较稳定,后期迅速下降,在饥饿120 d后仍存活较好,无死亡个体出现[30-34].在自然栖息环境中,进入底栖生活的东风螺主要以死亡的海洋动物尸体为食物来源,由于其活动能力有限,容易遭受食物缺失的威胁.为了适应生存的需要,东风螺在长期进化中可能形成了一套适应饥饿的能量代谢调控机制,使其具有很强的耐饥饿能力.
2.4 免疫与毒理
与其他无脊椎动物类似,东风螺只具备先天性免疫能力,主要由非特异性细胞免疫和体液免疫两部分组成,其中细胞免疫主要由血细胞发挥作用,构成了机体免疫反应的第一道防线.通过对方斑东风螺的血细胞种类进行鉴定,发现其血细胞由颗粒细胞和透明细胞组成[35].当机体受到病菌侵染时,两种血细胞对病原微生物均具有清除作用,但颗粒细胞对病原菌的吞噬率显著高于透明细胞,并且受病原菌侵染后两种血细胞中免疫相关蛋白质的表达明显不同,预示两者的杀菌效率和免疫功能存在差异[36-37].在细胞免疫发生的同时,也伴随着体液免疫的吞噬作用和呼吸暴发反应,两者共同作用抵御病原微生物对机体造成的危害[36].然而,目前针对东风螺的抗病免疫研究开展较少,相关研究有待进一步加强.
随着工业化与城市化的快速发展,我国越来越多的沿岸海域处于重金属污染状态下,海洋底栖腹足类动物因移动性小且分布广泛,受重金属等污染物的威胁较大.通过开展重金属Cu2+、Zn2+、Cd2+、Pb2+对泥东风螺胚胎和面盘幼体的毒性效应研究,发现4种重金属对胚胎和幼体的毒性大小顺序为Cu2+>Zn2+>Cd2+>Pb2+,其中Cd2+对生物体危害严重,且具有能蓄积、难降解、可沿食物链传递等特性;进一步研究发现,Cd2+对东风螺稚螺的96 h半致死质量浓度为3.59 mg/L,安全质量浓度为0.36 mg/L,Cd2+通过东风螺摄取的食物相进行营养传递,对其产生的毒性较水体直接暴露低,但摄食受Cd2+污染的食物是东风螺蓄积Cd2+的主要途径,且东风螺的肝胰脏对Cd2+的蓄积量最高[38-40].此外,在东风螺中存在严重的性畸变现象,其表现为雌性个体会产生不正常的雄性特征,如阴茎和输精管的形成,性畸变严重时甚至会导致雌性个体生殖能力的丧失,这种结果主要由环境有机锡污染所致[41-42].因此,东风螺也可作为开展环境有机物污染和重金属污染研究的良好材料.
3 养殖与育种
3.1 适宜养殖条件
对于水生养殖动物而言,其周围水环境因子和养殖条件的变化将对动物的生长、发育和存活产生直接影响,其中温度、盐度和养殖密度与东风螺的养成结果密切相关.对不同温度条件下养殖的方斑东风螺进行比较,发现其适宜的养殖温度为26~30 ℃,最佳养殖温度为26.81 ℃;与之类似,研究发现方斑东风螺适宜的养殖盐度为26~30,最佳养殖盐度为28.76,最佳养殖密度为527.07 m-2[43-44].在以上3项指标的最优养殖条件下,方斑东风螺的累积生长率和存活率分别达到36.84 mg/d和99.99%,满意度函数值为99.71%[44].
3.2 营养价值与需求
东风螺以其鲜美而独特的味道深受消费者喜爱,市场需求量供不应求,价格居高不下.对国内养殖种方斑东风螺和泥东风螺进行营养成分分析发现,两种东风螺腹足肌肉的蛋白质质量分数高达70%左右,脂肪质量分数为5%左右,糖类质量分数接近10%,氨基酸种类齐全,必需氨基酸相对质量分数高,必需氨基酸指数在43以上,二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)相对质量分数总和分别为7.1%和10.5%,不饱和脂肪酸质量分数为6.4%~15.0%,属于滋补海产品[45].
目前东风螺在养殖中的饵料来源以冰鲜杂鱼为主,但鱼肉品质不稳定且质量难以把控.在明确东风螺的基本营养成分组成后,开展东风螺的营养需求研究,对开发人工配合饲料、保障东风螺养殖产业的健康发展具有重要作用.本课题组以白鱼粉和酪蛋白为饲料蛋白源开展研究,结果显示方斑东风螺饲料蛋白质的适宜质量分数为36.47%~43.10%[46].在此基础上,以鱼油为脂肪源设计5种不同脂肪水平的饲料进行投喂分析,获得方斑东风螺对脂肪的适宜需求质量分数为7.78%~10.74%[47].
为寻找较适宜的蛋白源,本课题组开展了方斑东风螺对不同蛋白源利用的研究.选用鱼粉、豆粕、菜籽粕和啤酒酵母为原料设计6种不同蛋白源组合的饲料,通过投喂实验证实,日粮中各种蛋白源以适当比例混合使用才能获得最佳的生长表现及饲养效益,其中以鱼粉、豆粕、菜籽粕质量比为1∶1∶1的组合为方斑东风螺较优蛋白源[48].为确定方斑东风螺的钙、磷营养需求量,用不同钙和磷含量的饲料饲喂方斑东风螺60 d后,不同钙水平(质量分数0和1.5%)的饲料并不对方斑东风螺的生长性能及机体组成产生显著影响(P>0.05),但不同磷添加水平则对方斑东风螺的体质量增长量和相对增长率有显著影响(P<0.05),且钙与磷之间存在交互作用(P<0.05);饲料中添加质量分数0.5%的磷(总磷质量分数0.64%)可得到最佳生长表现,饲料效果也显著优于其他各实验组.以体质量增长量为指标,采用回归分析法确定饲料中的最适总磷添加质量分数为0.64%~0.97%,适宜的钙磷质量比范围为0.42~0.64[49].
当前,东风螺的人工配合饲料研发和应用较为滞后,市场上尚未出现一种被广泛应用的东风螺饲料.上述研究为东风螺饲料的配方设计和生产提供了数据支持.
3.3 选择育种及遗传参数估算
选择育种是目前动植物新品种培育中最常用和行之有效的手段之一.针对生长性状,按照10%的选择强度,本课题组对主要养殖种方斑东风螺泰国和海南两个地理基础群进行了歧化选择,并估算了两个群体的选择反应和现实遗传力,结果发现不同遗传背景的群体在不同发育阶段的遗传力大小表现不同,且选择反应也存在差别;同时,通过对方斑东风螺泰国群体和海南群体的生长性状进行比较,发现泰国群体在壳长和体质量两个生长性状上表现出显著优势(P<0.01)[50].
另外,遗传参数的估算正确与否直接关系到整个育种工作效率的高低,其中遗传力和遗传相关性是动植物育种中十分重要的遗传参数.本课题组采用巢氏平衡设计法,在泰国群体和海南群体中,共利用27只雄方斑东风螺与81只雌方斑东风螺建立了27个父本半同胞家系与81个全同胞家系,通过同胞分析的方法估算了方斑东风螺主要生长性状的狭义遗传力,结果显示方斑东风螺生长相关的遗传力值处于中上水平,采用群体选育的方法是有效的;同时,采用相关分析的方法研究了方斑东风螺主要生长性状间的遗传相关性,结果显示,除螺旋部长外,壳长、壳宽等其他生长性状间均呈显著相关(P<0.05);此外,采用通径分析的方法研究了壳长等壳型性状对体质量的影响效应,结果表明壳长对体质量的直接效应最大,螺旋部长对体质量的间接效应最大,揭示在东风螺选育过程中可以直接测量壳长指标,同时结合螺旋部长为辅选指标对体质量进行定向选育可取得较好的选育效果[51].因此,以壳长和体质量为选育目标对方斑东风螺泰国群体和海南群体进行了连续4代的选育.2018年,以速长的泰国选育系申报并获得国审“海泰1号”(图3)新品种证书(GS-01-008-2018).

图3 “海泰1号”方斑东风螺新品种Fig.3 "Haitai No.1" new variety of B.areolata
方斑东风螺“海泰1号”贝壳呈长卵圆形,壳质稍薄,螺层约9层,壳面被黄褐色壳皮,壳皮上分布着微黄色不规则的长方形或条形棕褐色或红褐色斑块.该品种生长速度快,在相同养殖条件下,与未经选育的方斑东风螺相比,6月龄的“海泰1号”壳长平均提高18.7%,体质量平均提高32.1%.养殖周期明显缩短,经济效益显著提升.目前方斑东风螺“海泰1号”已在海南省、广东省、福建省等多地开展推广养殖应用,对推动东风螺养殖产业的稳定发展发挥着重要作用.
3.4 杂交育种
杂交实质是不同亲本间基因资源的重新聚合,能快速打破原有遗传的保守性,使杂种获得更大的基因流动性,是增加变异的重要途径,可快速且显著地实现杂交子代生活力、生长势等优良性状的提高,在贝类的遗传改良中具有重要意义[52].因此,杂交育种也成为东风螺遗传改良研究的重要方向.
方斑东风螺广泛分布于东南亚及中国东南沿海地区,因自身活动能力差、喜群居等生活特性,不同群体间存在较大的遗传分化和差异,且群体间不存在交配和生殖障碍问题,群体间杂交是优良品种创制的有效途径.本课题组[53]于2010年率先从泰国罗勇引进方斑东风螺泰国群体并自繁成功;随后采用完全双列杂交的方式,以方斑东风螺海南翁田群体与泰国罗勇群体作为材料,进行群体间远距离杂交.实验结果显示:在幼体发育阶段,泰国群体♀×海南群体♂杂交组合在孵化时间、变态率和变态时间3个指标上均表现出超亲优势,超亲优势率分别为15.9%,8.7%和20.53%;在周年的养殖过程中,泰国群体♀×海南群体♂杂交组合表现出显著的生长优势,其壳长和体质量的中亲杂种优势率分别为20.71%和42.94%,同时保持较低的死亡率,其存活中亲杂种优势率为37.86%;但海南群体♀×泰国群体♂杂交组合在存活上优势更明显,整个养殖周期内其死亡率显著低于其他组合.上述结果表明,方斑东风螺不同群体间杂交存在杂种优势现象,这为方斑东风螺的育种选配和新品种培育指明了方向.
4 DNA分子标记开发和利用
分子标记对动植物的遗传学分析和育种研究具有重要的作用.微卫星标记是一种共显性标记,被广泛应用于物种遗传多样性检测、群体遗传结构分析、亲子鉴定、种质资源的评价与保护以及遗传连锁图谱构建等方面,是贝类育种最常用的标记之一.
本课题组[1,54]采用生物素-磁珠吸附微卫星富集法构建了方斑东风螺和泥东风螺的微卫星文库.在方斑东风螺中,磁珠富集的含有微卫星序列的目的片段大小主要集中在200~1 000 bp,随机挑选88个200~1 000 bp目的片段的阳性克隆进行测序,结果发现67个含有微卫星序列,针对这些微卫星序列共设计16对引物,其中有9对引物能够扩增出清晰稳定的条带;在泥东风螺中,随机挑选100个200~1 000 bp目的片段的阳性克隆进行测序,结果发现80个含有微卫星序列,针对微卫星序列共设计15对引物,其中有9对引物能够扩增出清晰稳定的条带.
应用新开发的9对微卫星标记对中国沿岸方斑东风螺和泥东风螺的遗传多样性及遗传结构进行研究.其中方斑东风螺的海南临高、广东湛江、广西北海和福建诏安4个野生群体的平均等位基因数目范围为10.8~13.6,遗传多样性较高,与应用扩增片段长度多态性(AFLP)标记分析的结果[55]较一致,且4个群体间存在显著的遗传分化(P<0.05),福建诏安和广东湛江2个群体的遗传距离最大,海南临高和广东湛江2个群体的遗传距离最小;泥东风螺的海南临高、广东湛江、广东汕尾和福建诏安4个野生群体的平均等位基因数目范围为21.63~28.38,福建诏安和广东湛江2个群体的遗传距离最大,福建诏安和广东汕尾2个群体的遗传距离最小,4个群体间遗传分化显著(P<0.05),群体间的遗传变异达到23%[1].上述结果说明我国沿海野生东风螺的遗传多样性较高,地理距离是造成遗传分化和遗传变异的主要因素.
此外,采用10对微卫星引物(包括上述新开发的)对方斑东风螺的泰国和海南2个选育系的连续多代群体进行了遗传多样性和遗传变异分析,发现泰国野生群体与海南野生群体存在显著的遗传分化,通过连续3代的生长选择育种,2个选育系的遗传多样性均表现出明显下降,最终海南选育系的遗传结构有偏向泰国选育系的趋势[56],这为利用分子标记辅助东风螺开展选择育种提供了重要参考.
5 展 望
前期针对东风螺生物学的研究多集中于繁殖生物学和生态学方面,在此过程中探明了东风螺的繁殖生物学特性,并突破了东风螺的幼体培养与人工育苗技术难关;此外,明晰了东风螺的营养成分组成及营养价值与需求,为东风螺饲料的研发奠定了重要基础.进而开展东风螺的人工养殖条件及遗传育种研究,促进了东风螺养殖业的发展.但近年来,伴随着东风螺养殖业的快速发展,育苗和养成期大规模暴发性病害时常发生,诸如吻肿病、翻身症、脱壳症等均给东风螺养殖业造成了巨大的经济损失[57-59].分析导致养殖东风螺暴发性病害流行的原因,除养殖技术不佳和养殖生态环境恶化的原因外,养殖东风螺种质的退化也是主要因素之一.多年来,东风螺种苗生产所用亲螺多以农户自养自留为主,由于缺少科学规范的留种方案,严重的近交造成种质退化严重,导致东风螺抗逆和抗病等生产性能明显下降.
目前,虽然东风螺的遗传改良取得了一定的进展,但是针对当下养殖产业面临的新问题和困境,今后应重点关注抗逆、抗病等复杂性状的遗传改良.随着水产动物基因组时代的来临,在东风螺的全基因组序列信息陆续被破译后,应加强基因组育种在东风螺新品种培育中的应用,通过创制具优良性状尤其是抗病性能强的东风螺新品种,并推广应用于生产,以改变当前东风螺养殖业受病害困扰的不利局面.此外,应加快对东风螺人工配合饲料的研发,为东风螺养殖企业提供一种质量稳定可靠的东风螺饲料,用来替代目前杂鱼的投喂以减少安全隐患;同时应加强对东风螺养殖模式和养殖技术的创新研究,探索出一套环境可控、集约化程度高的现代工厂化养殖模式以满足产业发展的需求.综上,多方面的不断提升和改进可为我国东风螺养殖产业的稳定健康发展提供有力支撑.
