硫酸庆大霉素滴眼液质量评价
2023-06-11梅芊卢玉凤张婷婷李倚天杨海燕郭姣梅李洁刘英
梅芊?卢玉凤?张婷婷?李倚天?杨海燕?郭姣梅?李洁?刘英
摘要:目的 对国产硫酸庆大霉素滴眼液的质量现状进行评价。方法 采用法定标准检验与探索性研究相结合,对国家药品计划抽验的23批次样品与调研企业收集的样品进行检验与统计分析。结果 法定标准检验结果显示,23批次硫酸庆大霉素滴眼液合格率为100%。探索性研究揭示,硫酸庆大霉素滴眼液的处方仍有进一步优化的空间,优化硫酸庆大霉素滴眼液的黏度和表面张力可改善其治疗效果,选择合理的抑菌剂可减少其刺激性。同时,现行标准中缺失有关物质、庆大霉素C组分、抑菌剂含量测定及不溶性微粒等检查项;对贮藏条件的要求也不十分合理。结论 目前国产硫酸庆大霉素滴眼液整体质量一般,质量标准有待提高,建议企业关注处方合理性。
关键词:硫酸庆大霉素滴眼液;质量分析;包材;抑菌剂;有关物质;庆大霉素C组分;贮藏条件
中图分类号:R917,R978.1文献标志码:A
Abstract Objective To evaluate the quality status of domestic gentamicin sulfate eye drops. Methods According to the general requirements of national assessment program, the statutory standard methods combined with exploratory researches were used to evaluate the quality of the 23 batches of samples from the national drug market and from pharmaceutical manufacturers were analyzed. Results The legal test results showed that the qualified rate was 100%. But exploratory research showed that the prescription of gentamicin sulfate eye drops could be further optimization. The therapeutic effect can be improved by optimizing the viscosity and surface tension, and the selection of reasonable bacteriostatic agents can reduce its irritation. Additionally, the quality of samples could not be better controlled because of the lack of some examination items, i.e. related substances, C components, the preservative content, and particulate matter. The requirement for storage condition was also not very reasonable. Conclusion The quality of domestic gentamicin sulfate eye drops at present is generally good. The current statutory standard needs to be improved and companies need to focus on the rationality of preparation prescription.
Key words Gentamicin sulfate eye drops; Quality analysis; Packaging material; Preservatives; Related substances; C components; Storage condition
硫酸庆大霉素为氨基糖苷类抗生素,临床主要用于治疗由需氧革兰阴性菌引起的各种感染[1]。1963年,由美国先灵公司在降红小单孢菌属和棘孢小单孢菌属的发酵液中获得[2]。1965年我国中科院福建微生物研究所分离得到产生菌,1969年投产并用于临床[3]。国内现有剂型包括:片剂、胶囊剂、注射剂、颗粒剂和滴眼剂等。
1970年6月,先灵葆雅公司研发的0.3%硫酸庆大霉素滴眼液首先在美国上市;1983年7月和1984年10月,日本点眼药研究所(Nitten)株式会社和美国Allergan公司的仿制药分别在日本和美国上市;1984年,陕西榆林制药厂在中国首仿成功。已上市的国内外产品均为多剂量包装,规格分别为3mg/mL(即 0.3%)与5mg/mL。目前,国内共有硫酸庆大霉素滴眼液生产企业16家,批准文号17个。
2021年,国家药品抽检从11个省(直辖市、自治区)抽取到23批次硫酸庆大霉素滴眼液,涉及2家生产企业,2个批准文号。本文按《中国药典》(以下简称ChP)2015年版[4]或2020年版[5]二部硫酸庆大霉素滴眼液质量标准进行检验,并从药品质量控制、安全有效的角度,基于质量源于设计(QbD)理念,围绕处方、包材、生产工艺、贮藏的合理性及质量可控等方面,对其质量现状进行客观评价,为进一步提高产品质量与完善标准提供依据。
1 仪器与试药
1.1 仪器与试剂
Waters2695高效液相色谱仪(2998 PDA检测器、2489紫外检测器);Thermo Scientific Vanquish高效液相色谱仪(Dionex Corona Veo RS电喷雾检测器);Thermo QE plus 离子轨道阱高分辨质谱仪;Dionex Ultimate 3000双三元液相色谱仪;Mettler Toledo Excellence Titrator T5 自动电位滴定仪;Anton Parr Lovis 2000 M/ME全自动微量落球黏度计;DP-AW精密数字压力计;美国BIO-RAD 680XR酶标仪;英国Grant GD BD-115电热恒温培养箱;长沙维尔康湘鹰TDZ5-WS台式低速离心机;BD Phoenix Spec Nephelometer比浊仪;维科生物ZW-200A型智能集菌仪;PE Frontier傅里叶变换红外分光光度计;Agilent 7010B GC/MS Triple Quad氣相质谱联用仪;Agilent 7900型电感耦合等离子体质谱仪,Thermo XSERIES 2型电感耦合等离子体质谱仪,CEM MARS 6 型微波消解仪;Mettler XPE205电子天平;Mettler Toledo Seven Excellence多参数测定仪;天津天河SMC30C-1渗透压摩尔浓度测定仪。
三氟醋酸、三乙胺、甲醇、乙腈、正己烷、硝酸、甲酸均为色谱纯;水为MilliQ去离子水;其余试剂均为分析纯。
1.2 试药
标准物质:庆大霉素(批号130326-201716)、小诺米星(批号130342-202105)、西索米星(批号130635-202102)、羟苯甲酯(批号100278-201906)、羟苯乙酯(批号100847-201604)、羟苯丙酯(批号100444-202005)、硫柳汞钠(批号135050-201401)、苯扎氯铵(批号100549-201805)、苯扎溴铵(批号135051-202002)均购自中国食品药品检定研究院;对羟基苯甲酸(批号LRAC5151)、四硼酸钠十水合物(批号WXBC5916V)、硼酸(批号SLCG7351)、抗氧剂BHT(批号BCCC0032)购自Sigma-Aldrich;17种邻苯二甲酸酯类混合标准溶液(批号D0010004)购自北京曼哈格生物科技有限公司;8种抗氧剂均购自河北百灵威超精细材料有限公司;元素标准溶液均购自国家有色金属及电子材料分析测试中心;NDMA(批号510166-202003)购自中国食品药品检定研究院,NDEA(批号J1909183)购自上海阿拉丁生化科技有限公司,NMBA(批号C11549831)、EIPNA(批号C12428445)、DIPNA(批号C12617511)、NDPA(批号C11773242)、NDBA(批号C12232327)均购自上海麦克林生化科技有限公司。
试验菌种:铜绿假单胞菌[CMCC(B)10104]、大肠埃希菌[CMCC(B)44102]、金黄色葡萄球菌[CMCC(B)26003]、白色念珠菌[CMCC(F)98001]、黑曲霉[CMCC(F)98003],均购自中国食品药品检定研究院。
动物:家兔,雌雄各半,体重1.8~2.2 kg,购自北京富龙腾飞实验动物研究院有限公司。
样品:2021年硫酸庆大霉素滴眼液国家药品抽检样品23批次,涉及A与B共2个企业。调研收集A与B企业的辅料,2批次低密度聚乙烯药用滴眼剂瓶,2批次硫酸庆大霉素原料与3批次硫酸庆大霉素滴眼液。2批次国外对照样品:美国Allergan公司,规格0.3%,批号T0274;日本Nitten公司,规格0.3%,批号L20A9G。
2 试验方法
2.1 法定标准检验
按ChP2015/2020二部硫酸庆大霉素滴眼液质量标准进行检验,主要项目包括性状、鉴别、pH值、颜色、渗透压摩尔浓度、可见异物、装量差异、无菌和含量测定等。
2.2 探索性研究
2.2.1 处方合理性
通过对硫酸庆大霉素滴眼液中主药、辅料成分的检测,结合原辅料相容性研究及动物实验,从4个方面对处方的合理性进行评价。
(1) 活性药物成分分析
①有关物质 建立高效液相色谱-电雾式检测器(HPLC-CAD)法测定硫酸庆大霉素滴眼液中的有关物质,用十八烷基硅烷键合硅胶为填充剂(pH值适应范围0.8~8.0);以0.2 mol/L三氟醋酸溶液-甲醇(96: 4)为流动相;流速为0.6 mL/min;电雾式检测器(喷雾器温度50℃,数据采集频率10 Hz,滤波10.0 s,幂函数1.00)测定;进样体积20 μL。
②庆大霉素C组分 建立HPLC-CAD法测定硫酸庆大霉素滴眼液中各组分的含量,色谱条件同有关物质。
(2) 辅料测定
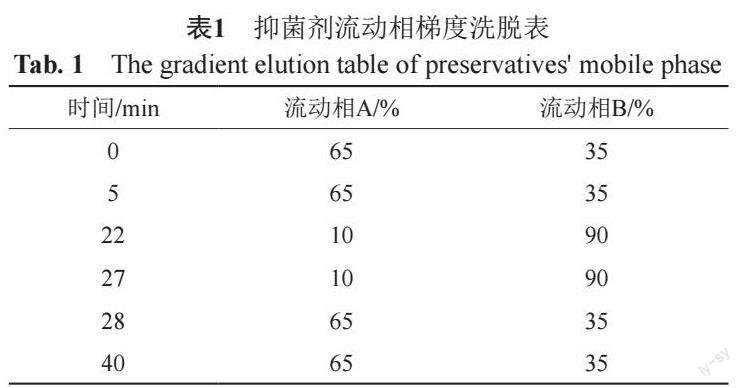
①抑菌剂 建立HPLC-UV法同时测定苯扎溴铵、苯扎氯铵、硫柳汞、羟苯甲酯、羟苯乙酯和羟苯丙酯等6种常用抑菌剂含量。采用Waters XBridge C18色谱柱(5 μm,4.6 mm×150 mm)色谱柱,流动相A为1%三乙胺溶液(用磷酸调pH值至3.05±0.05),流动相B为甲醇,梯度洗脱,见表1;流速1.0 mL/min;柱温30℃;进样量20 μL;检测波长214 nm。
模拟临床用法用量,取国内外代表性样品共7批次,室温放置,于每天早、中、晚从每瓶各挤出1滴弃去,分别在0、7、14、21和28 d采用上述方法测定抑菌剂含量,以考查多剂量包装滴眼剂在临床使用过程中抑菌剂含量稳定性。
采用影响因素试验考察影响抑菌剂稳定性的因素,并建立LC-MS法对样品中可能产生的降解产物进行确定并定量分析。
②pH调节剂/渗透压调节剂 硼砂的含量以0.01 mol/L盐酸为滴定液,建立电位滴定法测定。硼酸的含量是在样品中加入姜黄素,使之与硼形成有色络合物,采用HPLC-UV法间接测定总硼含量,色谱柱为Agilent Zorbax SB-C18色谱柱(5 μm,4.6 mm×150 mm);流动相A为0.012 mol/L四丁基溴化铵,流动相B为甲醇,梯度洗脱;流速1.0 mL/min;柱温30℃;进样量20 μL;检测波长540 nm,测定样品中总硼的含量,再减去电位滴定法测得硼砂含量,间接计算样品中硼酸的含量。
(3) 原辅料相容性
模拟两个企业处方工艺自制小样,分别置于玻璃具塞试管中以排除包材的干扰,在高温、高湿及强光照射条件下放置,于0、5、10和30 d(仅高温)取样,另取硫酸庆大霉素原料适量分别置于玻璃具塞试管中,在高温条件下放置30 d,按建立的有关物质和庆大霉素C组分测定方法对上述样品中有关物质和组分进行测定。
(4) 制剂有效性评价
①黏度 采用Anton Parr Lovis 2000 M/ME全自動微量落球黏度计,试验温度20℃,毛细管倾角45°,测定样品的动力黏度。
②表面张力 使用DP-AW精密数字压力计,采用最大泡压法测定硫酸庆大霉素滴眼液表面张力,试验温度22℃。
③溶血刺激试验 取家兔心脏血离心沉淀的红细胞混悬液,采用红细胞溶血(RBC)试验对硫酸庆大霉素滴眼液的溶血性进行检测,评价该品种的体外刺激性。
④对急性细菌性结膜炎模型治疗作用研究 取健康家兔,上眼睑结膜下注射金黄色葡萄球菌的菌悬液建立急性细菌性结膜炎模型,将成功建模家兔随机分组后立即给予药物治疗,模拟考察国内外硫酸庆大霉素滴眼液的临床疗效差异。
2.2.2 包材合理性
(1)包材透明度
取国内外4家企业的硫酸庆大霉素滴眼液各1支,去除标签,倾出内容物,目视观察各滴眼液瓶身透明度情况,并参照国家药包材标准(2015)YBB00012002-2015低密度聚乙烯输液瓶[6]检查瓶身的透光率。
(2)包材材质
取国内外4家企业滴眼液瓶的瓶身,在 4000~600 cm-1范围内进行红外光谱测定,与包材对照红外图谱比较,确定材质。
(3)水蒸气透过量
取国内外4家企业样品,分别在40℃相对湿度95%、40℃相对湿度25%、4℃相对湿度95%和4℃相对湿度25%条件下放置14 d,计算包材的水蒸气透过量。
(4)滴出量
参照国家药包材标准(2015)YBB00062002-2015低密度聚乙烯药用滴眼剂瓶[7]中滴出量检查方法,取国内外4家企业样品,擦干瓶口,先弃去前10滴,然后均匀收集(10滴/min)50滴,测定体积,计算平均滴出量。
(5)包材相容性
包材的迁移试验包括建立GC-MS法测定17种邻苯二甲酸酯类增塑剂、HPLC-UV法测定8种抗氧剂,以及ICP-MS法测定16种金属元素;通过影响因素试验对样品中有关物质、庆大霉素C组分与抑菌剂含量的测定来评估包材的吸附性。
2.2.3 生产工艺合理性
(1)羟苯乙酯稳定性
羟苯乙酯常温下难溶于水,国内2家企业制剂生产工艺中均采用加热至微沸使其溶解。模拟工艺中羟苯乙酯溶解方法设计试验,考察加热工艺对羟苯乙酯稳定性的影响。
(2)有关物质
通过测定硫酸庆大霉素原料和对应批次的滴眼液有关物质含量,考察制剂的生产工艺对有关物质的影响。
(3)不溶性微粒
采用光阻法对国内两家企业样品进行不溶性微粒检查,考察该品种的生产工艺是否能够控制微粒的污染。
(4)基因毒性杂质
硫酸庆大霉素属于发酵产生的多组分氨基糖苷类抗生素,发酵过程是一个复杂的生物化学反应,原材料如各种培养基来源于自然界,含有亚硝酸盐,且庆大霉素结构中含有多个伯胺基和仲胺基,这些类型的胺尤其是仲胺,在一定条件下存在与水中或其他污染途径中的亚硝酸盐反应产生N-亚硝胺类基因毒性杂质的风险。参考USP-NF通则<1469>[8]方法,建立UPLC-MS/MS法测定硫酸庆大霉素滴眼液中7种N-亚硝胺杂质。
(5)影响因素试验
以有关物质、颜色、pH值、可见异物、渗透压摩尔浓度、抑菌剂、基因毒性杂质、抗氧剂迁移、塑化剂迁移、金属元素迁移和庆大霉素C组分含量等为指标,考察高温(60℃)、高湿(相对湿度92.5%、25℃)与光照(4500 Lx)[9]对国内外硫酸庆大霉素滴眼液質量的影响。
3 结果与讨论
3.1 法定标准检验
按法定标准检验,23批次样品均符合规定,合格率100%。对与产品质量密切相关的主要检验项目如pH值、渗透压摩尔浓度和含量测定结果进行统计分析。
3.1.1 pH值
23批次样品pH值测定结果在6.6~6.8之间,A企业样品pH值均为6.8,B企业样品pH值均为6.6,表明两企业生产工艺的稳定性均较好。
3.1.2 渗透压摩尔浓度
23批次样品渗透压摩尔浓度测定结果在285~296 mOsmol/kg之间,同一企业不同批次样品的渗透压摩尔浓度值接近,RSD≤1.5%。
3.1.3 含量测定
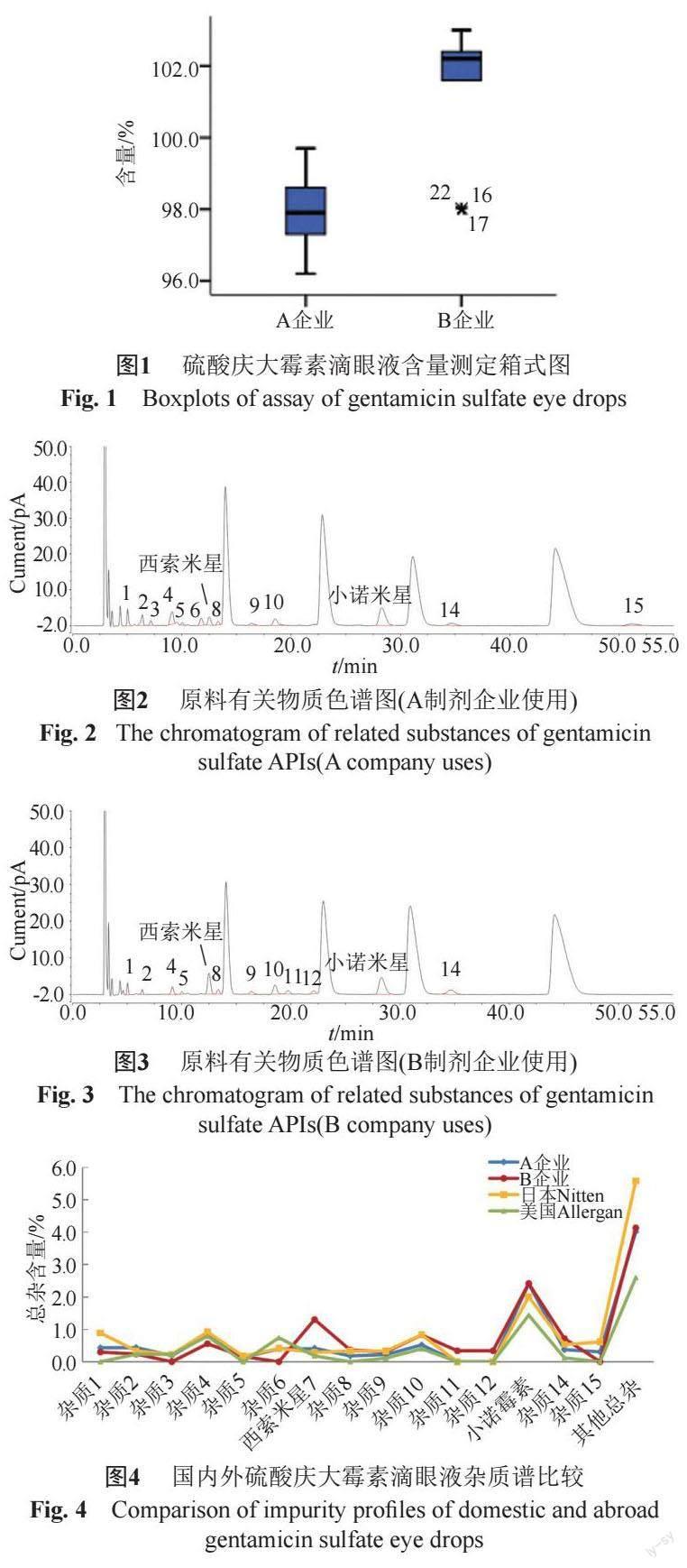
23批次样品含量测定结果为96.2%~103.0%范围内,平均值为100.5%,A企业不同批次样品的含量接近,B企业2021年新生产的3批次样品由于更换原料批次导致含量与同企业其他批次样品含量相比偏低,提示该企业应关注投料稳定性,见图1。
3.2 探索性研究
3.2.1 处方合理性
(1)活性药物成分分析
①有关物质 采用拟定方法对23批次抽检样品、3批次调研收集样品、2批次调研收集原料及2批次国外对照样品进行有关物质进行测定,并对制剂与原料杂质谱、国内外制剂杂质谱对比分析。
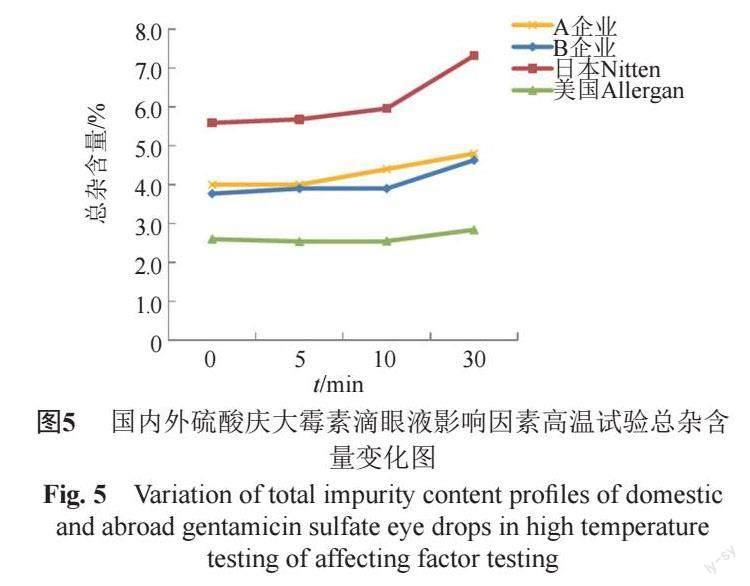
2家企业制剂的杂质谱不同,但均与各自使用的原料一致,见图2~4;制剂的生产工艺对有关物质无贡献;国内外制剂杂质谱差异不大,与原料来源相关,见图5。
②组分 国内2家企业制剂的C2和C2a组分含量差异较大,为原料来源不同导致;A企业产品批次间各组分含量差异较小,B企业2021年新生产产品由于更换原料批次导致与其余批次产品的C1、C1a和C2组分含量差异较大;国内外制剂由于原料的来源不同,导致产品中4个组分的含量不一致。
(2)辅料
①抑菌剂 国内2家企业的样品中均检出羟苯乙酯,且产品的效期与羟苯乙酯含量存在显著正相关;国外2批次样品均检出苯扎氯铵,但类别不同,日本Nitten使用为n-C14H29单取代,美国Allergan使用为n-C12H25、n-C14H29混合取代。
模拟28 d临床使用期,期间国内外样品的抑菌剂含量均无明显变化,表明使用中抑菌剂含量稳定。
国外制剂中的苯扎氯铵在高温、高湿和强光照射条件下含量无明显变化;国内制剂中的羟苯乙酯在高湿和强光照射条件下,含量无明显变化,但在高温条件下,随放置时间延长,羟苯乙酯含量不断降低。经LC-MS法和包材提取试验确认,一部分降解成对羟基苯甲酸,大部分被包材吸附。
国内外制剂的抑菌效力均可达ChP2020中的A级标准;国外制剂的抑菌效力高于国内制剂;国内2家企业的处方不添加抑菌剂也可达ChP2020中的A级标准。2017年中检院承担的硫酸庆大霉素滴眼液抑菌效力专项抽检中,对抑菌剂使用情况进行过探索性研究。认为使用羟苯乙酯可以满足《中国药典》对抑菌效力的要求,但处方量0.3 mg/mL高于国际公认的眼用制剂羟苯乙酯安全剂量0.26 mg/mL[10]。提示国内产品可能存在抑菌剂添加过量问题。建议企业对处方中抑菌剂使用的合理性进行充分的评估。
②pH调节剂/渗透压调节剂 本次抽检的2家企业制剂处方中均以硼酸/硼砂体系作为缓冲剂来调节样品的pH值和渗透压。在美国FDA 批准的非活性成分数据库(2021年)[11]中,滴眼液的硼酸最大用量为1.55%(W/V),硼砂的最大用量为1.1%(W/V)。23批次抽检样品中硼砂和硼酸含量与处方量基本一致,无违规投料现象。但国内2家企业制剂中的硼酸用量均高于FDA规定的滴眼液中硼酸的最大用量,其合理性值得进一步的评估。
(3)原辅料相容性
模拟两企业处方的溶液在高湿及强光照射条件下,有关物质(西索米星、小诺米星、单杂)和C组分含量均无明显变化;高温条件下有关物质和C组分含量无明显变化,但总杂在30 d时增大,与对应的原料高温放置30 d有关物质的变化结果一致,说明杂质谱变化源于原料自身,与辅料无关;提示该品种滴眼液处方较稳定,原辅料相容性良好。
(4)制剂有效性评价
①黏度 黏度控制是滴眼液的一个重要功能性指标,适当增加黏度可延长药物在眼内滞留时间,从而增加生物利用度,提高疗效,也可减少对眼部的刺激性。眼用溶液适宜的黏度在4.0~5.0 mPa·s[12],本次抽检的国内2家企业及日本Nitten的滴眼液处方中未添加黏度调节剂,测得黏度值与纯水相当,远低于滴眼液黏度推荐值,滴眼时药液易快速流出,可能影响其药效。美国Allergan滴眼液处方中添加有黏度调节剂聚乙烯醇,黏度较适宜。
②表面张力 药物溶液的表面张力直接影响其表面吸附及黏膜上的吸附,表面张力愈小,越有利于与泪液混合,也有利于药物与角膜的接触,使药物更易渗入角膜。滴眼液表面张力在40~46 mN/m范围内可与泪液膜保持较好的相容性[13],本次抽检的国内2家企业和日本Nitten样品的平均表面张力与水接近,美国Allergan滴眼液的表面张力虽较小,但也大于滴眼液表面张力推荐值40~46 mN/m,提示它们与泪液膜的相容性均较差,不利于滴眼液与泪液混合,也不利于药物与角膜的接触,因而可能导致疗效降低。
③溶血刺激试验 日本Nitten制剂有中度刺激性,国内2家企业和美国Allergan制剂均为轻度刺激性。日本Nitten产品刺激性较大的原因可能与其使用的抑菌剂苯扎氯铵为n-C14H29单取代组分有关,C14取代的苯扎氯铵的刺激性较C12取代的苯扎氯铵的刺激性大[6]。
④对急性细菌性结膜炎模型治疗作用研究 国内外样品中,美国Allergan制劑对家兔急性细菌性结膜炎的治疗作用最好,表明其处方组成较合理,其添加的黏度调节剂,能很好地提高活性成分的生物利用度,保证本品的有效性;国内2家企业样品次之;日本Nitten制剂较弱,其原因可能与对眼部的刺激性较大有关。
上述结果提示,硫酸庆大霉素滴眼液的处方仍有进一步优化的空间。调节处方改变其黏度和表面张力改善其治疗效果,选择合理的抑菌剂减少其刺激性,将使得处方更为合理。
3.2.2 包材合理性
(1)包材透明度
目视与透光率测定结果一致,4家企业中,B企业包材透光率最大,A企业次之,日本Nitten较小,美国Allergan基本不透光。滴眼剂瓶的透光率与粒料来源、添加剂与瓶体厚度有关。由于硫酸庆大霉素滴眼液中原、辅料对光均不敏感,且滴眼液的瓶身粘贴标签已具有一定的遮光作用,因而,在保证滴眼剂瓶保护功能和使用性能的前提下,选用透光率适宜的包材,以利于制剂的可见异物检查及患者使用时观察药液颜色变化和异物情况。
(2)包材材质
国内外4家企业滴眼液瓶的材质均为聚乙烯材料,但A企业说明书中未明确包材材质,其余3家企业说明书中标示的包材材质与实际检测一致。建议企业说明书应对包材的材质进行规范的描述。
(3)水蒸气透过量
在40℃相对湿度95%、4℃相对湿度95%和4℃相对湿度25%条件下,国内外样品的包材几乎均无水蒸气交换。40℃相对湿度25%条件下均有不同程度的重量损失,且国内2家企业包材的减失重量均小于国外2家企业包材,提示国内企业包材阻隔性能优于国外企业。
(4)滴出量
日本Nitten、A企业与B企业样品的滴出量接近,为0.041~0.044 mL/滴,美国Allergan样品的滴出量为0.054 mL/滴。滴出量的差异与滴眼液的黏度、表面张力、聚乙烯瓶瓶身的软硬度及瓶嘴的孔径尺寸等因素相关,美国Allergan产品的滴出量高于国内,这可能是其对急性细菌性结膜炎的治疗作用优于国内样品的原因之一。
(5)包材相容性
国内外样品中均未发现抗氧剂迁移,金属离子和增塑剂的迁移量均远低于参考限值,表明该品种由包材迁移带来的安全风险较低。吸附试验结果表明,聚乙烯瓶对硫酸庆大霉素原料无吸附作用;高温条件下,包材聚乙烯瓶对样品中的抑菌剂羟苯乙酯具有一定的吸附作用。
上述结果提示,国产制剂使用的包材基本可以满足硫酸庆大霉素滴眼液的需要;建议企业应在说明书对包材材质进行规范的描述。
3.2.3 生产工艺合理性
(1)羟苯乙酯稳定性
羟苯乙酯经加热至微沸保持5和10 min,或水浴放置1 h后,其降解产物对羟基苯甲酸含量很小,均不大于0.1%,表明生产中羟苯乙酯几乎不会降解。
(2)有关物质
原料和对应批次的制剂有关物质结果一致,表明生产工艺对有关物质无影响。
(3)不溶性微粒
国内两家企业代表性样品中25及50 μm的微粒均未检出,10 μm的微粒均不超过2粒/mL。虽然《中国药典》对眼用制剂中的不溶性微粒未做出具体的限度要求,但USP-NF通则<789>[14],JP18通则6.0[15]均规定了眼科溶液中不溶性微粒检查法及限度。本次检验中,国产样品中的不溶性微粒符合USP通则<789>的限度规定,且满足ChP2020通则0903[16]中注射剂的要求。表明企业的过滤工艺、直接接触药液的包材质量及处理工艺均较理想。
(4)基因毒性杂质
国内外样品以及调研收集的国内硫酸庆大霉素原料均未检出7种N-亚硝胺杂质,表明上述杂质在原料、制剂的生产过程中和储存过程中均未产生,可以保证药物的安全性。
(5)影响因素试验
①有关物质 高温、高湿及光照条件下,国内外样品的西索米星、小诺米星和最大单杂含量基本无变化;高湿及光照条件下,各样品的总杂基本无变化,但高温条件下,除美国Allergan外,其余3家企业样品的总杂均略有增大趋势。
②庆大霉素C组分 影响因素试验3种条件下,国内外样品中各组分和总组分含量均无明显变化。
③颜色 高温5与10 d、高湿及光照时,各样品颜色无变化,日本Nitten为微黄色,其余均为无色,高温30 d时,国内2家企业与日本Nitten样品的颜色均加深,但美国Allergan样品的颜色在影响因素试验3种条件下均为无色,无变化。通过原、辅、包交叉相容性试验结果,判断制剂经高温放置后颜色变化源于原料本身,与辅料和包材无关。
④pH值 影响因素试验3种条件下,国内2家企业与日本Nitten样品的pH值均无明显变化,仅高温条件下美国Allergan样品的pH值由6.8(0 d)降至6.3(30 d)。其可能原因与其处方无缓冲盐体系有关。
⑤渗透压摩尔浓度 高湿和光照下,各样品渗透压摩尔浓度值均无明显变化,但在高温条件下,诸样品的渗透压摩尔浓度均呈不断增大趋势,其中美国Allergan样品的渗透压摩尔浓度由306 mOsmol/kg(0 d)升至340 mOsmol/kg(30 d),远大于规定的上限(320 mOsmol/kg);而国内2家企业样品渗透压摩尔浓度仅由290/296 smol/kg(0 d)升至298/302 smol/kg(30 d),日本Nitten的渗透压摩尔浓度由288 mOsmol/kg(0 d)升至301 mOsmol/kg(30 d)。结合前述包材水蒸气透过量结果,其可能原因为高温干燥条件下水分丢失所致。
(6)抑菌剂 高湿及光照下,国内2家企业样品中抑菌剂羟苯乙酯含量基本无变化,但高温时由于包材对其的吸附作用,其含量不断降低。高温、高湿及强光照射条件下,国外2家企业样品中抑菌剂苯扎氯銨含量基本无变化。
(7)可见异物、基因毒性杂质、抗氧剂迁移、塑化剂迁移、有害金属元素释放,均无明显变化。
3.2.4 贮藏
ChP2020二部[5]规定硫酸庆大霉素滴眼液贮藏条件为“密闭,在凉暗处保存”,USP-NF[17]和JP18[18]中贮藏条件分别为“密闭,不超过40℃保存”和“密闭保存”。硫酸庆大霉素制剂历年国家药品抽检(2011与2012的注射液、2017年的片/颗粒)结果显示,硫酸庆大霉素性质稳定,极难降解。上述影响因素试验结果也表明,光照对硫酸庆大霉素滴眼液的质量无影响,高温条件下仅部分考察指标略有变化,提示该品种在阴凉处保存,无须刻意避光即可保证产品质量,合理的贮藏条件可降低本品的贮藏和运输成本。
4 总结
采取法定标准检验结合探索性研究对硫酸庆大霉素滴眼液的质量现状进行了评价。按法定标准检验,23批次硫酸庆大霉素滴眼液均符合规定。探索性研究显示,优化硫酸庆大霉素滴眼液的黏度和表面张力可改善其治疗效果,选择合理的抑菌剂可减少其刺激性,提示硫酸庆大霉素滴眼液的处方仍有进一步优化的空间。此外,《中国药典》在有关物质、庆大霉素C组分、抑菌剂含量、不溶性微粒等方面仍有提升的空间,且其贮藏条件也可进一步合理化。
参 考 文 献
Bo L, Erwin A, Ann V S, et al. Analysis of unknown compounds in gentamicin bulk samples with liquid chromatography coupled with ion trap mass spectrometry[J]. Rap Commun Mass Spectr, 2006, 20: 393-402.
Roger J B, Sheldon S, William M M. Laboratory and clinical studies of gentamicin:A new broad-spectrum antibiotic[J]. Ann Int Med , 1963, 59(5): 593-604.
搜狐网. 新中国抗生素研制故事: 让人又爱又恨、聋了一代人耳朵的庆大霉素[EB/OL]. [2021-12-27]. https://www.sohu.com/a/195945077_793726.
国家药典委员会. 中华人民共和国药典[S](2015年版二部). 北京: 中国医药科技出版社, 2015: 1328.
国家药典委员会. 中华人民共和国药典[S](2020年版二部). 北京: 中国医药科技出版社, 2020: 1580-1581.
中国食品药品检定研究院. 国家药包材标准[S]. 北京: 中国医药科技出版社, 2015: 123-136.
中国食品药品检定研究院.国家药包材标准[S]. 北京: 中国医药科技出版社, 2015: 147-149.
USP-NF Online[EB/OL]. [2022-4-12].https://doi.org/10.31003/USPNF_M15715_02_01.
國家药典委员会. 中华人民共和国药典[S](2020年版四部). 北京:中 国医药科技出版社, 2020: 457-460.
马仕洪, 戴翚, 胡昌勤. 国产抗生素滴眼液中抑菌剂应用的合理性分析[J]. 中国抗生素杂志, 2021, 46(3): 196-201.
U.S. Food & Drug Administration[EB/OL]. [2021-9-17]. https://www.accessdata.fda.gov/scripts/cder/iig/index.cfm?event=BasicSearch.page.
潘卫三. 新药制剂技术[M]. 北京: 化学工业出版社, 2004.
Martina H G, Marina J, Anita H, et al. Tear fluid-eye drops compatibility assessment using surface tension[J]. Drug Dev nd Pharm, 2017, 43(2): 275-282.
USP-NF Online[EB/OL]. [2021-1-27].https://online.uspnf.com/uspnf/document/1_GUID-79EB4754-EA8C-481D-833F-77EF93739DE6_1_en-US.
The Japanese European ⅩⅧ[S]. Ministry of Health, Labour and Welfare, 2021: 168-169.
国家药典委员会. 中华人民共和国药典[S](2020年版四部). 北京: 中国医药科技出版社, 2020: 125-126.
USP-NF Online[EB/OL]. [2020-11-16].https://online.uspnf.com/uspnf/document/1_GUID-F14C0514-21AD-49F6-8F47-ED2AE19E07EE_2_en-US .
The Japanese European ⅩⅧ[S]. Ministry of Health, Labour and Welfare, 2021: 1067.
