注射用头孢噻肟钠的质量评价
2023-06-11王韵王强李香荷高燕霞
王韵?王强?李香荷?高燕霞
摘要:目的 按照国家药品抽检要求,评价国内不同企业生产的注射用头孢噻肟钠的质量。方法 国家标准检验与探索性研究相结合,对全国范围内的224批次抽检样品进行评价。结果 按法定标准检验,合格率为100%,但产品在溶液的澄清度、溶液的颜色、装量差异等项目存在边缘合格产品;探索性研究结果显示,法定标准在杂质控制、聚合物测定等方面存在一定不足,原料缺少对生产过程产生的基因毒性杂质2-巯基苯并噻唑的控制。结论 国产注射用头孢噻肟钠质量较优,且近年有明显质量提升。建议修订质量标准,完善聚合物、有关物质等控制,建议生产企业关注产品中2-巯基苯并噻唑的潜在安全风险。
关键词:注射用头孢噻肟钠;质量评价;有关物质;聚合物;基因毒性杂质
中图分类号:R978.1文献标志码:A
Abstract Objective To evaluate the quality of cefotaxime sodium for injection produced by different domestic enterprises according to the national drug sampling requirements. Methods According to the results of national standard inspection combining research, 224 batches of sampled samples from the nationwide were evaluated. Results The qualified rate was 100%, but there were some edge qualified products on the items of solution clarity, solution color, and weight variation. The exploratory research results showed that the legal standard was insufficient on impurity profile control and polymer determination, and lacks the control of genotoxic impurity 2-mercaptobenzothiazole in raw material which was produced in the manufacture process. Conclusion The quality of domestic cefotaxime sodium for injection is good and significantly improved in recent years. It is suggested to revise the quality specification including to improve the determination methods on polymer and related substances, and is suggested that the manufacturers pay attention to the potential safety risks of 2-mercaptobenzothiazole in the products.
Key words Cefotaxime sodium for injection; Quality evaluation; Related substances; Polymers; Genotoxic impurity
头孢噻肟钠(cefotaxime sodium)为第三代头孢菌素,于1975年由法国Roussel Uclaf公司研究所发现,并与德国Hoechst公司共同开发,1980年在德国上市[1]。具有抗菌谱广、稳定、使用安全的特性,临床上主要用于敏感细菌引起的急性和慢性细菌感染[2]。
头孢噻肟钠制剂国外有注射用头孢噻肟钠和头孢噻肟钠注射液两种,我国目前仅批准有注射用粉针剂。根据对制剂企业的调研,国内注射用头孢噻肟钠均由无菌原料直接分装制成,生产过程中未添加其他辅料。经查询国家药品监督管理局网站,国内现有注射剂生产企业76家,批准文号227个,有0.25、0.5、0.75、1.0、1.5、2.0、2.5、3.0和4.0 g共9种规格。注射用头孢噻肟钠收载于《中国药典》2020年版[3]及USP44版[4]。非国家基本药物。
2022年,注射用頭孢噻肟钠列为国家药品抽检品种。按照国家抽检的基本要求[5],在完成法定标准检验的基础上,进行了探索性研究,对国内注射用头孢噻肟钠的质量现状进行评价,并从安全性和有效性角度,提出相关建议。
1 仪器与试药
1.1 仪器
LC-20AT高效液相色谱仪(日本岛津公司),Sciex Atrap6500质谱仪(AB Sciex公司),U3000高效液相色谱仪(美国赛诺菲公司),Mettler Toledo XS205型电子天平(瑞士Mettler Toledo公司);YB-II型澄明度测定仪。
1.2 试药
头孢噻肟对照品(130483-202106,90.0%),2-巯基苯并噻唑(195066-202001,99.1%)购自中国食品药品检定研究院。
醋酸铵、乙酸和甲醇均为色谱纯(fisher chemical),水为超纯水,其他试剂均为分析纯。
1.3 样品
本次抽检共抽取到31家生产企业的224批次样品,涉及批准文号51个。抽样覆盖全国30个省/自治区/直辖市,抽样最多的省份为广东省,为20批次,占全部抽样量的8.9%。抽检样品可较好地表征国内本品种目前的生产和使用状况。
2 试验方法
2.1 法定标准检验
本次抽检涉及的31家生产企业中,29家企业执行《中国药典》2020年版或2015年版标准;2家企业部分产品执行《中国药典》2020年版标准,部分产品执行国家药品监督管理局标准,包括YBH13792021、YBH13752021和YBH13762021。各标准的主要区别在于有关物质和聚合物的测定。
2.2 有关物质及聚合物测定
采用高效液相色谱法(HPLC)。色谱条件:色谱柱为岛津Shim-pack GISS C18柱,4.6 mm×250 mm,5 μm;以0.05 mol/L磷酸盐缓冲液(取7.1 g无水磷酸氢二钠,置1000 mL量瓶中,加水溶解并稀释至刻度,用磷酸调节pH值至6.25)为流动相A,以甲醇为流动相B,按表1梯度洗脱程序进行洗脱;流速为1.0 mL/min;柱温为30℃;检测波长为235 nm;进样体积10 μL。
2.3 有关物质及聚合物质谱分析
色谱条件:色谱柱为岛津Shim-pack GISS C18柱,4.6 mm×250 mm,5 μm;以乙酸铵缓冲液(取3.85 g乙酸铵,置1000 mL量瓶中,加水溶解并稀释至刻度,用乙酸调节pH值至6.25)为流动相A,以甲醇为流动相B,按表1梯度洗脱程序进行洗脱;流速为每分钟1.0 mL;柱温为30℃;检测波长为235 nm;聚合物杂质定位对照溶液进样20 μL,其余进样体积均为10 μL。
质谱条件:离子源 ESI;Nebulizimg Gass流速
1.5 mL/min;CDL温度200℃;Heat Block 温度200℃;Equipment温度40℃;扫描方式正离子扫描;检测器电压:1. 54 kV。
2.4 基因毒性杂质2-巯基苯并噻唑的测定
采用HPLC方法。色谱条件:色谱柱岛津WondaSil C18-WR柱,4.6 mm×250 mm,5 μm,流动相为0.1%磷酸(量取磷酸0.1 mL至100 mL量瓶中,加水稀释至刻度):乙腈=70:30混匀。流速0.8 mL/min,柱温40℃,检测波长为319 nm,进样量20 μL。
3 结果与讨论
3.1 产品总体质量
依据现行标准检验,本次抽检的224批次注射用头孢噻肟钠全部符合规定。该品种2010年曾被列为国家抽检品种,检验合格率为94.76%,不合格样品12批,涉及8个企业,不合格项目为装量差异和溶液的澄清度[6]。此次抽检合格率为100%,提示注射用头孢噻肟钠产品总体质量近年来有所提升。与产品质量密切相关的几个关键检测项目结果如下。
3.1.1 溶液的澄清度
溶液的澄清度为《中国药典》评估注射药品质量的一个常规检查项。本次抽检中,全部样品的溶液澄清度均符合规定,合格率100.0%,但检验结果发现,208批次样品溶解及加酸后呈澄清,16批次样品略出现浑浊(浊度不浓于1号浊度标准液),提示上述批次样品质量状况不理想,对其效期中溶液澄清度的变化应予以关注。分析澄清度近限度的样品与样品杂质总和的相关性,未发现二者有明显的相关。文献报道,药物与胶塞之间的相互作用可能使药物的澄清度不稳定[7],提示企业应重视包材相容性的考察。与2010年国家药品抽检结果相比,该项目2010年为主要不合格项,说明近年来该项目上药品质量有了一定的提升;由于仍存在近限度样品,说明溶液的澄清度仍是影响注射用头孢噻肟钠质量的一个重要因素,应引起生产单位和检验部门的充分重视。
3.1.2 溶液的颜色
本次抽检的224批样品的溶液的颜色均符合规定,样品溶液的颜色为黄绿色。检验结果发现,93.7%的样品溶液的颜色为黄绿色2号至黄绿色5号;颜色较深的样品来自不同企业,其中5批次样品溶液的颜色介于黄绿色6号与黄绿色7号之间,已接近颜色限度。对溶液的颜色与贮存时间进行相关性分析,呈正相关(P<0.05),提示上述批次样品的溶液颜色在有效期内仍可能增加,存在安全风险。提示企业应关注样品效期内溶液颜色的变化。
3.1.3 有关物质
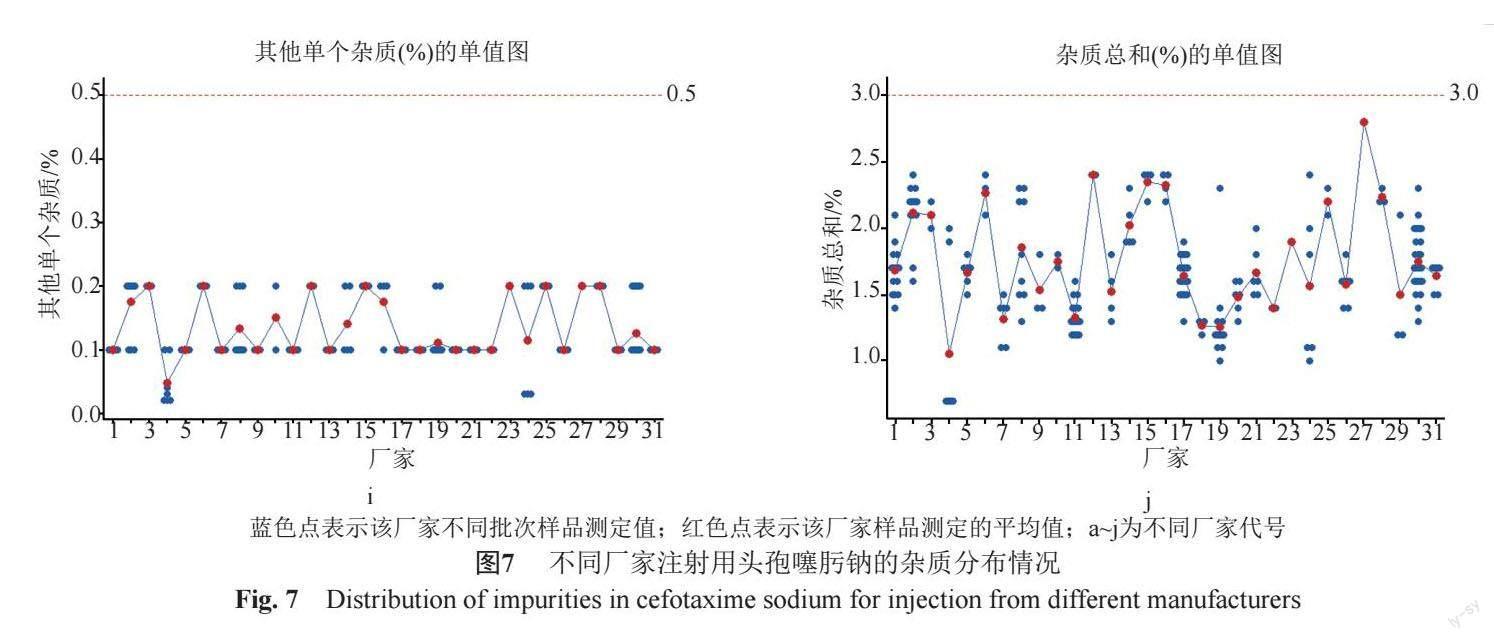
采用HPLC法,按现行标准检验合格率100%。其中单个杂质含量为0.2%~0.8%,主要集中在0.2%~0.5%之间;杂质总和含量为0.7%~3.0%,均未超过标准规定的限度,详见图1 。不同企业间杂质含量差异较大,但从全部测定结果可以看出,单个杂质与杂质总和含量均远小于《中国药典》中相应的限度规定,提示現行药典标准仍有提高的空间。
3.1.4 头孢噻肟聚合物
本次抽检所涉及的药品标准中均设有分子排阻法测定头孢噻肟聚合物的检查项(限度为1.0%),样品合格率为100.0%。此外,厂家29同时采用反相色谱法测定聚合物。本次抽检中该厂家的3批次样品,采用分子排阻法测得头孢噻肟聚合物含量均为0.01%,采用反相色谱法测得头孢噻肟聚合物含量分别为0.3%、0.3%和0.4%。提示现行药典方法检测不能检测到全部聚合物类杂质。
3.1.5 装量差异
224批次样品装量差异测定结果均符合《中国药典》2020年版要求。对本次抽检结果进行分析,厂家17、厂家30、厂家8各有1批次,在初试中有一支样品超出限度,进行复试后符合规定;厂家16有 2批次,厂家19、厂家14各有1批次有一支样品装量差异达到±5%;提示该品种的装量差异仍具体潜在风险,应予以关注。由企业调研结果可知,注射用头孢噻肟钠原料粉体的性质会导致制剂分装性的差异。头孢噻肟钠结晶工艺中的搅拌速度、晶种加量、养晶时间对原料药的比容及流动性均有影响,从而可能影响制剂分装工艺的稳定性[8]。综上,提示各企业应根据其制剂分装工艺的特点确定适宜原料的粉体性质,当使用不同厂家原料时,需要重视其粉体特性对分装的影响。
3.1.6 含量测定
224批次样品的含量以无水物计算,分布于91.1%~97.0%,均值为93.3%;按平均装量计算,分布于94.6%~103.8%,均值为99.2%(图2)。主成分含量测定值均在各标准所规定的限度范围内,未发现低限投料问题。
3.2 探索性研究
3.2.1 有关物质及头孢噻肟聚合物测定
比较EP10.8、USP44和《中国药典》2020年版头孢噻肟钠原料的有关物质测定方法,认为EP10.8的分析方法较理想,以此为基础,参考YBH13762021和YBH13752021对其梯度洗脱程序进行了优化,建立了可同时测定有关物质及聚合物的分析方法。
应用LCMS-IT-TOF技术,对样品中的杂质进行分析,通过与头孢噻肟杂质A、杂质B、杂质E、杂质F、杂质G、氨噻肟酸、7-氨基头孢烷酸对照品的比对,参考EP10.8和USP44中的杂质结构,确定了其中7个杂质的结构。有关物质分析的典型HPLC色谱图见图3,其中杂质1为氨噻肟酸,杂质2为7-氨基头孢烷酸,杂质B为去乙酰头孢噻肟,杂质A为头孢他美,杂质E为去乙酰头孢噻肟内酯,杂质F为头孢噻肟二聚体,杂质G为头孢噻肟二肟。各杂质结构见表2。
根据强制降解试验结果及LC-MS/ MS质谱的结果分析,通过酸、碱、氧化、光、紫外和热降解试验可知,在不同的条件下各杂质的变化不同(表3)。头孢噻肟钠在酸、热、碱、氧化和紫外条件下都有一定的降解,杂质B、E、F为最易产生的杂质;在光照和紫外降解条件下,头孢噻肟钠可降解产生杂质D。提示企业应关注原料和制剂的生产条件,并注意产品的运输、贮存条件。
参考国家药品标准YBH13762021和YBH1375 2021及相关文献,优化了新的有关物质分析方法,对聚合物杂质定位对照溶液进行分析(图4),可发现6个主要杂质。结合文献报道的聚合物结构[9-10],对检测到的聚合物杂质峰进行归属,并应用LCMS-IT-TOF技术对结果进行验证。
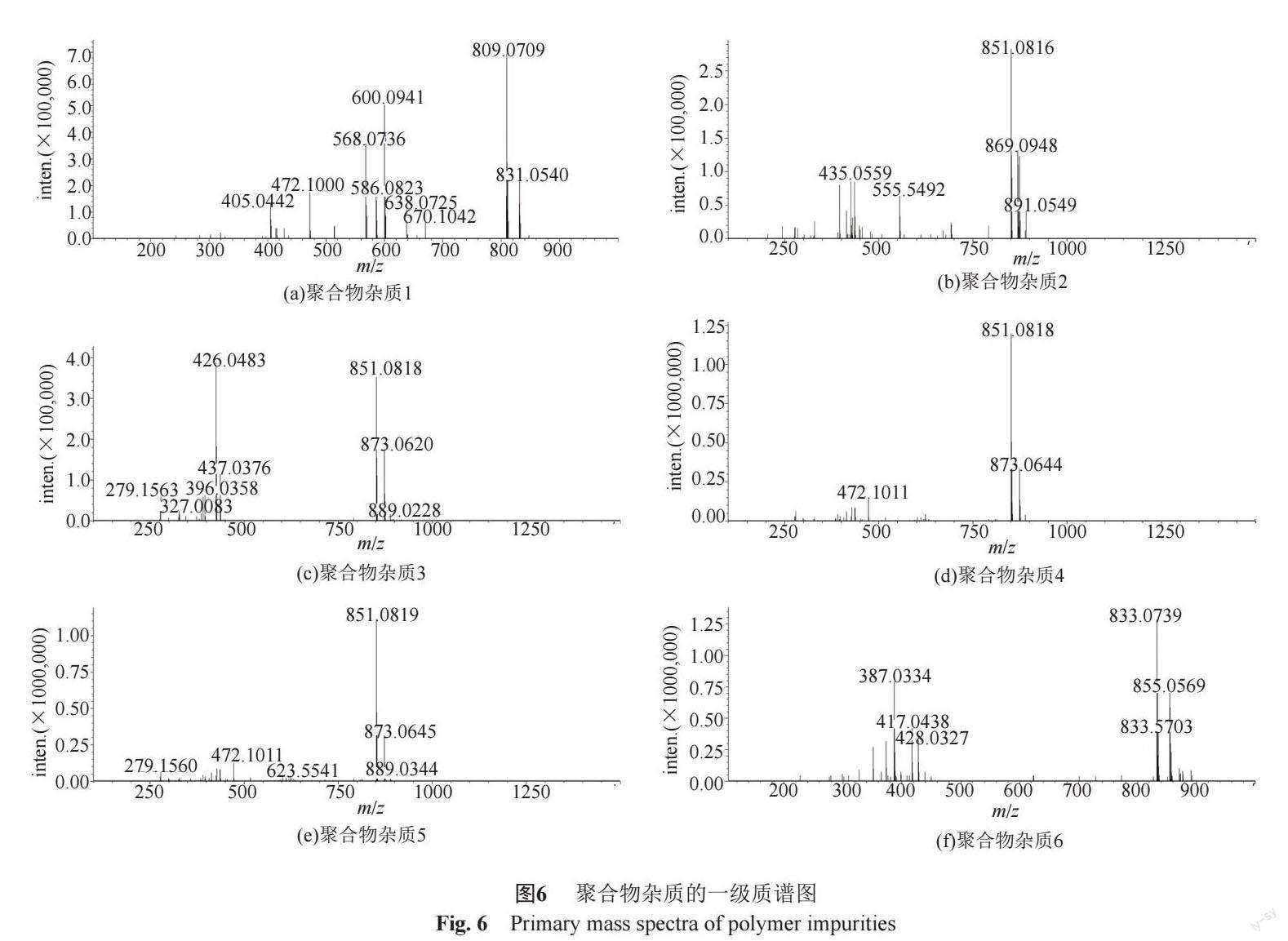
头孢噻肟钠中的聚合物杂质主要为其二聚体及二聚体水解物,其可能的结构见图5[9]。质谱分析显示,聚合物杂质1 [M+H]+峰的质荷比为809.0709(图6a),结合其保留值,推测其可能为头孢噻肟二聚体脱三位侧链水解物(图5a),分子式为C28H28N10O11S4,分子量为808.08。
聚合物杂质2~5的质谱分析显示,其[M+H]+峰的质荷比分别为851.0816、851.0818、851.0818、851.0819(图6 b~e),提示他们的分子量均为850,推测他们可能为头孢噻肟二聚体或二聚体水解物,其可能结构见图5b~d。其中聚合物杂质3通过与对照品比对,可确认为杂质F(图5b);结合其保留值[9],推测聚合物杂质2和杂质5可能分别为开环聚合形成图5c结构时产生的一对异构体,聚合物杂质4的可能结构为图5d。
在聚合物杂质6的 一级质谱图中,其 [M+H]+峰的质荷比为833.0739(图6f),结合其保留值[9],推测聚合物杂质6为头孢噻肟分子间氨基与羧基酰化反应脱水形成的二聚体(图5e),分子式为C30H28N10O11S4,分子量为832.08。
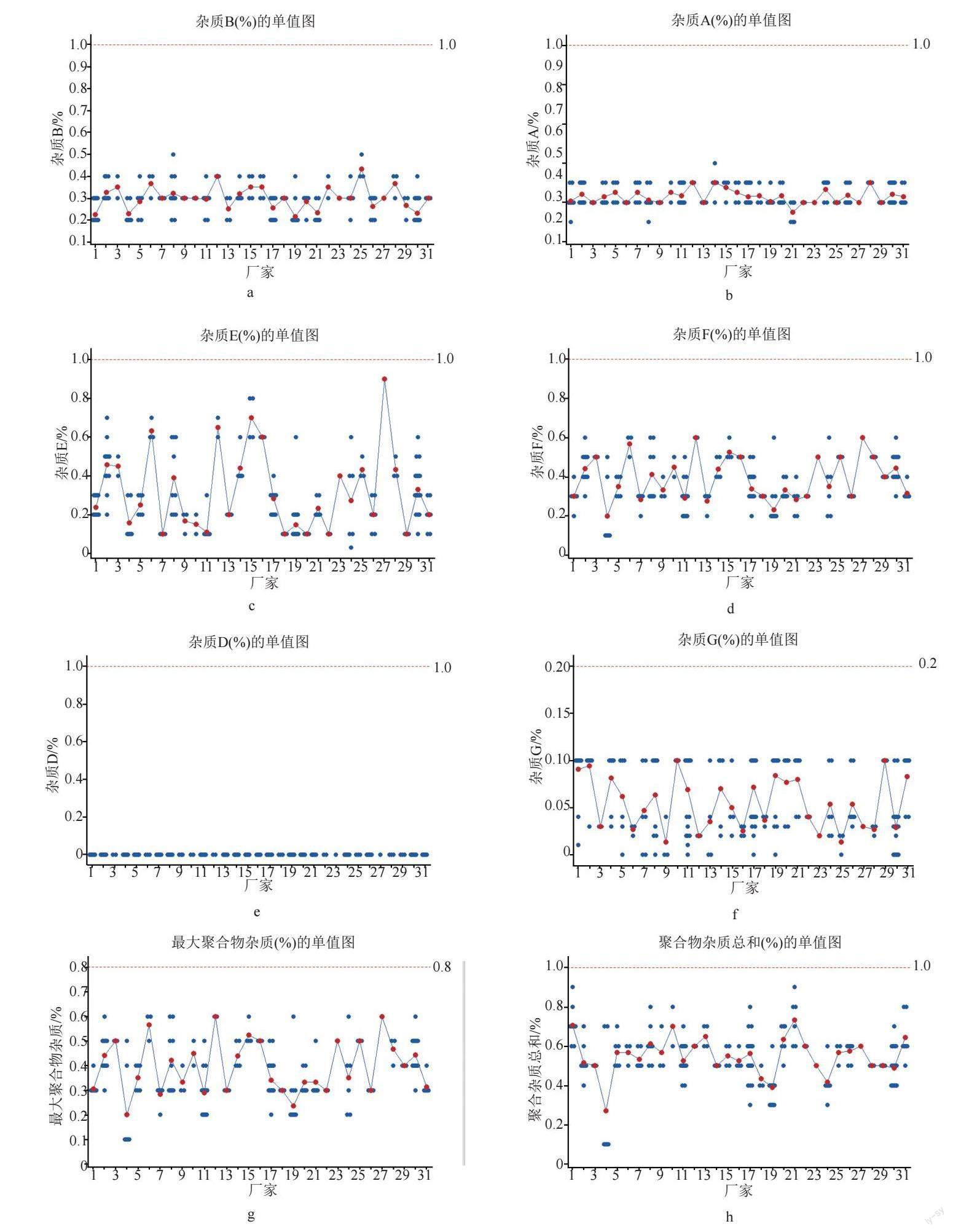
对224批次注射用粉针剂进行分析,杂质B含量为0.2%~0.5%,杂质A含量为0.1%~0.4%,杂质E含量为0.1%~0.9%,杂质F含量为0.1%~0.6%,杂质G含量均未大于0.1%,最大聚合物杂质含量为0.1%~0.6%,其他单个杂质(除聚合物杂质)含量为0.02%~0.2%,聚合物杂质总和含量为0.1%~0.9%,杂质总和含量为0.7%~2.8%。
不同厂家注射用头孢噻肟钠的杂质分布情况见图7。进一步分析显示,最大杂质集中于杂质E和杂质F。不同企业间产品杂质B和杂质A的差异不大,而杂质E、杂质F和聚合物杂质总量的差异较大;厂家6、12、15和27的产品杂质E和杂质F偏高,厂家27的1批次样品总杂质和杂质E的含量达到2.8%和0.9%。厂家12、16、15和27的产品总杂质含量较高,提示不同企业产品的质量水平仍存在一定差异,但224批次全部样品均可符合EP10.8头孢噻肟钠的限度规定,提示目前国产样品的质量较为理想。
3.2.2 基因毒性杂质2-巯基苯并噻唑的测定
调研结果提示,头孢噻肟钠合成的第一步为7-氨基头孢烷酸与AE活性酯反应生成头孢噻肟酸,合成过程中会生成副产物2-巯基苯并噻唑,且2-巯基苯并噻唑也是以氨噻肟酸和二硫化二苯并噻唑为起始原料产生AE活性酯的副产物。因此,在头孢噻肟钠原料中可能残留有2-巯基苯并噻唑。在世界卫生组织国际癌症研究机构公布的致癌物清单中,2-巯基苯并噻唑属于 2A 类致癌物,被视为潜在基因毒性杂质。对调研收集到的36批原料药进行检测,2-巯基苯并噻唑的含量为2.04~27.37 ppm,提示有2-巯基苯并噻唑引入致癌的风险。
3.3 结论
本次评价性抽检结果显示,224批样品依照法定标准检验均符合规定,且均符合EP10.8头孢噻肟钠的规定,提示国产注射用头孢噻肟钠总体质量状况“较好”;但现行《中国药典》标准仍有待进一步完善。建议:①提高原料和注射剂的有关物质的控制水平,增加杂质A、B、D、E、F和G的控制;②优化聚合物测定方法,使其真实反映药品聚合物杂质水平;③原料药企业内控标准增加2-巯基苯并噻唑检查项,并进行周期性检验,控制产品的潜在安全风险。
参 考 文 献
卢娥辉, 震熙展. 头孢噻肟成盐工艺研究[J]. 中国现代应用药学杂志, 2006, 23(2): 117-120.
張淑华, 袁靖, 欧真容, 等. 注射用头孢噻肟钠等6种头孢菌素的体外抗菌活性研究[J]. 中国抗生素杂志, 2004, 29(6): 357-360.
国家药典委员会. 中华人民共和国药典[S]. (2020年版二部). 北京: 中国医药科技出版社, 2020: 362.
The United States Pharmacopoeia 44th Edition[S]. Rockville MD: The United States Pharmacopoeia Convention.
胡昌勤. 对抗生素药品评价性抽验基本思路与方法的思考[J]. 中国抗生素杂志, 2013, 38(1): 1-11.
姚蕾, 王立新, 王红梅, 等. 229批国产注射用头孢噻肟钠的质量评价[J]. 药品评价, 2012, 9(11): 22-27.
吴红洋, 韩海燕, 任学毅, 等 .药用胶塞质量对头孢菌素类注射剂澄清度的影响[J]. 中国药业, 2022, 31(6): 25-27
田红玉, 聂飞, 王涛, 等. 头孢噻肟钠分装性研究[J]. 煤炭与化工, 2019, 42(3): 131-132
胡昌勤, 李进, 张夏. 7-氨噻肟头孢菌素的聚合物分析[J]. 中国抗生素杂志, 2022, 47(3): 209-220
李进, 姚尚辰, 尹利辉, 等. 头孢噻肟钠原料的聚合物杂质分析[J]. 中国抗生素杂志, 2020, 45(9): 883-892.
