头孢地尼口服固体制剂的质量分析与评价
2023-06-11张琳杨倩刘海玲杜旭郭艳娟顾云鲁瑞娟
张琳?杨倩?刘海玲?杜旭?郭艳娟?顾云?鲁瑞娟
摘要:目的 评价头孢地尼口服固体制剂(头孢地尼胶囊、头孢地尼分散片、头孢地尼片)的质量现状。方法 采用法定检验方法结合探索性研究,对2021年国家药品抽检工作中获得的样品的质量状况及质量标准的合理性进行了分析。结果 按法定标准检验160批次样品,合格率为100%。但现行质量标准存在检验方法不一致、个别项目限度不合理等问题。探索性研究建立了可同时测定有关物质和聚合物类杂质的RP-HPLC法,对产品中杂质谱的差异进行了比较;通过溶出度试验考察头孢地尼口服制剂在不同介质中的溶出行为,并同日本橙皮书中参比制剂的溶出行为进行了比较,发现国内制剂的溶出速率更快。结论 目前国内市场流通的头孢地尼胶囊(片剂、分散片)质量总体较好,现行标准基本可行,部分检验项目需进一步完善统一。
关键词:头孢地尼口服固体制剂;质量评价;溶出行为
中图分类号:R978.1文献标志码:A
Abstract Objective To evaluate the quality status of domestic cefdinir capsules, cefdinir dispersible tablets, and cefdinir tablets. Method According to the general requirements of national assessment programs, the statutory specification methods combined with exploratory researches were used to evaluate the quality of cefdinir oral solid preparations. Results 160 batches of cefdinir oral solid preparations were determined according to the legal specification. The qualified rate was 100%. However, some methods and limits in different specifications have some differences. The further approach showed that the specifications used had some problems, such as unreasonable limit. Based on the comparisons of some related substance methods with the method in ChP, an optimal RP-HPLC method for the determination of impurities including the polymers was established. The method was used to compare the differences of impurity profiles of different products. Additionally, the dissolution profiles of cefdinir oral solid preparation in different dissolution media were investigated and compared with the reference preparation recorded in the Japanese Orange Book. Conclusion The quality of cefdinir oral solid preparations was generally good, and the current statutory specifications should be unified and further improved.
Key words Cefdinir oral solid preparations; Quality evaluation; Dissolution behavior
頭孢地尼为半合成的广谱第三代头孢菌素,通过抑制细菌细胞壁的合成产生抗菌作用,对革兰阳性菌和阴性菌均有效,并对大部分β-内酰胺酶稳定,许多耐青霉素和头孢菌素的致病菌对本品敏感。在临床上广泛应用于内科、外科、皮肤科、妇产科、泌尿科等敏感菌导致的感染。不良反应轻微,多呈自限性,常见的不良反应主要为腹泻、腹痛、胃部不适、烧心、恶心等消化道反应和皮疹、瘙痒等过敏反应[1]。
头孢地尼由日本藤泽药品工业公司研发,于1991年首次在日本上市,1997年获得FDA批准在美国上市,2001年国产仿制品获准在国内上市[2]。头孢地尼虽未列入国家基本药物,但为国家医保目录(2019年版)品种。据国家药品监督管理局网络数据库检索结果,目前国内有11家原料药生产企业和13家制剂生产企业。头孢地尼原料和胶囊剂在ChP2020、USP2021和JP第十七改正版中均有收载,但各国药典中均未收载头孢地尼分散片和头孢地尼片。头孢地尼胶囊(片、分散片)列为2021年国家药品抽检品种。国家药品抽检的目的在于客观地评价国内药品的质量现状,分析产品的主要质量问题,进而明确产品质量提高的方向[3]。本文通过分析头孢地尼口服制剂标准检验与探索性研究结果,对其质量状况进行全面评价。
1 仪器与试药
1.1 仪器
Shimadzu LC-20AD高效液相色谱仪、Agilent1260高效液相色谱仪;LC-MS系统:液相色谱系统为Waters ACQUITY 2D UPLC,质谱系统为 Waters Xevo G2-XS QTof 质谱仪;天大天发RC806D溶出仪,FODT-601光纤药物溶出度实时测定仪;Mettler Toledo XS205电子天平。
1.2 色谱柱
常规有关物质分析:Welch Ultimate Plus C18色谱柱(4.6 mm×250 mm,5 μm),大曹三耀CAPCELL PAK C18MGⅡ色谱柱(250 mm×4.6 mm,5 ?m),YMC-Pack ODS-AM色谱柱(150 mm×4.6 mm,5 μm,12 nm),TIANHE Kromasil C18色谱柱(4.6 mm×250 mm,5 ?m 100?),Ultimate ODS-3色谱柱(4.6 mm×150 mm,3 ?m),GL Sciences Wondasil C18-WR色谱柱(4.6 mm×250 mm,5 ?m);LC-MS分析:Waters HSS T3 C18(100 mm×2.1 mm,1.8 μm)色谱柱;凝胶色谱分析:TSKgel G2000SWxl色谱柱(7.8 mm×300 mm),Agilent Adv.Bio SEC色譜柱(130?,7.8 mm×300 mm, 2.7 μm)。
1.3 对照品
头孢地尼对照品(含量98.1%,批号:130502-201904)购自中国食品药品检定研究院,头孢地尼有关物质A(批号:R066G0)、头孢地尼有关物质B(批号:R079W0)为美国药典对照品。
1.4 试剂和试药
乙腈、甲醇为色谱纯,Merck公司;四甲基氢氧化铵溶液(25%)为分析纯,国药集团化学试剂有限公司;其他试剂均为分析纯。
本文涉及的头孢地尼制剂均为2021年国家药品抽检样品,共160批次。其中头孢地尼胶囊75批,头孢地尼分散片79批,头孢地尼片6批。涉及13家生产企业(A-M),其中企业C、D、E的头孢地尼胶囊(规格:100 mg)和企业I的头孢地尼分散片(规格:100 mg)均已通过一致性评价或视同通过一致性评价。
2 方法
2.1 法定检验
按药品批准文号规定的质量标准进行法定检验。头孢地尼胶囊检验项目包括性状、鉴别、有关物质(或有关物质Ⅰ)、有关物质Ⅱ、干燥失重、溶出度、微生物限度、装量差异和含量测定;头孢地尼分散片检验项目包括性状、鉴别、有关物质、头孢地尼聚合物、干燥失重(或水分)、溶出度、微生物限度、重量差异、分散均匀性和含量测定;头孢地尼片检验项目为性状、鉴别、有关物质、干燥失重、溶出度、重量差异和含量测定。
2.2 探索性研究
根据法定检验结果,结合专题调研、文献检索等情况,围绕着药品的安全性、有效性开展了有关物质、头孢地尼聚合物和体外溶出行为等研究。
2.2.1 有关物质
参考《中国药典》2020年版(ChP2020)头孢地尼和头孢地尼胶囊[4]项下有关物质测定方法,分别对8批次头孢地尼原料和160批次头孢地尼制剂进行考察研究,并对结果进行分析。
2.2.2 聚合物类杂质分析
在ChP2020收载的头孢地尼有关物质检查法基础上,参照文献[5]建立了新的梯度洗脱方法,以利于强保留杂质的洗脱;并采用碱降解的方式,获得了含有头孢地尼二聚体指征性杂质的系统适用性试验溶液;采用飞行时间质谱(LC-QTOF/MS)对碱降解样品和实际样品中的强保留杂质进行了定性研究;对8批次头孢地尼原料和51批次不同企业生产的头孢地尼制剂中的聚合物类杂质进行了测定。
2.2.3 体外溶出行为比较
参照日本橙皮书对体外药物溶出度研究的要求,分别以水、pH1.2盐酸溶液、pH4.0醋酸盐缓冲液和pH6.8磷酸盐缓冲液4种溶出介质,对不同企业的头孢地尼胶囊、片剂和分散片分别进行了溶出曲线分析,并以日本橙皮书中收载的头孢地尼胶囊溶出曲线为参比,采用f2因子比较法对溶出曲线进行比较,评估各生产企业的头孢地尼制剂(胶囊剂、分散片、片剂)的溶出行为,以ChP2020头孢地尼胶囊的溶出介质考察各企业产品溶出曲线的变异系数。
3 结果与讨论
3.1 法定检验
本次国家药品抽检的160批次样品按各自的标准检验,全部符合规定,合格率为100%。但13家生产企业的产品涉及16个质量标准,各标准在检验项目、检验方法和限度的设置上差异明显,较难通过法定检验结果对不同企业之间的产品质量进行评价。
对现行质量标准进行比较,主要差异如下:①有关物质(有关物质Ⅰ)色谱方法不统一;对特定杂质的控制如杂质计算方式、限度存在明显差异;部分已知杂质由于保留时间较接近,利用相对保留时间进行定位时,不易判断杂质峰归属。②有关物质Ⅱ(头孢地尼聚合物)各国药典均未对头孢地尼聚合物进行专门控制,仅3个通过国家一致性评价的产品在其质量标准中控制了聚合物类杂质,但方法和限度各不相同。③各质量标准虽然均设有溶出度检查项,但在溶出方式、转速、溶出介质、溶出时间、检查方法和限度等方面存在一定差异。
3.2 探索性研究
3.2.1 有关物质
采用ChP2020收载的头孢地尼有关物质检查方法,对3家原料生产企业8批次头孢地尼原料进行分析,系统适用性溶液典型色谱图见图1,结果见表1。
由表1可见,目前国内制剂企业使用率较高的头孢地尼原料质量水平良好,总杂质均不大于1.0%(ChP限度为3.0%)。其杂质主要为杂质A、杂质F、杂质G、H、杂质I、杂质J、杂质K、杂质L杂质M、N和杂质R。1#~6#原料为同一企业产品,但杂质谱呈一定的差异,提示原料的生产存在一定的不稳定性,其质量可直接影响制剂的质量。
采用相同方法,对不同企业制剂的杂质谱进行分析,并与其原料结果进行比较。F企业(进口原研)产品检出杂质个数最少;其他国内企业的头孢地尼仿制产品杂质主要集中在杂质A、杂质F、杂质G、H、杂质I、J、K、L、杂质M、N和杂质R,与头孢地尼原料杂质谱基本一致。据以往研究资料表明,头孢地尼杂质谱中常见杂质多为降解杂质(已知杂质中杂质C、杂质F、杂质G、杂质O和杂质S为原料合成时引入,其他杂质均为降解产生)。此次对头孢地尼原料和制剂有关物质分析结果表明,制剂杂质含量与原料呈现一定的相关性,杂质个数和杂质含量在制剂过程中略有增加但不明显(提供原料的企业中,其产品总杂质最高为1.12%)。以C企业为例,其提供的3#、4#原料杂质A含量分别为0.05%和0.17%,C企业28批次制剂中,3批样品杂质A低于忽略限,1批次为0.09%,其余24批次均分布在0.16%~0.20%之间,与其提供的2批原料情况基本一致。说明该品种在制剂过程中杂质控制情况较好。
对ChP头孢地尼有关物质分析方法进行评价。采用头孢地尼已知杂质混合溶液,在3台高效液相色谱仪上采用3根不同品牌的色谱柱,考察对已知杂质的准确定位情况,典型色谱图见图2。
结果表明,杂质谱中的主要杂质如杂质F、杂质G、杂质I、J、K、L、杂质N的相对保留时间与ChP参考值基本一致,而杂质A、杂质R及保留较强的杂质S、杂质T和杂质U的相对保留时间与ChP参考值差异较大,且不同系统之间亦存在一定的差异;其中,杂质S、杂质T和杂质U在系统适用性溶液色谱图中易与未知杂质混淆导致结果误判;杂质M的相对保留时间与ChP给出的参考值有一定的差异(杂质M和杂质N为同分异构体,杂质M的稳定性较差,实验中几乎全部转化为杂质N,测定中杂质M和杂质N的含量合并计算,对测定结果影响不大)。提示对特定杂质的准确定位方法仍有待改善。
此外,结果显示,H企业和G企业的产品采用《中国药典》方法检验结果均较其各自执行的现行法定标准方法略偏高,以总杂质为例,两企业样品总杂质分别偏高0.08%~0.22%(平均值0.15%)和0.20%~0.50%(平均值0.27%),提示不同分析方法的專属性仍存在一定的差异,企业现行法定标准使用的杂质相对响应因子及限度的合理性有待研究,质量标准仍有提高空间。
3.2.2 聚合物类杂质
参考文献[5]制备碱聚合溶液,其特征图谱见图3。对图中的杂质1~9进行定性研究(见表2),可见,其中含有多个头孢地尼二聚体和三聚体同分异构体,并存在优势聚合;杂质2(相对保留时间为2.12)的二聚体杂质为主要聚合物杂质,其特征质谱图见图4。头孢地尼的3位的丙烯基结构异构化理论上可形成8种异构体(具有3个手性位点),头孢地尼二聚体也可能在聚合中形成多种具有相同分子量的二聚体γ内酯[6]。本文中发现了多个分子离子峰(m/z)为791.1的二聚体同分异构体,进一步证明了二聚体γ内酯的存在。
在该色谱条件下,保留时间最大的已知杂质U的相对保留时间为2.0,头孢地尼聚合物类杂质的相对保留时间均大于2.0,故将相对保留时间大于2.0的杂质总量作为有关物质Ⅱ(除聚合物杂质外,还存在少量的小分子杂质),控制聚合物类杂质的总量。
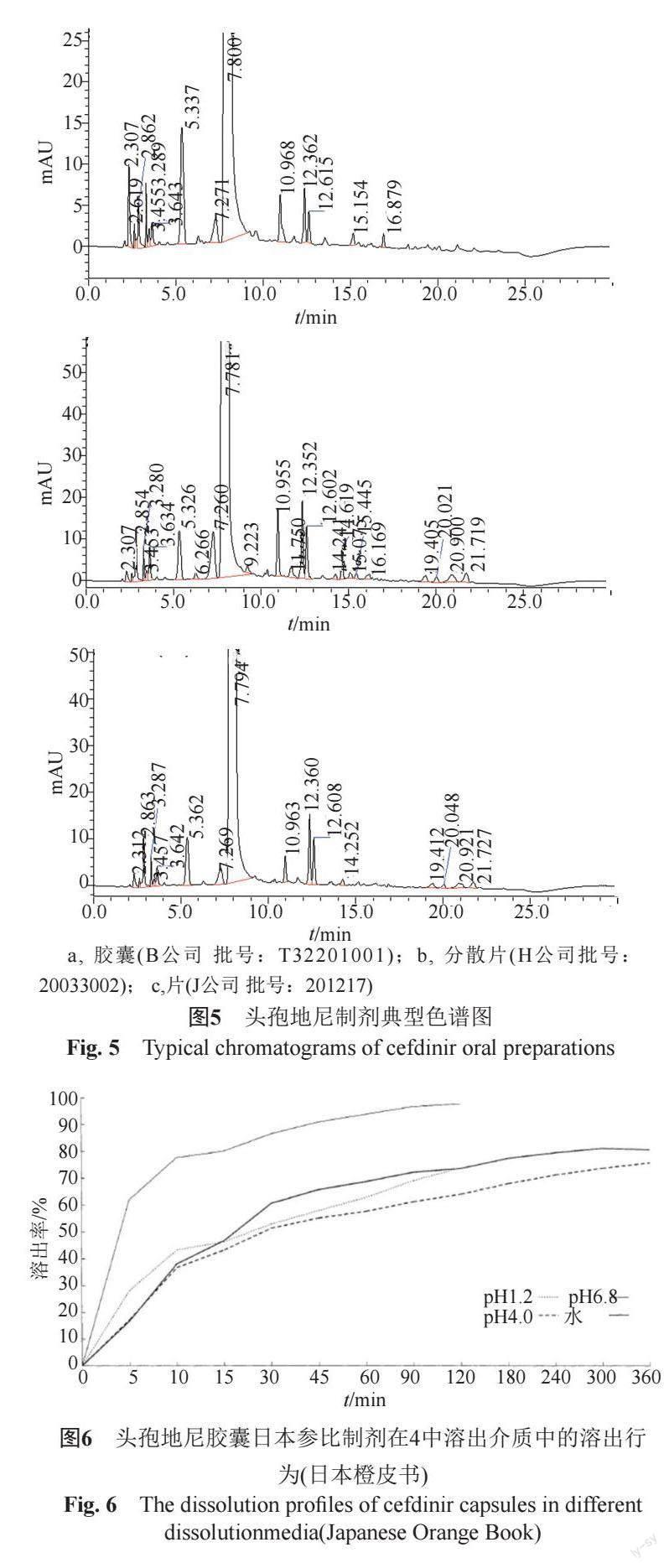
实验选择6个厂家的22批次头孢地尼胶囊,7个厂家的26批次头孢地尼分散片,1个厂家3批次头孢地尼片及7批头孢地尼原料按照所建立的反相高效液相色谱法测定有关物质Ⅱ,供试品特征色谱图见图5。样品考察结果表明,仅H公司生产的1批头孢地尼分散片(批号:20033002)有关物质Ⅱ的含量超过0.1%,说明头孢地尼原料和制剂在生产和贮藏过程中不易聚合生成聚合物类杂质。
3.2.3 体外溶出行为
按照美国FDA推荐的生物药剂学分类系统,头孢地尼原料药属于BSC Ⅳ类[7],即低溶解性、低渗透性药物。难溶性药物溶出度是影响其生物利用度的重要因素,也是考察制剂质量的重要指标。经查询,日本橙皮书中收录有头孢地尼胶囊溶出曲线(图6)。
(1)头孢地尼胶囊
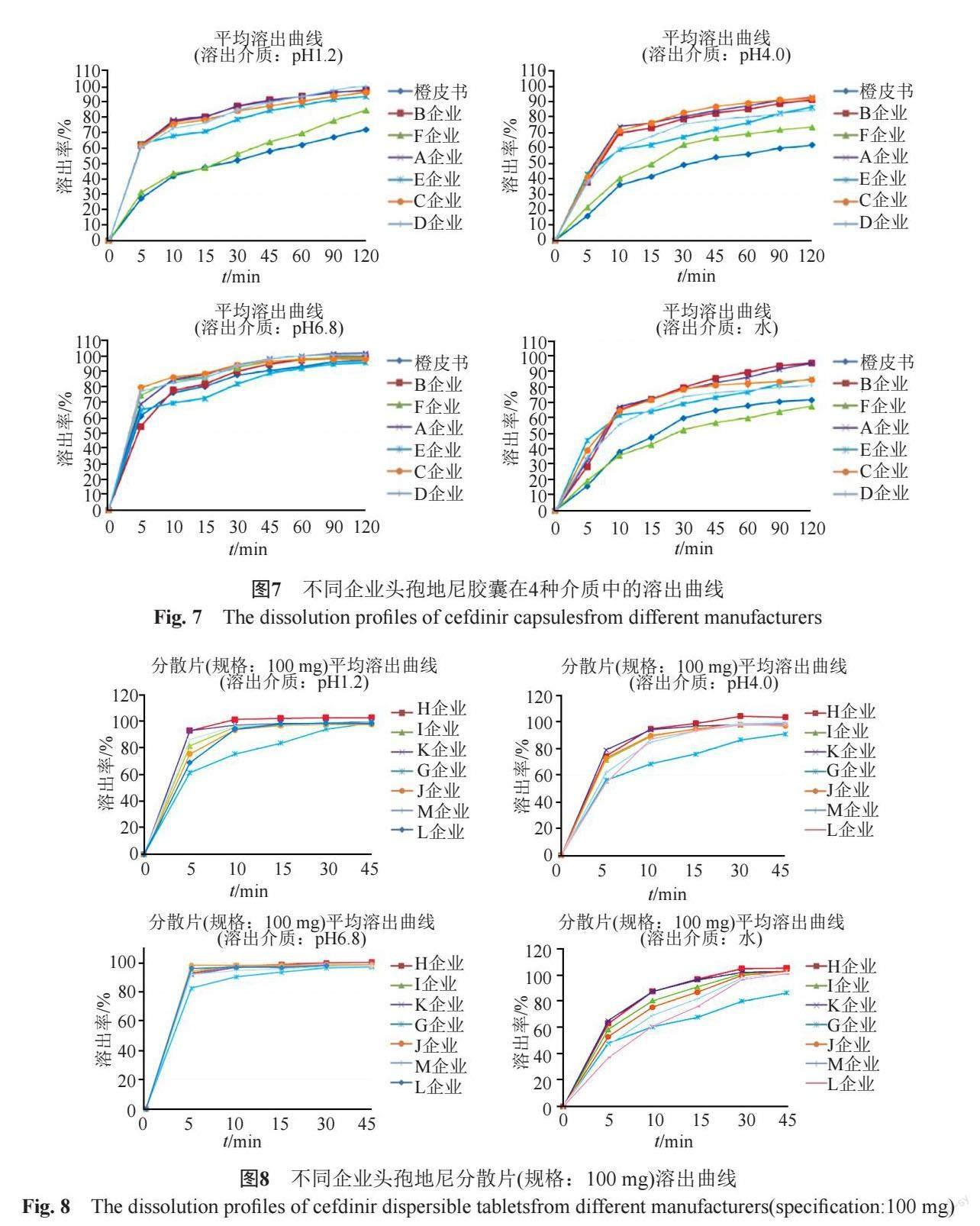
各企业的头孢地尼胶囊在四种溶出介质中的溶出曲线见图7,其中参比制剂(企业F(Choseido Pharmaceutical Co., Ltd. Kawauchi factory)生产的头孢地尼胶囊[8])的溶出行为与橙皮书最为接近,5家国内生产企业样品的溶出行为各不相同,且与橙皮书差异较大。
采用ChP头孢地尼胶囊溶出度方法,对6家企业的头孢地尼胶囊进行溶出曲线比较。15 min时,除F企业(参比制剂)外,其余5家企业胶囊剂的溶出度均达到85%以上。5家国产制剂的平均溶出曲线与参比制剂的相似因子(f2)均低于50(分布于30.9~40.2)。上述溶出曲线结果表明,5家国内企业头孢地尼胶囊的处方及生产工艺与参比制剂之间均存在一定的差异,亦与橙皮书收载的原研制剂存在显著差异。
分别对6家生产企业头孢地尼胶囊溶出曲线差异性进行分析,批内差异和批间差异分析结果表明,D企业样品的批间差异较大,3批样品中有2批15 min时溶出度超过85%,另1批未达到80%;以前者为参比制剂,后者为受试制剂进行计算,相似因子(f2)为41.6,提示D企业的生产工艺稳定性有待提高。
(2)头孢地尼分散片
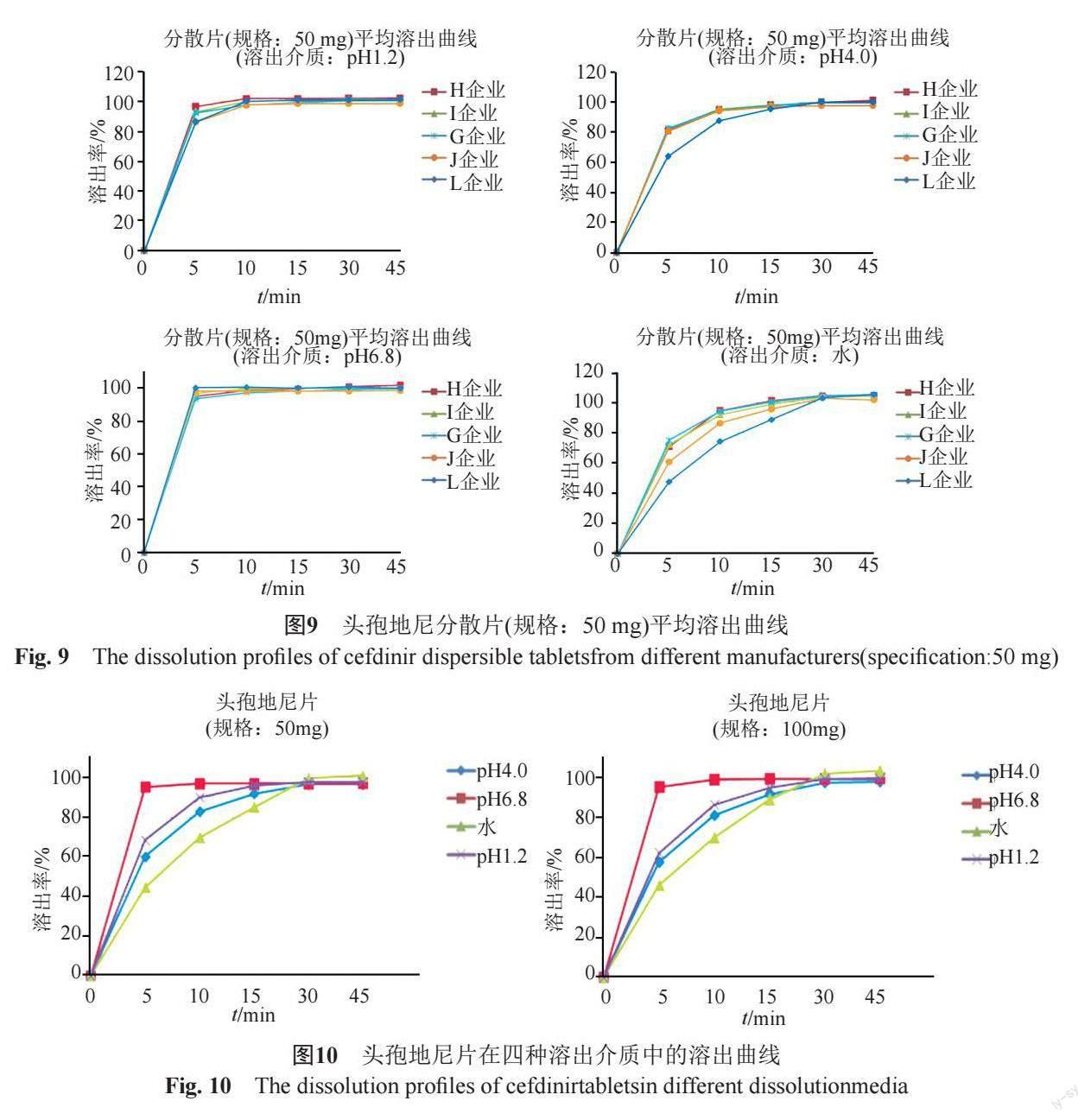
分别对7家企业2个规格头孢地尼分散片的溶出曲线进行考察(图8~9),结果表明,样品在pH6.8磷酸盐缓冲液中的溶出速度最快,在水中的溶出速率最慢;规格100 mg样品45 min时的溶出度方达到85%,而50 mg样品15 min时的溶出度已达到85%,可能与本品的低溶解特性相关。
进一步分析不同企业产品溶出特性的差异。L企业50 mg样品在水和pH4.0醋酸盐缓冲液中的溶出速度较其他企业同规格的样品偏慢;G企业100 mg样品在四种介质中的溶出速率均明显低于其他企业同规格的产品,且样品的批间差异较大,即G企业产品的工艺稳定性较差。企业应高度关注对工艺过程的控制,以保证产品的一致性。
(3)头孢地尼片
头孢地尼片仅涉及1家企业的两个规格产品,样品在四种溶出介质中的溶出行为基本一致(图10)。结果表明,两个规格的样品批内的溶出曲线的重合性均较好,6 min时批内溶出曲线的变异系数已降至10%以下。
CFDA于2016年3月5日发布了《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》,本次抽检样品中4家企业的产品已通过一致性评价,另有2家企业的产品于抽检工作结束后亦通过了一致性评价。在一致性评价中,仿制制剂是否必须与参比制剂的溶出曲线相同一直是争论的焦点。对本品的溶出特性研究表明,虽然本品的溶出曲线与橙皮书相比有一定的差异,但生物等效比体外溶出行为应更重要。在不同溶出介质中,国产头孢地尼制剂溶出情况明显快于参比制剂和橙皮书中的参比制剂。曾有文献采用软件模拟技术评价头孢地尼胶囊制剂的有效性,认为现代制剂工艺使得头孢地尼胶囊剂的溶出速率快于日本橙皮书中的参比胶囊剂,其生物利用度也得到了提高;从治疗的角度来看都是有效制剂[9]。本研究的结果进一步说明,通过溶出行为评价/控制头孢地尼等难溶性制剂的工艺稳定性较评价其生物等效性更有意义。
参 考 文 献
国家药典委员会. 中华人民共和国国家药典临床用药须知化学药和生物制品卷2015年版, 中国医药科技出版社: 678-679.
文斌, 王维. 抗生素历史观念的转折点——世扶尼(头孢地尼胶囊)[J]. 天津药学, 2002, 14(1): 77.
胡昌勤. 对抗生素药品评价性抽验基本思路与方法的思考[J]. 中国抗生素杂志, 2013, 38(1): 1-11.
国家药典委员会. 中华人民共和国药典[S]. 北京: 中国医药科技出版社, 2020(二部): 297-301.
李进, 姚尚辰, 尹利辉. 头孢地尼原料及制剂的聚合物杂质分析[J]. 中国抗生素杂志, 2020, 45(10): 1005-1016.
胡昌勤, 李进, 张夏. 7-氨噻肟头孢菌素的聚合物分析[J]. 中国抗生素杂志, 2022, 47(3): 209-220.
Lindenberg M, Kopp S, Dressman J B. Classification of orallyadministered drugs on the World Health Organization modellist of essential medicines according to the biopharmaceutics classification system[J]. Eur J Pharm Biopharm, 2004, 58(2): 265-278.
国家食品药品监督管理总局. 总局关于发布普通口服固体制剂参比制剂选择和确定等3个技术指导原则的通告(2016年第61号): 普通口服固体制剂溶出曲线测定与比较指导原则[EB/OL]. (2016-03-18)[2017-09-13]. http://www.sda.gov.cn/WS01/CL0087/147583.html.
潘瑞雪, 余方键, 邹文博, 等. 用GastroPlus软件模拟技术评价头孢地尼胶囊制剂的有效性[J]. 中国新药杂志, 2014, 23(13): 1506-1513.
