注射用乳糖酸红霉素质量评价
2023-06-11黄晓春刘琦李珉车宝泉刘照振刘祝月刘海涛寇晋萍侯金凤
黄晓春?刘琦?李珉?车宝泉?刘照振?刘祝月?刘海涛?寇晋萍?侯金凤
摘要:目的 評价国产注射用乳糖酸红霉素的质量现状。方法 采用法定标准对80批抽验样品进行检验;结合注射剂一致性评价要求,利用参比制剂开展比较研究,通过对复溶时间、颗粒形貌、有关物质及成盐率等关键质量属性的考察,分析评价不同企业制剂的质量差异及现行标准的合理性。结果 法定检验结果显示80批注射用乳糖酸红霉素合格率为100%。现行法定标准无游离乳糖酸检查项,有关物质和含量测定方法及限度与参比制剂标准存在差异。国内制剂的复溶时间约为参比制剂的2倍,粒径分布及颗粒形貌与参比制剂存在差异。国内制剂的成盐率为0.93~1.08,批次间波动较大;参比制剂钠离子含量(4.3 ppm)显著低于国内制剂(11.9~288.2 ppm)。新建有关物质检测HPLC方法在检出杂质种类及杂质总量方面均优于现行法定标准,国内制剂与参比制剂杂质谱相似,杂质检出差异可接受。探讨利用HPLC方法测定的红霉素组分含量估测其效价值,对各企业制剂的效价估测值与微生物检定法的效价测定结果无显著差异。结论 注射用乳糖酸红霉素总体质量较好,与参比制剂在一些质量属性方面存在差异,建议国内企业优化生产工艺尤其是冷冻干燥工艺流程以提升产品质量;现行标准可进行提高。
关键词:注射用乳糖酸红霉素;评价性抽验;质量评价;一致性评价;含量测定
中图分类号:R978.1文献标志码:A
Abstract Objective To evaluate the current quality of domestic erythromycin lactobionate for injection. Methods The statutory standard methods combined with exploratory researches focused on quality consistency evaluation for injections were used to evaluate the quality of the 80 samples. Through the investigation of critical quality attributes such as redissolution, particle morphology, related substances, and the salt-forming rate, the quality differences of products from different manufactures and the rationality of the current statutory standard were analyzed and evaluated. Results The qualified rate for the 80 samples was 100% showed by the statutory tests. Compared to the reference preparation standards, the statutory standard did not include the free lactobionic acid test and there were differences between the related substances, assay methods, and limits. The redissolution time of domestic preparations was about twice as long as that of the reference preparation. The particle size distribution and morphology of domestic preparations were different from those of the reference preparation. The salt-forming rate of domestic preparations was 0.93~1.08, with large fluctuations between batches. The sodium ion content of the reference preparation (4.3 ppm) was significantly lower than that of the domestic preparations (11.9~288.2 ppm). The HPLC method for the detection of related substances was superior to the current statutory standard in terms of the types and total amount of impurities detected. The impurity spectra of domestic preparations were similar to those of the reference preparation, and the impurity contents were acceptable. The potency of erythromycin lactobionate for injection was calculated based on the contents of erythromycin components determined by the established HPLC method. There was no significant difference between the calculated potency and the tested potency determined by the microbial assay for the preparations of different manufactures. Conclusion The overall quality of erythromycin lactobionate for injection was good, but some differences of quality attributes were found between the reference preparation and domestic preparations. In order to improve product quality, it is recommended that the production processes, especially the freeze-drying process should be optimized by domestic manufacturers; the current statutory standards should be further improved.
Key words Erythromycin lactobionate for injection; Evaluative testing; Quality evaluation; Consistency evaluation; Content determination
乳糖酸红霉素(erythromycin lactobionate)是红霉素和乳糖酸(1:1)的成盐产物,属第一代大环内酯类抗生素[1],主要通过抑制敏感微生物的蛋白质合成产生抑菌作用。注射用乳糖酸红霉素由Hospira公司于1964年上市,临床用于青霉素过敏患者敏感菌感染的替代用药以及敏感军团菌、衣原体属、支原体属微生物的感染治疗等[1]。目前在多国药典中均已收载该品种[2-3]。注射用乳糖酸红霉素不良反应有皮疹、呕吐、瘙痒症和肝功能异常等。
注射用乳糖酸红霉素为国家基本药物目录品种,国内现有19家生产企业生产,存在30个批准文号。注射用乳糖酸红霉素为2021年国家评价性抽验品种,抽验涉及国内23个省、自治区和直辖市的药品生产、经营和使用单位,共获得80批次样品。本文采用现行法定标准对全部抽检样品进行检验,依据发现的问题开展探索性研究;对当前注射用乳糖酸红霉素的质量状况进行客观评价和分析。
1 仪器及试药
1.1 仪器
Waters e2695高效液相色谱仪;Thermo UltiMate 3000型超高效液相色谱仪;Thermo LTQ Orbitrap Velos Pro 质谱仪;梅特勒托利多G20S电位滴定仪;PALL CASCADA I纯水机;梅特勒托利多XS205电子天平;Thermo Nicolet 5700傅里叶红外光谱仪;Malvern Mastersizer 2000激光粒度仪;MERLIN compact扫描电镜仪; Ultima IV X射线衍射仪;ZY-300Ⅳ型抑菌圈测量仪;SPX-250B-Z型生化培养箱等。
1.2 试药
80批次注射用乳糖酸红霉素均为2021年度国家药品评价性抽验样品,涉及4个生产企业(A、B、C和D企业),两种规格0.25g(25万单位)和0.3g(30万单位);参比制剂为Hospira公司产品(批号:091053A)。
红霉素标准品(批号:510140-201701) 来源于中国食品药品检定研究院;乳糖酸红霉素对照品(货号:001xV7,batch 1.0)、红霉素A对照品(货号:00516P,batch 3.2)、红霉素B对照品(货号:00TjNt,batch 5.0)、红霉素C对照品( 货号:003azi,batch 5.0)、N-去甲基红霉素A (杂质B,货号:005kq0,batch 3.2)及红霉素系统适用性对照品(货号:00p9A0,batch 2.0)来源于欧洲药品质量管理局(EMQD);红霉素E(杂质C)、脱水红霉素A(杂质D)、红霉素A烯醇醚(杂质E)、表红霉素A烯醇醚(杂质F)及红霉素A氮氧化物(雜质H)由范德生物科技天津公司合成。
短小芽胞杆菌[CMCC(B)63202],抗生素检定用培养基Ⅰ号(北京路桥,批号:200511)。乙腈和氨水为色谱纯,其他试剂为分析纯,实验用水均为超纯水。
2 试验方法
2.1 法定检验
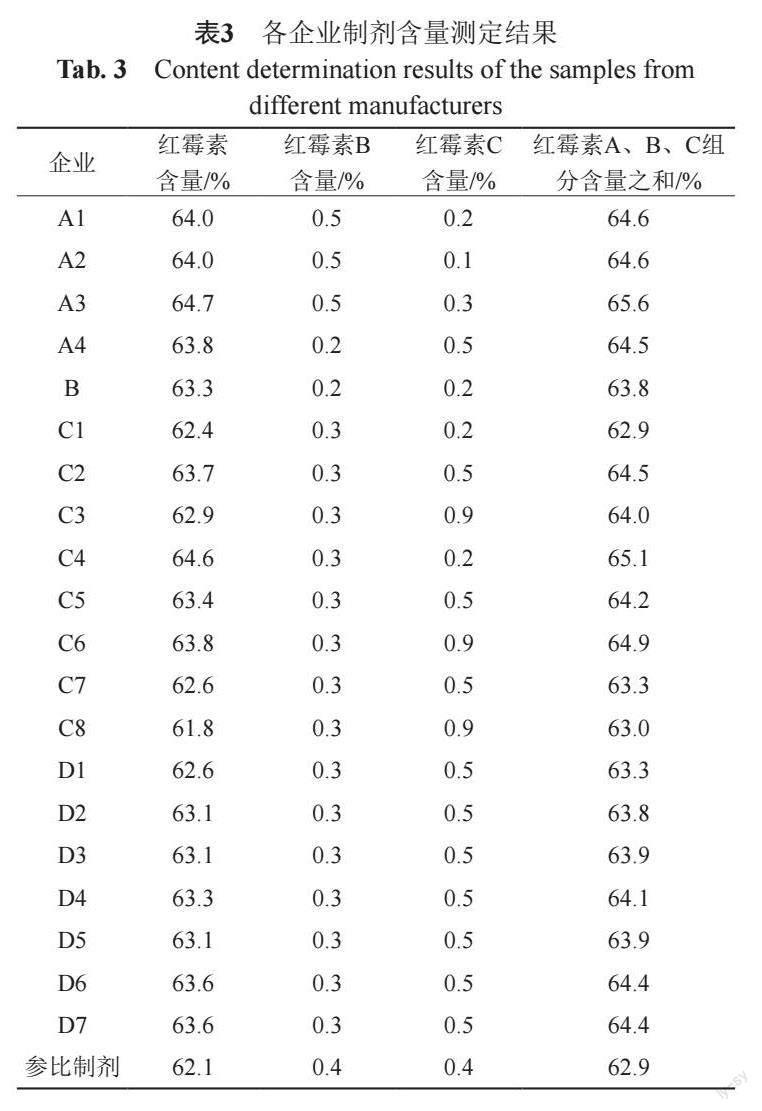
按照《中国药典》2020年版标准对80批注射用乳糖酸红霉素进行检验。主要检验项目包括鉴别、有关物质、红霉素A、红霉素B、红霉素C组分及含量测定等。
2.2 探索性研究
2.2.1 复溶行为及复溶时间测定
不同企业注射用乳糖酸红霉素各3支,(25℃±2℃)条件下按标示量加入适量灭菌注射用水(按说明书配置,标示量每0.25 g加水5 mL,用一次性注射器抽取加入),每隔5 min振摇30 s;观察30 min内样品的溶解情况,并记录样品完全溶解的时间点,完全溶解需时的均值为各样品的复溶时间。
2.2.2 粉末差异评价
利用粉末粒径分布测定(干法空压机喷射样品直接进样测定)、偏光显微镜和扫描电镜粉末成像分析(采用扫描电镜仪,电压设定为20 kV,样品用双面胶带固定在铜板上,并用金喷射)、粉末吸湿性检测、粉末X射线衍射分析、红外光谱等多种方法检测国产制剂与参比制剂的粉末特性,利用测定结果评估各制剂粉末的差异。
2.2.3 成盐率[2]测定
利用电位滴定法,基于0.1 mol/L的氢氧化钠滴定液和高氯酸滴定液分别滴定各两份约0.5 g的注射用乳糖酸红霉素粉末,依据平均消耗的滴定液体积折算1 g样品消耗浓度为0.1 mol/L的高氯酸滴定液及氢氧化钠滴定液体积(VHCLO及VNaOH),VNaOH与VHCLO的比值为样品中乳糖酸与红霉素摩尔数比值(即为乳糖酸红霉素的成盐率)。乳糖酸与红霉素完全成盐的摩尔数比值应为1.0。
2.2.4 钠离子含量测定
基于《中国药典》2020版通则中原子吸收分光光度法第一法(标准曲线法)测定注射用乳糖酸红霉素样品中钠离子含量。
2.2.5 HPLC法测定有关物质及含量
在现行各国药典标准和文献报道的有关物质检测方法[2-4]基础上,以有效分离注射用乳糖酸红霉素的主要已知杂质为目标,建立HPLC有关物质及含量检测方法。
色谱条件:Waters Xbridge C18色谱柱(4.6 mm×
100 mm,3.5 μm),以0.4%氨水溶液为流动相A,乙腈为流动B,按表1方式进行线性梯度洗脱。流速为1.0 mL/min;柱温为40℃;检测波长215 nm;进样体积35 μL。样品临用新制,样品室温度4℃。
2.2.6 HPLC方法替代抗生素微生物检定方法可行性考察
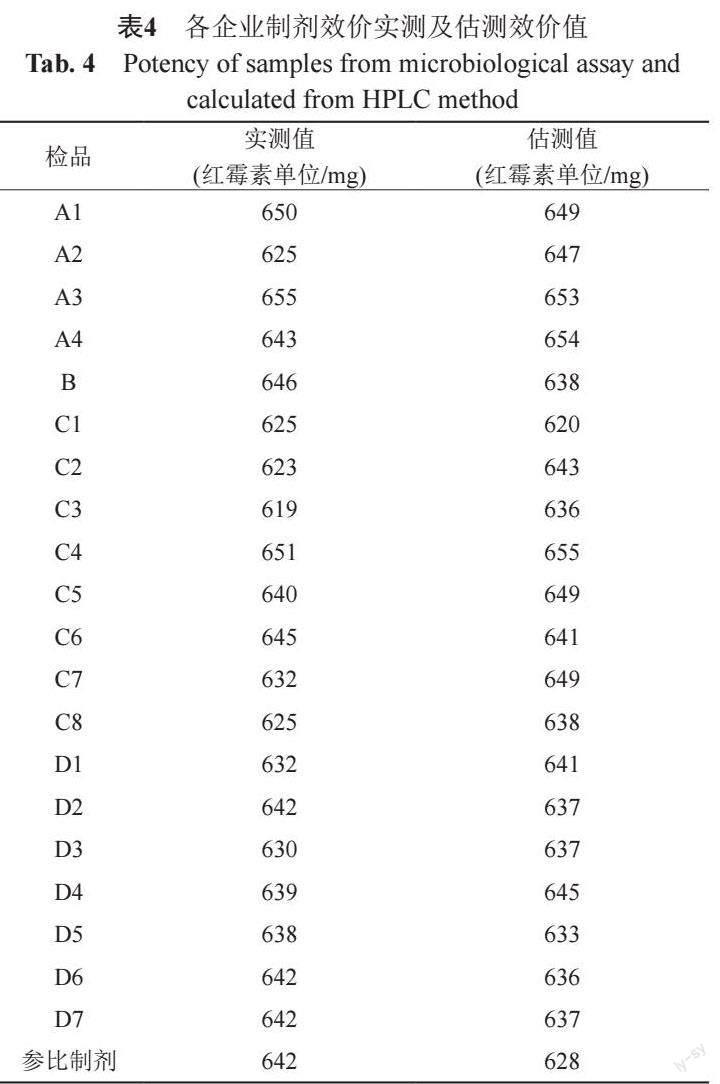
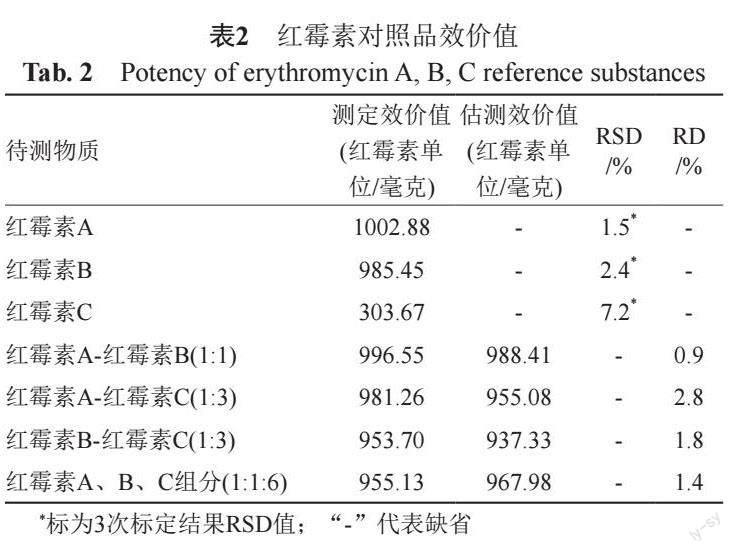
基于中检院红霉素标准品,采用《中国药典》2020年版抗生素微生物检定法进行红霉素A、B、C 3组分的各自效价值标定。同法进行不同配比的红霉素A-红霉素B(1:1)、红霉素A-红霉素C(1:3)、红霉素B-红霉素C(1:3)及红霉素A、B、C组分(1:1:6)对照品混合物的效价测定,基于3组分对照品含量及各自标定效价值计算混合对照品的估测效价值;比较效价测定值与估测值评估3组分间的相互作用。HPLC法测定21批不同来源的注射用乳糖酸红霉素样品中红霉素A、B、C组分含量,通过量效转换计算出效价估测值,并与抗生素微生物检定法测定效价值进行数据等效性验证。
3 结果与讨论
3.1 法定标准检验
按现行法定标准检验,80批注射用乳糖酸红霉素全部合格,合格率为100%。
3.2 法定检验中发现的问题
本次抽验法定检验的过程中发现以下问题:①B、C、D企业制剂与原研参比制剂采用冷冻干燥工艺,A企业制剂采用喷雾干燥工艺;不同企业制剂的性状及复溶行为有差异;②现行有关物质检查方法检出已知杂质种类少,已知杂质检出量在杂质总量中占比低;③本品的各国药典标准有差异,与欧洲药典(EP)10.0标准[2]相比,我国现行法定标准的有关物质检查方法有待改进、无乳糖酸含量的检查项目,含量测定方法采用抗生素微生物检定法耗时且效率低;④国内制剂胶塞外表面均有不同数量的制剂粉末残留,提示制剂生产工艺尤其灌装工艺方面的不足。
3.3 探索性研究
3.3.1 复溶行为及复溶时间
注射用粉末类注射剂的复溶时间常与临床疗效密切相关,是注射用粉针剂的关键质量属性[5-6]。注射用乳糖酸红霉素国内制剂的复溶时间(11.0~12.5 min)是参比制剂复溶时间(5.5 min)的一倍余。国内制剂溶解过程中少量团块和/或絮状的未溶物,漂浮和/或贴于安瓿瓶底导致粉末全部溶解需时长于参比制剂。采用冷冻干燥工艺(参比及B、C、D企业的制剂)与采用喷雾干燥工艺(A企业制剂)的产品间复溶行为差异明显,A企业制剂形成粉液混合物,贴安瓿瓶壁部分粉末易为液膜包被。冷冻干燥工艺生产的制剂,粉末团块加入注射用水后即消融;参比制剂全溶前仅安瓿瓶底可见湿润冰渣样未溶物不同与企业B、C、D的制剂。参比制剂的标示量与安瓿品体积折算后与国内制剂相仿。粉末复溶行为及复溶时间的差异提示各制剂粉末物化参数的差异[7],尤其是制剂粉末晶型、粒径分布及颗粒形貌[8]等的差异。
3.3.2 粉末差异评价
含参比制剂在内的5种注射用乳糖酸红霉素的粒径分布测定结果见图1。国内制剂粒径分布d(0.1)、d(0.5)和d(0.9)值均略大于参比制剂的1.65、8.38及25.1 μm;除C企业制剂外,A、B及D企业制剂粉末均含有大于100 μm的颗粒。采用喷雾干燥工艺的A企业制剂与采用冷冻干燥工艺的制剂(参比制剂和B、C、D企业制剂)粒径分布差异明显。
含参比制剂在内的5种注射用乳糖酸红霉素粉末的颗粒形貌比较见图2。冷冻干燥工艺的参比制剂和B、C、D企业制剂以含微孔结构的团块状微粒为主,而采用喷雾干燥工艺的A企业制剂为无微孔的、表面光滑的多棱面微粒。与参比制剂相比,B、C企业制剂的孔隙小而密,而D企业制剂的孔隙相对较少。
各企业制剂与参比制剂的粉末X衍射图谱显示所有制剂粉末均为无定型粉末,X衍射图谱基本一致。各企業制剂粉末吸湿性检测、红外光谱及热重法测试的结果亦无明显差异。
制剂粉末粒径分布与颗粒形貌的差异与制剂生产工艺相关[7-8],是导致国内制剂复溶行为、复溶时间与参比制剂差异的因素。
3.3.3 成盐率考察
成盐率是影响注射用乳糖酸红霉素制剂澄清度、酸碱度和复溶时间等关键质量属性的关键因素之一[6]。抽检的80批样品中乳糖酸红霉素的成盐率在0.93~1.08之间,均值为1.00(标准差为0.03,n=80)。国内A、C、D 3家企业制剂多批次成盐率分布的箱体图见图3。A企业为0.95~1.08之间,均值1.03(标准差为0.03,n=30);C企业为0.93~1.05之间,均值0.98(标准差为0.03,n=31);D企业为0.99~1.07之间,均值1.03(标准差为0.03,n=18)。参比制剂和B企业各1批次的成盐率分别为1.01和1.00。国内3家企业多批次制剂的成盐率波动明显,其中D企业制剂乳糖酸红霉素的成盐率整体优于A企业和C企业。乳糖酸红霉素的成盐率与调研资料中各企业提供的制备乳糖酸红霉素反应终止时药液的pH值参数范围相关。红霉素A是pKa为8.6的弱碱,其在溶液中的成盐或游离与溶液pH值直接相关[9]。成盐率的测定能反应各企业生产工艺控制水平,乳糖酸红霉素制备反应终止的pH值是关键工艺参数。
3.3.4 钠离子含量测定
注射用乳糖酸红霉素制剂中钠离子含量与生产工艺、玻璃包材相关,参比制剂说明书及文献[10]均提示钠离子的存在影响制剂的复溶过程。参比制剂的钠离子含量仅为4.3 ppm,国内制剂的钠含量依次为A企业(11.9 ppm)、B企业(83.5 ppm)、D企业(245.6 ppm)及C企业(288.2 ppm)。结合国内制剂生产工艺,分析钠离子可能源于乳糖酸钠经离子交换制备乳糖酸工艺及冷冻干燥过程可能的钠钙玻璃包材的转移。参比制剂包材采用中硼硅玻璃,企业A和C采用钠钙玻璃,企业B和D采用低硼硅玻璃。按注射剂一致性评价技术要求及玻璃包材对极冷耐受性考量[11],建议采用冷冻干燥生产工艺的B、C、D 3家企业检查制备的乳糖酸药液中钠离子含量,酌情采用中硼硅玻璃包材。
3.3.5 HPLC法测定有关物质
目前注射用乳糖酸红霉素的有关物质谱主要涉及13种已知杂质[2,12]。基于文献和现有的标准方法,优化建立了新的有关物质测定方法(见“2.2.5”),典型的系统适用性图谱见图4。包括参比制剂在内的5种制剂的有关物质检测结果见图5。各制剂杂质总量检出范围为2.24%~3.29%,由低到高依次为C企业、D企业、参比制剂、A企业、B企业。国内制剂的杂质谱主要涉及杂质A、B、C、D、E及F,主要杂质为前三者。杂质E的检出量A企业制剂最高(0.85%),显著高于参比制剂(0.05%)、C企业(0.06%)、D企业(0.10%)及B企业(0.21%)。与参比制剂比较,国内制剂有关物质总量、已知杂质含量、未知杂质含量都符合现行EP10.0标准[2]的限度要求。新建HPLC方法对已知杂质检出由2种增加至6种,已知、未知及杂质总量检出值均高于现行法定标准。
基于乳糖酸红霉素对照品的酸、碱、氧化、高温、光照等因素强制降解实验结果显示,乳糖酸红霉素主要对酸、碱、高温不稳定。酸性破坏条件杂质E、杂质D增大最明显,杂质F、杂质D在碱性破坏条件下增大最明显,高温破坏导致杂质E增加。文献报道杂质A、B、C主要为红霉素原料来源,降解杂质D、E和F可作为注射用乳糖酸红霉素生产工艺优化的质控指标[12-13]。
结合各企业制剂有关物质的检出结果及可获得的工艺参数,采用喷雾干燥工艺生产的A企业制剂中杂质E含量显著高于采用冷冻干燥工艺企业的制剂,分析与喷雾干燥工艺温度≥65℃的高温因素相关,杂质E含量的测定可用于A企业生产工艺的改进。
3.3.6 HPLC法测定含量
红霉素A、红霉素B、红霉素C对照品效价标定结果和混合对照品效价测定及估测结果见表2。红霉素A、红霉素B组分效价值约为红霉素C组分的3倍。假设红霉素A、红霉素B及红霉素C 3组分对短小芽胞杆菌的抗菌活性无交互作用,3组分混合对照品的效价测定值与按组分间无相互作用的理论计算值比较,可基本确认3组分的抗菌活性无交互作用。因而,基于红霉素A、红霉素B、红霉素C的理论效价(纯品效价)1002.9、985.5和303.7红霉素单位/毫克,可利用3组分含量测值进行样品效价值的估测。
基于新建HPLC方法,采用对照品溶液利用外标法按峰面积计算供试品溶液中红霉素A、B及C 3组分含量(mg/mL)。包括参比制剂在内的共21批次样品中红霉素A、B及C组分含量(%)利用公式1计算的结果见表3。
供试品红霉素组分含量(%)=红霉素组分含量(mg/mL)×供试品稀释倍数×折算系数×[1-供试品水分(%)]×100/供试品称样量(mg)(1)
其中,红霉素A、B及C 3组分对应的折算系数为1.4877、1.4986及1.4972[2]。
依据各组分标定效价值及HPLC方法测定含量值计算注射用乳糖酸红霉素样品的估测效价值,计算公式为:
估测效价(红霉素单位/毫克)=红霉素A理论效价×红霉素A含量(%)+红霉素B理论效价×红霉素B含量(%)+红霉素C理论效价×红霉素C含量(%) (2)
样品的估测效价值与依据抗生素微生物检定法测定的效价值结果比较见表4。样品效价实测值为(641±9)红霉素单位/毫克(n=21),估测效价值(637±10)红霉素单位/毫克(n=21)。统计学配对t检验结果t值为1.30,双侧P值为0.20,单侧为0.10,均大于0.05;提示样品效价实测值与基于含量测定结果的估测值无显著差异,新建HPLC方法进行含量测定可行[14-15]。
4 结论
本次国家评价性抽验采用前期调研、文献检索、法定标准检验结合探索性研究的方式对注射用乳糖酸红霉素的质量现状进行评价和分析。按照法定标准检验,80批次样品均合格,合格率为100%,国产注射用乳糖酸红霉素总体质量较好。
在探索性研究中,发现国内仿制制剂与原研参比制剂在复溶时间、粒径分布、颗粒形貌、成盐率及有关物质等关键质量属性方面存在差异。原研参比制剂的复溶时间低于国内仿制制剂,国内仿制制剂多批次产品间成盐率值波动大。此外钠离子含量参比制剂显著低于国内制剂。采用喷雾干燥工艺的A企业制剂杂质E显著高于采用冷冻干燥工艺的制剂。上述质量属性差异提示,国内企业需进一步优化生产工艺以提升产品质量。
现行注射用乳糖酸红霉素《中国药典》标准中有关物质检测方法需要提升,含量测定方法可以用HPLC方法测定红霉素A、红霉素B及红霉素C组分替代抗生素微生物检定法。
参 考 文 献
李大魁, 金有豫, 汤光, 等译. Sweetman S C 主编. 马丁代尔药物大典(原著第37版)[S]. 北京: 化学工业出版社, 2014, 256-260.
The European Pharmacopoeia Commission. European Pharmacopoeia10.0[S]. 2020: 2533-2536.
The United States Pharmacopeial Convention. United States Pharmacopeia[S]. 42th Edition. 2019: 1668.
Bosschea L V, Lodib A, Schaarc J, et al. An interlaboratory study on the suitability of a gradient LC-UV method as a compendial method for the determination of erythromycin and its related substances[J]. J Pharmaceut Biomed, 2010, 53: 109-112.
國家药品监督管理总局. 化学药品注射剂仿制药质量和疗效一致性评价技术要求[S]. 2019.
胡昌勤. 对抗生素注射剂一致性评价/再评价的思考[J]. 中国抗生素杂志, 2019, 44(3): 281-288.
Hiwale P, Amin A, Kumar L, et al. Variables affecting reconstitution time of dry powder for injection[J]. Pharm Tech, 2008, 32(7): 62-68.
盖荣银, 赵同新, 姚劲挺, 等. 注射用粉末剂型仿制药一致性评价关键技术要点解析[J]. 中国医药工业杂志, 2019, 50(2): 226-228.
刘昌胜, 邬行彦. 红霉素在几种缓冲液中的溶解度[J]. 中国抗生素杂志, 1995, 20(1): 17-19.
王新宇, 蒋睿, 张艳仙. 乳糖酸红霉素溶媒选择分析[J]. 中国处方药, 2021, 19(1): 42-43.
陈婧, 希迪·莫苏拉, 杨宗蕊. 中性硼硅玻璃与药物相容性研究进展[J]. 包装工程, 2021, 42(10): 37-43.
刘聪. 红霉素类抗生素相关物的制备及有关反应方法学的研究[D]. 北京理工大学, 2014: 5-7.
武建卓, 李雪, 张蔚, 等. 国产红霉素肠溶片的质量分析[J]. 中国抗生素杂志, 2019, 44(3): 308-312.
赵述强, 赵卫, 史孙亮, 等. 改进高效液相色谱法测定硫酸奈替米星注射液含量[J]. 中国抗生素杂志, 2018, 43(10): 1217-1221.
黄敏文, 侯玉荣, 张倩, 等. 高效液相色谱-脉冲安培电化学检测器法替代微生物检定法测定硫酸新霉素效价的研究[J]. 中国药学杂志, 2020, 55(2): 133-140.
