基于脂质组学探究健脾利湿方对NAFLD小鼠肝脏脂质的调控作用
2023-06-10金天姿罗子宸许伟辰种莹时晨单进军
金天姿,罗子宸,3,许伟辰,种莹,时晨,单进军
(1.南京中医药大学中医儿科学研究所,江苏 南京 210023;2.南京中医药大学医学代谢组学中心,江苏 南京 210023;3.南京中医药大学江苏省中药高效给药系统工程技术研究中心,江苏 南京 210023)
非酒精性脂肪肝(NAFLD)已成为21世纪以来严重威胁人类健康的代谢性疾病之一,截至2020年底,NAFLD患病率高达25%,且逐年增加[1]。临床以除酒精和其他明确的损肝因素所致的肝细胞内脂肪过度沉积为主要特征作为NAFLD诊断标准,同时该病易恶化为非酒精性脂肪肝炎、肝纤维化、肝癌等[2]。NAFLD为肝系疾病,多由脾失健运,痰浊阻滞所致[3-4]。治疗多以健脾疏肝、散瘀化浊降脂为主[5],辅以利湿类药物,可健运脾胃、疏泄肝气,调整机体运化状态,抑制脂质积累[6]。
健脾利湿方为仝小林院士所创,由山药、茯苓、薏苡仁三味中药组成,具有健脾、益气、渗湿之功效。临床研究表明,该方能够调节糖脂代谢,抑制患者体内脂质积累,缓解患者虚胖表型,改善患者体内代谢状态[7]。现采用高脂饮食诱导的NAFLD小鼠模型,进行健脾利湿方防治NAFLD的药效学评估,并运用脂质组学技术手段,从脂质代谢角度分析其潜在作用机制。
1 材料
1.1 动物
SPF级雄性C57BL6/J小鼠18只,8周龄,体质量为18~20 g,购自北京维通利华实验动物技术有限公司,饲养于南京中医药大学实验动物中心。饲养条件:12 h昼夜循环,相对湿度50%~60%,温度(22±2)℃。适应性饲养1周后,给予高脂饮食进行造模12周。经南京中医药大学实验动物伦理委员会批准,伦理号:202103A009。
1.2 仪器
Vortex-Genie2涡旋震荡仪(美国Scientific industries公司);RETSCH球磨仪(德国Retsch公司);5427R高速冷冻离心机、Bio Photometer蛋白核酸分析仪、Matercycler gradient PCR自动系列化分析仪(德国Eppendorf公司);SPD1010离心浓缩挥干机、QuantStudio 7 Flex荧光定量PCR仪、UHPLC-Q-ExactiveOrbitrap/MS(美国Thermo公司);Allegra超高速冷冻离心机(美国Beckman公司);FA1004N万分之一分析天平(上海舜宇恒平科学仪器有限公司)。
1.3 药物及试剂
山药、茯苓、薏苡仁购自南京中医药大学附属医院;60%高脂饲料(D12492,美国Diet research公司);甲醇、乙腈、MTBE(美国Merck公司,质谱纯);异丙醇、甲酸铵、乙酸铵、甲酸(美国ROE公司,质谱纯)、TRIZOL(美国Thermo公司);甘油三酯(TG,A110-1-1)、总胆固醇(TC,A111-1-1)、高密度脂蛋白(HDL-C,A112-1-1)、低密度脂蛋白(LDL-C,A113-1-1)、谷草转氨酶(AST,C010-2-1)、谷丙转氨酶(ALT,C009-2-1)生化指标检测试剂盒(南京建成生物工程研究所);HiScript Ⅲ RT SuperMix for qPCR(R323-01)、Taq Pro Universal SYBR qPCR Master Mix(Q712-03)PCR试剂(南京诺唯赞生物技术有限公司)。
2 方法
2.1 药物制备
取山药15 g,茯苓15 g,薏苡仁30 g,浸泡过夜,分别加入10倍、8倍超纯水各煎煮1 h,过滤,减压浓缩至生药量1.95 g·kg-1,将药物分装储存于-20 ℃冰箱备用。
2.2 分组及给药
将18只雄性C57BL/6J小鼠随机分为空白组(ND)、模型组(HFD)、健脾利湿方组(JPLS),每组6只。空白组小鼠给予正常饮食、自由饮水,其余2组给予高脂饮食诱导NAFLD模型。从造模第1天进行连续给药12周,给药方式采用自主饮药,给药剂量按临床等效剂量折算,约为7.8 g·kg-1·d-1。每周记录小鼠体质量与进食量。12周后处死小鼠进行样本取材,包括摘眼球取血、摘取肝脏组织,取约200 mg肝脏放入4%多聚甲醛中固定,约200 mg肝脏液氮速冻,剩余组织保存于-80 ℃冰箱。
2.3 葡萄糖耐量(OGTT)实验
于造模第11周进行OGTT实验,小鼠禁食14 h后,空腹状态下,测量小鼠血糖水平,作为基础血糖,随后灌胃2 g·kg-1的葡萄糖溶液,分别于15、30、60、120 min采用尾静脉采血检测小鼠血糖水平,全程禁食处理。
2.4 组织病理学分析
将固定于4%多聚甲醛中的肝脏组织进行石蜡包埋、切片、HE染色及封片保存。将液氮速冻的肝脏组织冷冻切片、油红染色及封片保存。最后于光学显微镜下观察肝脏组织病理学改变。
2.5 生化指标检测
离心取小鼠血清,进行生化指标TG、TC、LDL-C、HDL-C、ALT、AST的检测,实验方法根据试剂盒操作说明进行。
2.6 肝脏脂质代谢指标的检测
称取小鼠肝脏20 mg,采用Trizol法提取小鼠肝脏总RNA,而后将其反转为cDNA,储存于-20 ℃备用。采用qPCR法进行脂质代谢相关基因检测,运用2-ΔΔCT公式计算mRNA相对表达量,引物序列见表1。

表1 引物序列Table 1 Primer sequence
2.7 脂质组学检测
2.7.1 脂质组学样本前处理 以n=6进行实验样本取材,精密称取(20±0.5) mg肝脏组织加入200 μL超纯水于提前预冷的球磨仪进行匀浆,吸取20 μL匀浆液于1.5 mL的离心管中,加入含内标LysoPE(17∶0),SM(17∶0)和PE(17∶0/17∶0)的冰甲醇溶液,涡旋10 s,加入750 μL冰甲基叔丁基醚(MTBE),涡旋10 s后于4 ℃振荡10 min后加入冰超纯水188 μL,涡旋20 s,于4 ℃,18 000 r·min-1下离心2 min,吸取上清液350 μL至1.5 mL的离心管中,于离心浓缩挥干机中挥干。取挥干后的样本加入110 μL 复溶液(甲醇∶甲苯=9∶1),涡旋10 min,超声10 min,于4 ℃,18 000 r·min-1,离心10 min,吸取60 μL上清进样分析[8]。
2.7.2 色谱条件 色谱柱:ACQUITY CSH C18(2.1 mm×100 mm,1.7 μm),流速:0.6 mL·min-1,流动相:正离子模式A为乙腈-水(6∶4)+10 mmol·L-1甲酸铵+0.1%甲酸,B为异丙醇-乙腈(9∶1)+10 mmol·L-1甲酸铵+0.1%甲酸;负离子模式A为乙腈-水(6∶4)+10 mmol·L-1乙酸铵,B为异丙醇-乙腈(9∶1)+10 mmol·L-1乙酸铵。流动相梯度:0~2 min,15%→30%B;2~2.5 min,30%→48%B;2.5~11 min,48%→82%B;11~11.5 min,82%→99%B;11.5~12 min,99%B;12~12.1 min,99%→15%B;12.1~15 min,15%B。柱温:65 ℃,进样量4 μL。
2.7.3 质谱条件 Q-Exactive四极杆-静电场轨道阱高分辨质谱仪,电离源:HESI源。扫描模式:正(+)/负(-)离子模式。喷雾电压为3.5 kV(+)和3.0 kV(-),离子源温度为306 ℃(+)和325 ℃(-),毛细管温度为300 ℃,鞘气和辅助气均为氮气,鞘气流为275 kPa,辅助气流为104 kPa,S-lens为50,扫描范围为m/z215~1 800[8]。
2.7.4 脂质组学数据处理 将正、负离子模式下质谱原始文件进行Abf格式转化,于MS-DAIL4.24软件中进行谱图信息比对,完成脂质成分鉴定。数据上传至metaboanalyst 5.0(https://www.metaboanalyst.ca/)网站进行数据可视化处理;根据Fold Change>1.5或<0.67、P<0.05条件筛选差异脂质。
2.8 统计学方法

3 结果
3.1 各组小鼠形态学比较
如图1A所示,经高脂饮食诱导12周后,与空白组比较,模型组小鼠体质量明显上升(P<0.001),经12周健脾利湿方干预后,小鼠体质量相较于模型组显著下降(P<0.001),且进食量无明显差异(图1)。
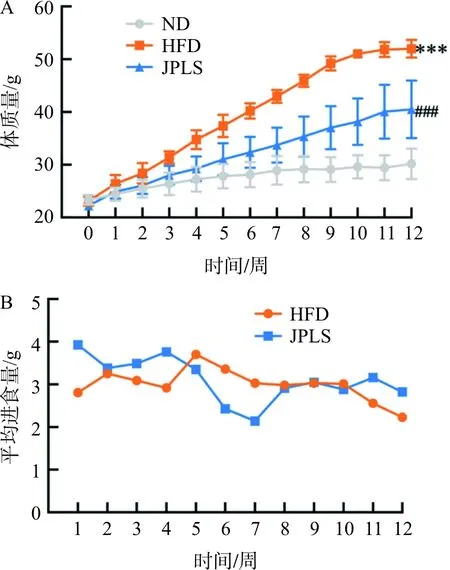
注:A.体质量变化曲线图;B.平均进食量曲线图。与空白组比较,***P<0.001;与模型组比较,###P<0.001。ND.空白组;HFD.模型组;JPLS.健脾利湿方组图1 各组小鼠体质量、进食量变化曲线Fig.1 Body weight and food intake curve of mice at different group
3.2 各组小鼠OGTT变化
OGTT实验结果显示(图2),模型组血糖曲线高于空白组,糖耐量下降(P<0.001)。健脾利湿方干预后小鼠血糖明显下降(P<0.05,P<0.01,P<0.001),表明小鼠对葡萄糖调控能力恢复。
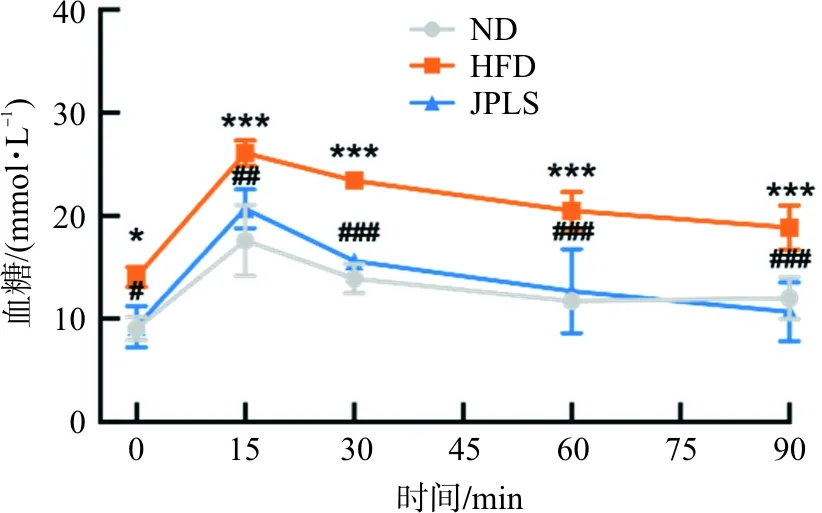
注:与空白组比较,*P<0.05,***P<0.001;与模型组比较,ND.空白组;HFD.模型组;JPLS.健脾利湿方组图2 各组小鼠血糖变化比较Fig.2 The blood sugar in each group
3.3 NAFLD小鼠肝脏病理学分析
HE染色显示(图3),空白组小鼠肝脏细胞排列紧密,结构完整。高脂饮食组小鼠肝脏出现气球样病变,细胞边界模糊;健脾利湿方给药组肝脏中脂肪空泡较少,组织损伤程度较轻。油红染色(图3)结果表明,高脂饮食组脂滴数目多且形状较大。与模型组比较,健脾利湿方组脂滴数目少,且形状较小,甘油三酯沉积明显改善。
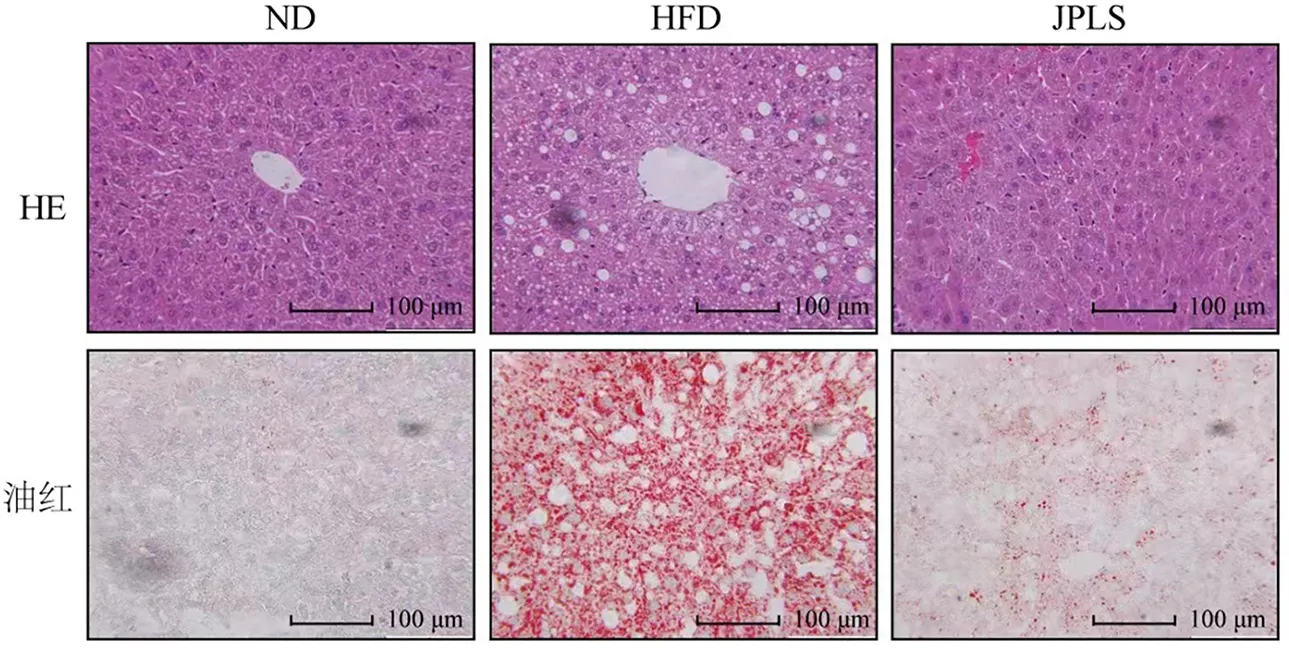
注:ND.空白组;HFD.模型组;JPLS.健脾利湿方组图3 HE、油红染色结果比较(200×,n=3)Fig.3 HE and Oil red staining results (200×,n=3)
3.4 各组小鼠血清脂质水平比较
如表2所示,与空白组比较,模型组小鼠TG(P<0.05)、TC(P<0.001)、HDL-C(P<0.001)、LDL-C(P<0.01)含量显著升高。与模型组比较,给予健脾利湿方干预的小鼠血清脂质相关生化指标含量均明显下降(P<0.05,P<0.001),提示健脾利湿方显著缓解了高脂饮食导致的脂质沉积。
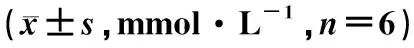
表2 各组小鼠血清脂质水平变化比较Table 2 The serum lipid level in each group mmol·L-1, n=6)
3.5 各组小鼠肝脏损伤水平比较
如表3所示,与空白组比较,模型组血清中ALT、AST水平明显升高(P<0.001);给予健脾利湿方干预后,血清中ALT、AST水平显著降低(P<0.001),表明健脾利湿方可有效改善肝脏损伤。
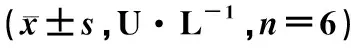
表3 各组小鼠肝脏损伤水平比较Table 3 The liver injury in each group U·L-1, n=6)
3.6 各组小鼠肝脏脂质代谢相关基因表达水平比较
由图4所示,与空白组比较,模型组小鼠肝脏脂质代谢相关基因Fasn、CD36、SCD1、Srebp1c mRNA表达均显著增加(P<0.01,P<0.001),CPT1α mRNA水平明显下降(P<0.001);与模型组小鼠比较,健脾利湿方组Fasn、CD36、SCD1、Srebp1c的mRNA低表达(P<0.05,P<0.01,P<0.001),CPT1α mRNA表达略增加,但不具有统计学意义。
注:与空白组比较,*P<0.05,***P<0.001;与模型组比较,ND.空白组;HFD.模型组;JPLS.健脾利湿方组图4 各组小鼠肝脏脂质代谢相关基因表达水平比较Fig.4 Comparison of liver lipid metabolism-related gene expression levels in each group
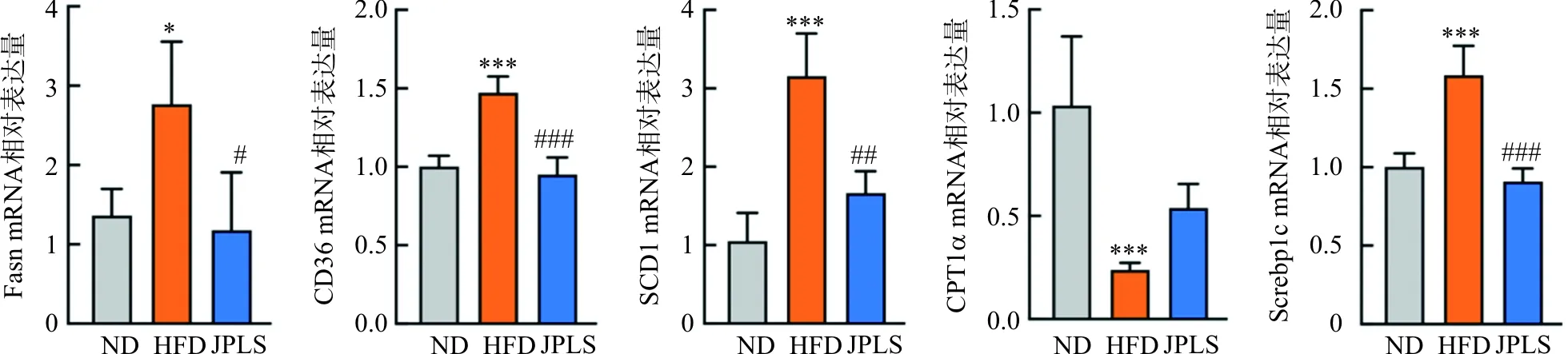
3.7 脂质组学结果
采用UPLC-Q-Exactive Orbitrap/MS对NAFLD小鼠肝脏脂质成分进行检测,采集正、负离子模式下总离子流图(图5)。负离子模式下,3组在脂肪酸(FA)水平上存在差异;正离子模式下,模型组甘油三酯(TG)水平明显上升,健脾利湿方组TG水平相对于模型组有所下降。
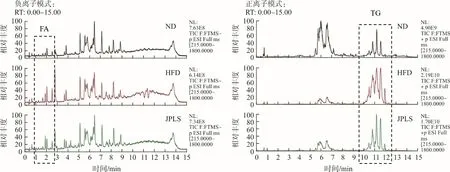
图5 总离子流图(TIC)Fig.5 Total ion flow diagram(TIC)
通过MS-Dail 4.24软件对脂质成分进行鉴定,正、负离子模式下分别鉴定出429、213种脂质成分。主成分分析(PCA)结果显示(图6),正、负离子模式下空白组、模型组、健脾利湿方组3组置信区间均有较好区分,且健脾利湿方组置信区间趋于空白组,说明健脾利湿方可一定程度回调高脂饮食所致的脂质代谢紊乱。
注:A.正离子模式PCA图;B.负离子模式PCA图图6 主成分分析(PCA)图Fig.6 Principal component analysis (PCA)
根据Fold Change≥1.5或≤0.67,P<0.05对正、负离子差异脂质成分进行筛分。正离子模式下,模型组/空白组共有290个差异脂质(上调217个,下调73个),健脾利湿方组/模型组共有231个差异脂质(上调83个,下调148个),共同差异脂质184个,见表4。负离子模式下,模型组/空白组共有113个差异脂质(上调56个,下调57个),健脾利湿方组/模型组共有58个差异脂质(上调44个,下调14个),共同差异脂质43个,见表5。按脂质种类进行富集分析,气泡图显示(图7)模型组肝脏中TG水平显著增加,FA、DG水平上调,提示NAFLD小鼠肝脏中脂肪酸摄取活动及脂肪合成活动增加,而PE、PI、PS等磷脂在高脂饮食诱导后降低。磷脂作为细胞膜主要成分之一,低细胞膜磷脂水平预示肝脏细胞膜发生损伤[9]。健脾利湿方干预后,小鼠肝脏中FA、DG、TG水平相较于模型组表达下降,提示其一定程度上抑制了中性脂肪的积聚;PC、PE、PI、PS等磷脂水平表达上升,表明健脾利湿方具有调控磷脂代谢水平的作用。
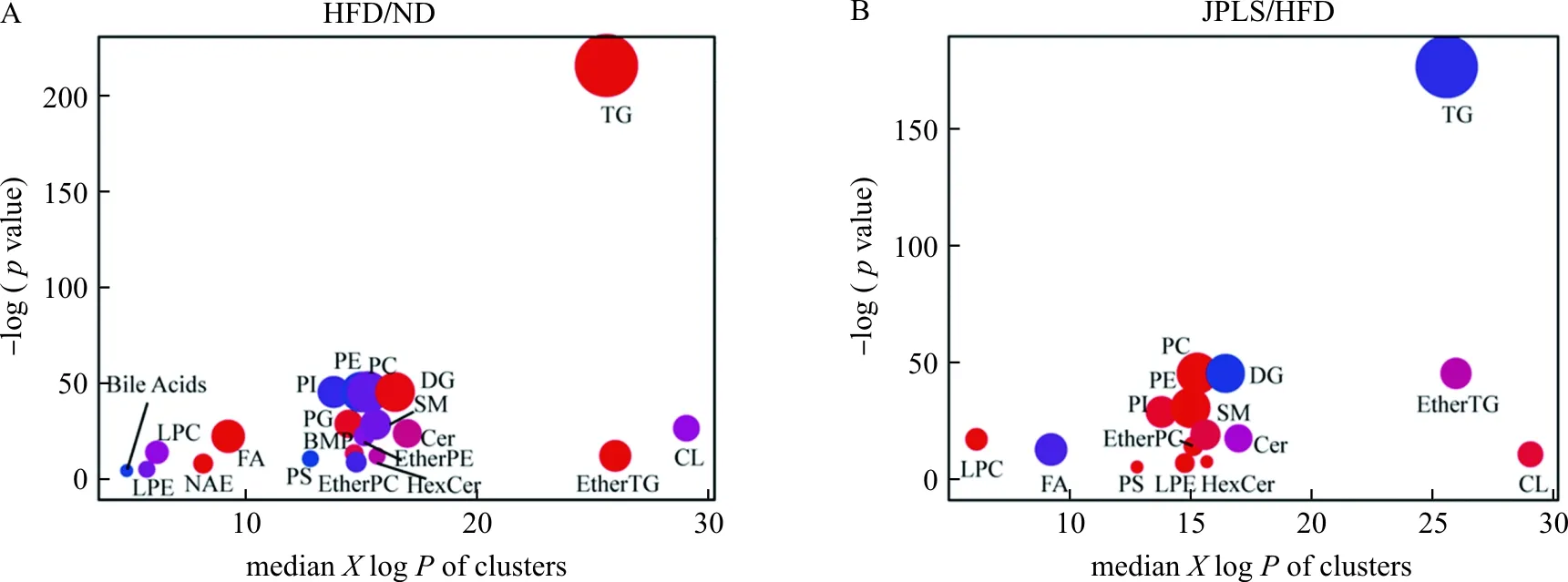
注:红色表示上调,蓝色表示下调;图中对应脂质为:磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、磷脂酰甘油(PG)、磷脂酰肌醇(PI)、磷脂酰丝氨酸(PS)、溶血性磷脂酰胆碱(LPC)、溶血性磷脂酰乙醇胺(LPE)、磷脂酰胆碱醚(Ether PC)、磷脂酰乙醇胺醚(EtherPE)、脂肪酸(FA)、神经酰胺(CerHexCer)、己糖神经酰胺(HexCer)、鞘磷脂(SM)、双(单酰基甘油)磷酸酯(BMP)、N-酰基乙醇胺(NAE)、甘油二酯(DG)、甘油三酯(TG)、胆汁酸(Bile Acids)、甘油三酯醚(Ether TG)、心磷脂(CL)。A.模型组(HFD)与空白组(ND)相比的差异脂质;B.健脾利湿方组(JPLS)与模型组(HFD)相比的差异脂质图7 差异脂质富集分析Fig.7 Differential lipid enrichment analysis
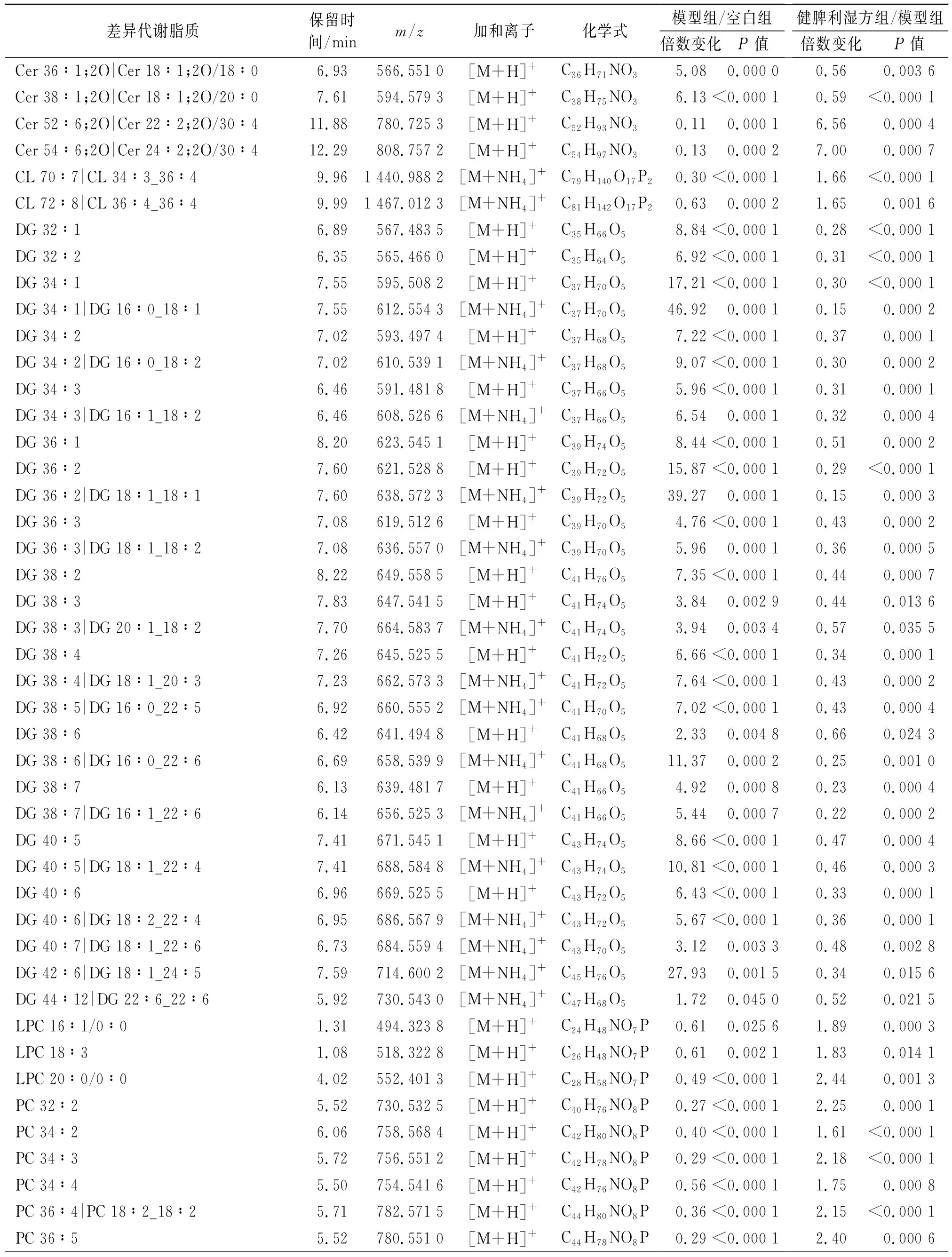
表4 正离子模式肝脏差异脂质Table 4 Liver differential lipids in positive ion mode
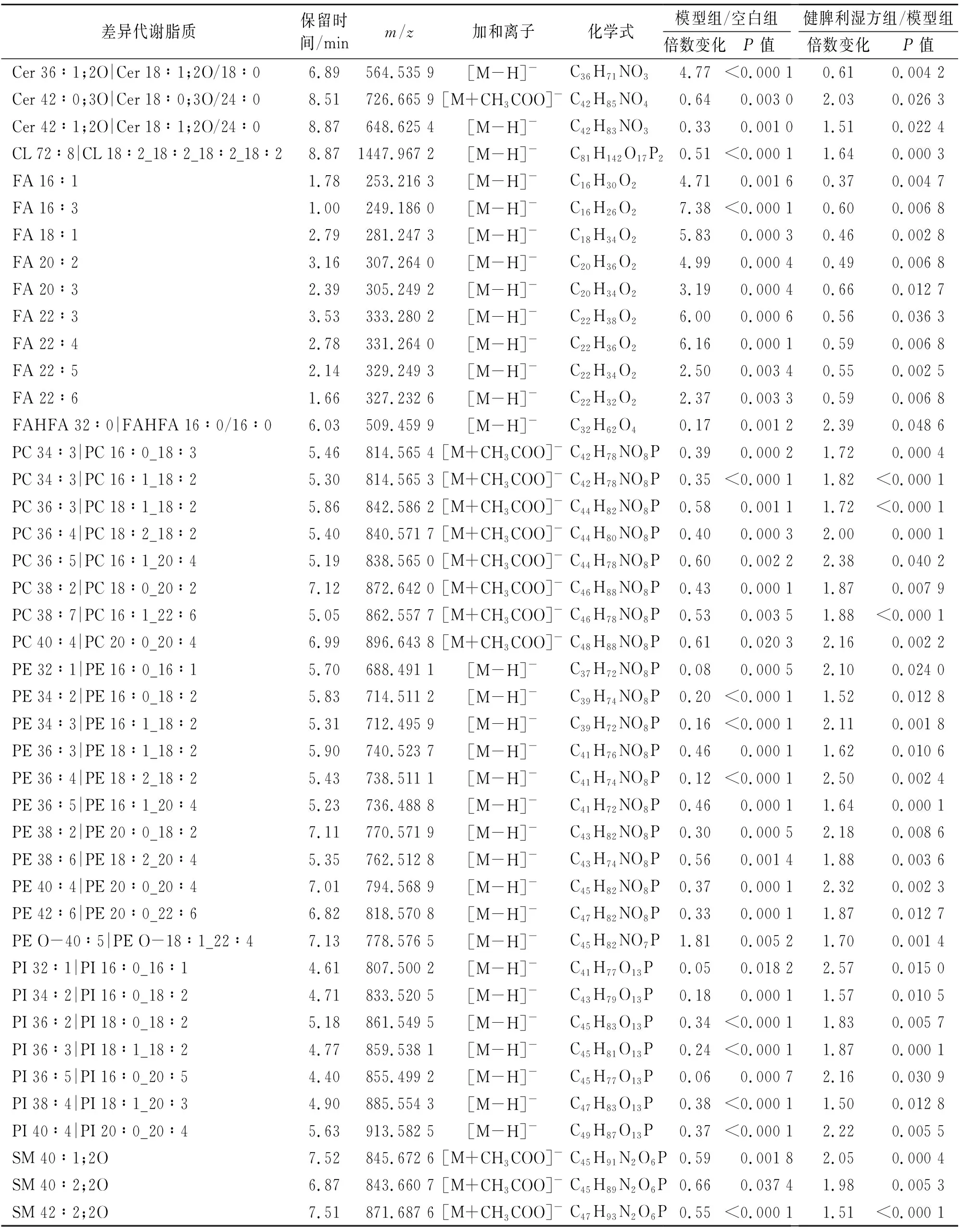
表5 负离子模式肝脏差异脂质Table 5 Liver differential lipids in negative ion mode
4 讨论
健脾利湿方为仝小林院士所创,由山药、茯苓、薏苡仁三味药物组成,山药和茯苓配伍增加健脾益气,佐以薏苡仁兼能化湿,全方具有健脾、益气、渗湿之功效[10-12]。本研究结果显示健脾利湿方能够有效改善高脂饮食诱导的小鼠肥胖表型,降低血清中TG、TC、HDL-C、LDL-C、AST、ALT水平,有效调节机体脂质代谢,减轻肝脏细胞脂质沉积与损伤。qPCR检测结果表明,健脾利湿方可有效抑制肝脏脂质代谢相关基因Fasn、CD36、SCD1、Srebp1c mRNA表达水平。提示健脾利湿方可能通过促进Fasn泛素化及蛋白酶体降解,有效防止肝细胞脂质沉积[13]。Srebp1c为胰岛素激活的关键脂质性转录因子,调控肝脏糖异生[14],同时,Srebp1c可受NF-κB P50亚基调控,从而减轻肝脏脂肪变性[15]。
脂质种类及含量变化与疾病的发生存在密切的关系,脂质组学为代谢组学重要分支之一[16]。本次肝脏脂质组学研究结果表明健脾利湿方干预后小鼠TG、TC、FA水平下降,磷脂水平(PC、PE、PI、PG等)升高。肝脏中饱和脂肪酸的积聚可通过激活Fasn/Srebp1c/HMG-CoA信号,诱导胆固醇合成增加,进一步导致TG、LDL-C的升高[17]。文献研究表明饱和脂肪酸可通过模仿LPS的作用促进机体释放大量致炎性细胞因子[18],如棕榈酸(FA 16∶0)通过激活肝脏细胞死亡受体5(DR5),促进肝脏细胞释放细胞外囊泡,诱导巨噬细胞炎症表型[19]。细胞磷脂水平与细胞膜完整性有关,适当提高磷脂水平有助于维护磷脂双分子层水油平衡,提高细胞膜稳定性。文献研究表明,过高或过低的磷脂水平都会导致TG水平的增多,低水平的PC可能会诱导肝脏中TG水平的增高,高水平的PC会升高DG含量促进TG合成。临床上,通过补充多烯磷脂酰胆碱促进肝组织再生,治疗肝脏损伤类疾病[20-21]。S-腺苷甲硫胺酸(SAM)与NAFLD、NASH的发生密切相关。SAM作为PC合成的关键甲基供体,为肝脏输出VLDL所必需的,同时SAM可以通过磷脂酰乙醇胺N-甲基转移酶途径参与脂质合成,该酶缺乏会导致SAM积累,导致组蛋白和主要磷酸酶PP2A甲基化,促进机体活性氧ROS积聚,诱发机体氧化应激反应[22]。磷脂组成多样,并非所有磷脂均可发挥抗非酒精性脂肪肝作用,如L-α-溶血性磷脂酰肌醇(LPI)可作为G蛋白偶联受体GPR55内源性配体,在NASH患者肝脏中表达上升,促进肝脏脂肪酸从头合成,降低脂肪酸β氧化,诱导乙酰辅酶A羧化酶(ACC)表达上升,促进肝星状细胞的激活并提高肝脏脂质含量[23]。氧化应激而产生的氧化磷脂(OxPLs)可促进ROS积累诱发肝细胞线粒体功能障碍,具有促炎和促动脉粥样硬化作用。通过靶向抑制OxPLs可改善NASH肝脏脂肪变性、炎症,纤维化、肝细胞死亡特征,抑制其进展为肝细胞癌[24]。
综上所述,健脾利湿方有助于调控脂质代谢紊乱,从而达到防治NAFLD的作用。脂质组学可全面描绘机体脂质代谢状态,为疾病的治疗提供了一定的思路。
